Número Atual: Abril-Junho 2017 - Volume 1 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Perfil dos pacientes com urticária e angioedema por anti-inflamatórios não esteroidais do Serviço de Alergia e Imunologia do Hospital do Servidor Público do Estado de São Paulo
Profile of patients with urticaria and angioedema caused by nonsteroidal anti-inflammatory drugs in the Allergy and Immunology Division of Hospital do Servidor Público Estadual de Sao Paulo
Priscila Bechaalani1; Veridiana Aun-Pereira2; Andrea Pescadinha de Carvalho2; Wilson Tartuce Aun3; Joao Ferreira de Mello4
DOI: 10.5935/2526-5393.20170024
1. Médica estagiária do Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual de Sao Paulo (HSPE-SP), Sao Paulo, SP
2. Médica assistente do Serviço de Alergia e Imunologia, HSPE-SP, Sao Paulo, SP
3. Chefe da Seçao de Imunologia do Serviço de Alergia e Imunologia, HSPE-SP, Sao Paulo, SP
4. Diretor do Serviço de Alergia e Imunologia, HSPE-SP, Sao Paulo, SP
Endereço para correspondência:
Veridiana Aun-Pereira
E-mail: veridiana.aun@uol.com.br
Submetido em: 19/04/2017
Aceito em: 03/05/2017.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVOS: Identificar pacientes com história de urticária e angioedema desencadeados por anti-inflamatórios nao esteroidais (AINEs), no Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual de Sao Paulo, classificá-los como seletivos e nao seletivos e avaliar a tolerabilidade ao inibidor de COX-2 (etoricoxib 90 mg).
MÉTODOS: Os indivíduos com múltiplas reaçoes desencadeadas por AINE, de grupos diferentes, foram submetidos a teste de provocaçao oral com Etoricoxib 90 mg. Pacientes com história de urticária e/ou angioedema a um único grupo de AINE, ou com primeiro episódio, realizaram testes de provocaçao oral com outro grupo de AINE, para classificá-los em seletivo ou nao.
RESULTADOS: Estudou-se 43 pacientes, com idade entre 18 e 71 anos, predomínio do sexo feminino (77%). A maioria dos pacientes apresentavam reaçoes a múltiplos AINE (nao seletivos) e 2 (5%) a um único AINEs (seletivos). Observou-se sintomas alérgicos em 53%, com predomínio da rinite (61%). Os fármacos mais implicados foram: dipirona (39%), diclofenaco (18%) e AAS (14%). Todos os pacientes apresentaram teste com etoricoxib 90 mg negativo.
CONCLUSAO: A maioria dos pacientes apresentou reaçao nao seletiva, e todos os pacientes apresentaram teste com etoricoxib 90 mg negativo, demonstrando segurança e ser uma boa opçao terapêutica.
Descritores: Reaçao a anti-inflamatórios nao esteroidais, inibidor da COX-2, angioedema e urticária.
INTRODUÇAO
Os anti-inflamatórios nao esteroidais (AINEs) compoem um grupo heterogêneo de medicamentos que frequentemente sao prescritos para a analgesia, como anti-inflamatórios ou antipiréticos1,2. Representam a segunda causa mais comum de reaçoes induzidas por medicamentos, sendo os antibióticos betalactâmicos a primeira causa2-4. Entretanto, alguns centros apresentam resultados diferentes, como relatado por Tanno et al., em 2009, em que a prevalência de hipersensibilidade a AINEs foi de 49% no Serviço de Alergia do HSPE, e de 47% no Serviço de Imunologia e Alergia do Hospital das Clínicas de Sao Paulo, enquanto as reaçoes a antibióticos betalactâmicos foram respectivamente de 9% e 10%5.
Segundo a EAACI/ WAO (World Allergy Organization), as reaçoes de hipersensibilidade ou alérgicas ao AINE podem ser classificadas em relaçao ao mecanismo envolvido, sendo imunológicas (por anticorpos ou células T), ou nao imunológicas, via inibiçao da ciclooxigenase (COX)2-4,6,7. A classificaçao atual foi originalmente proposta por Stevenson e colaboradores, em 2001, e modificada pela Força-Tarefa do ENDA/EAACI, em 20114,6. Nessa classificaçao, as reaçoes sao divididas em imediatas (< 24 horas) ou tardias (> 24 horas).
Dentre as manifestaçoes imediatas, estao: doença respiratória exacerbada pelo AINE (DREA), urticária e angioedema exacerbados, urticária e angioedema induzidos e urticária, angioedema ou anaflaxia em menos de 1 hora após a administraçao do AINE. Na DREA e nas urticárias exacerbadas ou induzidas pelo AINE, o mecanismo mais provável envolvido seria a inibiçao da COX-1; diferente da anafilaxia, que se presume a participaçao do anticorpo IgE4,6,8.
A maioria dos pacientes com hipersensibilidade ao AINE apresenta sintomas após a ingestao de mais de um AINE, quimicamente nao relacionados, compartilhando a propriedade da inibiçao da enzima cicloxigenase-1 (COX-1). Essa enzima é responsável pela produçao de prostaglandinas (PGE) e tromboxanos e sua inibiçao causa a reduçao das PGE, especialmente a PGE2 e ativaçao da via da lipoxigenase (LO)7-9. Essa ativaçao ocasiona aumento na produçao de leucotrienos, principalmente os cisteinilleucotrienos (LTC4, LTD4 e LTE4), que sao quimiotáticos para eosinófilos, potentes vasodilatadores e aumentam a permeabilidade vascular, induzindo o edema e broncoconstriçao7-10. Assim, os pacientes que reagem a múltiplos AINE sao classificados como nao seletivos1,6,8,9.
Os sintomas também podem ocorrer após a ingestao de um único AINE específico (ou mais de um, mas pertencendo ao mesmo grupo químico), sendo uma reaçao seletiva, com tolerância aos demais fármacos e considerada imunologicamente mediada (IgE mediada)4,6,11.
As reaçoes tardias apresentam os sintomas, em geral, após 24 horas da ingestao do fármaco, e as manifestaçoes clínicas mais comuns sao: erupçoes fixas à droga, maculopapulares, fotossensibilidade, urticária tardia, dermatite de contato, além de reaçoes graves como pustulose exantemática generalizada aguda, síndrome de Stevens-Johnson, necrólise epidérmica tóxica e reaçao à droga com eosinofilia com sintomas sistêmicos, mas estes tipos de reaçao nao serao abordados neste trabalho4,10.
É importante salientar que além da enzima COX-1, que é constitutiva, há a COX-2, que apresenta a mesma estrutura proteica primária e catalisa essencialmente a mesma reaçao, mas é induzida nos processos inflamatórios9, sendo encontrada em células como macrófagos, monócitos, sinoviócitos, e também em órgaos como rins, cérebro, ovário, útero e endotélio vascular. Alguns AINEs sao considerados inibidores fracos da COX-1 (como o paracetamol, nimesulide e meloxicam), sendo tolerados pela maioria dos indivíduos nao seletivos. A inibiçao seletiva da COX-2 diminui os efeitos colaterais induzidos pela inibiçao da COX-1 como epigastralgia e aumento da liberaçao de leucotrienos, podendo ser uma opçao para os pacientes com reaçoes a múltiplos AINEs10,11.
Assim, o objetivo do nosso trabalho foi identificar os pacientes com história de urticária e angioedema desencadeados por AINEs em nosso serviço, classificá-los em reatores seletivos e nao seletivos, e avaliar a tolerabilidade dos reatores nao seletivos ao inibidor seletivo da COX-2 (Etoricoxib 90 mg).
MÉTODOS
Os pacientes foram selecionados do ambulatório de Alergia e Imunologia do HSPE, com idade acima de 18 anos, com história de reaçoes imediatas (até 24 horas) de urticária e/ou angioedema desencadeadas pelo uso de AINE no período de 2011 a 2016.
Os indivíduos com múltiplas reaçoes desencadeadas por AINE, de grupos diferentes, foram classificados como nao seletivos e submetidos a teste de provocaçao oral com Etoricoxib 90 mg (inibidor seletivo de COX-2). Pacientes com história de reaçoes à múltiplos fármacos, incluindo paracetamol 750 mg, realizaram provocaçao oral com paracetamol 500 mg.
Nos indivíduos com história de urticária e/ou angioedema a um único grupo de AINE correlacionados, ou seja, reaçao seletiva, foram realizados testes de provocaçao oral com outro grupo de AINE. Quando o resultado do teste foi negativo, seguiu-se com o teste de puntura e intradérmico com a droga suspeita, na tentativa de verificar a presença de IgE. Se o resultado do teste de provocaçao com outro grupo fosse positivo, o paciente era classificado como nao seletivo e submetido a provocaçao com Etoricoxib 90 mg para opçao terapêutica.
As pessoas que procuraram o serviço no primeiro episódio de urticária e/ou angioedema por AINE foram submetidas à provocaçao oral com AINE de outro grupo para classificá-lo como reator seletivo ou nao seletivo. Os pacientes nao seletivos eram provocados com Etoricoxib 90 mg, para avaliar a tolerabilidade.
Foram excluídos os pacientes com idade inferior a 18 anos, com reaçao imediata exclusivamente respiratória, cutâneas diferentes de urticária e/ou angioedema e reaçoes tardias.
RESULTADOS
Estudamos 43 pacientes com idade compreendida entre 18 a 71 anos (mediana 48 anos), e predomínio do sexo feminino (77%). Grande parte (53%) dos pacientes estudados apresentavam sintomas alérgicos, sendo rinite a mais prevalente (61%), seguida de asma e rinite (26%) e asma (13%), elucidado na Figura 1.
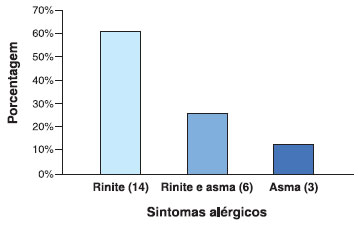
Figura 1 Prevalência de sintomas alérgicos nos pacientes com reaçao a AINE
Os sintomas relatados pelos pacientes foram: angioedema (65%), urticária e angioedema (30%) e somente urticária (5%). Desses pacientes, somente 1 (2%) apresentava antecedente de anafilaxia (Figura 2). Neste paciente com anafilaxia, o fármaco implicado foi a dipirona.
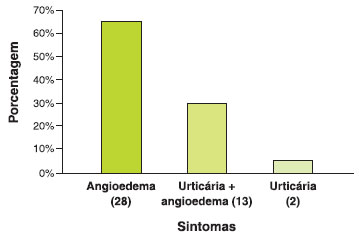
Figura 2 Sintomas relatados pelos pacientes após administraçao do AINE
A grande maioria dos indivíduos (95,4%) apresentava reaçao com múltiplos AINEs (nao seletivos), sendo os fármacos mais implicados: dipirona (39%), diclofenaco (18%), AAS (14%), ibuprofeno (12%), nimesulida (5%) e cetoprofeno (4%), apresentados na Figura 3. Dos pacientes nao seletivos, 7 (17,1%) relataram reaçao ao paracetamol 750 mg (inibidor fraco da COX-1). Estes pacientes foram submetidos a provocaçao oral com paracetamol 500 mg, e apenas 1 (2,3%) apresentou teste positivo.
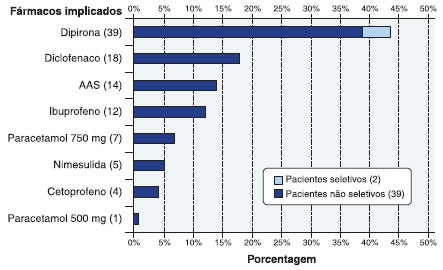
Figura 3 Principais AINEs implicados nas reaçoes de hipersensibilidade
Somente 2 indivíduos (4,6%) tiveram reaçao com um único fármaco, no caso a dipirona, e foram classificados como seletivos. Esses pacientes foram submetidos a teste com AAS 500 mg, que foi negativo. Realizado teste de puntura e intradérmico com dipirona, que foi positivo, comprovando a participaçao da IgE.
Todos os pacientes que realizaram teste de provocaçao oral com inibidor da COX-2 (etoricoxib 90 mg) tiveram resultado negativo. Nao houve exacerbaçao da asma nos pacientes atópicos e nem queda do pico de fluxo durante a realizaçao deste teste.
DISCUSSAO
Os AINEs sao amplamente prescritos para o tratamento de várias doenças inflamatórias, porém os mesmos podem causar reaçoes de hipersensibilidade que variam desde reaçao leve (cutânea ou vias aéreas) a sintomas sistêmicos, incluindo a anafilaxia1,2. O alto número de prescriçoes e a automedicaçao destes fármacos elevaram o uso deles e concomitantemente as reaçoes de hipersensibilidade. Isso nos mostra a importância de estudar este tipo de reaçao e suas opçoes terapêuticas, quando necessário.
Nesse estudo, observou-se o predomínio do sexo feminino (77%) e história pessoal de atopia (53%), sendo mais prevalente a rinite (61%). Infelizmente a confirmaçao de atopia por testes de puntura e/ ou dosagem de IgE específica nao foi obtida até o presente momento. Genevieve, em 2013, ao avaliar a tolerância do inibidor de COX-2 em 74 pacientes, também obteve predomínio do sexo feminino (59%)2; e Sanches-Borges et al., em 2000, mostraram a atopia como fator de risco para a reaçao de hipersensibilidade a AINE12.
A maioria dos pacientes estudados foi classificada como nao seletivo, por apresentar reaçoes a múltiplos AINES, provavelmente por inibiçao da COX-1, e, dentre os fármacos implicados, destacaram-se as pirazolonas (ex: dipirona), diclofenaco, AAS e ibuprofeno. Diferente dos nossos resultados, Sanches-Borges e Di Leo encontraram predomínio do AAS, seguido das pirazolonas1,11,12. Possivelmente esta discordância ocorre pela facilidade em adquirir as pirazolonas, especialmente a dipirona em nosso país.
Dos 43 pacientes, somente 2 pacientes (4,6%) apresentaram reaçao a um único fármaco (seletivos), e conseguimos comprovar participaçao da IgE por testes cutâneos. Somente 1 destes pacientes apresentava como antecedente a anafilaxia, desencadeada por AINE, com necessidade de cuidados intensivos, e o fármaco associado foi a dipirona. Na literatura, o grupo das pirazolonas (por exemplo, dipirona e fenilbutazona) é o principal responsável pelas reaçoes seletivas, que sao menos frequentes3, mas que podem ocorrer em 0,1 a 3,6% dos casos8.
Dentre os pacientes com reaçoes a múltiplos fármacos, 7 informaram também reaçao com paracetamol 750 mg (17,1%), mas somente 1 paciente nao tolerou 500 mg, apresentando teste de provocaçao oral positivo. Sanches-Borges em 2005 selecionou 11 trabalhos envolvendo 1201 pacientes sensíveis a AINE, dos quais 173 (14,4%) apresentaram reaçoes com paracetamol13. Em 2009, o mesmo autor mostrou que 40,9% dos pacientes com reaçoes a AINES reagem também com algum inibidor fraco da COX-1, como paracetamol, nimesulide, meloxicam e inibidores da COX-214, o que nos faz refletir se existe a necessidade de testar paracetamol e outros inibidores fracos da COX-1, antes de sua prescriçao.
Neste estudo, confirmamos achados relatados por Di Leo et al.1, Nettis et al.15 e Quercia et al.10, que avaliaram a tolerabilidade ao etoricoxib em pacientes com reaçao aos AINEs, e encontraram, respectivamente, 173 (100%), 139 (98,5%) e 63 pacientes (97%) com teste do etoricoxib 90 mg negativo. Genevieve et al. mostraram que mesmo na dose de 120 mg, 95% (70) dos pacientes tiveram teste negativo. Os pacientes com reaçao positiva nao apresentaram reaçao anafilática2. Isso nos mostra que o etoricoxib pode ser uma opçao terapêutica segura a estes pacientes com reaçao ao AINE.
Os fármacos inibidores seletivos da COX-2 (celecoxib ou etoricoxib) tornam-se alternativas terapêuticas para os pacientes que apresentam essas reaçoes nao seletivas, relacionadas à inibiçao da COX-11,10,15,16. Em nosso serviço em 2006, foi realizado um estudo com teste de provocaçao oral com o inibidor da COX-2 (etoricoxib), na dose de 120 mg, pois era a dose recomendada e liberada naquele momento. Observou-se 7 pacientes (17,5%) com reaçao positiva, com sintomas clínicos de angioedema e urticária durante o teste17, mas em meados de 2008, foi proibida essa apresentaçao, sendo liberada somente na dose de 90 mg. Desde entao, nao se observou pacientes com reaçao positiva, o que nos leva a questionar se as reaçoes apresentadas anteriormente foram dose-dependentes.
CONCLUSAO
Em nosso estudo, a maioria dos pacientes apresentaram reaçao com múltiplos fármacos e somente 2 foram seletivos e com participaçao da IgE para dipirona.Todos os pacientes avaliados apresentavam mais de um episódio de urticária ou angioedema e teste com etoricoxib 90 mg negativos, o que o torna opçao terapêutica segura.
AGRADECIMENTO
Agradeço a Deus pela oportunidade, minha família e a minha preceptora, Veridiana Aun Rufino Pereira, pelos ensinamentos e paciência.
REFERENCIAS
1. Di Leo E, Aloia AM, Nettis E, Cardinale F, Fot C, Distaso M, et al. Long-term tolerability of etricoxib in patients with previous reaction to non-steroidal anti-inflammatory drugs. Int J Immunopathol Pharmacol. 2009;22:1131-4.
2. Llanora GV, Loo EXL, Gerez IFA, Cheng YK, Shek LP. Etoricoxib: a safe alternative for NSAID intolerance in Asian patients. Asian Pc J Allergy Immunol. 2013;31:330-3.
3. Kowalski ML, Makwska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hipersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) classification, diagnosis and management: review of the EAACI/ENDA and GA2LEN/HANNA. Allergy. 2011;66:818-29.
4. Arruda KL. Classificando reaçoes de hipersensibilidade a antiinflamatórios nao-esteroidais (AINEs) na prática clínica: uma tarefa em sete passos. J Allergy Clin Immunol. 2014;2:83-86.
5. Tanno L, Ensina L, Rodrigues F, Giavina-Bianchi P, Kalil J, Aun W, Mello J. Drug hypersensitivity reactions: clinical and epidemiological differences between allergy clinics of two services in Sao Paulo, Brazil. European Journal of Allergy and Clinical Immunology. 2010;65:209-682.
6. Kowalski ML, Asero R, Bavbek S, Blanca M, Lopez NB, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. J Allergy Clin Immunol. 2013;68:1219-32.
7. Demoly P, Adkinson NF, Brokow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. J Allergy Clin Immunol. 2014;420-37.
8. Ortega N, Dona I, Moreno E, Audicana MT, Barasona MJ, Beges- Gimeno MP, etal. Practical Guidelines for Diagnosing Hypersensitivity Reactions to Nonsteroidal Anti-inflammatory Drugs. J Investig Allergol Clin Immunol. 2014;24:308-23.
9. Dona I, Lopez NB, Jagemann LR, Torres MJ, Rondon C, Campo P, et al. Response to a selective COX-2 inhibitor in patients with urticaria/angioedema induced by nonsteroidal anti-inflammatory drugs. Allergy. 2011;66:1428-33.
10. Quercia O, EmilianiF, Foschi FG, Stefanini GF. Safety of Etoricoxibin patient with reactions to NSAIDs. J Investig Allergol Clin Immunol. 2008;18:163-7.
11. Sanches-Borges M, Hulet A C, Fonseca FC. The multiple faces of nonsteroidal anti-inflammatory drug hypersensitivity. J Invest Allergol Clin Immunol. 2004;14:329-34.
12. Sanches-Borges M, Capriles, Hulett A. Atopy is a risk factor for non-steroidal anti-inflammatory drug sensitivity. Ann Allergy Asthma Immunol. 2000;84:101-6.
13. Sánchez-Borges M, Capriles-Hulett A, Caballero F F. Hypersensitivity reactions to weak COX inhibitors. Allergy Clin Immunol Int J.World Allergy Org. 2005;17:58-63.
14. Sánchez-Borges M, Capriles-Hulett A, Caballero-Fonseca F. A Novel phenotype of nonsteroidal anti-inflammatory drug hypersensitivity high risk patient. WAO J. 2009;2:17-9.
15. Nettis E, Colanardi MC, Ferrannini A, Vacca A, Tursi A. Short-term tolerability of etoricoxib in patients with cutaneous hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Ann Allergy Asthma Immunol. 2005;95:438-42.
16. El Miedany, Youssef S, Ashmed I, El Gaafary M. Safety of etoricoxib a specific cyclooxygenase-2 inhibtor in asthmatic patients with aspirin-exacerbated respiratory disease. Ann Allergy Asthma Immunol. 2006;97:105-9.
17. Yamashita MM, Itokazu C, Aun-Pereira V. Segurança do etoricoxib em pacientes com urticária e angioedema a AINH, 2008 - nao publicado.



