Número Atual: Outubro-Dezembro 2024 - Volume 8 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Anafilaxia: atualizando as recomendações do Practice Parameter 2023
Anaphylaxis: updating Practice Parameter 2023 recommendations
Albertina Varandas Capelo1; Alex Eustáquio de Lacerda2; Jane da Silva3; Renata Neiva Bittar4; Marisa Rosimeire Ribeiro5; Alexandra Sayuri Watanabe6; Elaine Gagete Miranda-da-Silva7; Ana Carolina D'Onofrio-Silva6; Fabiana Andrade Oliveira2; Mario Gueller8; Nathalia Coelho Portilho Kelmann6
1. Universidade Federal do Estado do Rio de Janeiro, UNIRIO, Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
2. Universidade Federal de São Paulo, UNIFESP, Alergia e Imunologia - São Paulo, SP, Brasil
3. Departamento de Clínica Médica da Universidade Federal de Santa Catarina e HU-UFSCEBSERH, Alergia e Imunologia - Florianópolis, SC, Brasil
4. Universidade Federal de Goiás, Alergia e Imunologia - Goiânia, GO, Brasil
5. Instituto de Assistência Médica ao Servidor Público Estadual de S. Paulo, IAMSPE, Alergia e Imunologia - São Paulo, SP, Brasil
6. Faculdade de Medicina da Universidade de São Paulo, FMUSP, Disciplina de Imunologia Clínica e Alergia da FMUSP - São Paulo, SP, Brasil
7. Faculdade de Medicina UNESP, Alergia e Imunologia - Botucatu, SP, Brasil
8. Academia de Medicina do Rio de Janeiro, Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Albertina Varandas Capelo
E-mail: albertinacapelo@hotmail.com
Submetido em: 29/07/2024
Aceito em: 03/09/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A anafilaxia é uma emergência médica potencialmente fatal que requer intervenção rápida e eficaz. Compreender e atualizar as práticas clínicas é crucial para garantir os melhores cuidados aos pacientes. Esta atualização baseada em evidências e experiência clínica de especialistas mostra uma discussão de aspectos focados em sete diferentes áreas com novas evidências e diferentes das diretrizes práticas anteriores. O texto resume desde aspectos do diagnóstico da anafilaxia, mastocitose, com destaque para o escore de indicação de biópsia de medula óssea e alfa triptasemia hereditária, investigação da anafilaxia perioperatória, influência dos betabloqueadores e inibidores da enzima de conversão da angiotensina, além das importantes indicações da prescrição dos autoinjetores de adrenalina, destacando-se aspectos práticos no manejo da autoprescrição.
Descritores: Anafilaxia, epinefrina, diagnóstico, mastocitose.
Introdução
O CID 11 define anafilaxia como reação de hipersensibilidade sistêmica grave, com ameaça à vida, com início rápido de alterações potencialmente fatais em vias aéreas, respiração ou circulação e geralmente associada às alterações em pele e mucosas1. O diagnóstico é clínico, não há marcadores definitivos, e não há um padrão evolutivo de sintomas2. Em 2019, a WAO propôs modificações para simplificar o diagnóstico e englobar reações graves não classificadas como anafilaxia pelos critérios anteriores (Tabela 1)3.
Podem ocorrer reações com rápida progressão, porém de início tardio após exposição ao alérgeno, como as causadas por alfa-gal e imunoterapia3.
Mastocitose e Síndromes de Ativação Mastocitária (SAM)
As doenças mastocitárias estão comumente associadas à anafilaxia. O risco de anafilaxia na mastocitose sistêmica é estimado em torno de 40% a 50% nos adultos e 10% em crianças. Atualmente, são conhecidos vários fenótipos, métodos diagnósticos, além de tratamentos voltados tanto para a prevenção quanto para a resolução efetiva dos diferentes quadros anafiláticos. São descritos fatores de risco para anafilaxia associada à mastocitose: sexo masculino, IgE sérica maior que 15 kU/L, atopia, triptase sérica basal menor que 42 ng/mL4.
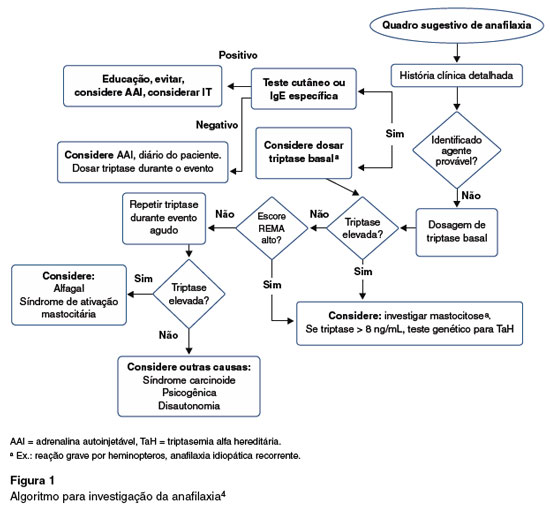
Na anafilaxia é necessário, sempre que possível, dosar a triptase sérica. Porém, quando houver suspeita de mastocitose sistêmica, mesmo com triptase normal, deve-se realizar investigação com biópsia de medula óssea. Além disso, devem-se excluir diagnósticos diferenciais quando triptase estiver elevada, como neoplasia, infecção por helmintos, insuficiência renal, e síndrome hipereosinofílica, além da mastocitose sistêmica, alfa-tripatasemia hereditária (SAM). A triptase sérica basal é importante quando se trata de anafilaxia por picadas de insetos himenópteros, particularmente com hipotensão arterial independente da presença de urticária, anafilaxia idiopática, e na suspeição de mastocitose. Nestes casos, sugere-se a biópsia de medula óssea, principalmente quando o escore preditor da Rede Espanhola de Mastocitose (REMA), que estabelece desordem clonal de mastócito, for ≥ 2 (Tabela 2)5.
O valor laboratorial normal para a triptase sérica é de 11,4 ng/mL. A elevação da triptase sérica, dentro de 2 horas após o episódio anafilático para indicar SAM, deve sofrer aumento de 20% da triptase basal mais 2 ng/mL. Além disso, nível basal elevado (acima de 8 ng/mL) pode indicar a presença de alfa-triptasemia hereditária6.
Na mastocitose, com critérios estabelecidos pela WHO, pode ocorrer anafilaxia espontaneamente, e às vezes também pela prática de exercícios aeróbicos. Outros gatilhos potenciais incluem alergia alimentar, medicamentosa e a alergia pólen-fruta3. Mastocitose cutânea e mastocitomas benignos podem surgir em crianças, e não costumam se associar a mastocitose sistêmica. Pacientes com mastocitose e anafilaxia pelos insetos himenópteros devem fazer imunoterapia subcutânea com extratos alergênicos por toda a vida, e se necessário, iniciá-la durante a gestação. Nestes casos, o maior risco de reações sistêmicas aumenta com a imunoterapia e, portanto, deve ser usada com cautela, e pode necessitar adição de omalizumabe para a prevenção de potencial anafilaxia, principalmente nos protocolos de rápida dessensibilização7.
As síndromes de ativação mastocitária têm em comum a desgranulação citoplasmática dos mediadores da anafilaxia presentes nos mastócitos. Podem ser classificadas em três grupos: Primárias/Clonais (monoclonal e mastocitose sistêmica); Secundárias (IgE-mediadas); e Não-Clonais Idiopáticas (anafilaxia idiopática). Portanto, todo paciente que não preencha critérios de anafilaxia deve ser identificado quanto aos três critérios abaixo (incluir os três)8:
(1) Sintomatologia em pelo menos dois órgãos diferentes (cardiovascular, respiratório, nasocular, gastrointestinal e cutâneo);
(2) Documentação bioquímica da liberação de mediadores da anafilaxia (triptase, prostaglandina D2, prostaglandina F-2-alfa, leucotrieno E4, e catecolaminas);
(3) Resposta terapêutica aos antimediadores, estabilizadores de membrana, e nos produtores das substâncias vasoativas (anti-histaminicos H1 e H2, anti-leucotrieno, cetotifeno, cromoglicato, omalizumabe e corticoide).
Pacientes com sintomas crônicos e inespecíficos envolvendo vários órgãos, além daqueles com intolerâncias alimentares e ambientais que não preenchem os critérios acima, não devem ser diagnosticados como SAM.
O algoritmo de diagnóstico mostra os critérios atualizados na investigação da anafilaxia4 (Figura 1).
Anafilaxia em lactentes e crianças
Embora com nível de evidência baixo, o documento sugere os mesmos critérios de anafilaxia para adultos, já que não há consenso para a faixa etária. Em bebês e crianças pequenas a idade não se correlaciona com a gravidade da reação, e que anafilaxia é improvável em bebês como reação inicial a um alimento ou medicamento na primeira exposição. Com relação à apresentação clínica, bebês e crianças pequenas apresentam mais sintomas cutâneos e subjetivos, como puxar e arranhar, e menos sintomas respiratórios em comparação com crianças mais velhas9. Em bebês, as alterações comportamentais incluem retraimento, choro inconsolável, irritabilidade ou apego. Sugere prescrição das doses de 0,1 mg ou 0,15 mg de adrenalina autoinjetável para bebês/crianças com peso inferior a 15 kg e aponta que agulhas mais longas aumentam risco de atingir o osso. Mais pesquisas são necessárias para determinar o verdadeiro risco de injeção intraóssea e como ela pode afetar a eficácia da adrenalina10.
Betabloqueadores (BB) e Inibidores da Enzima Conversora de Angiotensina na Anafilaxia (IECA)
Quanto aos Betabloqueadores (BB) e Inibidores da Enzima Conversora de Angiotensina na Anafilaxia (IECA) deve-se considerar a contraindicação anterior deles em pacientes com alto risco para anafilaxia, já que a maioria dos estudos anteriores era com BB não seletivos e não consideraram comorbidades cardíacas que poderiam explicar, de forma independente, o aumento do risco de anafilaxia grave. Além disso, interrupção ou mudança do tratamento pode ter mais riscos do que o de anafilaxia mais grave. Abaixo estão destacados os casos específicos, em que os BB e IECA devem ser continuados quando a necessidade supere a probabilidade de maior gravidade de anafilaxia: histórico de anafilaxia por himenópteros antes da imunoterapia; imunoterapia com veneno; e durante a fase de manutenção, em geral não há necessidade de interromper. Porém, o uso deve ser desencorajado quando houver risco significativo de anafilaxia recorrente ou episódios imprevisíveis, como alergias alimentares graves, mastocitose e síndrome de ativação mastocitária ou anafilaxia induzida por exercício; mas sempre com avaliação personalizada e cautelosa. Em procedimentos planejados, como exames contrastados, teste de provocação/dessensibilização e infusão, a discussão deve ser compartilhada, avaliando-se o risco relativo de anafilaxia, possibilidade de reação mais grave se medicação continuada, e risco de sua interrupção11.
Anafilaxia perioperatória
A Anafilaxia Perioperatória (APO) ocorre em uma taxa de 15,3 por 100.000 casos1. Tem sido percebida uma tendência na diminuição das anafilaxias por látex e um aumento por antimicrobianos, especialmente a cefazolina. A anafilaxia pode ocorrer devido à ativação imunológica e não imunológica de mastócitos. Já existem evidências suficientes que demonstram que a reanimação em si não implica no aumento da triptase sérica, e, portanto, elevações de triptase estão diretamente ligadas aos casos de anafilaxias graves. A dosagem da histamina plasmática não é recomendada devido a sua rápida degradação e declínio dos valores sanguíneos após a anafilaxia. A interpretação dos níveis de triptase obtidos na proximidade da morte ou post-mortem pode não ser confiável, pois aumentos inespecíficos ocorrem durante a isquemia. Estima-se que a triptase seja estável por até 1 ano se uma amostra de sangue for congelada após o processamento. Porém, o tempo para a coleta da triptase deve ser levado em conta, ocorrendo pico inicial em torno de 30 minutos e decrescendo em 120 minutos aproximadamente. Se o nível sérico de triptase estiver aumentado após APO, deve-se repetir a dosagem após a recuperação do paciente para se obter nível basal de triptase12.
Testes cutâneos de hipersensibilidade imediata (percutâneo e intradérmico) e/ou testes de IgE específicos in vitro devem ser realizados para todos os possíveis culpados farmacológicos e não farmacológicos usados no perioperatório. Se o teste não for possível, sugerimos o encaminhamento para outro centro ou, o uso dos agentes mais eficazes, estruturalmente diferentes do culpado mais provável1.
Os agentes bloqueadores neuromusculares (NMBA) estão entre as causas mais comuns de APO, devendo os testes sempre incluir o NMBA potencial culpado e quaisquer agentes NMBA alternativos para afastar reatividade cruzada entre agentes quimicamente relacionados, o que ainda não está bem documentado. Os testes cutâneos de hipersensibilidade imediata como opioides ou vancomicina podem não ser confiáveis devido às altas taxas de resultados falso-positivos, uma vez que são ativadores diretos de mastócitos. Além disso, evitar medicamentos com resultado positivo no teste cutâneo é a melhor opção quando alternativas igualmente eficazes e estruturalmente não relacionadas estejam disponíveis. Os dados revelam que a administração de agentes com resultados de testes negativos pode prosseguir com segurança, sugerindo que os testes podem ser úteis na seleção de medicamentos para anestesia subsequente. Outrossim, quando o resultado do teste cutâneo for negativo (por exemplo, látex, lidocaína, clorexidina, iodopovidona), deve ser realizada a provocação, uma vez que a sensibilidade dos testes não está bem estabelecida. Para alguns agentes, por exemplo, NMBAs, midazolam, propofol, seria apropriado que um anestesiologista os administrasse em uma dose graduada (isto é, "dose teste"), de 10%, imediatamente antes do procedimento planejado e após observação, aplicar a dose completa. Indica-se o atraso do teste cutâneo de hipersensibilidade imediato por 4 a 6 semanas após a anafilaxia; e quando não for possível realizar os testes ou encaminhar a um centro para fazê-los, ou urgência no procedimento, deve-se evitar os culpados mais prováveis e usar agentes estruturalmente diferentes mais eficazes13.
Quanto à penicilina, o teste cutâneo de hipersensibilidade imediata é validado, e, portanto, quando o teste for positivo apenas para os betalactâmicos e a avaliação de outra alternativa não for viável, deve-se usar todos os medicamentos perioperatórios, exceto os betalactâmicos. O ambiente livre de látex deve ser orientado se houver suspeita de alergia ao látex, quando a investigação não tiver sido concluída.
Outra evidência é de que não existe consenso a favor ou contra o uso de pré-tratamento antes da cirurgia em pacientes com investigação negativa. Portanto, é recomendado que esta decisão seja individualizada.
A repetição da anestesia deve prosseguir no contexto da tomada de decisão de forma compartilhada, orientada pela história e pelos resultados da avaliação diagnóstica. Estudos mostram que a recorrência da APO ocorre em 1,7% dos casos, quando tomadas as medidas acima14.
Anafilaxia em ambientes comunitários
A literatura mostra que quanto mais jovem a população, maior a frequência de eventos de anafilaxia vivenciada no ambiente doméstico. Porém, tem aumentado nas escolas e restaurantes, sendo que 1 em cada 10 reações alérgicas e casos de anafilaxia em crianças ocorrem em creches ou escolas. Embora as mortes por anafilaxia sejam raras, elas podem ocorrer em qualquer lugar. Não há recomendação para proibição de alimentos específicos dentro das creches e escolas, podendo ser apropriado implementar zonas restritas aos alérgenos (por exemplo: mesa sem leite) quando houver crianças que não tenham a capacidade de se autogerirem. Outras estratégias incluem lavar as mãos antes e depois de comer, evitar compartilhar alimentos e bebidas com outras pessoas e verificar listas de ingredientes em busca de alérgenos suspeitos. Além disso, supervisão de um adulto durante as refeições e lanches, a limpeza das superfícies onde os alimentos são preparados e consumidos e a adoção de medidas para evitar os alérgenos ao planejar atividades em sala de aula (por exemplo, festas, artesanato, projetos de ciências), ou viagens de campo15.
Sugere-se aos médicos que orientem os pacientes, que apesar da "Lei do Rótulo" (divulgação dos principais alérgenos nos rótulos dos alimentos pré-embalados), os restaurantes não são obrigados a declararem os ingredientes. O ideal seria instruir colaboradores de restaurantes, particularmente para pedidos online, e de comida asiática. Neste caso, deveriam listar alérgenos (os principais implicados foram amendoim, nozes, e leite) ou ingredientes no cardápio, particularmente alguns alimentos, como gergelim, recentemente adicionado pela FDA (Food and Drug Administration). A maioria dos países não permite que restaurantes comprem epinefrina autoinjetável, sem receita médica.
Estudo mostrou que epinefrina foi administrada em 10% a 15% dos casos de alergia a bordo, porém, possivelmente, menos de 50% notificaram as companhias aéreas. Estima-se frequência de 1 anafilaxia a cada 37.750 voos. Muitas companhias aéreas fornecem algumas informações para pacientes com alergia, no entanto, apenas alguns oferecem refeições livres de alérgenos ou permitem embarque prioritário, além disso, o piloto pode recusar o embarque a um passageiro com risco potencial de desvio de voo, ou perigo para o mesmo.
Nos parques e outros espaços ao ar livre, a anafilaxia ocorre principalmente por ferroadas de insetos. Anafilaxia induzida por exercício dependente de alimento também ocorre mais frequentemente durante refeições ao ar livre, sendo as reações medicamentosas mais comuns em domicílio16.
Recomenda-se que seja opcional aos indivíduos em risco de anafilaxia, usar ou portar identificação médica (por exemplo, joias ou cartão), devendo o texto de alerta ser verificado quanto à exatidão por um profissional de saúde. Não se sabe se joias de alerta médico ou cartões de identificação reduzem o risco de anafilaxia ou resultem em tratamento mais rápido1.
Quando prescrever autoinjetores de adrenalina?
Embora não haja indicação validada que informe quando prescrever autoinjetores de adrenalina, a sua prescrição está indicada, de acordo com a orientação de especialistas nos vários casos (Tabela 3)17-19.
A indicação da adrenalina autoinjetável para pacientes em uso de omalizumabe é feita na sua bula, porém a FDA não recomenda esta prática, com base nos resultados atualizados dos estudos. Somente os EUA indica a prescrição de autoinjetores de adrenalina para pacientes em tratamento com imunoterapia sublingual. Portanto, deve-se avaliar o risco em cada caso, indicando-se os autoinjetores de adrenalina (AIA) se houver história de anafilaxia anterior, para pacientes asmáticos, ou outros potenciais fatores de risco20,21.
Para pacientes de menor risco, os autores sugerem que haja um processo de decisão compartilhada levando em conta os fatores de risco, valores e preferências dos pacientes. Existem fatores de risco que aumentam significativamente o risco relativo de anafilaxia, porém o risco absoluto permanece pequeno. O risco de anafilaxia de um paciente depende em parte do seu diagnóstico específico, do histórico de reação(ões) prévia(s), da facilidade com que pode evitar agentes ou circunstâncias causais, cofatores presentes e se terminaram uma imunoterapia específica1.
Recomenda-se que fatores como dosagem, comprimento da agulha, custo e acesso e preferências de tratamento do paciente, devem ser levados em consideração ao prescrever um autoinjetor22. Por exemplo, no caso do paciente obeso, pode ocorrer injeção subcutânea ao invés de intramuscular, o que poderia ser devido ao tamanho da agulha, insuficiente para alcançar a musculatura. Além disso, a dose fixa dos autoinjetores no caso das crianças poderia ser insuficiente ou mesmo ser aplicado uma super dosagem. Apesar disso, para a grande maioria dos pacientes com anafilaxia os autoinjetores são a opção mais segura e eficaz, e seu porte cotidiano deve ser estimulado por todos que estão sob risco de apresentar novos episódios da doença. A Tabela 4 mostra as características dos principais autoinjetores de adrenalina disponíveis no mercado.
A prescrição de dois dispositivos de adrenalina se justifica, mesmo com aumento do custo, uma vez que menos de 10% das reações requerem duas ou mais doses de epinefrina durante um episódio de anafilaxia23.
Ademais, existe a probabilidade de atraso em conseguir assistência médica como, por exemplo, em áreas de difícil acesso ou durante viagens. Portanto, para justificar a prescrição de apenas um dispositivo, autoinjetores de "uso genérico" ou de "estoque" precisariam estar disponíveis em escolas e outros ambientes públicos, semelhante ao fornecimento comunitário de desfibriladores cardíacos, o que não ocorre na prática em nosso meio1.
Outro aspecto importante que se destaca, é que apesar do aumento da difusão dos conhecimentos sobre anafilaxia, permanece baixa a prescrição de adrenalina e sua utilização pelo profissional. Além disso, pacientes e familiares, mesmo sendo treinados e orientados corretamente, ainda se sentem inseguros, ansiosos e com medo da aplicação do autoinjetor. Reforça-se, portanto, que o treinamento do paciente e de sua família seja contínuo e de fácil entendimento, com o objetivo do reconhecimento precoce dos sintomas e do pronto tratamento24,25.
Em relação à recomendação da dose, a FDA aprova a dose de 0,3 mg para pacientes com peso acima ou igual a 30 kg, 0,15 mg para pacientes com peso entre 15 e 30 kg, e 0,1 mg (Auvi-Q) para pacientes com peso entre 7,5 e 15 kg26. No entanto, várias organizações médicas, como a Academia Americana de Alergia, Asma e Imunologia (AAAAI), Academia Americana de Pediatria, Sociedade Canadense de Alergia e Imunologia Clínica e a Academia Europeia de Alergia e Imunologia Clínica apoiam a opção de usar a dose de 0,1 mg (se disponível no país) para pacientes com peso entre 7,5 e 13 kg; a dose de 0,15 mg para pacientes pesando 13 a 25 kg; e acima de 25 kg a dose de 0,3 mg. Para pacientes com 45 quilos ou mais, recomenda-se a dose de 0,5 mL, porém poucos fabricantes comercializam autoinjetores com 0,5 mg de adrenalina (Tabela 5)27.
Além disso, é indicado que quando for aplicada a dose de 0,3 mL de adrenalina e houver necessidade de repetir, que seja usada a dose maior de 0,5 mL. Também o treinamento de como e quando usar a adrenalina é fundamental e faz parte do aconselhamento ao paciente. O uso precoce de adrenalina na anafilaxia diminui o risco de reação bifásica e de hospitalização26.
A revisão destaca que diferentemente do que se indicava quanto ao acionamento do serviço de emergência em qualquer caso de anafilaxia28,29, acionar o serviço de emergência após o uso de autoinjetor pode não ser necessário se o paciente apresentar uma resposta imediata, completa e duradoura ao tratamento e se portar um outro autoinjetor de adrenalina. Portanto, indica-se acionamento do serviço de emergência no caso de anafilaxia grave, ou sintomas que não desapareçam imediatamente ou quase completamente, ou, ainda sintomas que retornem ou piorem. Porém, esta decisão deve ser compartilhada, considerando as limitações pessoais e sociais dos pacientes.30,31 A Tabela 6 mostra as recomendações quanto ao acionamento do serviço de emergência e administração de uma segunda dose de adrenalina.
Pacientes e cuidadores devem sempre lembrar-se de substituir os dispositivos após terem sido usados ou expirados. Caso esqueçam de substituir o autoinjetor vencido ou não puderem fazê-lo por outros motivos, é preferível usar o dispositivo expirado em detrimento de não usar dispositivo algum para tratar a anafilaxia. Estudos recentes descobriram que autoinjetores vencidos apresentam concentração de adrenalina (80%-90%), muito além de suas datas de validade32,33. As doses pediátricas podem degradar-se mais rapidamente após o vencimento da data de validade em comparação com as doses para adultos26,33.
Referências
1. Simons FE, Ardusso LR, Bilò MB, El-Gamal YM, Ledford DK, Ring J, et al.; World Allergy Organization. World allergy organization guidelines for the assessment and management of anaphylaxis. World Allergy Organ J. 2011 Feb;4(2):13-37. doi: 10.1097/WOX.0b013e318211496c.
2. Golden DBK, Wang J, Waserman S, Akin C, Campbell RL, Ellis AK, et al. Anaphylaxis: A 2023 practice parameter update. Ann Allergy Asthma Immunol. 2024;132(2):124-76.
3. Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organization Journal. 2020 Oct 1;13(10).
4. Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. The diagnosis and management of anaphylaxis: an updated practice parameter. J Allergy Clin Immunol. 2005 Mar;115(3 Suppl 2):S483-523. doi: 10.1016/j.jaci.2005.01.010.
5. Alvarez-Twose I, González de Olano D, Sánchez-Muñoz L, Matito A, Esteban-López MI, Vega A, et al. Clinical, biological, and molecular characteristics of clonal mast cell disorders presenting with systemic mast cell activation symptoms. J Allergy Clin Immunol. 2010 Jun;125(6):1269-1278.e2.
6. Lyons JJ. Hereditary alpha tryptasemia: genotyping and associated clinical features. Immunol Allergy Clin North Am. 2018;38(3):483-95.
7. Giannetti M, Silver J, Hufdhi R, Castells, MC. One-day ultrarush desensitization for Hymenoptera venom anaphylaxis in patients with and without mast cell disorders with adjuvant omalizumab. J Allergy Clin Immunol Pract. 2020;8:1431-5.
8. Gülen T, Akin C, Bonadonna P, Siebenhaar F, Broesby-Olsen S, Brockow K, et al. Selecting the Right Criteria and Proper Classification to Diagnose Mast Cell Activation Syndromes: A Critical Review. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3918-28.
9. Greenhawt M, Gupta RS, Meadows JA, Pistiner M, Spergel JM, Camargo CA Jr, et al. Guiding Principles for the Recognition, Diagnosis, and Management of Infants with Anaphylaxis: An Expert Panel Consensus. J Allergy Clin Immunol Pract. 2019 Apr;7(4):1148-1156.e5.
10. Robinson LB, Arroyo AC, Faridi MK, Rudders S, Camargo Jr. CA. Trends in US Emergency Department visits for anaphylaxis among infants and toddlers: 2006-2015. J Allergy Clin Immunol Pract. 2021;9(5):1931-1938.e2.
11. Nassiri M, Babina M, Dolle S, Edenharter G, Rueff F, Worm M. Ramipril and metoprolol intake aggravate human and murine anaphylaxis: evidence for direct mast cell priming. J Allergy Clin Immunol. 2015;135(2):491-9.
12. Laroche D, Gomis P, Gallimidi E, Malinovsky JM, Mertes PM. Diagnostic value of histamine and tryptase concentrations in severe anaphylaxis with shock or cardiac arrest during anesthesia. Anesthesiology. 2014;121(2):272-9.
13. Gonzalez-Estrada A, Pien LC, Zell K, Wang XF, Lang DM. Antibiotics are an impor- tant identifiable cause of perioperative anaphylaxis in the United States. J Allergy Clin Immunol Pract. 2015;3(1). 101-5.e1.
14. Elwyn G, Frosch D, Rollnick S. Dual equipoise shared decision making: definitions for decision and behaviour support interventions. Implement Sci. 2009;4:75.
15. Waserman S, Cruickshank H, Hildebrand KJ, Mack D, Bantock L, Bingemann T, et al. Prevention and management of allergic reactions to food in child care centers and schools: practice guidelines. J Allergy Clin Immunol. 2021;147(5):1561-78.
16. Greenhawt M, MacGillivray F, Batty G, Said M, Weiss C. International study of risk-mitigating factors and in-flight allergic reactions to peanut and tree nut. J Allergy Clin Immunol Pract. 2013;1(2):186-94.
17. Lieberman JA, Wang J. Epinephrine in anaphylaxis: too little, too late. Curr Opin Allergy Clin Immunol. 2020;20(5):452-8.
18. Schworer SA, Kim EH. Sublingual immunotherapy for food allergy and its future directions. Immunotherapy. 2020;12(12):921-31.
19. Saleh-Langenberg J, Flokstra-de Blok BMJ, Goossens NJ, Kemna JC, van der Velde JL, Dubois AEJ. The compliance and burden of treatment with the epinephrine auto-injector in food-allergic adolescents. Pediatr Allergy Immunol. 2016;27 (1):28-34.
20. Corren J, Casale TB, Lanier B, Buhl R, Holgate S, Jimenez P. Safety and tolerability of omalizumab. Clin Exp Allergy. 2009;39(6):788-97.
21. Shaker M, Briggs A, Dbouk A, Dutille E, Oppenheimer J, Greenhawt M. Estimation of health and economic benefits of clinic versus home administration of omalizumab and mepolizumab. J Allergy Clin Immunol Pract. 2020;8(2):565-72.
22. Song TT, Lieberman P. Epinephrine auto-injector needle length: what is the ideal length? Curr Opin Allergy Clin Immunol. 2016;16(4):361-5.
23. Patel N, Chong KW, Yip AYG, Ierodiakonou D, Bartra J, Boyle RJ, et al. Use of multi ple epinephrine doses in anaphylaxis: a systematic review and meta-analysis. J Allergy Clin Immunol. 2021;148(5):1307-15.
24. Lieberman JA, Wang J. Epinephrine in anaphylaxis: too little, too late. Curr Opin Allergy Clin Immunol. 2020;20(5):452-8.
25. Prince BT, Mikhail I, Stukus DR. Underuse of epinephrine for the treatment of anaphylaxis: missed opportunities. J Asthma Allergy. 2018;11:143-51.
26. PR Newswire. U.S. FDA approves Kaleo 's AUVI-Q (Epinephrine injection, USP) 0.1-mg auto-injector for life-threatening allergic reactions in infants and small children [Internet]. Disponível em: https://www.prnewswire.com/news-releases/us-fda-approves-kaleosauvi-q-epinephrine-injection-usp-01-mg-auto-injector-for-life-threatening-allergicreactions-in-infants-and-small-children-300559170.html. Acessado em: 15/09/2022.
27. Li LDX, Abrams EM, Lavine E, Hildebrand K, Mack DP. CSACI position statement: transition recommendations on existing epinephrine autoinjectors. Allergy Asthma Clin Immunol. 2021;17(1):130.
28. Wang J, Sicherer SH; SECTION ON ALLERGY AND IMMUNOLOGY. Guidance on Completing a Written Allergy and Anaphylaxis Emergency Plan. Pediatrics. 2017;139(3):e20164005.
29. American Academy of Allergy, Asthma & Immunology. Anaphlyaxis emergency action plan [Internet]. Disponível em: https://www.aaaai.org/aaaai/media/medialibrary/pdf%20documents/libraries/anaphylaxis-emergency-action-plan.pdf. Acessado em: 07/09/2022.
30. Casale TB, Wang J, Nowak-Wegrzyn A. Acute at home management of anaphylaxis during the COVID-19 pandemic. J Allergy Clin Immunol Pract. 2020;8 (6):1795-7.
31. Casale TB, Wang J, Oppenheimer J, Nowak-Wegrzyn A. Acute at-home management of anaphylaxis: 911: what is the emergency? J Allergy Clin Immunol Pract. 2022;10(9):2274-9.
32. Cantrell FL, Cantrell P, Wen A, Gerona R. Epinephrine concentrations in EpiPens after the expiration date. Ann Intern Med. 2017;166(12):918-9.
33. Kassel L, Jones C, Turin R, Daly M, Mengesha A. Enantiomeric degradation of epinephrine in autoinjector products. J Allergy Clin Immunol Pract. 2022;10(9):2463-2465.e1.