Número Atual: Outubro-Dezembro 2024 - Volume 8 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Faradiba Sarquis Serpa
- Gustavo Falbo Wandalsen
- Solange Oliveira Rodrigues Valle
- Adelmir Souza Machado
- Alfeu Tavares França
- Álvaro Augusto Cruz
- Antonio Carlos Pastorino
- José Angelo Rizzo
- José Elabras-Filho
- Luane Marques de-Mello
- Patricia Polles de Oliveira Jorge
- Pedro Giavina-Bianchi
- Ekaterini Simões Goudoris
- Fabio Chigres Kuschnir
ARTIGO ESPECIAL
Aspergilose Broncopulmonar Alérgica (ABPA): guia da Associação Brasileira de Alergia e Imunologia para o diagnóstico e manejo
Allergic bronchopulmonary aspergillosis: Brazilian Association of Allergy and Immunology guidelines for diagnosis and management
Faradiba Sarquis Serpa1,2; Gustavo Falbo Wandalsen2,3; Solange Oliveira Rodrigues Valle2,4; Adelmir Souza Machado2,5; Alfeu Tavares França4; Álvaro Augusto Cruz2,5; Antonio Carlos Pastorino2,6; José Angelo Rizzo2,7; José Elabras-Filho2,4; Luane Marques de-Mello2,8; Patricia Polles de Oliveira Jorge2,9; Pedro Giavina-Bianchi2,6; Ekaterini Simões Goudoris4,10; Fabio Chigres Kuschnir11,12
1. Escola Superior de Ciências da Santa Casa de Misericórdia de Vitória - Vitória, ES, Brazil
2. Associação Brasileira de Alergia e Imunologia, ASBAI, Departamento Científico de Asma - São Paulo, SP, Brazil
3. Universidade Federal de São Paulo, UNIFESP - São Paulo, SP, Brazil
4. Universidade Federal do Rio de Janeiro, UFRJ - Rio de Janeiro, RJ, Brazil
5. Universidade Federal da Bahia, UFBA - Salvador, BA, Brazil
6. Faculdade de Medicina da Universidade de São Paulo, FMUSP - São Paulo, SP, Brazil
7. Universidade Federal de Pernambuco, UFPE - Recife, PE, Brazil
8. Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, FMRP-USP - Ribeirão Preto, SP, Brazil
9. Universidade Federal de São Carlos, UFSCAR - São Carlos, SP, Brazil
10. Associação Brasileira de Alergia e Imunologia, ASBAI, Diretoria Científica - São Paulo, SP, Brazil
11. Universidade do Estado do Rio de Janeiro, UERJ - Rio de Janeiro, RJ, Brazil
12. Associação Brasileira de Alergia e Imunologia, ASBAI - São Paulo
Endereço para correspondência:
Faradiba Sarquis Serpa
E-mail: faradibasarquis@uol.com.br
Submetido em 28/10/2024
Aceito em 01/11/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A Aspergilose Broncopulmonar Alérgica (ABPA) é uma doença imunoalérgica pulmonar causada por reações de hipersensibilidade aos antígenos do fungo Aspergillus fumigatus. A doença afeta principalmente pessoas com asma ou fibrose cística e pode levar a dano pulmonar irreversível se não diagnosticada e adequadamente tratada. Apesar de descrita há quase 70 anos, a doença ainda é subdiagnosticada. Isso pode estar relacionado aos métodos de diagnóstico utilizados, à falta de testes padronizados e a critérios diagnósticos ainda imprecisos. O tratamento principal envolve o uso de corticosteroides sistêmicos. Antifúngicos azólicos são indicados para tratar exacerbações e são a estratégia preferencial para reduzir o uso de corticosteroides. Medicamentos biológicos prometem ser úteis no tratamento da ABPA, devido à sua capacidade de inibir a inflamação tipo 2, regular os níveis de eosinófilos e IgE e modular citocinas inflamatórias. Assim, frente a pacientes com asma, principalmente aqueles que têm dificuldade em alcançar o controle da doença, deve ser considerada a hipótese de ABPA. Devido à variabilidade dos critérios diagnósticos e à necessidade de verificar a sua validação em populações distintas, são necessários mais estudos para um melhor entendimento da doença, possibilitando sua detecção precoce e manejo adequado. Nestas diretrizes procuramos atualizar dados sobre epidemiologia, manifestações clínicas, diagnóstico, diagnóstico diferencial e tratamento desta doença.
Descritores: Aspergilose broncopulmonar alérgica, aspergilose pulmonar, asma, bronquiectasia, eosinofilia, imunoglobulina E.
Introdução
A Aspergilose Broncopulmonar Alérgica (ABPA) é uma doença pulmonar complexa, descrita originalmente em 1952 por Hinson e cols. na Inglaterra em indivíduos que apresentavam bronquite/asma, eosinofilia periférica, bronquiectasias e/ou eliminação de tampões mucosos com a presença do fungo Aspergillus fumigatus (Af )1. Em 1968, a doença foi relatada nos Estados Unidos2 e, em 1974, França AT descreveu nove casos no Brasil, sendo oito em adultos e um em criança3.
A ABPA é a causa mais comum de Micose Broncopulmonar Alérgica (MBPA), uma enfermidade não invasiva, porém com alto poder destrutivo pulmonar. Acomete indivíduos com condições favoráveis à germinação de conídios do fungo Af, especialmente pacientes com asma ou com fibrose cística (FC)4.
O Af é um fungo de distribuição universal encontrado principalmente em locais com matéria orgânica em decomposição como plantas e animais mortos. A concentração do fungo na atmosfera, o tamanho dos conídios (2,5-3 mm), a mutabilidade, o grau de alergenicidade, as condições atmosféricas, a termotolerância (12-52 °C), a produção de micotoxinas, assim como a idade e a competência imune do hospedeiro são fatores determinantes para a sua patogenicidade4,5.
A presença de inflamação da mucosa brônquica como ocorre na asma e na FC facilita a retenção e germinação dos conídios, com formação do tubo germinativo e hifas, que são as produtoras dos principais antígenos do Af. Logo, dependendo da genética e do estado imune do indivíduo podem ocorrer reações de hipersensibilidade dos tipos I e III ocasionando a ABPA. As manifestações clínicas da ABPA podem variar desde broncoespasmo leve até fibrose pulmonar 4-6.
A ABPA é uma doença que permanece pouco reconhecida e cerca de 30% dos pacientes são inicialmente diagnosticados erroneamente com tuberculose, principalmente em países em desenvolvimento como o Brasil6.
Dada a propensão da doença a causar complicações irreversíveis, é essencial formular políticas de rastreamento para ABPA, pois a detecção precoce da doença é fundamental para o tratamento adequado e um melhor prognóstico.
Este manuscrito tem como objetivo fornecer uma revisão sobre a ABPA, incluindo sua epidemiologia, manifestações clínicas, diagnóstico, diagnóstico diferencial e tratamento.
Epidemiologia
No mundo, estima-se que mais de 4 milhões de pessoas sejam afetadas pela ABPA4,7. Entretanto, a exata prevalência da doença ainda não está totalmente estabelecida, e varia de acordo com a região estudada. A ABPA ocorre em torno de 2,5% a 15% dos pacientes com asma e entre 7% e 9% dos pacientes com FC4,8.
A prevalência da ABPA é maior que 40% em pacientes com asma sensíveis ao Af, sendo mais frequente nos asmáticos graves8. No Brasil, em asmáticos adultos sensibilizados ao Af, a prevalência foi de 20%9. Em crianças com FC (mediana de idade de 7,3 anos) a taxa de sensibilização alérgica detectada por teste cutâneo ou IgE sérica específica variou entre 12,5% e 23%10,11. Na comparação global, a maior prevalência de ABPA foi relatada na Índia12.
Não há predileção por idade ou sexo para a ocorrência de ABPA, mas a maior frequência ocorre em indivíduos adultos13. Além disso, a predisposição genética, como alelos específicos do HLA-DR, pode contribuir para o desenvolvimento da ABPA em indivíduos suscetíveis14.
As dificuldades em relação à real prevalência de ABPA têm sido relacionadas à falta de testes e de critérios diagnósticos padronizados, além de características da população estudada.
O Aspergillus fumigatus
O Aspergillus é um fungo que exerce um papel importante na manutenção e equilíbrio ecológico, contribuindo com a reciclagem da matéria orgânica e a disponibilização de nutrientes15. É um organismo eucariota e heterotrófico que pertence ao Domínio Eukarya, Reino Fungi, Filo Ascomycota, Classe Eurotiomycetes, Ordem Eurotiales, Família Trichocomaceae, gênero Aspergillus, espécie Aspergillus fumigatus16.
O gênero Aspergillus é dividido em seis subgêneros: Circumdati, Nidulantes, Fumigati, Aspergillus, Cremei e Polypaecilum, que englobam 27 seções e 446 espécies17. Dentre elas, o A. fumigatus é a espécie patogênica mais importante devido a sua capacidade superior de sobreviver e crescer em uma ampla gama de condições ambientais em comparação com outras espécies18,19.
A taxonomia do Aspergillus é intrincada e sofre transformações frequentemente20. Tradicionalmente, a classificação era embasada em caracteres fenotípicos, contudo nas últimas décadas vem sendo influenciada pela caracterização molecular e quimiotaxonômica21. As novas abordagens se justificam pelo grande número de espécies que esse fungo possui, dificultando uma identificação precisa. Uma metodologia polifásica, pautada na combinação de biótipo e genótipo, vem se demonstrando mais apropriada para realizar essa identificação. A análise do biótipo compreende a forma, tamanho, cor dos conídios e termotolerância18.
A termotolerância é uma característica importante nessa diferenciação, pois o Af se distingue das outras espécies de Aspergillus pela temperatura ideal de crescimento. A do Af é de 37 °C, podendo variar de 20 a 52 °C, sendo que ele é capaz de sobreviver por longos períodos de tempo a 55 °C. Assim sendo, o Af pode ser encontrado em qualquer parte do planeta, especialmente em ambientes autoaquecidos, como feno, milho e adubos19,21.
Genotipicamente, algumas técnicas de biologia molecular podem ser utilizadas para a categorização das espécies, como, por exemplo, o uso de sequências ribossomais de RNA, do polimorfismo de comprimento de fragmentos de DNA (RFLP), de sequências de genes de proteínas codificadoras e de sequências multilocos (MLST)20. A análise das sequências dos genes que codificam beta-tubulina e calmodulina e os genes da segunda subunidade maior da RNA polimerase II (RPB2) parecem ser mais adequadas para a distinção entre as espécies de Aspergillus21.
As características morfológicas do Aspergillus foram primeiramente descritas em 1729 por Pietro Micheli, um padre e biólogo italiano que o comparou com um aspersor de água benta. Por isso deu o nome de Aspergillus a esses fungos19. Eles são compostos por filamentos celulares denominados hifas, que ao se agruparem formam o micélio e por isso são intitulados fungos filamentosos. As hifas são septadas e hialinas de diferentes diâmetros e se ramificam formando os conidióforos, que são estruturas reprodutivas assexuadas produtoras de esporos assexuais chamados conídios. Os conidióforos saem da célula basal, situada na hifa e terminam em uma vesícula que se conecta à célula basal por meio de uma haste, a estipe. Da vesícula emergem as fiálides, que são as células produtoras de conídios. Os conidióforos do Af são unisseriados, pois emergem diretamente da vesícula15.
As espécies incluídas na seção Fumigati apresentam conidióforos lisos, vesículas em forma de balão, cabeça colunar, conídios globosos esverdeados, com textura que varia de lisa a rugosa e são unisseriadas22. O conidióforo é simples e geralmente asseptado. Possui hifas septadas e hialinas e variam quanto ao diâmetro18,20 (Figura 1).
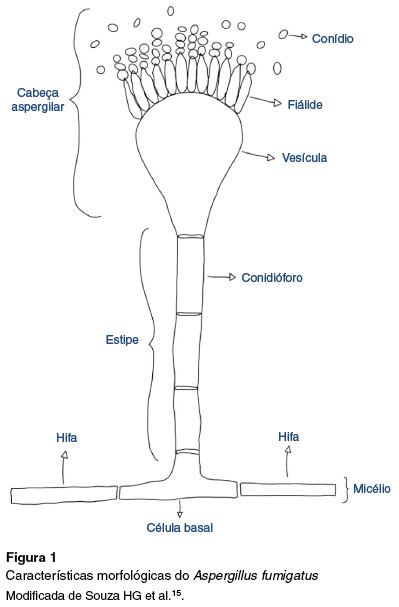
O ciclo de vida do Aspergillus é composto por duas fases: uma somática, com atividades alimentares por meio de absorção de nutrientes solúveis simples, e outra reprodutiva16. O gênero Aspergillus é anamórfico, pois, na natureza, realiza reprodução predominantemente assexuada pela produção de fiálides e conídios em cadeia20,23.
Após germinar, a hifa cresce, formando uma colônia. Na fase de colônia as hifas de Af são embebidas em uma matriz extracelular para formar um biofilme. A taxa de crescimento do Af é rápida, fator que favorece a disseminação desse fungo23.
Os conídios se desprendem e são aerotransportados, podendo ser encontrados no ambiente em concentrações entre 0,1 e 3 conídios por m3 de ar, o que permite que alcancem todos os níveis do trato respiratório. Além disso, podem permanecer adormecidos até encontrarem condições ambientais adequadas. O Af pode crescer em uma ampla variedade de substratos e tolerar congelamento ou desidratação por períodos prolongados19.
O primeiro caso de infecção por Aspergillus em humanos foi descrito por Sluyter em 184724. Dentre as patologias causadas pelo Aspergillus podemos citar micotoxicose, alergias, asma, aspergiloma, aspergilose necrotizante, aspergilose pulmonar invasiva e ABPA25.
Patogênese
A patogênese da ABPA é complexa, envolvendo fatores genéticos, interações hospedeiro-patógeno, resposta imune inata e adaptativa com reações de hipersensibilidade e inflamação eosinofílica.
Fatores genéticos podem contribuir para a suscetibilidade à ABPA. Estudos de genotipagem do antígeno leucocitário humano (HLA) identificaram alelos HLA-DR específicos, como o HLA-DR2 e HLA-DR5, associados a risco aumentado de desenvolver ABPA em pacientes asmáticos e com FC, respectivamente26. Por outro lado, o HLA-DQ2 contribui para o não desenvolvimento da doença27. Foi descrito que a variante rs35699176 no gene ZNF77 leva à perda de integridade das células do epitélio respiratório e exposição das proteínas da matriz extracelular facilitando a adesão, germinação e crescimento de conídios do Af 28. Polimorfismos nas vias da resposta imune inata, incluindo proteína surfactante A2 e receptores toll-like 3 e 9 também já foram descritos em pacientes com ABPA29-31.
O Aspergillus é um fungo saprófita onipresente no ar que é encontrado no solo e cresce em vegetação em decomposição23. O tamanho dos esporos do Aspergillus facilita sua penetração e deposição nas vias aéreas. A inalação desses esporos pode levar à colonização e germinação nas vias aéreas de indivíduos suscetíveis, especialmente aqueles com asma ou fibrose cística (FC)32.
Normalmente, o Af não provoca uma resposta imune, pois os conídios possuem uma camada hidrofóbica, composta pela proteína RodA, que impede o reconhecimento pelas células dendríticas, tornando-os imunologicamente inertes33.
Ao persistirem nas vias respiratórias os conídios germinam, dando origem às hifas, e perdem a camada hidrofóbica, fazendo com que padrões moleculares associados a patógenos (PAMPs) ativem os receptores de padrão das células epiteliais pulmonares, que liberam as alarminas IL-33, IL-25 e linfopoietina estromal tímica (TSLP) que ativam as células linfoides inatas do tipo 2 (ILC2). As ILC2 produzem citocinas T2 (IL-4, IL-5 e IL-13), resultando em eosinofilia, produção de muco e hiper-reatividade brônquica. Existem evidências de que as ILC2s interagem com linfócitos T CD4+ e facilitam o desenvolvimento da resposta imune adaptativa e inflamação persistente das vias aéreas34.
A depuração mucociliar prejudicada e a resposta imune local nesses indivíduos facilitam a persistência das hifas de Aspergillus nas vias aéreas, desencadeando uma resposta imune exagerada. Ocorre liberação de várias proteínas fúngicas e proteases (catalase, protease aspártica, metaloprotease, elastase e colagenase) que contribuem para a colonização e perpetuam o dano ao epitélio respiratório35-37.
Além disso, as hifas produzem os principais antígenos do Af. Na nomenclatura de alérgenos estabelecida pela World Health Organization e International Union of Immunological Societies (WHO/IUIS) estão listadas até o momento 30 proteínas do Af 38, sendo que cinco delas (Asp f1, Asp f2, Asp f3, Asp f4 e Asp f6) estão disponíveis para testagem como proteínas recombinantes39. A Asp f1, descrita por Arruda LK e cols., é uma proteína ribotoxina específica do Af, expressa e secretada apenas pelos esporos germinativos40. Asp f3, Asp f4 e Asp f6 são proteínas somáticas. Todos esses antígenos têm potencial para desencadear reações mediadas por IgE e IgG, entretanto, esses últimos têm potencial alergênico menor que Asp f139.
Desse modo, a patogênese da ABPA é caracterizada por um marcante processo inflamatório tipo-2 (T2) com a combinação de reações de hipersensibilidade tipo I (imediata) e tipo III (mediada por complexos imunes)41. Na hipersensibilidade do tipo I, os antígenos de Aspergillus se ligam à imunoglobulina E (IgE) na superfície de mastócitos e basófilos, levando à liberação de mediadores inflamatórios como histamina, leucotrienos e prostaglandinas, provocando broncoconstrição, aumento da permeabilidade vascular e produção de muco42. Na hipersensibilidade do tipo III, complexos imunes compostos por antígenos de Aspergillus e IgG se depositam no tecido pulmonar, ativando o sistema do complemento e consequentemente, atraindo células infamatórias, levando a dano tecidual e inflamação eosinofílica marcante43.
O processo inflamatório T2 na ABPA combina uma massiva infiltração das vias aéreas por eosinófilos e um alto nível de IgE policlonal. Os eosinófilos desempenham um papel central na patogênese da ABPA, contribuindo para a inflamação das vias aéreas, produção de muco e hiper-responsividade brônquica41. Citocinas, como interleucina (IL) 4, IL-5 e IL-13, produzidas por células Th2, estimulam o recrutamento, a ativação e a sobrevivência dos eosinófilos44. Além disso, as IL-4 e IL-13 promovem a produção de IgE por células B e induzem hiperplasia das células caliciformes, incrementando a secreção de muco. A inflamação das vias aéreas leva à produção de um muco eosinofílico denso contendo cristais de Charcot- Leyden que obstruem as vias aéreas. Variantes no gene regulador de condutância transmembrana da fibrose cística (CFTR) podem desempenhar um papel na ABPA, mesmo na ausência de FC, embora isso ainda não esteja plenamente esclarecido45.
Quadro clínico
Os achados clínicos mais frequentes na ABPA estão relacionados aos sintomas das doenças de base que a predispõem, além daqueles da própria ABPA que podem variar desde broncoespasmo leve até fibrose pulmonar. Podem ocorrer episódios de tosse paroxística e recorrente, dispneia, aumento da expectoração, sibilos, exacerbações recorrentes e intolerância aos exercícios. Dependendo do estágio da doença, são descritos expectoração de tampões mucosos acastanhados, algumas vezes hemoptise, e sintomas gerais como febre e mal-estar. Baqueteamento digital é incomum e encontrado nos pacientes com bronquiectasias de longa duração44,46.
Um subgrupo de pacientes com ABPA pode se apresentar sem asma brônquica subjacente, sendo os achados de exame de imagem do tórax os responsáveis pela suspeita da doença47. O diagnóstico de ABPA pode demorar até 10 anos para ser suspeitado e estabelecido, muitas vezes cogitado apenas nos casos de asma grave de difícil tratamento já em uso de altas doses de corticosteroides inalados associados a broncodilatadores de longa duração ou até mesmo corticosteroide oral (etapas 4 ou 5 da iniciativa GINA)48. Raramente pode ocorrer rinossinusite alérgica por Aspergillus simultaneamente, com sintomas de obstrução nasal, secreção nasal espessa e escurecida49.
Os achados clínicos da ABPA são importantes e podem definir o correto diagnóstico se associados a achados radiológicos característicos na tomografia computadorizada do tórax (impactações mucoides, opacidades parenquimatosas, entre outros), presença de biomarcadores (IgE total elevada, IgE sérica específica contra o A. fumigatus ou teste cutâneo alérgico de leitura imediata positivo), além de outros critérios como eosinófilos sanguíneos elevados, IgG específica para Af ou precipitinas séricas contra o Af 49-50.
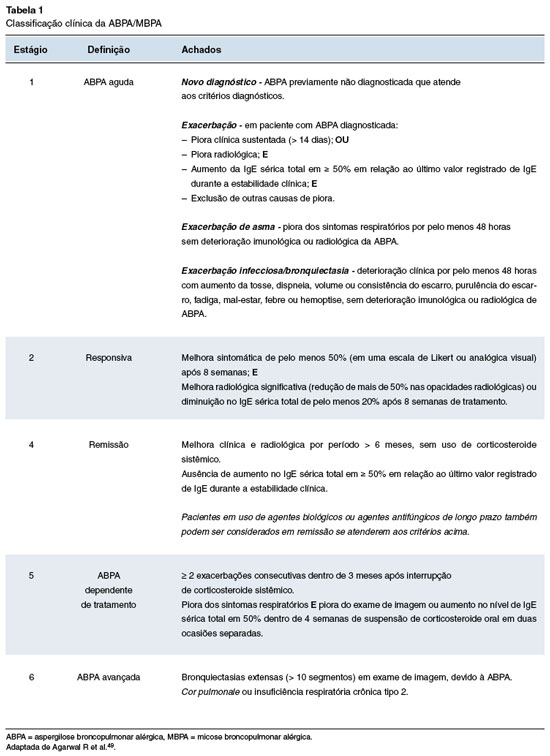
Foram descritos alguns estágios clínicos da ABPA, inicialmente apresentados por Patterson e cols. em 198250, mas que foram revistos mais recentemente por Agarwal e cols. em 202449, e são apresentados na Tabela 1.
Diagnóstico
O diagnóstico da ABPA é desafiador e envolve avaliação de critérios clínicos, imunológicos e radiológicos que permitem diferenciá-la de outras afecções pulmonares51. Os primeiros critérios diagnósticos da ABPA foram propostos por Rosenberg e cols. em 1977 (Tabela 2), e incluíam sete componentes primários (asma, eosinofilia no sangue periférico, hipersensibilidade cutânea imediata positiva ao antígeno de Aspergillus, presença de anticorpo precipitante ao antígeno de Aspergillus, níveis séricos aumentados de IgE total, opacidades pulmonares transitórias ou fixas e bronquiectasias centrais) e três componentes secundários (isolamento de Af no escarro, história de expectoração de tampão acastanhado e reação do tipo Arthus)52. Desde então, esses critérios foram os mais utilizados para o diagnóstico de ABPA. No entanto, em 2013, o grupo de trabalho em ABPA da International Society for Human and Animal Mycology (ISHAM) propôs novos critérios para fornecer diretrizes padronizadas para o diagnóstico da ABPA53.
Posteriormente, novas evidências surgiram sobre a sensibilidade e especificidade dos critérios da ISHAM. Essas evidências emergiram de um estudo que avaliou o desempenho dos vários critérios diagnósticos54. Demonstrou-se que testes de IgE sérica específica são mais sensíveis do que testes cutâneos para identificar sensibilização ao Aspergillus e que a sensibilidade e especificidade desses critérios aumentaram usando um valor mais baixo de IgE total. Além disso, um ponto de corte no nível de IgG específica para Aspergillus foi proposto. Essas evidências levaram a ISHAM a modificar os critérios diagnósticos em 202154. Os critérios propostos pela ISHAM foram validados, mas revelaram que a sensibilidade ainda era baixa para casos de Micose Broncopulmonar Alérgica (MBPA) causados por outros fungos. Assim, Asano e cols. propuseram e validaram novos critérios diagnósticos que mostraram maior sensibilidade e especificidade em comparação com os critérios anteriores de Rosenberg-Paterson e do ISHAM, mesmo em casos atípicos de ABPA e também nas MBPA55.
Considerando as novas descobertas e a falta de evidências em certos tópicos, recentemente foram publicadas novas diretrizes para auxiliar clínicos e pesquisadores no manejo da ABPA49.
Na Tabela 3 são apresentados os critérios diagnósticos propostos até o momento com suas vantagens e desvantagens.
Critérios clínicos
Os critérios clínicos para o diagnóstico da ABPA envolvem a presença de características clínicas e fatores de risco, especialmente asma e FC associadas aos sintomas e alguns sinais que podem servir de alerta para a possibilidade de ABPA, como: (i) asma não controlada, apesar do tratamento adequado; (ii) sintomas respiratórios persistentes, como tosse, dispneia, sibilância e expectoração; (iii) exacerbações agudas recorrentes com eosinofilia pulmonar; (iv) presença de bronquiectasias51,55.
Critérios imunológicos
Os marcadores imunológicos podem ajudar a confirmar a presença de hipersensibilidade ao Aspergillus e fornecem informações sobre a atividade da doença.
Nas últimas diretrizes da ABPA, são considerados suficientes para o diagnóstico níveis de IgE sérica total igual ou acima de 500 UI/mL para ABPA, e de 417 UI/mL para MBPA49,55. Uma elevação de 50% ou mais no nível de IgE sérica total é indicativo de exacerbação da ABPA49 (Tabela 3).
A detecção de IgE específica para antígenos do Aspergillus desempenha um papel crucial no diagnóstico, porém, a variabilidade nos métodos do teste e na qualidade dos alérgenos utilizados pode impactar a precisão dos resultados. Para superar esses desafios, propõe-se o uso de alérgenos recombinantes. Essas proteínas são produzidas por meio de técnicas de engenharia genética, permitindo uma produção mais controlada e padronizada em comparação com os alérgenos naturais. Essa abordagem visa melhorar a sensibilidade e especificidade dos testes, contribuindo para um diagnóstico mais preciso da ABPA. A presença de IgE rAsp f1 ou rAsp f3 demonstrou alta sensibilidade, e rAsp f4 ou rAsp f6 mostrou alta especificidade no diagnóstico de ABPA em pacientes com asma e fibrose cística39. A presença de IgE contra antígenos rAsp (f1, f2 e f4) foi considerada específica para ABPA em dois estudos56,57.
O Grupo de Trabalho em ABPA da EAACI propôs mudanças no algoritmo diagnóstico, incluindo a pesquisa de alérgenos recombinantes, mas reforçou a necessidade de recomendações adequadas para países com recursos limitados58. No entanto, é importante mencionar que um estudo brasileiro não conseguiu demonstrar vantagens no uso de alérgenos recombinantes (rAsp f 1, rAsp f 2, rAsp f 3, rAsp f 4 and rAsp f 6) nos testes imunológicos em comparação com os exames habituais. O estudo destacou a persistência do desafio no diagnóstico da ABPA59.
O teste cutâneo de hipersensibilidade imediata utilizando extratos de Aspergillus pode ser realizado para avaliar a resposta imunológica aos antígenos do fungo, substituindo a pesquisa de IgE específica6,49,53.
A detecção de anticorpos IgG específicos por meio de testes sorológicos, como imunodifusão dupla ou imunoensaio enzimático, também é considerada um critério importante para o diagnóstico da ABPA. Foi proposto um ponto de corte para IgE específica para Aspergillus de > 27 mgA/L em estudo realizado na população indiana60. Entretanto, esse ponto de corte varia de acordo com a metodologia de dosagem utilizada e entre diferentes populações, sendo considerado > 60 mgA/ L no Japão, e > 40 mgA/L no Reino Unido61,62.
A presença de eosinofilia no sangue periférico é comum na ABPA, mas isoladamente não permite diferenciá-la da asma eosinofílica ou outras doenças pulmonares que cursam com eosinofilia. Contagem de eosinófilos acima de 500 células/μL, é um marcador adicional para o diagnóstico da ABPA6,49,53,55. Eosinofilia no escarro também pode ser observada, entretanto, as diretrizes recentes enfatizam que a pesquisa de eosinófilos no escarro ainda é uma necessidade não atendida na ABPA49.
Adicionalmente, a visualização direta do fungo (Gram e Gomori-Grocott) bem como a cultura podem ser realizadas em amostras de escarro, escarro induzido ou lavado broncoalveolar. A presença de Aspergillus spp. na cultura pode reforçar o diagnóstico49.
As técnicas de biologia molecular, tais como a reação em cadeia da polimerase (PCR) em diferentes amostras clínicas (escarro, tecido pulmonar), podem ser úteis especialmente em casos de ABPA com culturas negativas ou quando para diagnóstico precoce51,55.
A sensibilidade da cultura de escarro para Aspergillus é baixa na ABPA, assim como a acurácia do teste para detecção de antígeno galactomanana sérico. Entretanto, nos casos suspeitos de Micose Broncopulmonar Alérgica (MBPA), as diretrizes atuais recomendam a realização de cultura de escarro obtido antes do início do tratamento para caracterizar o fungo e, posteriormente, permitir que se caracterize falha no tratamento49.
Critérios radiológicos
Os achados radiológicos típicos da ABPA podem variar de acordo com o estágio da doença e auxiliam na distinção de outras condições pulmonares6,49,51,53. A tomografia computadorizada de alta resolução é o padrão ouro para detectar o variado espectro de alterações decorrentes da ABPA. A presença de infiltrados pulmonares migratórios e recorrentes é um achado característico. Esses infiltrados podem ser vistos em diferentes lobos pulmonares e podem ser unifocais ou multifocais. As opacidades em "vidro fosco" são áreas de aumento da atenuação pulmonar sem obscurecimento completo dos vasos sanguíneos. Elas são frequentemente observadas e podem indicar inflamação alveolar com ou sem exsudato eosinofílico e mucoide. As bronquiectasias são dilatações permanentes e irreversíveis dos brônquios que, quando presentes na ABPA, são de distribuição preferencialmente central, em segmentos pulmonares proximais, nos lobos superiores e médio6,49,52,53.
O muco de alta atenuação (HAM) dentro dos brônquios, frequentemente associado a dilatações brônquicas lembrando um "dedo em luva", é outra imagem observada53. HAM está presente quando a densidade do muco é visivelmente maior do que a do músculo paravertebral, e pode estar relacionado à presença de sais de cálcio e íons metálicos (manganês ou ferro)63 ou muco desidratado64. Espessamento da parede brônquica e cicatrizes parenquimatosas, reflexo de inflamação e danos teciduais de longa data, também são descritos46,65.
Nódulos centrolobulares com padrão de "árvore em brotamento", indicativos de inflamação das pequenas vias aéreas, frequentemente associados à inflamação crônica, também são comumente identificados na ABPA66.
O estágio final da doença é o fibrótico e pode ser identificado pela presença de fibrose e distorção arquitetônica, predominantemente envolvendo os lobos superiores. A fibrose pulmonar pode se manifestar na tomografia do tórax de alta resolução como bronquiectasia de tração, imagem de "favo de mel" e perda de volume65,66.
O reconhecimento precoce e o tratamento da ABPA são fundamentais para evitar a progressão da doença, com o desenvolvimento de bronquiectasias, fibrose pulmonar e doença pulmonar em estágio avançado. A ABPA, em suas fases iniciais, quando apenas os marcadores sorológicos estão presentes, é designada ABPA sorológica. No entanto, infelizmente, o diagnóstico da ABPA frequentemente ocorre apenas após anos de doença, quando o processo de cicatrização/ fibrose/remodelação é evidente. O diagnóstico da ABPA é desafiador por várias razões, conforme descrito abaixo68.
- Não existe um biomarcador único para o diagnóstico e acompanhamento da doença. Alguns critérios foram propostos com base em parâmetros clínicos, imunológicos e radiológicos (Tabela 3).
- Alguns critérios não são específicos para a ABPA, e podem não estar presentes ao mesmo tempo.
- A apresentação clínica da ABPA é caracterizada por períodos de remissão e exacerbação.
- A falta de padronização dos alérgenos usados no diagnóstico afeta a reprodutibilidade dos resultados.
- O tratamento de pacientes asmáticos com corticosteroides e outros medicamentos anti-inflamatórios pode mascarar vários critérios.
- Outros fungos podem colonizar as vias aéreas inferiores e induzir uma doença semelhante à ABPA, denominada Micose Broncopulmonar Alérgica.
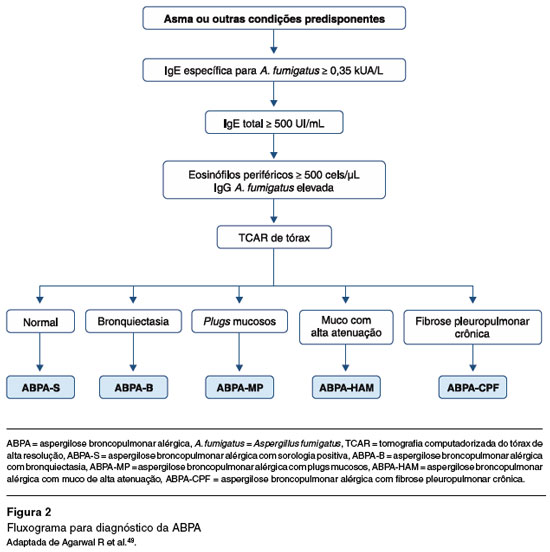
Nesse contexto, recomendamos seguir um fluxograma para melhorar a acurácia diagnóstica (Figura 2).
Diagnóstico diferencial
O diagnóstico diferencial da ABPA inclui condições que tem contagens elevadas de eosinófilos no sangue periférico, infiltrados pulmonares recorrentes, nível elevado de IgE sérica total ou que causem bronquiectasias69. Nesse contexto, os principais diagnósticos diferenciais são: fibrose cística, tuberculose pulmonar, sarcoidose, pneumonia infecciosa, pneumonia eosinofílica aguda e crônica, asma sensível ao Aspergillus, Granulomatose Eosinofílica com Poliangeíte (GEPA) ou Síndrome de Churg-Strauss, granulomatose broncocêntrica, eosinofilia pulmonar tropical e parasitoses com circulação pulmonar (síndrome de Löffler)12,70. Na Tabela 2 estão listados os principais diagnósticos diferenciais da ABPA relacionados à presença de bronquiectasias ou eosinofilia71.
Em consequência do frequente envolvimento dos segmentos posteriores dos lobos pulmonares superiores na ABPA e da alta prevalência de tuberculose no Brasil, muitas vezes os casos de ABPA são equivocadamente diagnosticados como tuberculose72.
A GEPA se apresenta geralmente com asma não controlada, associada a púrpura (vasculite cutânea), frequentemente nas mãos ou pernas e, em alguns casos, com neuropatia sensorial ou motora. Também pode cursar com infiltrados pulmonares, granulomas extravasculares, vasculite de pequenos vasos em biópsias pulmonares e eosinofilia no sangue periférico69.
No diagnóstico diferencial da ABPA também devem ser incluídas outras doenças pulmonares causadas por Aspergillus, como73:
- asma com sensibilização ao Aspergillus;
- pneumonite de hipersensibilidade;
- aspergiloma;
- aspergilose pulmonar crônica cavitaria e fibrótica;
- aspergilose invasiva aguda e subaguda (crônica necrotizante).
Dentre essas se destaca a asma com sensibilização ao Aspergillus, que consiste na presença de asma com reação de hipersensibilidade IgE-mediada a antígenos de Aspergillus, sem outras manifestações de ABPA, particularmente sem bronquiectasias, impactação mucoide ou IgG específica para o fungo73.
A sensibilização ao Aspergillus também pode ocorrer na asma grave com sensibilização fúngica. Essa acomete um subgrupo de asmáticos com sensibilização a antígenos de Aspergillus ou de outros fungos, que apresentam exacerbações frequentes, com necessidade de hospitalização recorrente. Seus critérios diagnósticos incluem73:
- asma grave (ou mal controlada);
- testes cutâneos positivos para fungos ou elevação de IgE específica ≥ 0,4 kU/L.
Tratamento
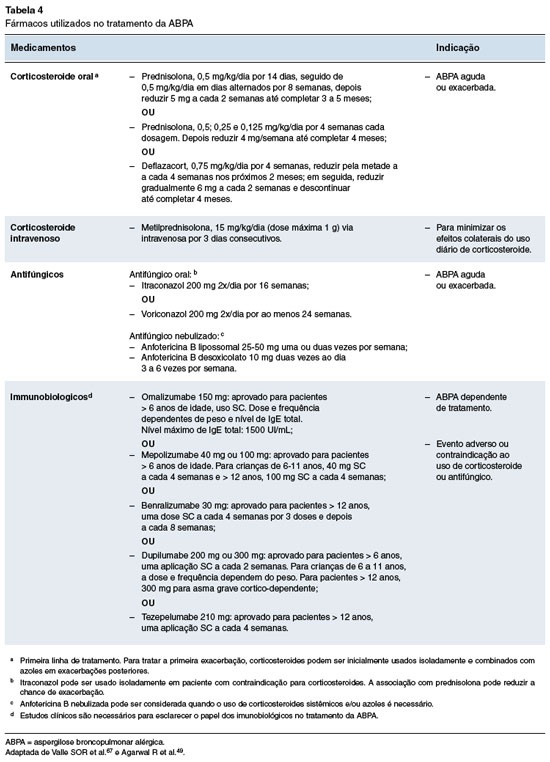
Os objetivos do tratamento da ABPA são a prevenção de danos pulmonares permanentes, melhoria do prognóstico e da qualidade de vida74. O tratamento da ABPA varia de acordo com o estágio da doença e envolve o uso de corticosteroides sistêmicos, terapia antifúngica, agentes imunobiológicos e fisioterapia respiratória adaptada às necessidades individuais do paciente (Tabela 4). Para os pacientes com a asma ou fibrose cística, o manejo deve também incluir o tratamento da doença subjacente. Os corticosteroides inalados e os broncodilatadores devem ser mantidos e/ou otimizados nos pacientes com asma.
Corticosteroides sistêmicos
Os corticosteroides orais são o tratamento de primeira linha da ABPA49,50. No entanto, existem vários regimes de tratamento, com diferentes dosagens e durações75. O regime mais utilizado tem início com uma dose diária de 0,5 mg/kg de prednisolona por um período de 14 dias, seguida de 0,5 mg/kg/dia em dias alternados por oito semanas, com posterior redução de 5 mg a cada duas semanas até completar 3 a 5 meses de tratamento5.
Embora a remissão da doença possa ser alcançada na maioria dos casos tratados com corticosteroides sistêmicos, a recaída ocorre em uma proporção significativa de pacientes (13,5 a 45%), e alguns podem se tornar dependentes de corticosteroides6,50.
Pulsoterapia com corticosteroides pode ser usada em substituição à administração oral. Metilprednisolona, 15 mg/kg/dia (não excedendo 1 g) por 3 dias, tem sido usada em crianças para minimizar os efeitos colaterais da terapia diária com corticosteroides76 e em casos de exacerbações refratárias ao tratamento por via oral77.
Terapia antifúngica
Os agentes antifúngicos diminuem a carga fúngica nas vias aéreas, o estímulo antigênico e a resposta inflamatória, podendo contribuir para a redução do uso de corticosteroide sistêmico. O uso de antifúngicos azólicos, isoladamente ou em combinação com corticosteroides, é uma opção no tratamento da ABPA78. Azólicos, como o itraconazol, são geralmente prescritos em uma dose de 200 mg duas vezes ao dia por 16 semanas75. O uso combinado de itraconazol e prednisolona resulta em uma maior redução na taxa de exacerbação em um ano, quando comparado ao uso desses medicamentos individualmente78.
Outros azólicos, como voriconazol, posaconazol e isavuconazol, também têm se demonstrado eficazes no tratamento da ABPA, especialmente em casos de intolerância ou resistência ao itraconazol49,79. No entanto, interações medicamentosas, hepatotoxicidade e biodisponibilidade variável podem limitar o uso dos antifúngicos80.
A eficácia da anfotericina B nebulizada no tratamento das exacerbações da ABPA parece ser limitada, podendo ser considerada quando outras alternativas foram esgotadas49,81.
Medicamentos imunobiológicos
Recorrências pós-tratamento são comumente observadas, seja após o uso de corticosteroides orais, terapia antifúngica ou a combinação de ambos. Além disso, o tratamento prolongado pode resultar em efeitos adversos. Portanto, a necessidade de novas estratégias de tratamento seguras e eficazes é clara. Dada a patogênese da ABPA, os imunobiológicos desenvolvidos para o tratamento da asma grave com foco na inflamação tipo 2 são considerados como potenciais alternativas de tratamento para a ABPA82. Embora as evidências sejam escassas, relatos recentes de casos e séries de casos demonstraram a eficácia desses fármacos no tratamento da ABPA82-85.
O anticorpo monoclonal anti-IgE, omalizumabe, mostrou potencial em reduzir o uso de corticosteroides, melhorar a função pulmonar e prevenir exacerbações84. O omalizumabe é administrado por via subcutânea a cada 2-4 semanas, com a dosagem determinada com base no peso do paciente e no nível sérico total de IgE84. No entanto, as doses utilizadas podem ser subótimas devido aos altos níveis de IgE observados na ABPA.
Os dois biológicos dirigidos para a IL-5, mepolizumabe e reslizumabe, e o anticorpo monoclonal (mAbs) contra a cadeia do receptor IL-5Rα (IL-5Rα), benralizumabe, demonstraram eficácia no tratamento de doenças pulmonares eosinofílicas, incluindo ABPA. Esses mAbs anti-IL-5/IL-5Rα têm sido bem-sucedidos em reduzir a frequência de exacerbações e a dosagem de corticosteroides orais, assim como melhorar a função pulmonar, mesmo naqueles não responsivos ao omalizumabe82.
O dupilumabe, anticorpo monoclonal anti IL-4Rα, mostrou efeitos terapêuticos benéficos nos sintomas e na função pulmonar83,86. Alguns pacientes com ABPA refratária ao tratamento com omalizumabe ou mepolizumabe responderam ao tratamento com dupilumabe83,87.
O tezepelumabe, um anticorpo monoclonal IgG2 humano que se liga especificamente a linfopoietina do estroma tímico (TSLP), mostrou-se eficaz em melhorar o controle da asma grave88. Um relato de caso recente sobre um paciente usando tezepelumabe mostrou benefícios no controle dos sintomas e redução dos tampões de muco e opacidades pulmonares associados à ABPA85.
Técnicas de fisioterapia respiratória e dispositivos de pressão expiratória positiva podem ser benéficos para pacientes com ABPA, especialmente naqueles com FC80. Essas técnicas podem ajudar a remover tampões de muco, melhorar a função pulmonar e reduzir o risco de infecções recorrentes.
O tratamento da ABPA na FC não é muito diferente daquele da ABPA na asma. Como os pacientes com FC frequentemente têm má absorção concomitante, o tratamento é mais complexo, pois medicamentos orais, especialmente cápsulas de itraconazol, podem ser mal absorvidos80.
A remissão é diagnosticada quando o paciente não apresenta exacerbações da asma e da ABPA, não é dependente de corticosteroides sistêmicos e tem sua melhor função pulmonar. Essa meta pode ser alcançada por meio do tratamento com corticosteroides, antifúngicos e agentes biológicos49.
Na Figura 3 é apresentado o fluxograma atualmente preconizado para tratamento da ABPA49.
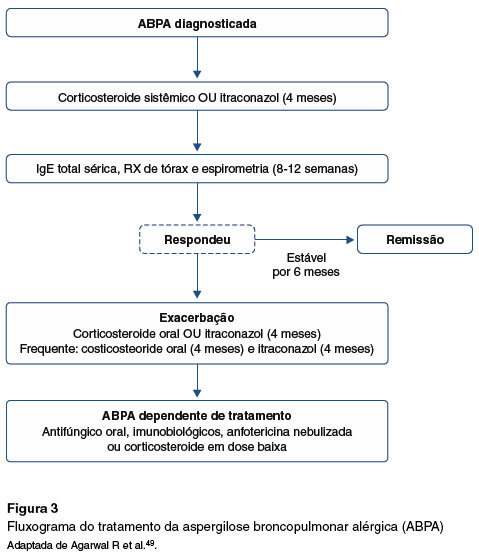
Monitoramento do tratamento
A resposta ao tratamento deve ser monitorada por parâmetros clínicos, radiografia de tórax e medições da concentração de IgE sérica total a cada oito semanas. Deve haver uma resolução das opacidades radiográficas e uma redução mínima de 25% nos níveis séricos totais de IgE, e é necessário estabelecer o novo nível de referência. Piora clínica e/ou radiológica juntamente com um aumento de 50% nos níveis de IgE sugere uma exacerbação80. No caso de pacientes em uso de omalizumabe, o monitoramento utilizando o parâmetro de dosagem de IgE total fica prejudicado, visto que ocorre elevação no nível durante a terapia.
ABPA e fibrose cística
A fibrose cística é uma doença genética autossômica recessiva caracterizada por função reduzida ou ausente da proteína reguladora de condutância transmembrana de fibrose cística (CFTR). Afeta cerca de 89.000 indivíduos em todo o mundo, dos quais mais de 6.000 são brasileiros cadastrados no Registro Brasileiro de Fibrose Cística (REBRAFC)89.
A CFTR se insere na porção apical da membrana celular e funciona como um canal iônico que permite o transporte dos íons cloreto para a luz epitelial. O transporte iônico defeituoso pela CFTR acarreta menos água no líquido periciliar e formação de grumos de mucina, comprometendo gravemente o batimento ciliar e o transporte de muco, resultando em acúmulo de secreções e consequentes infecções de repetição, com danos ao epitélio e demais estruturas das vias aéreas, em especial dos brônquios e bronquíolos. Ao longo do tempo formam-se dilatações em fundo de saco, as bronquiectasias, e começa um ciclo vicioso de acúmulo de secreções, infecções, dano estrutural, declínio da função pulmonar e progressão da doença90.
As manifestações clínicas respiratórias são tosse crônica produtiva, infecções recorrentes (Staphylococcus aureus, Haemophilus influenzae não encapsulados, Pseudomonas aeruginosa, Burkholderia cepacia, entre outras), sintomas e sinais de obstrução ao fluxo aéreo, sintomas recorrentes de sinusites e otites e baqueteamento digital. Alterações radiológicas compatíveis com doença de pequenas vias aéreas, bronquiectasias e sinusite são bastante comuns. Infecção e colonização pela P. aeruginosa estão geralmente associadas à progressão mais rápida desse ciclo vicioso90.
Favorecidas pelas alterações fisiopatológicas da FC, espécies fúngicas são comumente encontradas no escarro de pacientes com FC e, dentre elas, o Af é o mais frequente. No entanto, ao contrário da colonização por P. aeruginosa, seu impacto na progressão da doença é incerto. Por outro lado, nesses pacientes, conídios do Af inalados podem colonizar as vias respiratórias causando a ABPA em alguns casos, com significativo aumento na morbidade, deterioração mais acelerada da função pulmonar, progressão das bronquiectasias e fibrose pulmonar90.
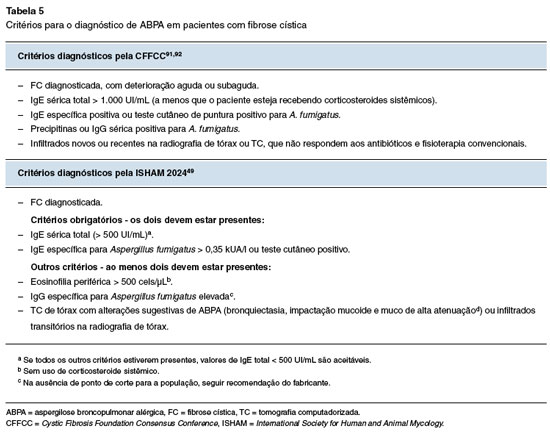
Diagnóstico de ABPA em pacientes com FC
Os critérios diagnósticos para ABPA em pacientes com FC propostos pela Cystic Fibrosis Foundation Consensus Conference (CFFCC) em 200391,92 são semelhantes aos da ISHAM de 202449 (Tabela 5). A colonização fúngica do escarro, em especial pelo Af, é frequente e não significa doença, a menos que haja piora clínica, quando então os critérios da Tabela 3 devem ser aplicados.
A CFFCC recomenda91,92 as seguintes ações:
- Pesquisar ABPA nos pacientes com idade > 6 anos com deterioração clínica.
- Dosar IgE sérica total anualmente: - IgE sérica total > 500 UI/mL
- dosar IgE específica para Af ou teste cutâneo de leitura imediata. Se positivo, considerar ABPA e realizar outros testes diagnósticos (IgG específica para Af ou precipitinas, tomografia do tórax);
- IgE sérica total entre 200 e 500 UI/mL
- repetir dosagem e, se o nível aumentar, realizar outros testes diagnósticos (IgE específica para Af ou teste cutâneo de leitura imediata, IgG específica para Af ou precipitinas, tomografia do tórax).
Tratamento da ABPA em pacientes com FC
O tratamento sugerido pelas Diretrizes Brasileiras para Diagnóstico e Tratamento da Fibrose Cística, embora indiquem uma estratégia a ser seguida, tem grau de evidência considerado baixo pelos autores, mas está de acordo com as estratégias terapêuticas apresentadas na Tabela 493 (vide abaixo).
- Prednisona: 0,5-2,0 mg/kg/dia (máximo 60 mg/dia) por 1 ou 2 semanas, reduzindo gradativamente para uso em dias alternados e retirada em 2 a 3 meses.
- Itraconazol: 5 mg/kg/dia (máximo 400 mg/dia) administrado de 12/12 horas se a dose for superior a 200 mg, por 3 a 6 meses; ou Voriconazol: 4 mg/kg (12/12 horas) máximo 400 mg/dia, por 3 a 6 meses.
Tratamentos alternativos/auxiliares incluem pulsoterapia com corticosteroides, imunobiológicos e anfotericina inalada93.
O papel dos modificadores da CFTR não está estabelecido nestes pacientes e nem sua interação com terapias antifúngicas94.
Em estudo retrospectivo recentemente publicado, abrangendo 65 pacientes com FC tratados para ABPA, foi verificado que o tratamento proposto com uso de prednisona em doses decrescentes por 18 dias, associado ao uso de itraconazol por 1 ano (com monitorização sérica) foi capaz de prevenir a deterioração da função pulmonar associada à ABPA, sem efeitos adversos dos corticosteroides sistêmicos95.
Micoses broncopulmonares alérgicas
A ABPA foi a primeira micose broncopulmonar alérgica (MBPA) descrita e é a mais frequentemente relatada na literatura. Entretanto, vários outros fungos anemófilos já foram identificados como sendo capazes de induzir resposta inflamatória crônica nos pulmões e sintomas como tosse, dispneia e hiperprodução de muco. Dada a sobreposição do repertório de antígenos da espécie Aspergillus, recomenda-se o uso do termo ABPA quando a doença é causada por qualquer Aspergillus spp. (não apenas A. fumigatus) e MBPA quando o agente causal é outro fungo49.
Informações mais detalhadas a respeito dos quadros de MBPA ainda são escassas, mas sabe-se que a doença pode levar a complicações como bronquiectasias, perda da função pulmonar e fibrose pulmonar se não reconhecida e tratada adequadamente96.
A prevalência de MBPA vem aumentando em várias regiões, principalmente em países com clima quente e úmido como Brasil, Índia, Austrália e alguns países da Europa73. Assim como a ABPA, as MBPA afetam mais frequentemente adultos jovens e de meia-idade, com asma, fibrose cística ou outras doenças pulmonares subjacentes, sem predominância por sexo. Por serem fungos anemófilos, dispersos no ar atmosférico, seu crescimento está sujeito às características locais, o que explica incidência variável das MBPA de acordo com a região55.
Agentes causais
Muitos fungos, além do Af, são reconhecidos como agentes causais de MBPA (Tabela 6). A Candida albicans é o agente causal mais prevalente, mas outros são capazes de se instalar no trato respiratório, proliferar, induzir inflamação imunomediada e promover as lesões características da MBPA96.
Mecanismos de doença
A patogênese das MBPA é essencialmente a mesma que a da ABPA e envolve fatores genéticos, interações hospedeiro-patógeno e respostas imunes inata e adaptativa. Variantes genéticas contribuem para susceptibilidade à MBPA26-31. Os fungos colonizam as vias respiratórias de indivíduos suscetíveis, desencadeando uma resposta inflamatória tipo 2 (T2), reações hipersensibilidade do tipo I e III, eosinofilia e produção de muco34-44. Esse processo inflamatório é exacerbado por fatores como a depuração mucociliar prejudicada e a produção de proteínas fúngicas que perpetuam o dano ao epitélio respiratório.
O processo inflamatório resultante leva à destruição das paredes brônquicas ocasionando o surgimento das bronquiectasias, lesões características da MBPA. As alterações anatômicas locais produzidas pelas bronquiectasias predispõem a infecções recorrentes, inflamação, dano pulmonar progressivo e fibrose97.
Quadro clínico
As doenças alérgicas fúngicas são condições que formam um grupo heterogêneo de apresentações clínicas98. As características clínicas da MBPA são semelhantes às da asma não controlada. Geralmente os pacientes se apresentam com tosse, dispneia e expectoração de tampões de muco. Outros sintomas inespecíficos como febre, mal-estar, dor torácica e hemoptise também podem estar presentes. Uma anamnese detalhada pode revelar a cronicidade dos sintomas e história de exames radiológicos com imagens compatíveis com pneumonia no passado. Dados têm mostrado a associação da MBPA e asma (32% dos casos) e outras alergias como rinossinusite, dermatite atópica e urticária (41%)96.
O exame físico dos pacientes frequentemente é normal, embora a ausculta pulmonar possa revelar crepitações grossas durante períodos de exacerbações agudas ou em pacientes com fibrose, e o baqueteamento digital possa ser encontrado em alguns casos.
Atelectasia por impactação de muco e bronquiectasias podem ser observadas nos exames de imagem e a investigação laboratorial geralmente fornece informações relevantes96,97.
Na nova classificação clínica proposta para a ABPA/MBPA são descritos cinco estágios clínicos: ABPA aguda, resposta, remissão, ABPA dependente de tratamento e ABPA avançada (Tabela 1).
Investigação laboratorial
Após avaliação exaustiva da história clínica do doente, os exames laboratoriais e os achados nos exames de imagem podem ser decisivos para se estabelecer o diagnóstico definitivo de MBPA.
A avaliação laboratorial das MBPA inclui, assim como na ABPA, dosagem de IgE total, IgE específica para fungos, IgG específica para fungos ou precipitinas séricas e tomografia computadorizada do tórax. Além desses, cultura do escarro ou do lavado brônquico pode ser útil para a identificação do fungo envolvido96,97.
Diagnóstico
O diagnóstico preciso da MBPA é tão desafiador quanto o da ABPA. Considerando-se que a apresentação clínica, as estratégias de tratamento antifúngico e o prognóstico da doença podem variar de acordo com o agente causal, a identificação precisa do fungo (não Aspergillus) é essencial para o manejo adequado do paciente com MBPA99. A presença de IgE específica para determinados componentes alergênicos confirma a sensibilização e pode ser usada para a confirmação do fungo causal. Entretanto, a questão da reatividade cruzada observada com o uso de extratos brutos dificulta a acurácia do diagnóstico etiológico99. O isolamento microbiológico repetido das vias aéreas também é um importante recurso, mas questões relacionadas à obtenção do material biológico podem dificultar a identificação precisa do fungo100.
Testes que avaliam a resposta imune celular (teste de ativação de basófilos e linfócitos) têm sido estudados e sua aplicação considerada promissora como alternativa aos testes atualmente utilizados no diagnóstico da MBPA em pacientes com doença pulmonar subjacente101.
A identificação de novos biomarcadores que facilitem o diagnóstico etiológico da MBPA é bastante aguardada, especialmente porque os critérios clínicos diagnósticos tradicionais são mais específicos para a ABPA102 e o diagnóstico com base nos componentes moleculares do fungo está disponível apenas para o A. fumigatus100.
Estudo publicado em 2021 demonstrou melhor sensibilidade e especificidade de novos critérios para diagnosticar MBPA quando comparados com os critérios convencionais55. Recentemente esses critérios foram revisados49 e são apresentados na Tabela 7.
Tratamento
Os princípios de tratamento da MBPA são semelhantes aos da ABPA, exceto que a identificação do fungo implicado pode orientar a escolha do antifúngico a ser utilizado49.
Os objetivos do tratamento da MBPA são:
- controle da inflamação;
- erradicação da colonização fúngica nas vias respiratórias;
- remoção de tampões de muco brônquico;
- identificação do foco e eliminação do agente causal do ambiente do paciente.
Os corticosteroides sistêmicos são a base do tratamento da MBPA, mas podem ser menos eficazes na prevenção das exacerbações e declínio da função pulmonar, como pode acontecer também na ABPA. A dose recomendada é de 0,5 mg/kg nas primeiras 2 semanas, com redução nos 3 meses subsequentes até a retirada total do medicamento, caso o paciente evolua sem complicações. A meta do tratamento é reduzir os níveis da IgE total em 35% a 50% no período de 6 a 8 meses e a resolução completa dos infiltrados pulmonares.
O uso de antifúngicos pode ser necessário para a erradicação da colonização da via respiratória. A escolha do antifúngico e o tempo de uso dependem da eficácia e da disponibilidade.
A impactação de muco pode ser resolvida por meio da broncoscopia96.
Para os pacientes com a asma, DPOC e fibrose cística, o manejo deve incluir o tratamento da doença subjacente. Os corticosteroides inalados e os broncodilatadores devem ser mantidos e/ou otimizados naqueles pacientes com asma e em alguns casos de DPOC.
A terapia com biológicos, especialmente omalizumabe e anti-IL-5, parece promissora no tratamento da MBPA, como tem sido demonstrado em alguns estudos mais recentes49.
O uso de antibióticos de largo espectro também pode ser necessário nos casos de infecção pulmonar, principalmente nos pacientes com bronquiectasias e com doenças subjacentes.
Da mesma forma, medidas terapêuticas complementares como fisioterapia e reabilitação pulmonar também devem fazer parte do plano terapêutico dos pacientes com MBPA97.
Conclusão
A ABPA ocorre em indivíduos geneticamente predispostos, principalmente com asma e fibrose cística, e sua prevalência exata ainda é desconhecida. Os critérios diagnósticos envolvem parâmetros clínicos, sorológicos e radiológicos, que sofreram alterações desde a primeira descrição da doença. Entretanto, até o momento, ainda não existe ampla divulgação dos critérios diagnósticos, o que contribui para que a doença seja subdiagnosticada. Além disso, a ABPA pode simular doenças comuns em nosso meio como a tuberculose. Em relação ao tratamento, existem vários esquemas propostos, sendo considerado como primeira linha o uso de corticosteroide oral, associado ou não a antifúngicos azólicos. Os imunobiológicos que têm como alvo a inflamação T2 têm se mostrado benéficos em alguns casos. Mais estudos são necessários para caracterizar critérios diagnósticos em diferentes populações, bem como ensaios clínicos com agentes terapêuticos alvo específicos nos pacientes com MBPA.
Referências
1. Hinson KFW, Moon AJ, Plummer NS. Bronchopulmonary aspergillosis: a review and report of eight new cases. Thorax. 1952;7:317-33.
2. Patterson R, Golbert TM. Hypersensitivity disease of the lung. Univ Mich Med Cent J. 1968;34:8-11.
3. França AT. Asma Brônquica: importância do Aspergillus fumigatus [tese livre docência]. Rio de Janeiro: Universidade Federal do Rio de Janeiro; 1974.
4. Denning DW, Pleuvry A, Cole DC. Global burden of allergic bronchopulmonary aspergillosis with asthma and its complication chronic pulmonary aspergillosis in adults. Med Mycol. 2013;51(4):361-70.
5. Greenberger PA. Allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol. 2002 Nov;110(5):685-92.
6. Agarwal R, Gupta D, Aggarwal AN, Behera D, Jindal SK. Allergic bronchopulmonary aspergillosis: lessons from 126 patients attending a chest clinic in North India. Chest. 2006;130(2):442-8.
7. Gago S, Denning DW, Bowyer P. Pathophysiological aspects of Aspergillus colonization in disease. Med Mycol. 2019;57(Supplement_2):S219-S227.
8. Agarwal R, Nath A, Aggarwal NA, Gupta D, Chakrabarti A. Aspergillus hypersensitivity and allergic bronchopulmonary aspergillosis in patients with acute severe asthma in a respiratory intensive care unit in North India. Mycoses. 2010;53:138-43.
9. Serpa FS. Aspergilose Broncopulmonar Alérgica: critérios diagnósticos em pacientes sensíveis ao Aspergillus fumigatus [dissertação]. Rio de Janeiro: UFRJ; 1997.
10. Valle SOR. Identificação de aspergilose broncopulmonar alérgica em pacientes com fibrose cística e reatividade cutânea aos antígenos do Aspergillus fumigatus [dissertação]. Rio de Janeiro: Universidade Federal do Rio de Janeiro; 1998.
11. Rosario NA, Riedi CA. Cystic fibrosis and atopy. Allergol Immunopathol (Madr). 2013;41(2):137-9.
12. Agarwal R, Sehgal IS, Dhooria S, Muthu V, Prasad KT, Bal A, et al. Allergic Bronchopulmonary aspergillosis. Indian J Med Res. 2020;151:529-49.
13. Muthu V, Sehgal IS, Prasad KT, Dhooria S, Aggarwal AN, Garg M, et al. Allergic bronchopulmonary aspergillosis (ABPA) sans asthma: A distinct subset of ABPA with a lesser risk of exacerbation. Med Mycol. 2020;58:260-3.
14. Chauhan B, Santiago L, Hutcheson PS, Schwartz HJ, Spitznagel E, Castro M, et al. Evidence for the involvement of two different MHC class II regions in susceptibility or protection in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol. 2000;106(4):723-9.
15. Souza HG, Sales LS, Figueiredo CN, Santana Neto D, Cruz- Magalhães V, Souza JT, et al. Diversidade taxonômica e identificação de Aspergillus. In: Soares ACF, Evangelista-Barreto NS, Santos PA, orgs. Tópicos em Microbiologia Agrícola. Cruz das Almas, BA: EDUFRB; 2020. p. 219-46.
16. Moraes AML, Paes RA, Holanda VL. Micologia. In: Molinaro EM, Caputo LFG, Amendoeira MRR, orgs. Conceitos e Métodos para formação de profissionais em laboratórios de saúde: volume 4. Rio de Janeiro: EPSJV, IOC; 2009. p. 399-496 p. ISBN:978-85-98768- 41-0.
17. Houbraken J, Kocsubé S, Visagie CM, Yilmaz N, Wang XC, Meijer M, et al. Classification of Aspergillus, Penicillium, Talaromyces and related genera (Eurotiales): An overview of families, genera, subgenera, sections, series and species. Stud Mycol. 2020;95:5-169.
18. Sugui JA, Kwon-Chung KJ, Juvvadi PR, Latgé JP, Steinbach WJ. Aspergillus fumigatus and related species. Cold Spring Harb Perspect Med. 2014;5(2):a019786.
19. Gugnani HC. Ecology and taxonomy of pathogenic aspergilli. Front Biosci. 2003;8:s346-57.
20. Silva FC, Chalfoun SM, Batista LR, Santos C, Lima N. Taxonomia polifásica para identificação de Aspergillus flavi: uma revisão. Revista Ifes Ciência. 2015;1(1). doi: https://doi.org/10.36524/ric.v1i1.235.
21. Samson RA, Visagie CM, Houbraken J, Hong SB, Hubka V, Klaassen CHW, et al. Phylogeny, identification and nomenclature of the genus Aspergillus. Studies in mycology. 2014:78:141-73.
22. Mesquita-Rocha S. Aspergillus fumigatus: aspectos gerais e importância na medicina contemporânea. J Health Sci Inst. 2019;37(2):169-73.
23. van de Veerdonk FL, Gresnigt MS, Romani L, Netea MG, Latgé J. Aspergillus fumigatus morphology and dynamic host interactions. Nat Rev Microbiol. 2017;15(11):661-74.
24. Bodey GP, Vartivarian S. Aspergillosis. Eur J Clin Microbiol Infect Dis. 1989;8:413-37.
25. Simões D, Caetano LA, Cristina Viegas VC, Sabino R. Aspergillus collected in specific indoor settings: their molecular identification and susceptibility pattern. International Journal of Environmental Health Research. 2021;31(3):248-57.
26. Chauhan B, Santiago L, Kirschmann DA, Hauptfeld V, Knutsen AP, Hutcheson PS, et al. The association of HLA-DR alleles and T cell activation with allergic bronchopulmonary aspergillosis. J Immunol. 1997;159:4072-6.
27. Chauhan B, Santiago L, Hutcheson PS, Schwartz HJ, Spitznagel E, Castro M, et al. Evidence for the involvement of two different MHC class II regions in susceptibility or protection in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol. 2000;106(4):723-9.
28. Gago S, Overton NLD, Ben-Ghazzi N, Muralidhar K, Sarma PU. Lung colonization by Aspergillus fumigatus is controlled by ZNF77. Nat Commun. 2018;9(1):3835.
29. Saxena S, Madan T, Shah A, Muralidhar K, Sarma PU. Association of polymorphisms in the collagen region of SP-A2 with increased levels of total IgE antibodies and eosinophilia in patients with allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol. 2003;111(5):1001-7.
30. Carvalho A, Pasqualotto AC, Pitzurra L, Romani L, Denning DW, Rodrigues F. Polymorphisms in toll-like receptor genes and susceptibility to pulmonary aspergillosis. J Infect Dis. 2008;197(4):618-21.
31. Overton NL, Denning DW, Bowyer P, Simpson A. Genetic susceptibility to allergic bronchopulmonary aspergillosis in asthma: a genetic association study. Allergy Asthma Clin Immunol. 2016;12:47.
32. Knutsen AP, Bush RK, Demain JG, Denning DW, Dixit A, Fairs A, et al. Fungi and allergic lower respiratory tract diseases. J Allergy Clin Immunol. 2012;129(2):280-91; quiz 292-3.
33. Aimanianda V, Bayry J, Bozza S, Kniemeyer O, Perruccio K, Elluru SR. Surface hydrophobin prevents immune recognition of airborne fungal spores. Nature. 2009;460(7259):1117-21.
34. Kita H. ILC2s and fungal allergy. Allergol Int. 2015;64(3):219-26.
35. Tomee JF, Wierenga AT, Hiemstra PS, Kauffman HK. Proteases from Aspergillus fumigatus induce release of proinflammatory cytokines and cell detachment in airway epithelial cell lines. J Infect Dis. 1997;176(1):300-3.
36. Borger P, Koeter GH, Timmerman JA, Vellenga E, Tomee JF, Kauffman HF. Proteases from Aspergillus fumigatus induce interleukin (IL)-6 and IL-8 production in airway epithelial cell lines by transcriptional mechanisms. J Infect Dis. 1999;180(4):1267-74.
37. Kauffman HF, Tomee JF, van de Riet MA, Timmerman AJ, Borger P. Protease-dependent activation of epithelial cells by fungal allergens leads to morphologic changes and cytokine production. J Allergy Clin Immunol. 2000;105(6 Pt 1):1185-93.
38. World Health Organization. International Union of Immunological Societies (WHO/IUIS) Allergen Nomenclature Sub-Committee [internet]. Disponível em: https://allergen.org/search.php?allergensource=aspergillus+fumigatus&searchsource=Search. Acessado em 02/06/2024.
39. Muthu V, Sehgal IS, Dhooria S, Aggarwal AN, Agarwal R. Utility of recombinant Aspergillus fumigatus antigens in the diagnosis of allergic bronchopulmonary aspergillosis: a systematic review and diagnostic test accuracy meta-analysis. Clin Exp Allergy. 2018;48:1107-36.
40. Arruda LK, Platts-Mills TAE, Longbottom JL, El-Dahr JM, Chapman MD. Aspergillus fumigatus: identification of 16, 18, and 45 kd antigens recognized by human IgG and IgE antibodies and murine monoclonal antibodies. J Allergy Clin Immunol. 1992;89:1166-76.
41. Knutsen AP, Bush RK, Demain JG, Denning DW, Dixit A, Fairs A, et al. Fungi and allergic lower respiratory tract diseases. J Allergy Clin Immunol. 2012;129(2):280-91.
42. Knutsen AP, Slavin RG. Allergic bronchopulmonary aspergillosis in asthma and cystic fibrosis. Clin Dev Immunol. 2011;2011:843763.
43. Hohl TM, Feldmesser M. Aspergillus fumigatus: principles of pathogenesis and host defense. Eukaryot Cell. 2007;6(11):1953-63.
44. Roboubi A, Audousset C, Fréalle É, Brun AL, Laurent F, Vitte J, et al. Allergic bronchopulmonary aspergillosis: A multidisciplinary review. J Mycol Med. 2023;33(3):101392.
45. Agarwal R, Khan A, Aggarwal AN, Gupta D. Link between CFTR mutations and ABPA: a systematic review and meta-analysis. Mycoses. 2012 Jul;55(4):357-65.
46. Agarwal R, Gupta D, Aggarwal AN, Saxena AK, Chakrabarti A, Jindal SK. Clinical significance of hyperattenuating mucoid impaction in allergic bronchopulmonary aspergillosis: an analysis of 155 patients. Chest. 2007;132(4):1183-90.
47. Muthu V, Sehgal IS, Prasad KT, Dhooria S, Aggarwal AN, Garg M, et al. Allergic bronchopulmonary aspergillosis (ABPA) sans asthma: A distinct subset of ABPA with a lesser risk of exacerbation. Med Mycol. 2020;58:260.
48. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention [internet]. 2024. Disponível em: https://ginasthma.org/2024-report/. Acessado em: 10/09/2024.
49. Agarwal R, Sehgal IS, Muthu V, Denning DW, Chakrabarti A, Soundappan K, et al. Revised ISHAM-ABPA working group clinical practice guidelines for diagnosing, classifying and treating allergic bronchopulmonary aspergillosis/mycoses. Eur Respir J. 2024;63(4):2400061.
50. Patterson R, Greenberger PA, Radin RC, Roberts M. Allergic bronchopulmonary aspergillosis: staging as an aid to management. Ann Intern Med. 1982;96:286-91.
51. Patterson TF, Thompson GR 3rd, Denning DW, Fishman JA, Hadley S, Herbrecht R, et al. Executive Summary: Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016;63(4):433-42.
52. Rosenberg M, Patterson R, Mintzer R, Cooper BJ, Roberts M, Harris KE. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary aspergillosis. Ann Intern Med. 1977;86(4):405-14.
53. Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013;43(8):850-73.
54. Saxena P, Choudhary H, Muthu V, Sehgal IS, Dhooria S, Prasad KT, et al. Which Are the Optimal Criteria for the Diagnosis of Allergic Bronchopulmonary Aspergillosis? A Latent Class Analysis. J Allergy Clin Immunol Pract. 2021;9(1):328-335.e1.
55. Asano K, Hebisawa A, Ishiguro T, Takayanagi N, Nakamura Y, Suzuki J, et al. New clinical diagnostic criteria for allergic bronchopulmonary aspergillosis/mycosis and its validation. J Allergy Clin Immunol. 2021;147(4):1261-1268.e5.
56. Muthu V, Singh P, Choudhary H, Sehgal IS, Dhooria S, Prasad KT, et al. Diagnostic cutoffs and clinical utility of recombinant Aspergillus fumigatus antigens in the diagnosis of allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract. 2020;8:579-87.
57. Tanimoto H, Fukutomi Y, Yasueda H, Takeuchi Y, Saito A, Watai K, et al. Molecular-based allergy diagnosis of allergic bronchopulmonary aspergillosis in Aspergillus fumigatus-sensitized Japanese patients. Clin Exp Allergy. 2015;45:1790-800.
58. Caminati M, Feleszko W, Michel M, Annesi-Maesano I, Vitte J, EAACI Task Force Diagnosis, Management of ABPA. Aspergillus fumigatus and personalized medicine: Toward a clinically reliable algorithm. Allergy. 2022;77(11):3476-7.
59. Oliveira E, Giavina-Bianchi P, Fonseca LAM, França AT, Kalil J. Allergic bronchopulmonary aspergillosis' diagnosis remains a challenge. Respir Med. 2007;101(11):2352-7.
60. Agarwal R, Dua D, Choudhary H, Aggarwal AN, Sehgal IS, Dhooria S, et al. Role of Aspergillus fumigatus-specific IgG in diagnosis and monitoring treatment response in allergic bronchopulmonary aspergillosis. Mycoses. 2017;60:33-9.
61. Shinfuku K, Suzuki J, Takeda K, Kawashima M, Morio Y, Sasaki Y, et al. Validity of Platelia Aspergillus IgG and Aspergillus precipitin test to distinguish pulmonary aspergillosis from colonization. Microbiol Spectr. 2023;11: e0343522.
62. Hamada Y, Fukutomi Y, Nakatani E, Saito A, Watai K, Kamide Y, et al. Optimal Aspergillus fumigatus and Asp f 1 serum IgG cut-offs for the diagnosis of allergic bronchopulmonary aspergillosis. Allergol Int. 2021;70:74-80.
63. Kopp W, Fotter R, Steiner H, Beaufort F, Stammberger H. Aspergillosis of the paranasal sinuses. Radiology. 1985;156(3):715-6.
64. Dillon WP, Som PM, Fullerton GD. Hypointense MR signal in chronically inspissated sinonasal secretions. Radiology. 1990;174(1):73-8.
65. Agarwal R, Khan A, Garg M, Aggarwal AN, Gupta D. Chest radiographic and computed tomographic manifestations in allergic bronchopulmonary aspergillosis. World J Radiol. 2012;4(4):141-50.
66. Agarwal R, Khan A, Gupta D, Aggarwal AN, Saxena AK, Chakrabarti A. An alternate method of classifying allergic bronchopulmonary aspergillosis based on high-attenuation mucus. PLoS One. 2010;5(12):e15346.
67. Valle SOR, Serpa AS, Serpa FS. Allergic Bronchopulmonary Aspergillosis/Mycosis: An Underdiagnosed Disease [Internet]. Infectious Diseases. IntechOpen; 2023. Disponível em: http://dx.doi.org/10.5772/intechopen.112166.
68. Giavina-Bianchi P, Kalil J. Diagnosis of Allergic Bronchopulmonary Aspergillosis Exacerbations. J Allergy Clin Immunol Pract. 2017 Nov-Dec;5(6):1599-600.
69. Greenberger PA. Clinical Aspects of Allergic bronchopulmonary aspergillosis. Frontiers in Bioscience. 2003;8:119-27.
70. Patterson K, Strek ME. Allergic Bronchopulmonary Aspergillosis. Proc Am Thorac Soc. 2010;7:237-44.
71. Vlahakis NE, Aksamit TR. Diagnosis and Treatment of Allergic Bronchopulmonary Aspergillosis. Mayo Clin Proc. 2001;76:930-8.
72. Valle SOR, França AT. Aspergilose broncopulmonar alérgica: panorama atual. Revista do Hospital Universitário Pedro Ernesto. 2008;7:62-71.
73. Abreu DB, Silva D, Plácido JL. Aspergilose broncopulmonar alérgica. Rev Port Imunoalergologia. 2022;30(2):85-100.
74. Boaventura R, Sibila O, Agusti A, Chalmers JD. Treatable traits in bronchiectasis. Eur Respir J. 2018;52(3):1801269.
75. Agarwal R, Muthu V, Sehgal IS, Dhooria S, Prasad KT, Aggarwal AN. Allergic Bronchopulmonary Aspergillosis. Clin Chest Med. 2022;43(1):99-125.
76. Cohen-Cymberknoh M, Blau H, Shoseyov D, Mei-Zahav M, Efrati O, Armoni S, et al. Intravenous monthly pulse methylprednisolone treatment for ABPA in patients with cystic fibrosis. J Cyst Fibros. 2009;8(4):253-7.
77. Singh Sehgal I, Agarwal R. Pulse methylprednisolone in allergic bronchopulmonary aspergillosis exacerbations. Eur Respir Rev. 2014;23(131):149-52.
78. Agarwal R, Muthu V, Sehgal IS, Dhooria S, Prasad KT, Garg M, et al. A randomised trial of prednisolone versus prednisolone and itraconazole in acute-stage allergic bronchopulmonary aspergillosis complicating asthma. Eur Respir J. 2021;59(4):2101787.
79. Chishimba L, Niven RM, Cooley J, Denning DW. Voriconazole and posaconazole improve asthma severity in allergic bronchopulmonary aspergillosis and severe asthma with fungal sensitization. J Asthma. 2012;49(4):423-33.
80. Agarwal R, Sehgal IS, Dhooria S, Muthu V. Allergic bronchopulmonary aspergillosis. Chest. 2020;157(2),403-16.
81. Agarwal R, Sehgal IS, Dhooria S, Aggarwal AN. Developments in the diagnosis and treatment of allergic bronchopulmonary aspergillosis. Expert Rev Respir Med. 2016;10(12):1317-34.
82. Tomomatsu K, Yasuba H, Ishiguro T, Imokawa S, Hara J, Soeda S, et al. Real-world efficacy of anti-IL-5 treatment in patients with allergic bronchopulmonary aspergillosis. Sci Rep. 2023;13(1):5468.
83. Ramonell RP, Lee FE, Swenson C, Kuruvilla M. Dupilumab treatment for allergic bronchopulmonary aspergillosis: A case series. J Allergy Clin Immunol Pract. 2020;8(2):742-3.
84. Jin M, Douglass JA, Elborn JS, Agarwal R, Calhoun WJ, Lazarewicz S, et al. Omalizumab in Allergic Bronchopulmonary Aspergillosis: A Systematic Review and Meta-Analysis. J Allergy Clin Immunol Pract. 2023;11(3):896-905.
85. Ogta H, Sha K, Kotetsu Y, Enokizu-Ogawa A, Katahira K, Ishimatsu A, et al. Tezepelumab treatment for allergic bronchopulmonary aspergillosis. Respirol Case Rep. 2023;11(5):e01147.
86. Nishimura T, Okano T, Naito M, Tsuji C, Iwanaka S, Sakakura Y. Complete withdrawal of glucocorticoids after dupilumab therapy in allergic bronchopulmonary aspergillosis: A case report. World J Clin Cases. 2021;9(23):6922-8.
87. Mikura S, Saraya T, Yoshida Y, Oda M, Ishida M, Honda K, et al. Successful Treatment of Mepolizumab- and Prednisolone-resistant Allergic Bronchopulmonary Aspergillosis with Dupilumab. Intern Med. 2021;60(17):2839-42.
88. Menzies‐Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME, et al. Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med. 2021;384:1800-9.
89. Grupo Brasileiro de Estudos de Fibrose Cística - CGEFC. Registro Brasileiro de Fibrose Cística ano 2020 [internet]. Disponível em http://portalgbefc.org.br/. Acessado em: 03/08/2023.
90. Ong T, Ramsey BW. Cystic Fibrosis: A Review. JAMA. 2023;329(21):1859-71.
91. Farrell PM, White TB, Ren CL, Hempstead SE, Accurso F, Derichs N, et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. J Pediatr. 2017;181S:S4-S15.e1. Erratum in: J Pediatr. 2017;184:243.
92. Stevens DA, Moss RB, Kurup VP, Knutsen AP, Greenberger P, Judson MA, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis-state of the art: Cystic Fibrosis Foundation Consensus Conference. Clin Infect Dis. 2003;37 Suppl 3:S225-64. Erratum in: Clin Infect Dis. 2004 Jan 1;38(1):158.
93. Athanazio RA, Silva Filho LVRF, Vergara AA, Ribeiro AF, Riedi CA, Procianoy EDFA, et al. Brazilian guidelines for the diagnosis and treatment of cystic fibrosis. J Bras Pneumol. 2017;43(3):219-45.
94. Bercusson A, Jarvis G, Shah A. CF Fungal Disease in the Age of CFTR Modulators. Mycopathologia. 2021;186(5):655-64. doi: 10.1007/s11046-021-00541-5.
95. Gothe F, Schmautz A, Häusler K, Tran NB, Kappler M, Griese M. Treating Allergic Bronchopulmonary Aspergillosis with Short-Term Prednisone and Itraconazole in Cystic Fibrosis. J Allergy Clin Immunol Pract. 2020;8(8):2608-14.e3.
96. Chowdhary A, Agarwal K, Kathuria S, Gaur SN, Randhawa HS, Meis JF. Allergic bronchopulmonary mycosis due to fungi other than Aspergillus: A global overview. In Critical Reviews in Microbiology. 2014;40(1):30-48.
97. Rick EM, Woolnough K, Pashley CH, Wardlaw AJ. (2016). Allergic fungal airway disease. In Journal of Investigational Allergology and Clinical Immunology. 2016;26(6):344-54.
98. Wardlaw AJ, Rick EM, Ozyigit LP, Scadding A, Gaillard EA, Pashley CH. New perspectives in the diagnosis and management of allergic fungal airway disease. In Journal of Asthma and Allergy. 2021;14:557-73.
99. Nasu S, Satoh S, Shimizu K, Matsuno O, Morishita H, Yaguchi T, et al. Spontaneous regression of allergic bronchopulmonary mycosis due to curvularia lunata. Internal Medicine. 2018;57(2):243-6.
100. Fukutomi Y, Tanimoto H, Yasueda H, Taniguchi M. Serological diagnosis of allergic bronchopulmonary mycosis: Progress and challenges. In Allergology International. 2016;65(1):30-6.
101. Michel M, Gomez C, Sereme Y, Gouitaa M, Chartier C, Blanchard P, et al. Evaluation of Cellular Responses for the Diagnosis of Allergic Bronchopulmonary Mycosis: A Preliminary Study in Cystic Fibrosis PatientsFront Immunol. 2020;10:3149.
102. Moss RB. Diagnosing allergic bronchopulmonary aspergillosis/ mycosis: Return to lost horizons. Journal of Allergy and Clinical Immunology. 2021;147(4):1212-4.