Número Atual: Abril-Junho 2019 - Volume 3 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
O teste de contato (patch test ) na avaliação de sensibilização por alimentos em pacientes com dermatite atópica - estudo piloto
Patch testing in the evaluation of food sensitization in patients with atopic dermatitis - a pilot study
Cristiane Momoi; Lucila Camargo Lopes de Oliveira; Marcia Carvalho Mallozi; Renata Rodrigues Cocco; Dirceu Solé
DOI: 10.5935/2526-5393.20190026
Universidade Federal de São Paulo, Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria - São Paulo, SP, Brasil
Endereço para correspondência:
Lucila Camargo Lopes de Oliveira
E-mail: lucila_camargo@yahoo.com
Submetido em: 24/06/2019
Aceito em: 28/06/2019
Fonte de financiamento: a bateria comercial para realização dos testes de contato foi fornecida pela IPI ASAC Brasil (Grupo ASAC PHARMA Brasil).
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVOS: Investigar o papel do patch test na avaliação da sensibilização por alimentos e no diagnóstico de alergia alimentar em pacientes com dermatite atópica (DA) e comparar duas distintas apresentações do teste.
MÉTODOS: Esse estudo prospectivo envolveu 20 crianças (mediana de idade de 8,4 anos) com dermatite atópica moderada ou grave que foram submetidas ao teste cutâneo de hipersensibilidade tardia (patch test) com alimentos frescos e extratos comerciais, seguidos de teste de provocação oral (TPO) nos casos de resultado positivo, no intuito de avaliar a correlação clínica.
RESULTADOS: Entre os 20 pacientes avaliados, somente 4 (20%) apresentaram resultados positivos para o patch test, com maior positividade para os extratos comerciais (3/4), em comparação aos alimentos in natura. Não se observou concordância dos resultados obtidos entre as duas apresentações comparadas. Do total de 7 TPO realizados, 4 foram positivos (soja e milho para um paciente e amendoim para outros dois), com piora das lesões da DA (valor preditivo positivo de 57%). Apenas uma criança apresentou efeito adverso mais significativo.
CONCLUSÕES: Embora tenha sido encontrada baixa sensibilização aos alérgenos alimentares na população estudada e discordância entre os resultados dos patch tests com alimentos frescos e extratos comerciais, o teste mostrou-se seguro. Para uma melhor análise estatística, recomenda-se estudo em população maior.
Descritores: Dermatite atópica, hipersensibilidade alimentar, diagnóstico, teste de contato.
INTRODUÇÃO
A dermatite atópica (DA) é a doença inflamatória cutânea mais comum em crianças, acometendo mais de 20% delas em países desenvolvidos e com prevalência crescente nos de baixa renda1. Sua patogênese envolve alterações genéticas, como a mutação do gene da filagrina e alterações imunológicas da barreira cutânea, com importante participação de fatores ambientais desencadeantes (alérgenos alimentares e aeroalérgenos). O seu diagnóstico é clínico, sendo utilizados com maior frequência os critérios diagnósticos definidos por Hanifin e Rajka, em 19802.
A gravidade da DA pode ser avaliada pelo exame físico e quantificada pelo escore de sintomas denominado SCORAD (SCORing Atopic Dermatitis), que avalia os sintomas objetivos da doença tais como extensão e gravidade, além de sintomas subjetivos como prurido e comprometimento do sono3,4.
Sabe-se que a DA é uma doença de padrão misto (mediada e não mediada por imunoglobulinas E [IgE]) e está frequentemente relacionada à alergia alimentar (AA), principalmente nos casos de intensidade moderada e grave e em crianças menores de três anos de idade. Os mesmos alimentos que causam reações na população geral são responsáveis pela maioria das reações em crianças com DA. Leite de vaca, ovo, soja e trigo são responsáveis por 90% das alergias alimentares5.
Na metade dos casos, a AA pode se apresentar como uma reação de hipersensibilidade imediata, com características cutâneas não eczematosas, como urticária, com ou sem sintomas gastrintestinais, respiratórios ou anafilaxia, ocorrendo dentro de duas horas após a ingestão do alimento. Reações eczematosas tardias isoladas são bem menos frequentes: 10% das reações (3-4% de todas as crianças com DA moderada e grave) geralmente ocorrem após 6 horas da ingestão de um alimento. A combinação de ambas as reações ocorre em 40% dos casos6.
Até o momento, o teste de provocação oral (TPO), duplo-cego, controlado com placebo, permanece como o padrão-ouro para o diagnóstico de AA. É um procedimento, entretanto, que demanda tempo, custos e pode expor o paciente ao risco de reações alérgicas graves. Além disso, é um teste que apresenta maiores dificuldades em pacientes com DA, visto ser uma doença de caráter multifatorial. Como as reações eczematosas tardias geralmente ocorrem entre 6 e 48 horas após a ingestão do alimento, dificultam o estabelecimento da relação causal com o alérgeno alimentar. Portanto, tem-se procurado utilizar outras ferramentas diagnósticas para a investigação dos pacientes com suspeita de reação tardia, como o teste cutâneo de leitura tardia (patch test)7.
Embora amplamente utilizados na DA de difícil controle, na esofagite eosinofílica e em pacientes com distúrbios digestivos induzidos por alimentos8-16, ainda não existe uma padronização amplamente aceita de como realizar os patch tests e como interpretá-los. Até que ocorra essa padronização, a Academia Europeia de Alergia e Imunologia Clínica se posicionou em uma revisão institucional sobre o uso do patch test em pacientes com DA, considerando os testes com alimentos in natura preferíveis aos comerciais17.
Até o momento, poucos estudos abordaram a comparação entre as diferentes preparações dos alimentos a serem testados: alimentos frescos e extratos comerciais. O presente estudo teve como objetivos avaliar o papel do patch test com alimentos na identificação de sensibilização aos mesmos em pacientes com DA moderada e grave, e comparar os resultados obtidos com extratos comerciais e alimentos frescos, assim como verificar sua utilidade no diagnóstico da alergia alimentar por meio do TPO.
MÉTODOS
População do estudo
O estudo prospectivo avaliou 20 pacientes com diagnóstico de DA moderada ou grave, com idades entre 2 e 18 anos, regularmente matriculados e acompanhados no ambulatório de Alergia e Imunologia Clínica do Departamento de Pediatria da EPM-UNIFESP entre março e dezembro de 2016. Os pacientes foram selecionados independentemente da queixa dos pais de que algum alimento poderia estar contribuindo para a piora das lesões cutâneas da DA. Aqueles com história clínica convincente, IgE específica ou teste de provocação prévio positivos para reações imediatas não foram submetidos ao teste com o alimento envolvido, somente aos demais alérgenos.
À admissão no estudo foram coletados os seguintes dados clínicos: idade, sexo, idade de início e de duração da DA, gravidade (SCORAD), existência de outras doenças alérgicas associadas como asma, rinite alérgica e conjuntivite alérgica. A intensidade do SCORAD foi obtida conforme o recomendado: inferior a 20 = leve; entre 20 e 40 pontos = moderada; e acima de 40 pontos = grave3,4.
Não foram incluídos pacientes em uso de agente imunossupressor oral, os com DA em atividade e em tratamento com corticosteroides tópicos ou inibidores de calcineurina em região de dorso nas últimas 2 semanas18,19.
Teste de contato alérgico (patch test)
Os pacientes foram submetidos ao patch test utilizando-se extratos comerciais e alimentos in natura. A bateria comercial para realização dos testes de contato foi fornecida pela IPI ASAC Brasil (Grupo ASAC PHARMA Brasil), e os extratos testados e suas concentrações proteicas foram: Leite 40%, Caseína 15%, Amendoim 20%, Castanha do Pará e Castanha de Caju 20%, Clara de ovo 20%, Gema de ovo 20%, Ovo inteiro 20%, Milho 20%, Soja 20% e Trigo 20%. Com relação aos alimentos frescos, foi aplicada uma gota de cada mistura de 2 gramas do produto em pó (leite em pó a 3,5%, extrato de soja, farinha de trigo e fubá de milho) com 2 mL de soro fisiológico20. Somente no caso do ovo utilizou-se a clara pura, sem diluição. Como controles negativos foram utilizados a vaselina (controle comercial) e o soro fisiológico (controle in natura).
Tanto os alimentos frescos como os extratos comerciais foram acoplados a contensores plásticos (Finn-Chambers®) de 12 mm e fixados com fita adesiva hipoalergênica no dorso dos pacientes, em região de pele sem lesões, em sequência previamente estabelecida10,21. Para os alimentos frescos utilizou-se também o papel de filtro.
O tempo de oclusão foi de 48 horas, e a leitura ocorreu com 20 minutos e 24 horas após a remoção dos contensores. Após 72 horas de iniciado o teste, as reações foram classificadas como positivas quando houve o aparecimento de eritema, infiltração, presença de pápulas ou vesículas no local de aplicação dos contensores (Tabela 1)17.
O teste foi considerado negativo nos casos de reação positiva com 48 horas, porém negativa com 72 horas ou nos casos em que as duas leituras foram consideradas negativas.

Correlação clínico-laboratorial
Para confirmar a relação entre o resultado do patch test e a expressão clínica da DA, os pacientes que apresentaram no mínimo a presença de eritema e discreta infiltração (uma cruz) à leitura final do teste foram orientados a realizar dieta de restrição do alimento em questão, por 4 a 6 semanas. Após esse período, retornaram ao ambulatório de Alergia e Imunologia Clínica do Departamento de Pediatria da EPM-UNIFESP para nova avaliação e orientação sobre reintrodução diária do alimento (provocação oral) na dieta. O acompanhamento do eczema foi realizado com retornos ao serviço a cada 48 horas na primeira semana, e a cada 72 horas na segunda semana, totalizando 5 análises. O aumento de pelo menos 10 pontos no SCORAD em algum momento do seguimento foi considerado como piora da DA22.
O termo de Consentimento Livre e Esclarecido foi assinado pelos pais ou responsáveis, assim comoo Termo de Assentimento Livre e Esclarecido pelos pacientes maiores de 12 anos. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital São Paulo - UNIFESP (013216/2015).
RESULTADOS
Participaram do estudo 20 pacientes (50% do sexo masculino), com mediana de idade de 8,4 anos (6,4-11,5 anos). A mediana de idade de início da doença foi de 1,0 ano (0,5-2,3 anos) e o tempo médio de doença, de 7,1 anos. A maioria das crianças (85%) possuía outras condições alérgicas associadas, como rinoconjuntivite (75%) e asma (50%), e duas crianças apresentavam alergia alimentar IgE mediada. De acordo com o SCORAD, 65% dos pacientes apresentavam DA moderada, e 35%, DA grave. A média do SCORAD foi de 35,1 pontos.
Embora a utilização de imunossupressores orais fosse um critério de exclusão à admissão, uma criança de 6 anos em uso de tacrolimus desde os 5 meses de idade devido a transplante hepático não foi excluída do estudo. Três pacientes haviam utilizado ciclosporina oral com interrupção do medicamento há pelo menos um mês da avaliação, sendo, portanto, também incluídos.
Dos 20 pacientes submetidos ao patch test, 4/20 (20%) apresentaram resultados positivos com extrato comerciais e/ou in natura. Entre os testes positivos, 2/4 (50%) demonstraram sensibilização a apenas um alérgeno, 1/4 (25%) a dois alérgenos e um único paciente, a três alérgenos alimentares.
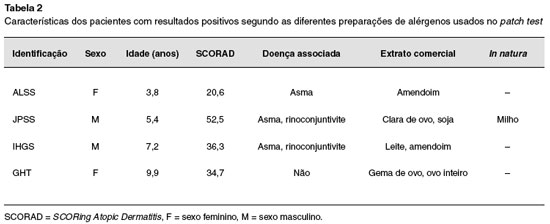
As características desses quatro pacientes e seus resultados encontrados de acordo com o tipo de apresentação do alimento utilizado são descritos na Tabela 2.
O patch test mostrou-se positivo para os seguintes alimentos: amendoim, clara e gema de ovo, ovo inteiro, leite, milho, soja e trigo, principalmente se sob a forma de extratos comerciais. Para aqueles alimentos presentes em ambas as preparações (clara de ovo, milho, trigo, soja e leite) houve concordância em resultados negativos apenas para o trigo, e nenhum paciente apresentou positividade para ambos os testes.
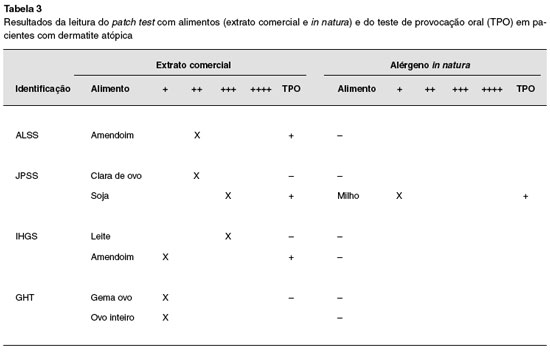
Entre os TPO realizados (n = 7) foram utilizados cinco alimentos (leite, amendoim, ovo, soja e milho), e destes, quatro foram considerados positivos, observando-se melhora da DA após a dieta de exclusão e posterior piora com a reintrodução do alimento. Duas crianças apresentaram desencadeamentos positivos para amendoim, e outro paciente, para soja e milho, resultando em um valor preditivo positivo (VPP) do patch test de 57%. Entretanto, não foi observada correlação entre a intensidade da positividade do patch test (em cruzes) e o resultado do TPO (Tabela 3).
Os efeitos adversos à realização do patch test não foram comuns, e entre os que apresentaram, na maioria foi leve, como prurido no local do contensor e irritação da pele pela fita adesiva. Apenas um paciente apresentou uma reação adversa mais significativa nos locais de aplicação do teste, chamada de Síndrome da Pele Excitada (Angry back syndrome), e considerado como resultado negativo.
DISCUSSÃO
Diversos estudos têm investigado o uso do patch test como ferramenta potencial para o diagnóstico de alergia alimentar não IgE-mediada9-16. Entretanto, a falta de padronização do teste é ainda uma limitação para sua utilização na prática clínica, uma vez que a interpretação dos resultados parece ser variável entre os estudos. Esse artigo descreve pela primeira vez os resultados encontrados em pacientes com DA acompanhados no Ambulatório de Alergia da UNIFESP, submetidos ao patch test realizado com duas formas de alérgenos (extrato comercial versus alimento in natura) e posterior correlação clínica por meio do TPO.
Entre os pacientes estudados, a taxa de sensibilização de 20% aos alérgenos alimentares foi inferior à obtida por outros estudos, que demonstram cifras de até 40% em crianças com DA e com alergia alimentar clinicamente relevante5. Tal diferença poderia ser explicada pelo fato de que a AA ocorre principalmente até os 3 anos, idade em que se adquire tolerância aos alimentos e ocorre maior sensibilização aos aeroalérgenos9. A população do estudo foi constituída principalmente por crianças maiores de 4 anos. Estudo prévio com predomínio de crianças menores de 2 anos de idade constatou menor frequência da positividade do teste entre os com mais de 2 anos23. Além disso, a análise estatística considerada incluiu pequeno número de pacientes neste estudo.
Não houve correlação positiva entre maior pontuação do SCORAD e a positividade ao teste de contato. A idade das crianças selecionadas, o considerável tempo de evolução da doença (média de 7 anos) e o parâmetro de avaliação (SCORAD) no momento da aplicação do teste e não ao início do aparecimento da DA, poderiam explicar a ausência de correlação.
Um dado relevante encontrado em nosso estudo foi a maior frequência de resultados positivos com a utilização dos extratos comerciais, apenas um resultado positivo foi verificado entre os alimentos frescos (milho), achado divergente ao relatado por outros11,24. Estudos prévios demonstram maior acurácia diagnóstica do patch test com alimentos frescos em crianças com sintomas gastrintestinais relacionados à alergia alimentar11,24. Além disso, a recomendação da Academia Europeia de Alergia e Imunologia Clínica é que se utilizem alimentos in natura até que ocorra uma padronização do teste17.
Além disso, não observamos concomitância entre os resultados obtidos para as diferentes preparações do mesmo alimento. É possível que o maior índice de positividade com extratos comerciais decorra de conterem maior concentração da proteína alergênica, pois são preparados a partir de alimentos liofilizados. Entretanto, esperaríamos uma associação com o resultado do alimento fresco, correspondente à reação in vivo.
Foram observados efeitos adversos leves durante a realização dos testes de contato, tais como prurido local. Apenas um paciente apresentou positividade em todas as regiões de aplicação do teste (Síndrome da Pele Excitada), caracterizando um estado de hiperreatividade cutânea, em que os testes positivos não são reproduzidos quando são testados posteriormente (falso-positivos)25. A ausência de exacerbação da DA e de reações mais graves demonstraram que o procedimento diagnóstico é seguro, sem complicações ou influências do tratamento.
Entre os cinco alimentos responsáveis por resultados positivos, quatro resultaram em melhora clínica quando eliminados da dieta e piora após sua reintrodução (amendoim em dois pacientes, soja e milho em outro). Entretanto, não foi observada correlação entre o nível de positividade do patch test (em cruzes) e o resultado do TPO. A presença de infiltração e de pelo menos sete pápulas em 72 horas no patch test são descritos como sinais cutâneos com maior acurácia diagnóstica para alergia alimentar em crianças com DA26. Nos estudos para avaliação da alergia alimentar em pacientes com DA, a sensibilidade dos patch test tem variado de 18 a 89% para o leite, de 60 a 97% para o ovo, e de 50 até 100% para o trigo; e com especificidade de 71 a 97% para o leite, 71 a 97% para o ovo, e de 35 a 97% para o trigo17.
O TPO aqui realizado foi aberto, sem a utilização de placebo e sem interrupção do uso de anti-histamínicos pelos pacientes em caso de prurido. As reações eczematosas tardias são de difícil relação causa versus efeito, e a DA origina-se de uma interação patológica complexa, incluindo desencadeantes ambientais como alérgenos, irritantes e micro-organismos. Todos esses fatores contribuem para as adversidades encontradas ao se realizar o TPO nesses pacientes.
O estudo apresenta limitações como o pequeno número de pacientes avaliados, composto principalmente por crianças maiores de 4 anos, além disso a não inclusão de grupo controle em que fosse realizado o TPO mediante o patch test negativo, o que inviabilizou a determinação da acurácia do método. Todavia, essa avaliação inicial nos permitiu avaliar o método para realização de estudos futuros em populações específicas, como fizemos em pacientes com esofagite eosinofílica8.
Em conclusão, o patch test mostrou ter relevância clínica para uma pequena parcela da população avaliada, com baixa concordância entre os resultados para os alimentos frescos e os extratos comerciais. Estudos com populações maiores são necessários para que conclusões mais significativas possam ser obtidas.
REFERÊNCIAS
1. Flohr C, Mann J. New insights into the epidemiology of childhood atopic dermatitis. Allergy. 2014;69:3-16.
2. Hanifin JM, Rajka G. Diagnostic features os atopic dermatitis. Acta Derm Venereol (Stockh). 1980;(Suppl. 92):44-7.
3. European Task Force on Atopic Dermatitis. Severity Scoring of atopic dermatites: The SCORAD Index Consensus Report of the European Task Force on Atopic Dermatitis. Dermatology. 1993;186:23-31.
4. Kunz B, Oranje AP, Labréze L, Stalder JF, Ring J, Taieb A. Clinical validation and guidelines for the SCORAD index: consensus report of the European task Force on Atopic Dermatitis. Dermatology.1997;195:10-9.
5. Sicherer SH, Sampson HA. Food hypersensitivity and atopic dermatitis: pathophysiology, epidemiology, diagnosis, and management. J Allergy Clin Immunol. 1999;104:S114-S122.
6. Gray CL, Levin ME. Food allergy in atopic dermatitis: how, when and why do we test?. Curr Allergy Clin Immunol. 2014:27(2):82-6.
7. Roehr CC, Reibel S, Ziegert M, Sommerfeld C, Wahn U, Niggemann B. Atopy patch tests, together with determinations of specific IgE levels, reduce the need for oral challenges in children with atopic dermatitis. J Allergy Clin Immunol. 2001;107:548-53.
8. Pereira RA, Cocco RR, Solé D, Mallozi MC, Aranda CS. Teste de contato alérgico (patch test) com alimentos no diagnóstico etiológico da esofagite eosinofílica: útil ou não? Arq Asma Alerg Imunol. 2019;3(1):93-4.
9. Yang H, Xiao YZ, Luo XY, Tan Q, Wang H. Diagnostic accuracy of atopy patch test for food allergy in children with atopic dermatitis aged less than two years. Allergol Immunopathol. 2014;42:22-8.
10. Levy SAP, Junior ADD, Pires AHS, Abe AT, Valle AOR, Coelho VP, et al. Atopy patch test (APT) in the diagnosis of food allergy in children with atopic dermatitis. An Bras Dermatol. 2012;87:724-8.
11. Canani RB, Ruotolo S, Auricchio L, Caldore M, Porcaro F, Manguso F, et al. Diagnostic accuracy of the atopy test in children with food allergy-related gastrointestinal symptoms. Allergy. 2007;62:738-43.
12. Mehl A, Werninghaus CR, Staden U, Verstege A, Wahn U, Beyer K, et al. The atopy patch test in the diagnostic workup of suspected food-related symptoms in children. J Allergy Clin Immunol. 2006;118(4):923-9.
13 Kalach N, Soulaines P, de Boissieu D, Dupont C. A pilot study of the usefulness and safety of a ready-to-use atopy patch test (Diallertest) versus a comparator (Finn Chamber) during cow´s milk allergy in children. J Allergy Clin Immunol. 2005;116:1321-6.
14. Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002;109(2):363-8.
15. Niggemann B, Reibel S, Wahn U. The atopy patch test (APT) - a useful tool for the diagnosis of food allergy un children with atopic dermatitis. Allergy. 2000;55:281-5.
16. Rokaite R, Labanauskas L, Vaideliene L. Role of the patch test in diagnosing food allergy in children with atopic dermatitis. Medicina (Kaunas). 2004;40:1081-7.
17. Turjanmaa K, Darsow U, Neggemann B, Rancé F, Vanto T, Werfel T. EAACI/GA2LEN position paper: present status of the atopy patch test. Allergy. 2006;61:1377-84.
18. Langeveld-Wildschut EG, Riedl H, Thepen T, Bihari IC, Bruijnzeel PL, Bruijnzeel-Koomen CA. Modulation of the atopy patch test reaction by topical corticosteroids and tar. J Allergy Clin Immunol. 2000;106(4):737-43.
19. Weissenbacher S, Traidl-Hoffmann C, Eyerich K, Katzer K, Braeutigam M, Loeffler H, et al. Modulation of atopy patch test and skin prick test by Pretreatment with 1% Pimecrolimus cream. Int Arch Allergy Immunol. 2006;140:239-44.
20. Spergel JM, Brown-Whitehorn T. The use of patch testing in the diagnosis of food allergy. Cur Allergy Asthma Rep. 2005;5(1):86-90.
21. Stromberg L. Diagnostic accuracy of the atopy patch test and the skinprick test for the diagnosis of food allergy in young children with atopic eczema/dermatitis syndrome. Acta Pediatr. 2002;91:1044-9.
22. Werfel T, Ballmer-Weber B, Eigenmann PA, Niggemann B, Rancé F, Turjanmaa K, et al. Eczematous reactions to food in atopic eczema: position paper of the EAACI and GA2LEN. Allergy. 2007;62:723-8.
23. Stromber L. Diagnostic accuracy of the atopy patch test and the skinprick test for the diagnosis of food allergy in young children with atopic eczema/dermatitis syndrome. Acta Paediatr. 2002;91(10):1044-9.
24. Boonyaviwat O, Pacharn P, Jirapongsananuruk O, Vichyanond P, Visitsunthorn N. Role of atopy patch test for diagnosis of food allergy-related gastrointestinal symptoms in children. Pediatr Allergy Immunol. 2015;26(8):737-41.
25. Duarte I, Lazzarini R. Síndrome da pele excitada associada à técnica de aplicação dos testes de contato. An Bras Dermatol. 2005;80(2):S107-8.
26. Heine RG, Verstege A, Mehl A, Staden U, Rolinck-Werninghaus C, Niggemann B. Proposal for a standardized interpretation of the atopy patch test in children with atopic dermatitis and suspected food allergy. Pediatr Allergy Immunol. 2006;17(3):213-7.