Número Atual: Abril-Junho 2019 - Volume 3 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Segurança da vacina de febre amarela em pacientes comprovadamente alérgicos à proteína do ovo
Safety of yellow fever vaccine in egg allergic patients
Clarissa Morais Busatto Gerhardt; Gislane de Sousa Juliao Feitosa; Bruna Pultrini Aquilante; Mayra de Barros Dorna; Cristiane de Jesus Nunes dos Santos; Antonio Carlos Pastorino; Ana Paula Beltran Moschione Castro
DOI: 10.5935/2526-5393.20190025
Instituto da Criança do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, Departamento de Alergia e Imunologia Pediátrica - São Paulo, SP, Brasil
Endereço para correspondência:
Clarissa Morais Busatto Gerhardt
E-mail: clarissa_g13@hotmail.com
Submetido em: 18/03/2019
Aceito em: 03/06/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: A vacina de febre amarela, recomendada em áreas endêmicas, é contraindicada em alérgicos à proteína do ovo (APO) por ser cultivada em ovos de galinha embrionados.
OBJETIVO: O objetivo do estudo foi mostrar a segurança da vacina de febre amarela em pacientes comprovadamente APO.
MÉTODO: Foi realizado estudo prospectivo em hospital quaternário, no período de janeiro a outubro de 2018. Foram incluídos pacientes com APO confirmada por teste de provocação oral (TPO), reação anafilática à proteína do ovo nos últimos 6 meses, ou reação de APO nos últimos 2 meses associada à IgE específica positiva. Todos foram submetidos ao teste de puntura com a vacina na apresentação pura. Se negativo, realizado teste intradérmico (ID) com a vacina na diluição de 1:100. Se ID negativo, vacina aplicada em dose plena. Se teste de puntura ou ID positivo, vacina aplicada fracionada segundo protocolo de dessensibilização.
RESULTADOS: Dos 78 pacientes com história presumida de APO, confirmou-se o diagnóstico em 43 (30M:13F, mediana idade 2,7 a): 30 por TPO, 7 com anafilaxia em menos de 6 meses da vacina, e 6 com reação imediata após ingestão do ovo há menos de 2 meses e IgE específica positiva. Durante o TPO, 12 apresentaram anafilaxia, e os demais (18) apresentaram urticária e/ou angioedema ou vômitos. Todos os testes de puntura (43) foram negativos. ID foi negativo em 37 pacientes, que receberam a dose plena da vacina, sem reações. Apenas 6 apresentaram ID positivo e necessitaram dessensibilização para vacina. Metade desses pacientes (3/6) apresentou reações de hipersensibilidade leves e foi tratada com anti-H1 e/ou corticoide oral. O ID positivo foi significativamente relacionado à reação à vacina (p = 0,0016).
CONCLUSÃO: Concluiuse ser possível vacinar alérgicos a ovo, com um protocolo seguro, mesmo em paciente comprovadamente anafilático. É necessária uma unidade especializada para sua realização, com capacidade de controlar possíveis situações de risco.
Descritores: Vacina contra febre amarela, hipersensibilidade a ovo, anafilaxia, dessensibilização imunológica.
INTRODUÇÃO
A febre amarela (FA) é uma doença infecciosa não contagiosa, causada pelo vírus do gênero Flavivirus, da família Flaviviridae, cujo principal vetor urbano é o Aedes aegypti. O quadro clínico apresenta início súbito e envolve sintomas gerais como febre, calafrios, cefaleia, lombalgia, dores musculares generalizadas, prostração, náuseas e vômitos. A forma grave caracteriza-se pela presença de insuficiência hepática e renal, com alta morbimortalidade, evoluindo para óbito em aproximadamente uma semana1.
No ano de 2016, houve um surto de FA no Brasil, com aumento do número de casos entre meados de 2017 e início de 20182. Ainda não se sabe a real causa do aumento expressivo de casos, mas dados epidemiológicos sugerem que possa ser decorrente do desmatamento de florestas e os macacos hospedeiros deste vírus se aglomeraram em espaços menores, intensificando a epizootia e atingindo áreas urbanas1,2. Outra justificativa pode estar relacionada a uma mutação genética do vírus, aumentando a susceptibilidade à doença1. Entre julho/2017 a junho/2018 foram notificados 7.518 casos suspeitos, sendo que 5.364 foram descartados e 778 continuavam em investigação, sendo confirmados 1.376 casos de FA, com 483 óbitos2.
A vacina contra febre amarela (VFA) é a maneira mais eficaz de prevenção, com impacto muito positivo no controle de surtos desde sua introdução, em 19472. A imunogenicidade da VFA é alta, com taxas de soroconversão ao redor de 97,5%3. No Brasil há dois tipos de vacinas disponíveis (Biomanguinhos-Fiocruz, utilizada pela rede pública, e Sanofi Pasteur, utilizada na rede privada), ambas compostas de vírus vivo atenuado (cepa 17D-204) e contendo excipientes capazes de desencadear reações de hipersensibilidade, entre outras reações adversas3. No processo de fabricação da VFA o vírus vivo atenuado é inoculado em ovos de galinha, que se multiplicam e são fecundados sem germes. O cultivo em ovos embrionados permite a detecção de níveis de ovoalbumina entre 0,067 µg/0,5 mL e 2,21 µg/0,5 mL3. Embora a alergenicidade da ovoalbumina possa ser reduzida com o aumento de temperatura, esta é uma etapa não contemplada no processo de fabricação da vacina, o que faz com que as recomendações presentes em bula contraindiquem a aplicação da VFA em pacientes com alergia à proteína do ovo (APO)3.
A APO atinge cerca de 2% da população pediátrica e, quando mediada por IgE, pode levar a reações imediatas capazes de evoluir para anafilaxia4,5. O diagnóstico de APO requer uma anamnese detalhada e complementada com exames, como o teste de puntura de leitura imediata ou dosagem sérica de IgE específica. Entretanto, vale ressaltar que em casos duvidosos será fundamental a realização do teste de provocação oral (TPO) para confirmação diagnóstica. Também devemos lembrar que boa parte dos alérgicos pode tolerar o ovo ao redor de 6 anos de idade6.
Faltam estudos publicados que comprovem a segurança da aplicação da VFA em pacientes com APO, especialmente com manifestações graves. Foram propostos protocolos onde se realizam testes cutâneos com a vacina e conforme resultado, um esquema de dessensibilização para sua aplicação7,8, mas ainda existem lacunas em relação a melhor conduta em pacientes com antecedente de anafilaxia7,8.
A Associação Brasileira de Alergia e Imunologia (ASBAI), diante do surto de FA em 2017, publicou uma recomendação em que pessoas com história de reações alérgicas leves a moderadas à proteína do ovo, poderiam receber a vacina sob supervisão médica com observação por 30 minutos após a vacinação. Pessoas com história de reações alérgicas graves, como anafilaxia, teriam contraindicação para receber a vacina, mas diante do risco de exposição à FA, o paciente deveria ser encaminhado ao especialista para realização de testes cutâneos com a VFA e se os testes fossem negativos, poderiam receber a vacina sob supervisão médica e com período de observação de 30 minutos; se positivos, o alergista poderia fracionar as doses ou promover a dessensibilização em ambiente seguro9. No mesmo período, o Ministério da Saúde e a Sociedade Brasileira de Imunizações (SBIM) publicaram que a VFA estaria contraindicada para pessoas com história de anafilaxia comprovada em doses anteriores ou relacionada a substâncias presentes na vacina (ovo de galinha e seus derivados, gelatina bovina ou a outras substâncias)10,11.
Diante do crescente número de casos de FA e sua alta mortalidade, a grande eficácia da proteção vacinal, somados à falta de publicações referentes a pacientes comprovadamente alérgicos à proteína do ovo que poderiam receber a VFA, a Unidade de Alergia e Imunologia do Instituto da Criança se motivou a iniciar a vacinação supervisionada de pacientes com APO e susceptíveis à doença, com o objetivo de provar a segurança da vacina em pacientes com APO confirmada.
METODOLOGIA
Trata-se de um estudo prospectivo em que foram incluídos todos os pacientes provenientes do ambulatório de Alergia e Imunologia do Instituto da Criança do Hospital das Clínicas de São Paulo no período de janeiro a outubro de 2018. Foram considerados elegíveis para esta avaliação pacientes que possuíam história pregressa de APO e que apresentavam indicação para VFA.
Foram considerados critérios de inclusão:
História de APO confirmada através de:
- TPO positivo realizado em até 6 meses da data de vacinação; ou
- pacientes com reação anafilática à proteína do ovo até 6 meses antes da data de vacinação; ou
- pacientes com história sugestiva de reação alérgica ao ovo até 2 meses antes da data de vacinação e com pesquisa positiva para IgE específica às proteínas do ovo (IgE sérica específica e/ou teste de puntura).
Os critérios de exclusão foram definidos por:
- tolerância à proteína do ovo comprovada após o TPO;
- outras contraindicações à administração da VFA;
- história de APO mediada por outro mecanismo imunológico;
- recusa em realizar TPO quando indicado pelo protocolo.
Todos os TPO (abertos) para confirmação de APO foram realizados no Instituto da Criança, em ambiente apropriado, segundo o protocolo em que o paciente recebeu 10% de um ovo cozido e aguardou 15 minutos. Posteriormente ingeriu o restante do ovo (90%) e foi mantido em observação clínica por 2 horas. Na ausência de reação objetiva de hipersensibilidade, recebeu uma porção de 0,5 gramas de albumina liofilizada em pó (10% de 1 ovo cru) após 15 minutos e, na ausência de reações, recebeu as demais 4,5 gramas da porção de albumina (total correspondente a 1 ovo) com período de observação de 2 horas. Nos pacientes que apresentaram manifestação clínica imediata e objetiva de APO, em qualquer etapa do teste, o procedimento foi imediatamente interrompido, considerado positivo e o paciente medicado conforme o quadro clínico12. Foram considerados resultados positivos os pacientes que apresentaram qualquer das seguintes manifestações clínicas, até duas horas da ingestão do alimento:
- envolvimento da pele, tecido mucoso ou ambos (urticária, prurido ou rubor facial, edema de lábios, língua e úvula);
- envolvimento respiratório (dispneia, sibilância, broncoespasmo, estridor, redução do pico de fluxo expiratório, hipoxemia);
- envolvimento gastrointestinal com sintomas persistentes (cólicas abdominais, vômitos, diarreia);
- envolvimento cardiovascular, com redução da pressão arterial ou sintomas associados de disfunção de órgão (hipotonia, colapso, síncope, incontinência).
A definição de anafilaxia respeitou os critérios propostos por Sampson et al. 13.
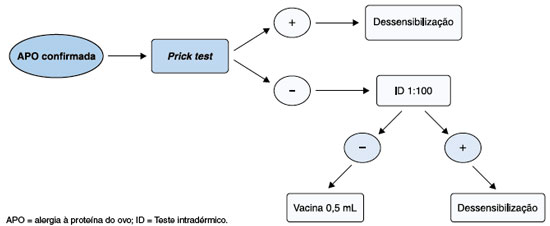
Pacientes com APO confirmada a ovo foram submetidos a um protocolo de vacinação que incluiu:
- teste de puntura para a VFA, de forma pura e para as proteínas do ovo (clara, ovoalbumina e ovomucoide) de acordo com técnica de Pepys14. A leitura foi realizada após 15 minutos e foram considerados positivos os testes cujas pápulas apresentaram diâmetro médio igual ou superior a 3 mm, após desconto do diâmetro do controle negativo e presença de controle positivo superior a 3 mm15.
- teste intradérmico (ID) com a VFA, na diluição de 1:100, foi realizado em pacientes cujo teste de puntura resultou em negativo. Injetou-se 0,05 mL da vacina diluída com cloreto de sódio 0,9%, via intradérmica, com seringa de 1 mL e agulha 10 x 4,5 mm ou 10 x 5 mm. Para validação do teste, foi obrigatória a formação de uma pápula deixando a pele com aspecto de "casca de laranja". A leitura foi realizada após 15 a 30 minutos e considerada positiva se o paciente apresentasse pápula maior que 3 mm de diâmetro da pápula inicial16.
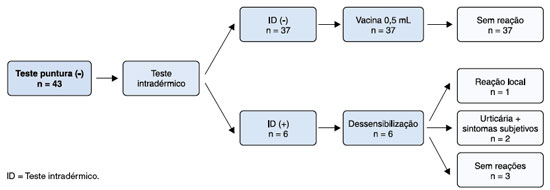
Pacientes com ID negativo receberam a VFA de forma habitual, na dose total de 0,5 mL, por via subcutânea. Se ID positivo, administrou-se a VFA fracionada seguindo protocolo americano de dessensibilização a vacinas17. A dessensibilização consistiu na aplicação subcutânea das seguintes doses da vacina, com intervalo de 15 minutos: 0,05 mL na diluição 1:10 da vacina; 0,05 mL na apresentação pura da vacina; 0,1 mL na apresentação pura da vacina; 0,15 mL na apresentação pura da vacina e 0,2 mL na apresentação pura da vacina. O tempo de observação após o término da aplicação da vacina foi de 1 hora, com registros sucessivos da avaliação clínica e descrição das reações de hipersensibilidade apresentadas (Figura 1).
Os resultados obtidos foram apresentados de maneira descritiva com medianas (mínimo e máximo), e realizado teste de Fisher para comparação entre pacientes com reação positiva no teste intradérmico ou presença de anafilaxia e as possíveis reações vacinais.
RESULTADOS
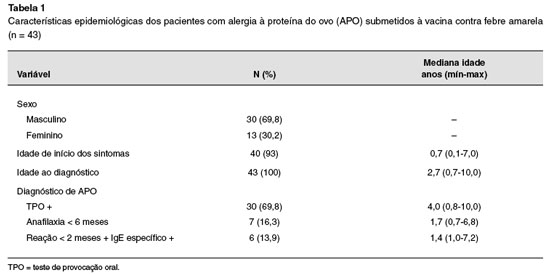
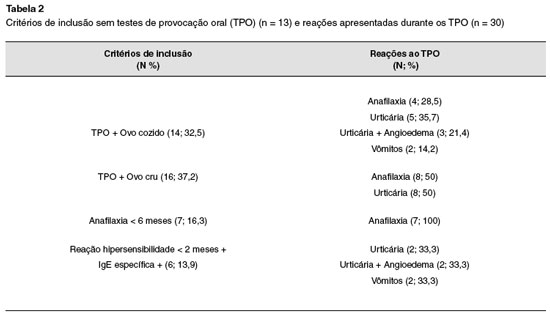
Dos 78 pacientes com história presumida de alergia a ovo, o diagnóstico foi confirmado em 43 (30M:13F), com mediana de idade ao diagnóstico de 2,7 anos (0,7 a 10,0 anos). Dos 43 pacientes, 21 referiam história pregressa de anafilaxia, 18 de outras manifestações alérgicas IgE mediadas, e 4 apenas de sensibilização. Foram confirmados 30 pacientes através do TPO (14 reagiram ao ovo cozido e 16 reagiram ao ovo cru). História de anafilaxia recente, há menos de 6 meses, foi o critério de inclusão de 7 pacientes, e 6 pacientes preencheram o critério de reação ao ovo há menos de 2 meses associado à IgE específica positiva (Tabela 1).
A Tabela 2 apresenta os critérios de inclusão e as reações apresentadas ao TPO (n = 30), sendo mais frequentes as manifestações cutâneas (13 urticárias e 3 urticárias com angioedema), seguidas pela anafilaxia (12), e 2 pacientes apresentaram apenas vômitos.
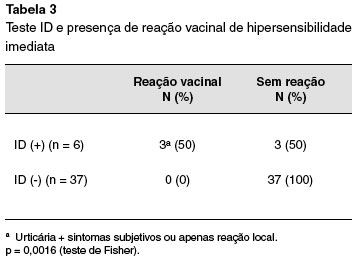
Todos os pacientes incluídos na pesquisa apresentaram o teste de puntura negativo (n = 43) e realizaram o teste ID. Apenas 6 apresentaram ID positivo, com 50% desses apresentando reações vacinais de hipersensibilidade (p = 0,0016, teste de Fisher) (Tabela 3).
Foram realizadas seis dessensibilizações com a VFA: três pacientes não apresentaram reações de hipersensibilidade, um apresentou reação local de urtica nos locais de aplicação e foi medicado com anti-H1 de 2ª geração oral, e dois apresentaram urticária com sintomas subjetivos (um apresentou náusea e dor abdominal leve, e outro apresentou prurido nasal e ocular), sendo medicados com anti-H1 de 2ª geração, prednisolona e sintomáticos, com melhora clínica. Os demais pacientes que apresentaram ID negativo (n = 37) receberam a VFA na dose total em uma única aplicação, sem reações (Figura 2).
Dezessete de 19 pacientes anafiláticos à proteína do ovo receberam a vacina sem reações de hipersensibilidade. Apenas dois apresentaram reações leves (urticária com sintomas subjetivos), que puderam ser contornadas em ambiente hospitalar, não sendo significante a história ou presença de anafilaxia para o desfecho de reações à vacina (p = 0,57) (Tabela 4).
DISCUSSÃO
Nos últimos anos a Região Sudeste vivenciou uma epidemia de FA e, neste cenário, a vacinação se torna a grande estratégia de controle. Entretanto, pacientes com história referida de APO muitas vezes são impedidos de receber a vacina pelo risco de reações adversas. Torna-se importante demonstrar o real status de APO no momento da imunização contra febre amarela para mensurar os possíveis riscos, sendo esta a principal motivação deste trabalho. A grande contribuição deste estudo foi aplicar, em pacientes comprovadamente alérgicos à proteína do ovo, inclusive anafiláticos, o protocolo de vacinação preconizado e demonstrar seu nível de segurança.
Reações alérgicas vacinais não são eventos frequentes, em especial se considerarmos as reações graves. Estimativas, incluindo reações de hipersensibilidade imediata, variam de 1 em 50.000 a 1 em 1.000.000 doses18. A anafilaxia, a mais preocupante delas, pode ocorrer em aproximadamente 1:100.000 a 1:1.000.000 doses para as vacinas mais comumente administradas19. Tais reações podem ser causadas por hipersensibilidade a antígenos vacinais, meios de cultura, estabilizantes, conservantes ou outros excipientes20. Dada a crescente prevalência de doenças alérgicas em todo o mundo21, em especial a alergia alimentar6, não é surpreendente que haja preocupações crescentes sobre os componentes de cada vacina e possíveis reações. A presença de quantidades facilmente mensuráveis de proteína do ovo na VFA pode ser uma causa de não vacinação em pacientes com alergia a este alimento ou mesmo naqueles em que há uma suspeita não confirmada.
Reações anafiláticas já foram relatadas após aplicação da VFA21, mas os trabalhos não mencionam a concomitância da APO no momento da vacinação. História referida de alergia pode não ser suficiente, pois a APO apresenta caráter transitório, gravidade variável e manifestações clínicas que se alternam conforme o tipo de preparação ofertada, se ovo cru ou cozido, se por via oral, parenteral ou até pelo contato. Incluir neste estudo pacientes sabidamente alérgicos a ovo no momento da vacinação foi um de seus pontos fortes, especialmente quando a maior parte dos pacientes teve sua história de APO confirmada através de TPO, um teste sabidamente reconhecido como padrão-ouro para diagnóstico de alergia alimentar. A realização do TPO em duas etapas, com ofertas distintas da proteína do ovo foi útil para mostrar a diferença nos perfis dos pacientes, pois praticamente metade destes tolerou ovo cozido e reagiu a ovo cru, a forma presente na vacina. Os pacientes que não realizaram TPO apresentaram, em sua maioria, anafilaxia em tempo inferior a seis meses, outra forte evidência da presença de alergia.
A avaliação da gravidade da APO e, principalmente, a revisão deste diagnóstico, deve anteceder a contraindicação da VFA. Essa investigação deve ser individualizada e cuidadosa, visto que uma parcela considerável de pacientes pode experimentar reações potencialmente fatais após contato com mínimas quantidades de proteína. Por outro lado, muitos pacientes com diagnóstico prévio de APO já adquiriram tolerância ao alimento e, ainda assim, mantêm o estigma de alérgico, contraindicando de maneira inadequada a aplicação da vacina.
Há poucos protocolos para vacinação de pacientes alérgicos a algum componente vacinal, sendo mais clássico o proposto por Pickering LK et al. As recomendações incluem testes de puntura com a vacina que pode ou não ser diluída, de acordo com a história pregressa referida. Na sequência, recomenda-se a realização de testes intradérmicos de acordo com resultado do teste de puntura e, finalmente, a vacina pode ser aplicada em cinco etapas progressivas até completar a dose total. Variações deste protocolo são descritas em algumas publicações22-23. No presente estudo, o teste de puntura não foi capaz de discriminar qualquer desfecho vacinal, uma vez que foi negativo em todos os pacientes. Este teste não foi representativo e tampouco útil para a triagem, podendo ser preterido em estudos posteriores.
A realização do teste ID contribuiu para predizer maior risco de reação vacinal. Somente pacientes que apresentaram ID positivo apresentaram reações vacinais. Ainda que o número de pacientes seja reduzido, é animador pensar que ele possa ser um exame de triagem adequado para pacientes com história recente de APO que demandem realizar VFA. Outro ponto de destaque foi a ausência de reações adversas na realização do teste, o que pode tornar este teste factível em centros de imunizações, possibilitando ser um divisor entre a aplicação da vacina em dose única ou fracionada, sempre garantindo segurança ao paciente. Trata-se de um aspecto deste estudo que deve ser melhor aprofundado. São necessários maiores estudos para se determinar seu grau de sensibilidade e de especificidade.
A anafilaxia à proteína do ovo sempre foi considerada um fator de risco à reação vacinal e em alguns cenários uma contraindicação. A ASBAI recomenda que pacientes com história pregressa de anafilaxia devam ser encaminhados a centros de referência para melhor avaliação. O presente estudo descreve a ausência de reações vacinais graves em pacientes com anafilaxia confirmada, o que pode contribuir ainda mais para o aumento do perfil de segurança na vacinação destes pacientes, sempre considerando vaciná-los em ambiente preparado a atender reações adversas.
História pregressa de APO não deve ser uma premissa para não vacinar pacientes com febre amarela. As discrepâncias entre história referida e história confirmada, a possibilidade de vacinar pacientes anafiláticos, ainda que em um protocolo de dessensibilização e a possibilidade de utilizar o teste intradérmico para a vacina como um auxiliar na tomada de decisão, são fatores que fortalecem a indicação desta vacina contra esta grave doença.
CONCLUSÃO
Foi possível vacinar alérgicos à proteína do ovo, com um protocolo seguro mesmo em pacientes comprovadamente anafiláticos. No entanto, é necessária a presença de profissional treinado para realização de testes cutâneos e dessensibilização, em ambiente capaz de atender e tratar possíveis reações adversas graves.
AGRADECIMENTOS
Agradecemos à toda equipe de Alergia e Imunologia Pediátrica do Instituto da Criança do Hospital das Clínicas da Faculdade de Medicina da USP, fundamental para a realização desse trabalho, e ao CRIE da Faculdade de Medicina da USP, pelo apoio.
REFERÊNCIAS
1. WHO Yellow fever in Africa and the Americas, 2016. Wkly Epidemiol Rec. 2017;92(32):442-52.
2. Brasil. Ministerio da Saude. Febre Amarela. Situação Epidemiológica/Dados. Situação Epidemiológica no Brasil. Disponível em: http://portalms.saude.gov.br/saude-de-a-z/febre-amarela-sintomastransmissao-e-prevencao/situacao-epidemiologica-dados. Acessado em: 8/10/2018.
3. Heinz FX, Stiasny K. Flaviviruses and flavivirus vaccines. Vaccine. 2011,30:4301-6.
4. Rona RJ, Keil T, Summers C, Gislason D, Zuidmeer L, Sodergren E, et al. The prevalence of food allergy: a metaanalysis. J Allergy Clin Immunol. 2007 Sep;120(3):638-46.
5. Sicherer SH. Epidemiology of food allergy. J Allergy Clin Immunol. 2011 Mar;127(3):594-602.
6. Leonard SA, Caubet JC, Kim JS, Groetch M, Nowak-Wgrzyn A. baked milk- and egg containing diet in the management of milk and egg allergy. J Allergy Clin Immunol Pract. 2015;3(1):13-23.
7. Gupta RS, Springston EE, Warrier MR, Smith B, Kumar R, Pongracic J, et al. The prevalence, severity, and distribution of childhood food allergy in the United States. Pediatrics. 2011;128:e9-17.
8. Castro AP, Pastorino AC, Gushken AK, Kokron CM, Filho UD, Jacob CM. Establishing a cut-off for the serum levels of specific IgE to milk and its components for cow's milk allergy: results from a specific population. Allergol Immunopathol (Madr). 2015;43(1):67-72.
9. Associação Brasileira de Alergia e Imunologia. Artigos, Imunização [internet]. 2018. Disponível em: http://www. asbai. org. br/secao. asp?s=81&id=1014. Acessado em 05/11/2018.
10. Brasil. Ministério da Saúde. Guia para Profissionais da Saúde, Brasília - DF, 2017.
11. Leão A, Cunha J, Ballalai I, Bravo F. Nota Técnica 17/04/2017; Sociedade Brasileira de Imunização; 2017.
12. Gushken AK, Castro AP, Yonamine GH, Corradi GA, Pastorino AC, Jacob CM. Double blind, placebo-controlled food challenges in Brazilian children: adaptation to clinical practice. Allergol Immunopathol (Madr). 2013;41(2):94-101.
13. Sampson HA, Muñoz-Furlong A, Campbell RL, Adkinson NF Jr, Bock SA, Branum A, et al. Second symposium on the definition and management of anaphylaxis: Summary report - Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. Ann Emerg Med. 2006;47(4):373-80.
14. Pepys J. Skin testing. Br J Hosp Med. 1975;14:412-5.
15. Position paper: Allergen standardization and skin tests. The European Academy of Allergology and Clinical Immunology. Allergy. 1993;48(14 Suppl):48-82.
16. Voorhost R. Perfection of skin testing technique. Allergy. 1980;35:247.
17. Pickering LK, Baker CJ, Long SS, McMillan JA, eds. Red Book:2006 Report of the Committee on Infectious Diseases. 27ª ed. ElkGrove Village, IL: American Academy of Pediatrics; 2006. p. 446-8.
18. Bohlke K, Davis RL, Marcy SM, Braun MM, DeStefano F, Black SB, et al. Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics. 2003;112(4):815-20. doi: 10.1542/peds. 112.4.815.
19. Cheng DR, Perrett KP, Choo S, Danchin M, Buttery JP, Crawford NW. Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013. Vaccine. 2015;33(13):1602-7. doi: 10.1016/j.vaccine. 2015.02.008.
20. Wood RA. Allergic reactions to vaccines. Pediatr Allergy Immunol. 2013;24(6):521-6. doi: 10.1111/pai. 12102.
21. Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016 Sep 16;9(1):32. doi: 10.1186/s40413-016-0120-5.
22. Barbaud A, Deschildre A, Waton J, Raison-Peyron N, Tréchot P. Hypersensitivity and vaccines: an update. Eur J Dermatol. 2013;23(2):135-41.
23. Ponvert C, Bloch-Morot E. Allergic and non-allergic hypersensitivity to vaccines. Revue française d'allergologie. 2013;53:9-17.
* Estudo agraciado com o Prêmio Ernesto Mendes, como melhor trabalho apresentado no XLV Congresso Brasileiro de Alergia e Imunologia, realizado de 20 a 23 de outubro de 2018, em Recife, PE