Número Atual: Abril-Junho 2019 - Volume 3 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo de Revisão
Imunoterapia no tratamento do câncer
Immunotherapy in cancer treatment
Juliano José Jorge
DOI: 10.5935/2526-5393.20190023
Clínica Dr. Juliano Jorge, Departamento de Alergia e Imunologia Clínica - Maringá, PR, Brasil
Endereço para correspondência:
Juliano José Jorge
E-mail: julianojjorge@gmail.com
Submetido em: 14/03/2019
Aceito em: 20/06/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O avanço no conhecimento do funcionamento do sistema imunológico e de seu comportamento frente às neoplasias nos tem levado a novas modalidades de tratamento do câncer. Terapias como inibidores de checkpoint imunológico, transferência de células adotivas, anticorpos monoclonais e vacinas preventivas têm revolucionado o enfoque terapêutico para diversos tipos de neoplasias. Este documento traz uma breve descrição dos mecanismos de ação destas novas classes terapêuticas, com o objetivo de fornecer aos médicos alergistas e imunologistas noções de sua aplicação, ajudando-os e estimulando-os a aprofundar o conhecimento nas várias frentes de atuação no tratamento do câncer.
Descritores: Imunoterapia, vacinas anticâncer, imunoterapia adotiva.
INTRODUÇÃO
Desde o século XIX, sabe-se que o sistema imunológico tem a capacidade de reconhecer e erradicar células cancerígenas. Umas das primeiras observações feitas desta ação do sistema imunológico foi a observação de regressão de alguns tipos de sarcomas em pacientes que desenvolveram infecção cutânea com Streptococcus pyogenes1, desenvolvendo uma resposta imunológica contra este tipo de câncer. Isto levou ao uso de cepas de S. pyogenes e Serratia marscecens, mortas por calor (Toxina de Coley), no tratamento e regressão de alguns tipos de sarcomas2.
Estas observações levaram ao desenvolvimento do conceito de imunovigilância, onde células T apresentam a capacidade de reconhecer proteínas cancerígenas, quando ligadas ao complexo de histocompatibilidade principal (MHC) em células apresentadoras de antígenos (APC). Logo, o sistema imunológico é capaz de controlar a imunogenicidade e a carga tumoral1. Este sistema de controle imunológico apresenta três fases:
- fase de eliminação: onde o sistema imunológico destrói as células cancerígenas, antes de qualquer apresentação clínica;
- fase de equilíbrio: a células que escaparam da fase de eliminação permanecem de forma controlada no organismo, através de ação do sistema imunológico. Por exemplo: estado livre de doença, apesar de micrometástases;
- fase de escape: o crescimento descontrolado do câncer através de escape do sistema imunológico, se dá devido a alguns destes fatores: resistência à citotoxicidade, perda da expressão dos antígenos do MHC, defeitos na apresentação de antígenos, perda de genes cruciais à resposta imunológica (genes relacionados ao interferon g, recrutamento de células imunorreguladoras3.
ATIVAÇÃO DO SISTEMA IMUNOLÓGICO
Para que ocorra a ativação dos linfócitos T, são necessárias complexas interações entre diversos receptores e seus ligantes. A primeira ligação necessária é entre o receptor do linfócito T (TCR) e o antígeno apresentado em uma molécula de MHC na célula apresentadora de antígenos (APC). Porém, esta única ligação é incapaz de ativar o sistema imunológico, sendo necessário um segundo sinal. Este sinal ocorre através da conexão da molécula de CD28 no linfócito, com o CD80/CD86 que é o seu ligante na APC. Logo, percebe-se que células tumorais não são capazes por si só de desencadear resposta imunológica, sendo necessária ação das APCs1.
Com o desenvolvimento tecnológico e maior conhecimento do sistema imunológico, chegamos ao reconhecimento de trajetos inibitórios, que atenuam esta resposta imunológica. A molécula de CTLA-4, expressa nos linfócitos T depois de ativados, possui grande homologia com a molécula CD28. Ela também apresenta maior afinidade ao CD80/CD86 que a molécula de CD28, ativando uma resposta imunorreguladora que inativa a resposta de linfócitos T4.
Os medicamentos com ação nesta interface do sistema imunológico são denominados inibidores de checkpoint imunológico.
INIBIDORES DE CHECKPOINT IMUNOLÓGICO
Terapia anti-CTLA-4
Como a ação da molécula CTLA-4 necessita da ligação com o mesmo receptor da molécula CD28, ela apresenta mecanismo imunorregulador inibitório de resposta inflamatória contra o câncer, evitando dano tecidual exagerado. Porém, este mecanismo acaba protegendo células do câncer, e ao bloquear sua ação, melhora-se a resposta antitumor.
O Ipilimumabe foi o primeiro anticorpo monoclonal contra CTLA-4. Seu uso se mostrou eficaz na regressão do melanoma, carcinoma renal, câncer de próstata, carcinoma urotelial e câncer do ovário5. O sucesso no seu uso levou à investigação e reconhecimento de outros mecanismos de regulação imunológica6.
Anti-PD1/PD1L
A PD1 (programmed death) pertence à família do CD28/CTLA-4. É expressa na superfície de linfócitos T ativados, células dendríticas e células NK. A PD1 exerce sua função imunorreguladora diretamente no TCR, diferente do CTLA-4 que age na interface CD28/CD80, fornecendo um sinal imunorregulador adicional. Anticorpos agindo na interação PD1/PD1L mostraram resposta clínica positiva em diversos tipos de tumores.
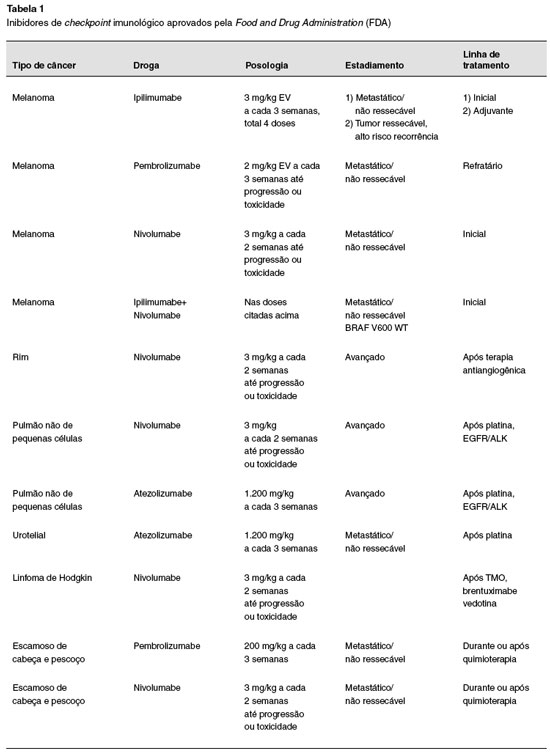
O Nivolumabe, foi a primeira droga anti-PD1 lançada, usada no tratamento de melanoma metastático. Pembrolizumabe é outra medicação anti-PD1 atualmente utilizada como terapia de checkpoint imunológico em câncer. Há também o Atezolizumabe, um anti-PD1L, aprovado no tratamento de câncer de bexiga7. A Tabela 1 enumera os principais inibidores de checkpoint imunológico aprovados para uso clínico.
O uso destes medicamentos tem sido extensamente avaliado clinicamente, porém alguns pacientes podem apresentar danos teciduais inflamatórios, denominados efeitos adversos imunorrelacionados. Os mais comuns são: diarreia, colite, rash cutâneo, dermatite, elevação de transaminases, hipofisite e tireoidite8. A combinação de anti CTLA-4 e Anti-PD1, apresenta maior incidência destes efeitos adversos, porém a maior parte deles é transitória e responsiva a corticoides. Em algumas ocasiões o tratamento com drogas imunomoduladoras, como a azatioprina ou micofenolato mofetil, pode ser necessário9.
Além dos efeitos adversos, outros fatores que limitam a eficácia clínica do uso dos inibidores de checkpoint imunológico são os mecanismos de resistência à terapia, que podem ocorrer da seguinte maneira:
- Ativação de vias oncogênicas que levam à inibição de células T no ambiente tumoral, como ativação de vias das cateninas e perda da expressão de PTEN (regulador negativo da via P13K-AKT).
- Perda da sinalização de interferon g, através da perda de função de genes envolvidos na sinalização de sua via de ativação.
- Maior recrutamento de linfócitos reguladores (TRegs).
- Microbioma: a composição do microbioma pode contribuir em diferentes respostas à imunoterapia. Estudos em ratos mostraram que floras intestinais ricas em espécies de Bifidobacterium apresentaram maior resposta imunológica contra os tumores. A administração destas bactérias em ratos com melanoma melhorou a resposta imunológica e eficácia com anti-PD110. Em outro estudo, mostrou-se que microbiota rica em Bacterioides fragilis apresentou melhor resposta ao tratamento com CTLA-411.
TRANSFERÊNCIA DE CÉLULAS ADOTIVAS
Esta é uma modalidade de tratamento na qual há a reinfusão de linfócitos isolados do tumor ou do sangue periférico do próprio paciente, que sofrem expansão clonal ex-vivo. Linfócitos presentes em tumores transplantáveis são capazes de reconhecer células tumorais in vitro, onde são clonalmente expandidos e reinfundidos para o tratamento, porém a técnica de isolar e expandir clonalmente estes linfócitos é muito cara e trabalhosa, o que limita seu uso12. Além de sua alta complexidade e custo, a realização desta modalidade de tratamento exige imunossupressão do paciente antes de sua aplicação, com o objetivo de melhorar sua eficácia. Uma alternativa de fonte de linfócitos é o sangue periférico, estratégias para isolar e expandir estas raras células T específicas estão sendo desenvolvidas para estudos clínicos em populações maiores.
No início dos anos 2000 foram introduzidos linfócitos modificados geneticamente. Para aumentar sua especificidade, foram desenvolvidos linfócitos T com receptores antigênicos quiméricos (CAR T cells), que reconhecem antígenos tumorais sem a necessidade de apresentação pelas APCs. Após o sucesso inicial, foram desenvolvidos receptores antigênicos quiméricos (segunda geração), onde foram incorporados a eles moléculas coestimuladoras como CD28, 4-1BB ou OX40 (moléculas da família do receptor de fator de necrose tumoral), ICOS (coestimulador de células T induzíveis)13. Receptores antigênicos quiméricos de terceira geração são incorporados a dois fatores coestimuladores. E mais recentemente surgiram os receptores antigênicos quiméricos blindados, onde além de duas moléculas coestimuladoras, estão associados transgenes para citocinas (IL-2) ou ligantes (CD40L ou 4-1BBL).
CTL019, uma CAR T cell de segunda geração foi o primeiro desta classe a receber aprovação pela FDA para o tratamento de leucemia linfoblástica adulta refratária ou recidivante (NCT02228096; ClinicalTrials.gov).
Transferência de células adotivas isoladas e modificadas para terem reatividade contra DNA viral podem tratar de maneira eficiente doenças linfoproliferativas pós-transplantes associadas ao vírus Epstein-Barr14.
Os efeitos colaterais são geralmente toleráveis, porém reações graves são relatadas. Efeitos adversos podem ocorrer quando linfócitos T transferidos além de reconhecer antígenos tumorais, passam a reconhecer estes antígenos em células saudáveis. Foram descritos vitiligo e uveíte em pacientes com melanoma que receberam esta modalidade de tratamento. Hepatotoxicidade foi relatada em pacientes com carcinoma renal, submetidos a transferência de células adotivas. O tratamento destas reações se baseia no uso tópico ou sistêmico de corticoides15. Uma das maiores preocupações em pacientes submetidos a tratamento com células T com receptores antigênicos quiméricos é a síndrome de liberação de citocinas (tempestade citocínica), caracterizada pelos altos níveis de citocinas (IL6, TNFa, Interferon g), levando a febre, tremores, hipotensão e hipóxia. Seu tratamento é feito com altas doses de corticoides ou uso de Tocilizumabe (anti-IL6R).
ANTICORPOS MONOCLONAIS
São anticorpos provenientes de um único clone de linfócitos B que se ligam a um específico epítopo antigênico. São compostos por uma porção FC que mediará a reação de citotoxicidade celular mediada por anticorpo (ADCC) e a citotoxicidade mediada por complemento; e uma porção FAB com alta afinidade para antígenos específicos16. No tratamento do câncer existem os anticorpos monoclonais isolados (naked mAbs), onde a ADCC é a principal mecanismo de atividade contra as células cancerígenas. Exemplos mais comuns dos naked mAbs são relacionados a seguir.
- Rituximabe, que possui especificidade contra moléculas CD20 da superfície de células B. É aprovado para o uso em linfoma de células B não Hodgkin CD20 positivo e leucemia linfocítica crônica.
- Transtuzumabe, específico contra EGFR-2 (receptor de tirosina quinase), que é expresso em exagero em pacientes com câncer de mama.
- Bevacizumabe, específico contra fator de crescimento endotelial vascular (VEGF), usado como tratamento de primeira e segunda linha contra câncer de colo metastático, associado a quimioterapia. Também usado em câncer de pulmão não pequenas células, como primeira linha de tratamento. Tem aplicação no glioblastoma em pacientes cujo tumor apresentou progressão após tratamento inicial1.
- Cetuximabe, específico contra EGFR, utilizado no tratamento no câncer colorretal metastático e no câncer de cabeça e pescoço recorrente, tanto como primeira linha (associado a derivados da platina), quanto como segunda linha nos casos de falência do tratamento inicial17.
Anticorpos monoclonais conjugados
Os mAbs são associados a agentes citotóxicos ou radioterápicos (radioimunoterapia), se encarregando de entregar estes agentes diretamente nas células tumorais alvo. As substâncias relacionadas abaixo são exemplos de uso clínico de anticorpos monoclonais conjugados.
- Ibritumomabe Tiuxetan (antiCD20) é um exemplo de radioimunoterapia, aprovado para o tratamento de diferentes tipos de linfomas.
- Brentuximabe Vedotina é um mAb específico contra CD30 conjugado a uma droga (monometil auristatina E). Estudos clínicos em Fase II mostraram remissão completa em 34% de pacientes com linfoma de Hodgkin refratário.
Há também os MAbs biespecíficos, neste caso são conjugados dois mAbs com especificidade contra dois antígenos. Blinatomumabe apresenta especificidade contra CD19 e CD3. Aprovado para uso em leucemia linfoblástica refratária aguda, onde 40% dos pacientes atingiram remissão ou resposta completa com recuperação hematológica parcial18.
VACINAS CONTRA CÂNCER
Existem as vacinas preventivas, que visam evitar infecções de determinados agentes que podem levar ao surgimento do câncer, como as vacinas contra o HPV, vírus associado ao surgimento de câncer em cabeça e pescoço, região anal e cérvix uterino.
Para pacientes com câncer de próstata, o Sipuleucel-T foi a primeira vacina aprovada para uso. Consiste no uso de células mononucleares autólogas ativadas ex-vivo com a proteína PA2024 (um antígeno prostático). O tratamento se mostrou eficaz em pacientes com tumores resistentes ao tratamento convencional. Seu exato mecanismo de ação não é conhecido19.
A imunoterapia com vírus oncolíticos é uma modadlidade de tratamento, ainda em estudos, onde vírus modificados são utilizados para combater determinados tipos de câncer. IMLYGIC é um herpes vírus modificado, preparado para se replicar dentro de células tumorais e provocar sua lise. Estudos mostram sua eficácia no tratamento de pacientes com melanoma avançado.
CONCLUSÃO
Imunoterapia para o câncer já é uma modalidade de tratamento bem estabelecida. Mostrou resposta satisfatória em diversos tipos de tumores malignos, inclusive em tipos refratários ao tratamento convencional.
Novas pesquisas seguem em andamento, com o objetivo de otimizar e criar novas estratégias de tratamento, assim como a identificação de biomarcadores. Com o avanço destes estudos, há esperança de que a imunoterapia contra o câncer possa se massificar, beneficiando cada vez mais pacientes.
REFERÊNCIAS
1. Sharma A, Campbell M, Yee C, Goswami S, Sharma P. Immunotherapy of cancer. In: Rich RR, Fleisher TA, Shearer WT, Schroeder HW, Frew AJ, Weyand CM, eds. Clinical immunology: principles and practice. 5ª ed. Elsevier; 2018. p. 1033-48.
2. Nauts HC. Bacterial pyrogens: beneficial effects on cancer patients. Prog Clin Biol Res. 1982;107:687-96.
3. Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol. 2004;22:329-60.
4. Krummel MF, Allison JP. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. 1995;182(2):45-65.
5. Sharma P, Allison JP. The future of immune checkpoint therapy. Science. 2015;348(6230):56-61.
6. Sharma P, Wagner K, Wolchok JD, Allison JP. Novel cancer immunotherapy agents with survival benefit: recent successes and next steps. Nat Rev Cancer. 2011;11(11):805-12.
7. Rosenberg JE, Hoffman-Censits J, Powles T, van der Heijden MS, Balar AV, Necchi A, et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet. 2016;387(10031):1909-20.
8. Gao J, He Q, Subudhi S, Aparicio A, Zurita-Saavedra A, Lee DH, et al. Review of immune-related adverse events in prostate cancer patients treated with ipilimumab: MD Anderson experience. Oncogene. 2015;34(43):5411-17.
9. Michot JM, Bigenwald C, Champiat S, Collins M, Carbonnel F, Postel-Vinay S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016;54:139-48.
10. Sivan A, Corrales L, Hubert N, Williams JB, Aquino-Michaels K, Earley ZM, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy. Science. 2015;350(6264):1084-9.
11. Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015;350(6264):1079-84.
12. Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 2015;348(6230):62-8.
13. Dai H, Wang Y, Lu X, Han W. Chimeric antigen receptors modified T-Cells for cancer therapy. J Natl Cancer Inst. 2016;108(7):djv439.
14. Rooney C, Leen A. Moving successful virus-specific T-cell therapy for hematopoietic stem cell recipients to late phase clinical trials. Mol Ther Nucleic Acids. 2012;1(11):e55.
15. Chandran SS, Paria BC, Srivastava AK, Rothermel LD, Stephens DJ, Dudley ME, et al. Persistence of CTL clones targeting melanocyte differentiation antigens was insufficient to mediate significant melanoma regression in humans. Clin Cancer Res. 2015;21(3):534-43.
16. Smaletz O, Mutti HB. Imunologia em Cancerologia. In: Geller M, Scheinberg MA, eds. Diagnóstico e Tratamento das Doenças Imunológicas. 2ª ed. Rio de Janeiro: Elsevier; 2015. p. 347-50.
17. Sartore-Bianchi A, Bencardino K, Cassingena A, Venturini F, Funaioli C, Cipani T, et al. Therapeutic implications of resistance to molecular therapies in metastatic colorectal cancer. Cancer Treat Rev. 2010;36(Suppl 3):S1-5.
18. Topp MS, Gökbuget N, Stein AS, Zugmaier G, O'Brien S, Bargou RC, et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol. 2015;16(1):57-66.
19. Yaddanapudi K, Mitchell RA, Eaton JW. Cancer vaccines: Looking to the future. Oncoimmunology. 2013;2(3):e23403.