Número Atual: Abril-Junho 2019 - Volume 3 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Imunoterapia e imunobiológicos na dermatite atópica
Immunotherapy and immunobiologicals in atopic dermatitis
Ataualpa Pereira dos Reis1; Fernando Monteiro Aarestrup2
DOI: 10.5935/2526-5393.20190022
1. Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, Imunobiologia - Belo Horizonte, MG, Brasil
2. Serviço de Alergia e Imunologia do Hospital Maternidade Therezinha de Jesus - Juiz de Fora, MG. Laboratório de Imunopatologia e Patologia Experimental. Universidade Federal de Juiz de Fora - Alergia e Imunologia - Juiz de Fora, MG, Brasil
Endereço para correspondência:
Ataualpa P. Reis
E-mail: ataualpapreis@gmail.com
Submetido em: 08/04/2019
Aceito em: 31/05/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Na última década, avanços consideráveis na compreensão da patogênese da dermatite atópica têm pavimentado a via de um número de novos tratamentos. A melhora da imunoterapia subcutânea com alérgenos e a introdução da imunoterapia sublingual deram lugar à prospecção de sua aplicação para adultos e crianças portadoras de dermatite atópica. Esta revisão apresenta resultados das pesquisas científicas, análises sistemáticas e metanálises que confirmam a eficácia clínica da imunoterapia com alérgenos para pacientes com dermatite atópica de curso moderado ou grave, que apresentam sensibilização a aeroalérgenos. Apresentamos também novas informações de como usar os bioterapêuticos que estão levando a tentativas mais eficazes de tratamento. A esperança é de que estes novos biológicos ou antagonistas de pequenas moléculas, que têm alta especificidade para as moléculas-alvo, possam diminuir os efeitos indesejáveis causados pelos agentes imunossupressivos sem um alvo específico, como os observados pelas drogas de ampla ação biológica. Com o desenvolvimento e subsequentemente com a aprovação dos bioterapêuticos pelas agências reguladoras, nós começamos a ver uma revolução clínica e terapêutica no tratamento da dermatite atópica. As fontes de dados incluíram artigos originais, revisões e publicações indexados nos bancos de dados PubMed, MEDLINE, LILACS, SciELO e publicações on-line nos últimos 15 anos. Como resultado, uma nova era no tratamento de pacientes com doenças crônicas graves está em andamento na nossa especialidade. O uso de imunoterapia subcutânea, imunoterapia sublingual e bioterapêuticos para dermatite atópica prometem grande precisão e efetividade na medicina personalizada.
Descritores: Imunoterapia, produtos biológicos, dermatite atópica.
INTRODUÇÃO
A dermatite atópica (DA) é uma doença inflamatória da pele, pruriginosa e recidivante, muitas vezes associada a níveis elevados de IgE no sangue circulante e que ocorre simultaneamente com outras doenças alérgicas do tipo Th2, tais como asma e rinite alérgica1. A dermatite atópica é considerada primariamente como uma doença infantil, já que 90% dos pacientes desenvolvem seus primeiros sintomas antes dos 5 anos de idade2,3. DA também afeta um significante número de adultos, tanto como persistência da doença da infância, como também por início na vida adulta ou recorrência4,5. A prevalência da DA nos adultos é cerca de 7 a 10%6,7. Muitos pacientes com DA podem alcançar o controle da doença com tratamento adequado da pele ou com tratamentos tópicos8. Contudo, estes tratamentos apresentam eficácia inadequada em pacientes nas formas moderada a grave. Até recentemente, o tratamento era com corticosteroides sistêmicos, mas estes não são mais recomendados por apresentarem efeitos colaterais e efeito rebote quando descontinuam a terapia9,10. Os pacientes com DA moderada a grave usam tratamento tópico ou em conjunto com tratamento sistêmico, mas muitos não estão bem controlados11,12. Embora primariamente a DA afete a pele, ela está sendo reconhecida cada vez mais como uma doença sistêmica com comorbidades atópicas e não atópicas, com implicações muito importantes no manejo e tratamento da doença13-15. A pele não lesada dos pacientes com DA moderada a grave mostra extensas anormalidades de barreira cutânea e imunológicas, refletindo a natureza sistêmica da moléstia13,16. Em adição, a DA pode estar associada com aumento de infecções6,11,16, desordens neuropsiquiátricas17-21, câncer 22-25 e possivelmente doenças cardiovasculares26,27. Isto mostra a necessidade de maiores tentativas sistêmicas, seguras e efetivas, que ataquem este complexo fisiopatológico. Avanços recentes na imunopatogênese da DA, incluindo uma melhor compreensão do papel de Th2 e Th1, e suas citocinas, principalmente Il-13, IL-22, IL-32, Il-17/IL-2328, estão proporcionando terapias mais dirigidas a estes mecanismos, tais como a imunoterapia e os imunobiológicos, levando a uma medicina de precisão e a possibilidade de personificar o tratamento da DA, abrindo uma nova era na terapêutica da DA. Nesta revisão pretendemos discutir o papel da imunoterapia e os novos compostos imunobiológicos focando as citocinas do mecanismo molecular da DA.
IMUNOTERAPIA EM DERMATITE ATÓPICA
Fatores desencadeadores e DA: a determinação da relação de causalidade na escolha e eficácia do tratamento
A maioria dos pacientes adultos com DA apresenta associação da doença com níveis de IgE sérica acima de 150 kU/L, rinite alérgica e asma, sensibilização a aeroalérgenos e/ou alergia alimentar29,30. Apesar de a alergia alimentar ser menos comum em adultos, em crianças com DA moderada a grave, tal associação é observada em cerca de um terço dos pacientes31. Ressalte-se que nesta situação não se pode restringir alimentos sem a comprovação de sensibilização e associação direta entre provocação de manifestações clínicas e exacerbação da DA, sendo extremamente importante diferenciar causalidade, doença coexistente e fatores modificadores da doença32,33. A comprovação da sensibilização alimentar deve ser realizada por prick test com extratos padronizados e/ou prick to prick com alimentos in natura, bem como por determinação dos níveis de IgE específica no soro por ImmunoCAP®32,33. Ainda tem recebido destaque o atopy patch test (APT), teste cutâneo de leitura tardia com aeroalérgenos e alimentos, visto que a positividade refletirá a sensibilização, mas podendo se confirmar ou não nos achados clínicos34-37. Dentre os fatores ambientais, os aeroalérgenos são extremamente relevantes como agentes desencadeadores da doença. As exacerbações de lesões eczematosas ocorrem após contato da pele com aeroalérgenos ou por inalação dos mesmos. Assim como na alergia alimentar, deve-se determinar a relação causal ou não entre a DA e a sensibilidade a aeroalérgenos. O diagnóstico de alergia a estes agentes é realizada pela identificação de IgE específica por meio de prick test ou pelo nível sérico desta imunoglobulina, porém ambas as avaliações têm um baixo valor preditivo. Por outro lado, o APT apresenta maior especificidade e menor sensibilidade, e pode caracterizar a sensibilização em pacientes negativos classificados anteriormente como portadores de DA com sensibilização IgE específica não comprovada. Naqueles pacientes com sensibilização comprovada, o emprego da imunoterapia com alérgenos (ITA) passou a ser estratégia terapêutica relevante, principalmente na última década, com o estabelecimento da relação causal entre a DA e ácaros da poeira domiciliar (Dermatophagoides pteronyssinus, Dermatophagoides farinae e Blomia tropicalis)38-48.
O mecanismo de ação da ITA foi comprovado no tratamento da rinite e asma alérgicas, e o mesmo se aplica à imunomodulação para tratamento da DA. Dados de Medicina Baseada em Evidências corroboram o emprego da imunoterapia subcutânea (ITSC) ou imunoterapia sublingual (ITSL) com aeroalérgenos em pacientes com DA.Visto que a dessensibilização alimentar não é empregada como estratégia de tratamento da DA, mesmo naqueles pacientes com sensibilização comprovada, a ITSC ou ITSL específicas para aeroalérgenos são as únicas formas de ITA empregadas como terapêutica adicional nesta doença.
Indicação da ITA como terapêutica adicional no tratamento da DA: precisão na seleção de pacientes leva à eficácia do tratamento
A partir da década de 1990, estudos clínicos, revisões sistemáticas e metanálises permitiram identificar as condições ideais para emprego da ITA no tratamento da DA, sendo que a seleção dos pacientes deve ser realizada por avaliação clínica e por meio dos testes alérgicos já descritos49. O desenvolvimento da DA é associado, preferencialmente, à síntese de citocinas por linfócitos Th2 (CD4+ GATA3+). Dentre estas citocinas, sabe-se que a IL-4 e a IL-13 caracterizam a fase inicial da inflamação cutânea via síntese de IgE e expressão de moléculas de adesão endoteliais, enquanto a IL-5, na cronificação, leva a maior população local de eosinófilos e a migração destes para o tecido32-35. Agudizações com exacerbação e episódios repetitivos de eczema em alguns pacientes vêm sendo associadas à exposição a alérgenos, principalmente aos ácaros D. pteronyssinus, D. farinae e B. tropicalis37,44,47. Embora as células Th2 tenham um papel crucial nas doenças alérgicas, os linfócitos Th1 (CD4+Tbet+) produtores de interferon gamma (IFN-γ) e as células Th17 também participam da patogênese da DA. Estas células Th1 são conhecidas por estarem envolvidas na indução da apoptose do epitélio na DA via produção de citocinas tais como IFN-γ e TGF-β, relacionando-se a episódios de exacerbação e gravidade da DA. A IL-17, sintetizada por células T, Th17, também tem sido reconhecida como uma importante citocina pró-inflamatória atuante nos processos alérgicos. Sucintamente, pode-se descrever o papel dos linfócitos Treg (CD4+ FoxP3+) produtores de IL-10 e TGF-β como crucial na regulação da resposta a alérgenos associados ao desenvolvimento da DA, atuando via inibição de células Th1, Th2 e também Th17 (Figura 150). Não obstante existirem vários trabalhos demonstrando a eficácia da ITSC e ITSL, particularmente em pacientes sensibilizados com ácaros da poeira domiciliar, o assunto ainda permanece controverso. A eficácia e segurança da ITA com estes ácaros da poeira domiciliar em pacientes com DA foi demonstrada em diversos estudos, e evidências demonstram que esta terapêutica modifica o curso clínico da DA em pacientes selecionados40-42,45. A ITA também se mostrou eficaz em pacientes com DA associada, principalmente, à sensibilização pelo mecanismo de hipersensibilidade de Tipo I com eczema atópico provocado por aeroalérgenos. Em uma revisão sistemática e metanálise envolvendo 385 indivíduos, foi constatado que a ITA tem efeito positivo sobre a evolução clínica da DA, bem como se mostrou eficaz no tratamento a longo prazo na forma grave da doença. Os autores destacaram, porém, a heterogeneidade metodológica e amostral entre os trabalhos analisados40. Estudo incluindo 251 pacientes com DA sensibilizados a ácaros da poeira doméstica que foram tratados com ITSC avaliou a utilidade clínica da ITSC no tratamento da DA. A gravidade clínica da DA foi medida por meio do sistema padronizado de avaliação da gravidade clínica para DA (SCORAD) no início do tratamento, e 12 meses após. Os autores consideraram diminuição do valor de SCORAD aos 12 meses, superior a 50% em relação ao valor basal como resposta clínica favorável à ITSC. A DA grave, por sua vez, foi definida como um valor SCORAD inicial acima de "50". A resposta clínica favorável à ITSC foi observada em 73,6% dos pacientes. A proporção de pacientes com quadro clínico favorável à resposta com ITSC foi significativamente maior em pacientes com DA grave (90,6%) do que nos pacientes com DA leve a moderada (63,7%) (p < 0,001). Os doentes com DA grave apresentando uma resposta clínica favorável tiveram uma duração significativamente mais curta da DA (12,3 ± 8,5 anos) do que os pacientes com DA grave sem resposta clínica significativa (20,6 ± 10,9 anos) (p < 0,05) no início do estudo. Os autores concluíram que a ITSC pode ser uma opção útil para pacientes com DA, principalmente nas formas graves da doença, quando os pacientes são sensibilizados aos ácaros da poeira domiciliar43. Doentes com DA grave (SCORAD > 50) mostram melhores resultados clínicos quando submetidos à ITA, principalmente aqueles com APT positivo e história correspondente de crises de eczema que receberam ITA com ácaros da poeira domiciliar40,42,45. A análise atual da literatura publicada sugere que o emprego da ITA, seja por via subcutânea ou sublingual, pode possibilitar o controle dos sintomas da DA e diminuição do emprego de medicações na maioria dos pacientes. A ITSL também tem sido investigada como opção terapêutica adicional na DA. Ensaio clínico duplo-cego placebo-controlado, publicado em 2007, comprovou a utilidade da ITSL no tratamento da DA. Após o período experimental de 18 meses, os autores observaram, no grupo que recebeu ITSL, melhora significativa na pontuação de gravidade clínica para DA (SCORAD) e no uso de medicação de resgate, quando comparado ao controle placebo. De modo interessante, quando os pacientes foram analisados segundo a gravidade da DA (leve/moderada e grave), houve diferença estatisticamente significativa apenas no grupo leve/moderada, em comparação com os placebos46. Posteriormente, em 2009, foram analisados diversos estudos que empregaram a ITSL no tratamento da DA em crianças. O autor observou que doses elevadas de ITSL reduziram os sintomas de DA e a quantidade de medicamentos em uso pelos pacientes, enquanto que doses baixas de ITSL reduziram novas sensibilizações. Ainda, na DA leve e moderada houve diminuição dos sintomas51. Mais recentemente, em 2014, em um estudo multicêntrico randomizado em crianças de 5 a 18 anos de idade com DA associada à sensibilização com ácaros da poeira domiciliar, os autores concluíram que a ITSL foi eficaz no tratamento da DA das crianças envolvidas no trabalho52. De acordo com o guideline "Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children" de 2018, as evidências sobre a ITA no eczema atópico são conflitantes, porém os dados mais recentes da literatura demonstram resultados que sugerem mais prós do que contras. Os autores destacam que os melhores resultados até agora são para a ITA com ácaros da poeira domiciliar, e que não há contraindicação para a realização de ITA em pacientes com doenças alérgicas respiratórias (rinoconjuntivite alérgica e asma brônquica alérgica leve) e DA concomitante. O consenso preconiza que a ITA atualmente não é uma opção de tratamento geral para o DA, mas que pode ser considerada para pacientes selecionados com DA grave e sensibilização comprovada que têm história de exacerbação clínica após a exposição ao alérgeno causador ou tenha um teste de adesivo atópico correspondente positivo53. Recentemente, em uma revisão de literatura abordando a questão da gravidade da DA refratária e sua associação com métodos imunomoduladores terapêuticos54, os autores destacam, dentre os diversos estudos avaliados, um trabalho randomizado multicêntrico desenvolvido para avaliar a eficácia da ITA. Os resultados demonstraram que nos pacientes adultos sensibilizados para ácaros que concluíram o estudo (n = 51) foi observada melhora da doença e redução na necessidade de corticosteroides tópicos48. Recentemente, um trabalho com pacientes brasileiros e investigando a relevância do APT no estudo de sensibilização à ácaros da poeira domiciliar, sugeriu que o APT é relevante para investigações clínicas em pacientes com sintomas alérgicos respiratórios, especialmente quando eles têm uma história clínica e resultados negativos de prick test e/ou IgE específicos para ácaros. O APT pode produzir resultados positivos em concordância com os resultados do prick test, mas também pode ser o único teste positivo (8%), como observaram no estudo55. O APT deve ser considerado como um teste adicional quando o prick test e IgE sérica específica são negativos em pacientes com histórias clínicas típicas de alergias, particularmente DA, auxiliando na avaliação da sensibilização alérgica e consequente indicação de ITA. Finalmente, acreditase que a decisão final do emprego da ITA como tratamento adicional na DA deve ser resultado de avaliação clínica e correta seleção dos pacientes com sensibilização comprovada por testes alérgicos adequados.
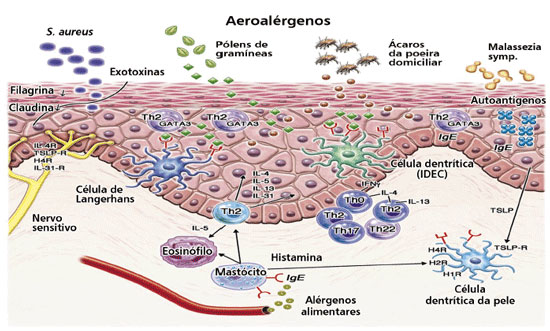
Figura 1 Mecanismos celulares e moleculares na pele lesionada de pacientes com DA. Um defeito de barreira cutânea causada por fatores genéticos e influências inflamatórias facilita a penetração de irritantes, produtos microbiológicos e alérgenos. O padrão Th2 de linfócitos é predominante na fase aguda e também está presente na fase crônica da DA. Outras subpopulações de linfócitos (Th1, Th17, e Th22) são também detectáveis na pele, assim como outros tipos celulares, tais como populações de células dendríticas inflamatórias e eosinófilos, são também encontrados em número aumentado na pele lesionada. Mediadores inflamatórios selecionados também são mostrados, alguns deles servindo como moléculas-alvo para novas tentativas de tratamento. Fonte: adaptado de Suárez-Fariñas M et al.16 e Werfel T et al.50.
Imunobiológicos em dermatite atópica
O uso dos imunobiológicos na DA vêm principalmente dos estudos em asma56. Estes esforços têm levado ao conhecimento maior do complexo network imune e dos mecanismos que contribuem para a inflamação alérgica, particularmente as do tipo Th2, com seus fenótipos e endotipos associados. Os imunobiológicos estão hoje disponíveis para modificar a resposta Th2, bloqueando IgE e as citocinas como IL-4, Il-13 e Il-22, IL-32, Il-17/IL-2350. Os imunobiológicos são uma classe de agentes farmacológicos montados por engenharia genética e dirigidos para os mediadores da inflamação alérgica. Recentemente, múltiplos ensaios clínicos estão demonstrando a eficácia desta terapia envolvendo bloqueio de citocinas ou de mediadores que têm papel fundamental na patogênese de DA. Dupilumabe é o primeiro imunobiológico aprovado para uso clínico pelo US Food and Drug Administration (FDA), pelo European Medicines Agency (EMA) e pela Anvisa para tratamento da DA em pacientes adultos com DA moderada a grave e que não estão bem controlados com as terapias usuais56. Estes imunobiológicos são um tratamento promissor para adultos com a DA, pois oferecem um tipo de tratamento que requer menos monitoramento laboratorial do que as terapias sistêmicas, além de apresentarem menores efeitos colaterais57.
INIBIDORES DA IL-4 E OU IL-13
Dupilumabe
Dupilumabe é um anticorpo monoclonal específico, totalmente humanizado, e que se liga à subunidade alfa dos receptores para IL-4 e IL-1358. Isto resulta na dowregulation do receptor que sinaliza a via JAK/STAT responsável pela regulação da expressão de vários genes envolvidos na patogênese da DA59. Dupilumabe é fornecido em uma seringa preenchida com uma dose única e que deve ser administrada por via subcutânea nas nádegas, abdômen ou braço superior. A dose recomendada é de 600 mg (duas injeções de 300 mg para duas regiões distintas) e continuadas por 300 mg a cada duas semanas, sempre variando o local da injeção. O Dupilumabe pode ser usado com ou sem a aplicação simultânea de corticosteroides tópicos (CT)60. Este imunobiológico tem também eficácia em pacientes que apresentam asma persistente com eosinofilia elevada, melhorando a função pulmonar, reduzindo exacerbações e diminuindo os biomarcadores de Th261. Vários ensaios randomizados, duplo-cego controlados e com controle placebo, em pacientes com DA moderada a grave foram realizados. O primeiro deles, denominados SOLO 1 e SOLO 2 investigou a eficácia e a segurança de dupilumabe comparados como placebo62. Os pacientes foram randomizados para receber toda semana uma injeção de 300 mg de dupilumabe ou placebo ou a mesma dose de dupilumabe a cada duas semanas ou placebo e por 16 semanas. Uma quantidade significante de pacientes recebendo dupilumabe melhorou pelo menos 75% da área de eczema de acordo com o escore do índex de área de eczema e gravidade (EASI), quando comparados com o grupo placebo. A percentagem de pacientes que alcançaram o EASI-50 e EASI-90, bem como a melhora do Escore de Dermatite Atópica (SCORAD) e a diminuição da área de superfície do corpo afetada pela DA foram significantemente mais altas no grupo dupilumabe do que no grupo placebo. Outros ensaios denominados de LIBERTY AD CHRONOS, tiveram o intuito de analisar um tratamento mais prolongado com pacientes portadores de DA moderada a grave com o uso concomitante de CT63. Na semana 52, a maioria dos pacientes com uso de dupilumabe mais o CT alcançaram o EASI-75, quando comparados aos grupos controle. No estudo LIBERTY AD CAFÉ, 390 pacientes com resposta inadequada ou intolerância ao uso de ciclosporina, a eficácia do dupilumabe foi também constatada64. A proporção de pacientes alcançando EASI-75 na semana 16 no grupo com dupilumabe foi muito maior do que nos grupos controles. Também, em todos estes estudos, o dupilumabe foi bastante seguro, sem aparecimento de toxicidade e poucos efeitos colaterais surgiram. Os mais comuns efeitos adversos foram efeitos locais e transitórios no local da injeção, tais com eritema e edema. Também conjuntivite foi um efeito adverso específico, mas tratado e bem resolvido com o uso de CT ou tracolimos 0,03% em forma de pomada oftálmica65. A razão desta conjuntivite não está compreendida e está sendo investigada. Existe a hipótese de que o bloqueio de IL-4 e IL-13 poderia aumentar atividade de citocinas relacionadas a ceratoconjuntivite66. Geralmente ela está presente em 90% dos pacientes do tipo leve a moderada e resolve rápida e facilmente. Existe apenas um caso na literatura de conjuntivite bilateral em paciente com DA e com cicatrização ectrópica associada ao dupilumabe67. Terapia com imunobiológico tem potencial de imunogenicidade, e anticorpos contra a droga aparecem em aproximadamente 7% dos pacientes em uso de dupilumabe na dose de 300 mg a cada 2 semanas e por 16 semanas, como é o caso do estudo SOLO 1 e 268. Aproximadamente 30% dos pacientes que apresentam estes anticorpos contra a droga desenvolvem anticorpos neutralizantes. No estudo CHRONOS igualmente 7% dos pacientes em uso de dupilumabe a cada 2 semanas e por 52 semanas desenvolvem anticorpos contra o dupilumabe, e 14% destes pacientes formam anticorpos neutralizantes. Existem vários estudos em andamento para uso de dupilumabe em crianças e adolescentes para se verificar igualmente efeitos positivos nesta população69. Em adição, dupilumabe está também sendo estudado em outras doenças, incluindo sinusite crônica com polipose nasal, esofagite eosinofílica, pênfigo vulgar e alergia alimentar70,71.
Tralokinumabe
Tralokinumabe é um anticorpo monoclonal específico, humanizado e dirigido para IL-13 e que tem sido estudado em DA72. A IL-13 é uma citocina Th2 que está implicada na patogênese da DA, por down-regulation da filagrina da barreira cutânea73,74. A IL13 está aumentada na pele lesionada e na pele não lesionada dos indivíduos com DA e se correlaciona com a gravidade da doença75. Um estudo duplo-cego e placebo controlado, em fase clínica II e envolvendo 204 pacientes adultos com DA moderada a grave está em andamento72. Na semana 12, a dose de 300 mg de tralokinumabe a cada 2 semanas produziu uma melhora significante em DA se comparada ao placebo, sendo que em particular uma grande percentagem alcançou EASI-50 (73,4% vs. 51,9%, p= 0,03) e também EASI-75 (42,5% vs. 15,5%, p = 0,003) em comparação com o placebo, embora o uso de CT possa ser uma variável que leva a uma eficácia maior do placebo. É bastante interessante que a presença de maior concentração dos biomarcadores do aumento de IL-13 mostram melhor resposta ao imunobiológico. Os efeitos colaterais mais frequentes foram maior ocorrência de infecções do trato respiratório superior e cefaleia, mas o estudo mostrou boa tolerância e segurança72.
Lebrikizumabe
Lebrikizumabe é um anticorpo monoclonal específico humanizado e dirigido para IL-1376 e com estudos em fase II para DA77. Um estudo em fase II, duplo-cego e placebo controlado, multicêntrico, está sendo realizado em pacientes adultos com DA moderada a grave77. No total, 209 pacientes foram randomizados para lebrikizumabe 125 mg em dose única, e lebrikizumabe 250 mg em dose única a cada 4 semanas e por 12 semanas ou placebo. Na semana 12 os pacientes recebendo lebrikizumabe em dose de 125 mg apresentavam EASI-50 mais do que os placebos (82,4% vs. 62,3%). Outra vez a alta performance do grupo placebo poderia ser o uso de CT. O imunobiológico foi bem tolerado e os efeitos adversos foram semelhantes entre grupo tratado e grupo placebo.
INIBIDORES DA IL-22
A IL-22 mostrou-se aumentada nas lesões agudas e crônicas da DA e correlacionando-se com a gravidade da DA76. Il-22 é produzida pelas células Th22 e é capaz de agir nos keratinócitos e prejudicar a função da barreira cutânea78.
Fezakinumabe
Fezakinumabe é um anticorpo monoclonal específico humanizado totalmente e dirigido para IL-22. Um estudo recente, randomizado, duplo-cego e placebo controlado com fezakilumabe em monoterapia de injeções intravenosas a cada 2 semanas e por 10 semanas e seguimento por mais 10 semanas foi completado79. No estudo, 60 pacientes foram randomizados 2:1, com 40 usando fezakinumabe e 20 com placebo. Os resultados mostraram que o índice SCORAD foi significativamente maior no grupo com fezakinumabe do que no grupo placebo nas semanas 12 (36,4% vs. 22,3%, p < 0,05) e na semana 20 (46,2% vs. 22,6%, p < 0,01). Efeitos colaterais ocorreram de maneira similar nos grupos tratado e placebo e, ainda, a droga foi bem tolerada79.
INIBIDORES DO RECEPTOR DE IL-31
A expressão de IL-31 e do IL-31R está aumentada em pacientes com DA80. Contudo, os pacientes com DA também apresentam níveis elevados de IL-31 no sangue, bem como também linfócitos produtores de IL-3181. Em adição, os níveis de IL-31 no sangue bem como na pele se correlacionam com gravidade de DA80,81, indicando um importante papel da IL-31 na patogênese da DA e na patofisiologia do prurido82.
Nemolizumabe
Nemolizumabe é um anticorpo monoclonal específico dirigido para o receptor A da IL-3183. Um estudo randomizado, duplo-cego e placebo controlado, com 12 semanas de duração e envolvendo 264 pacientes adultos com DA moderada a grave foi recentemente terminado84. Pacientes receberam nemolizumabe por injeções subcutâneas nas doses de 0,1; 0,5 ou 2,0 mg/kg de peso corporal ou placebo a cada 4 semanas. Redução significativa do prurido foi verificado desde a linha basal até na semana 12 em todos os braços das doses diferentes de nemolizumabe, com significado estatístico significante em todos os grupos. A mudança dos escores EASI foram maiores nas doses 0,5 e 2,0 mg de nemolizumabe em relação ao placebo. Os efeitos colaterais mais comuns foram exacerbação da DA, infecções do trato respiratório superior, e edema periférico mais comuns nos pacientes com o imunobiológico do que em relação ao grupo placebo. No mesmo estudo duplo-cego controlado em fase II, verificou-se a eficácia e segurança do nemolizumabe injetado subcutaneamente a cada 4 semanas ou 8 semanas, e com duração de 52 semanas84. O grupo de pacientes acompanhados foi de 191 indivíduos com nemolizumabe nas doses de 0,1; 0,5 ou 2,0 mg/kg. Uma melhora do prurido foi observada, desde a linha basal e nas semanas 12 e 64, com melhores escores no grupo com as doses de 0,5 mg/kg. A melhora do EASI também foi mantida ou aumentada na semana 64, com os melhores resultados no grupo das doses de 2,0 mg/kg, mostrando que o nemolizumabe em uso até 64 semanas foi eficaz e bem tolerado em pacientes com DA moderada a grave inadequadamente controlados com a terapia tópica. Os mais comuns efeitos colaterais observados neste grupo de longa duração foram nasofaringite (27%), exacerbação da DA (25%), aumento da creatinina (11%), infecção do trato respiratório superior (9%), cefaleia (8%), edema periférico (6%) e impetigo (6%).
Alguns agentes imunobiológicos que tiveram resultado em asma foram também investigados, como o Omalizumabe (anti-IgE) e o Ustekinumabe (um anticorpo monoclonal humanizado e específico, usado em psoriasis e artrite psoriática, contra IL-12/IL-23), mas não mostraram resultados efetivos. Alguns outros agentes imunobiológicos estão em uso para investigar sua participação na DA moderada a grave não controlada com a terapia convencional, sua segurança e efetividade, e que serão avaliados para se entender seu papel no tratamento da DA (Figura 285).
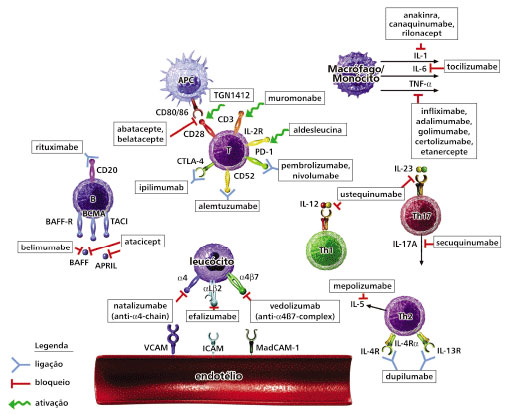
Figura 2 Sumário das interações de alvos imunobiológicos. Os alvos incluem moléculas específicas na superfície celular das células apresentadoras de antígenos, células B, células T, endotélio, células inflamatórias migratórias, e citocinas.
α4 = integrinas a4; α4β7 = integrinas α4β7; αlβ2 = integrinas αlβ2; APC = células apresentadoras de antígenos; BAFF = fator ativador de célula B; BCMA = antígeno maturador de célula B; ICAM-1 = molécula de adesão intercelular; IL-2R = receptor IL-2; MAdCAM-1 = molécula de adesão celular de mucosa vascular 1; TACI = ativador transmembrânico e interador CAML; VCAM-1= molécula de adesão vascular celular 1.
Fonte: adaptado de Davis BP & Ballas ZK85.
CONCLUSÕES
As terapias atuais da DA podem controlar os sintomas e a inflamação crônica existente na pele destes pacientes; contudo, estas terapias não afetam a resposta imunológica desregulada existente nesta patologia. Assim, elas se limitam a evitar a progressão da doença, e ela volta a ficar ativa se o tratamento é interrompido. Embora primariamente a DA afete a pele, ela está sendo reconhecida cada vez mais como uma doença sistêmica com comorbidades atópicas e não atópicas, a imunoterapia alérgeno específica (IT) é o único tratamento etiológico capaz de modificar a história natural da doença. As evidências mais recentes são capazes de explicar os múltiplos mecanismos indutores de uma dessensibilização rápida e uma indução de tolerância imunológica específica duradoura, assim como também explicar a supressão do processo inflamatório no tecido afetado. Dados de Medicina Baseada em Evidências corroboram o emprego da imunoterapia subcutânea (ITSC) ou imunoterapia sublingual (ITSL) com aeroalérgenos em pacientes com DA. A ITSC e a ITSL são capazes de reduzir sintomas, uso de medicação, melhorar a qualidade de vida e induzir mudanças favoráveis dos marcadores imunológicos.
Um número crescente de imunobiológicos vem sendo estudado em DA, e dupilumab (anti-IL-4/IL-13) é atualmente o primeiro agente biológico aprovado para tratamento da DA no nosso país e em alguns outros países. Outros imunobiológicos estão em curso de tratamento em fase II e III e principalmente aqueles dirigidos pra IL-13, receptor de IL-31, IL-22 e para subunidades de IL-12/IL-23. A comprovação de eficácia e segurança a longo prazo, comparações entre estes agentes e a experiência de mundo real para estes tratamentos, virão a responder a várias indagações e principalmente qual o regime ótimo para estes novos agentes. O avanço dos conhecimentos sobre o mecanismo da doença levarão à identificação de endotipos que poderão identificar os melhores candidatos para estas terapias específicas, contribuindo para uma medicina personalizada ou medicina de precisão na dermatite atópica.
REFERÊNCIAS
1. Eichenfield LF, Tom WL, Chamlin SL, Feldman SR, Hanifin JM, Simpson EL, et al. Guidelines of care for the management of atopic dermatitis, section 1:diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014;70:338-51.
2. Kay J, Gawkrodger DJ, Mortimer MJ, Jaron AG. The prevalence of childhood atopic eczema in a general population. J Am Acad Dermatol. 1994;30:35-9.
3. Perkin MR, Strachan DP, Williams HC, Kennedy CT, Golding J, ALSPAC Study Team. Natural history of atopic dermatitis and its relationship to serum total immunoglobulin E in a population-based birth cohort study. Pediatr Allergy Immunol. 2004;15:221-9.
4. Silverberg JI, Simpson EL. Association between severe eczema in children and multiple comorbid conditions and increased healthcare utilization. Pediatr Allergy. 2013;24:476-86.
5. Ellis CN, Mancini AJ, Paller AS, Simpson EL, Eichenfield LF. Understanding and managing atopic dermatitis in adult patients. Semin Cutan Med Surg. 2012;31:S18-22
6. Kim JP, Chao LX, Simpson EL, Silverberg JI. Persistence of atopic dermatitis (AD): a systematic review and meta-analysis. J Am Acad Dermatol. 2016;75:681-687.e11.
7. Mortz CG, Andersen KE, Dellgren C, Barrington T, Bindslev- Jensen C. Atopic dermatitis from adolescence to adulthood in the TOACS cohort: prevalence, persistence and comorbidities. Allergy. 2015;70:836-45.
8. Silverberg JI, Garg NK, Paller AS, Fishbein AB, Zee PC. Sleep disturbances in adults with eczema are associated with impaired overall health: a US population-based study. J Invest Dermatol. 2015;135:56-66.
9. Silverberg JI, Hanifin JM. Adult eczema prevalence and associations with asthma and other health and demographic factors: a US population-based study. J Allergy Clin Immunol. 2013;132:1132-8.
10. Sidbury R, Davis DM, Cohen DE, Cordoro KM, Berger TG, Bergman JN, et al. Guidelines of care for the management of atopic dermatitis, section 3: management and treatment with phototherapy and systemic agents. J Am Acad Dermatol. 2014;71:327-49.
11. Ortiz de Frutos FJ, Torrelo A, de Lucas R, González MA, Alomar A, Vera A, et al. Patient perspectives on triggers, adherence to medical recommendations, and disease control in atopic dermatitis: the DATOP study. Actas Dermosifiliogr. 2014;105:487-96.
12. Brunner PM, Silverberg JI, Guttman-Yassky E, Paller AS, Kabashima K, Amagai M, et al. Increasing comorbidities suggest that atopic dermatitis is a systemic disorder. J Invest Dermatol. 2017;137:18-25.
13. Ungar B, Garcet S, Gonzalez J, Dhingra N, Correa da Rosa J, Shemer A, et al. An integrated model of atopic dermatitis biomarkers highlights the systemic nature of the disease. J Invest Dermatol. 2017;137:603-13.
14. Ewald DA, Malajian D, Krueger JG, Workman CT, Wang T, Tian S, et al. Meta-analysis derived atopic dermatitis (MADAD) transcriptome defines a robust AD signature highlighting the involvement of atherosclerosis and lipid metabolism pathways. BMC Med Genomics. 2015;8:60.
15. Czarnowicki T, Malajian D, Shemer A, Fuentes-Duculan J, Gonzalez J, Suárez-Fariñas M, et al. Skin-homing and systemic T-cell subsets show higher activation in atopic dermatitis versus psoriasis. J Allergy Clin Immunol. 2015;136:208-11.
16. Suárez-Fariñas M, Tintle SJ, Shemer A, Chiricozzi A, Nograles K, Cardinale I, et al. Nonlesional atopic dermatitis skin is characterized by broad terminal differentiation defects and variable immune abnormalities. J Allergy Clin Immunol. 2011;127:954-964.e1-4.
17. Ellis CN, Drake LA, Prendergast MM, Abramovits W, Boguniewicz M, Daniel CR, et al. Cost of atopic dermatitis and eczema in the United States. J Am Acad Dermatol. 2002;46:361-70.
18. Chen MH, Su TP, Chen YS, Hsu JW, Huang KL, Chang WH, et al. Is atopy in early childhood a risk factor for ADHD and ASD? A longitudinal study. J Psychosom Res. 2014;77:316-21.
19. Garg N, Silverberg JI. Association between childhood allergic disease, psychological comorbidity, and injury requiring medical attention. Ann Allergy Asthma Immunol. 2014;112:525-32.
20. Lee CY, Chen MH, Jeng MJ, Hsu JW, Tsai SJ, Bai YM, et al. Longitudinal association between early atopic dermatitis and subsequent attention-deficit or autistic disorder: a population-based case-control study. Medicine (Baltimore). 2016;95:e5005.
21. Sanna L, Stuart AL, Pasco JA, Jacka FN, Berk M, Maes M, et al. Atopic disorders and depression: findings from a large, populationbased study. J Affect Disord. 2014;155:261-5.
22. Arana A, Wentworth CE, Fernández-Vidaurre C, Schlienger RG, Conde E, Arellano FM. Incidence of cancer in the general population and in patients with or without atopic dermatitis in the U.K. Br J Dermatol. 2010;163:1036-43.
23. Linabery AM, Jurek AM, Duval S, Ross JA. The association between atopy and childhood/adolescent leukemia: a meta-analysis. Am J Epidemiol. 2010;171:749-64.
24. Hwang CY, Chen YJ, Lin MW, Chen TJ, Chu SY, Chen CC, et al. Cancer risk in patients with allergic rhinitis, asthma and atopic dermatitis: a nationwide cohort study in Taiwan. Int J Cancer. 2012;130:1160-7.
25. Olesen AB, Engholm G, Storm HH, Thestrup-Pedersen K. The risk of cancer among patients previously hospitalized for atopic dermatitis. J Invest Dermatol. 2005;125:445-9.
26. Silverberg JI. Association between adult atopic dermatitis, cardiovascular disease, and increased heart attacks in three population-based studies. Allergy. 2015;70:1300-8.
27. Silverberg JI, Greenland P. Eczema and cardiovascular risk factors in 2 US adult population studies. J Allergy Clin Immunol. 2015;135:721-728.e6.
28. Nomura T, Kabashima K. Advances in atopic dermatitis in 2015. J Allergy Clin Immunol. 2016;138:1548-55.
29. Eichenfield LF, Tom WL, Chamlin SL, Feldman SR, Hanifin JM, Simpson EL, et al. Guidelines of care for the management of atopic dermatitis, section 1:diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014;70:338-51.
30. Kay J, Gawkrodger DJ, Mortimer MJ, Jaron AG. The prevalence of childhood atopic eczema in a general population. J Am Acad Dermatol. 1994;30:35-9.
31. Perkin MR, Strachan DP, Williams HC, Kennedy CT, Golding J. ALSPAC Study Team. Natural history of atopic dermatitis and its relationship to serum total immunoglobulin E in a population-based birth cohort study. Pediatr Allergy Immunol. 2004;15:221-9.
32. Bath-Hextall F, Delamere FM, Williams HC. Dietary exclusions for improving established atopic eczema in adults and children: systematic review. Allergy. 2009;64(2):258-64.
33. Sinagra J, Bordignon V, Ferraro C, Cristaudo A, Di Rocco M, Amorosi B, et al. Unnecessary milk elimination diets in children with atopicdermatitis. Pediatric Dermatology. 2007;24(1):1-6.
34. Eigenmann PA, Sicherer SH, Borkowski TA, Cohen BA, Sampson HA. Prevalence of IgE-mediated food allergy among children with atopic dermatitis. Pediatrics. 1998;101(3):E8.
35. Garritsen FM, ter Haar NM, Spuls PI. House dust mite reduction in the management of atopic dermatitis. A critically appraised topic. Br J Dermatol. 2013;168(4):688-91.
36. Oranje AP, Bruynzeel DP, Stenveld HJ, Dieges PH. Immediate- and delayed-type contact hypersensitivity in children older than 5 years with atopic dermatitis: a pilot study comparing different tests. Pediatr Dermatol. 1994;11(3):209-15.
37. Wollenberg A, Vogel S. Patch testing for noncontact dermatitis: the atopy patch test for food and inhalants. Curr Allergy Asthma Rep. 2013;13(5):539-44. 38.
Darsow U, Laifaoui J, Kerschenlohr K, Wollenberg A, Przybilla B, Wuthrich B, et al. The prevalence of positive reactions in the atopy patch test with aeroallergens and food allergens in subjects with atopic eczema: a European multicenter study. Allergy. 2004;59(12):1318-25.
39. Kerschenlohr K, Decard S, Darsow U, Ollert M, Wollenberg A. Clinical and immunologic reactivity to aeroallergens in "intrinsic" atopic dermatitis patients. J Allergy ClinImmunol. 2003;111(1):195-7.
40. Bae JM, Choi YY, Park CO, Chung KY, Lee KH. Efficacy of allergenspecific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2013;132(1):110-7.
41. Bussmann C, Bockenhoff A, Henke H, Werfel T, Novak N. Does allergen-specific immunotherapy represent a therapeutic option for patients with atopic dermatitis? J Allergy Clin Immunol. 2006;118(6):1292-8.
42. Gendelman SR, Lang DM. Specific immunotherapy in the treatment of atopic dermatitis: a systematic review using the GRADE system. Ann Allergy Asthma Immunol. 2013;111(6):555-61.
43. Nahm DH, Kim ME, Kwon B, Cho SM, Ahn A. Clinical efficacy of subcutaneous allergen immunotherapy in patients with atopic dermatitis. Yonsei Med J. 2016;57(6):1420-6.
44. Novak N. Allergen specific immunotherapy for atopic dermatitis. Curr Opin Allergy Clin Immunol. 2007;7(6):542-46.
45. Novak N, Bieber T, Hoffmann M, Folster- Holst R, Homey B, Werfel T, et al. Efficacy and safety of subcutaneous allergen-specific immunotherapy with depigmented polymerized mite extract in atopic dermatitis. J Allergy Clin Immunol. 2012;130(4):925-31 e4.
46. Pajno GB, Caminiti L, Vita D, Barberio G, Salzano G, Lombardo F, et al. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, double-blind, placebo-controlled study. J Allergy Clin Immunol. 2007;120(1):164-70.
47. Ring J, Alomar A, Bieber T, Deleuran M, Fink-Wagner A, Gelmetti C, et al. Guidelines for treatment of atopic eczema (atopicdermatitis) part I. J Eur Acad Dermatol Venereol. 2012;26(8):1045-60.
48. Werfel T, Breuer K, Rueff F, Przybilla B, Worm M, Grewe M, et al. Usefulness of specific immunotherapy in patients with atopic dermatitis and allergic sensitization to house dust mites: a multi-centre, randomized, dose-response study. Allergy. 2006;61(2):202-5.
49. Noon L. Prophylactic inoculation against hay fever. Lancet. 1911;177(4580):1572-3.
50. Werfel T, Allam JP, Biedermann T, Eyerich k, Gilles S, Guttman-Yassky E, et al. Cellular and molecular immunologic mechanisms in patients with atopic dermatitis. J Allergy Clin Immunol. 2016;138:336-49.
51. Larenas-Linnemann D. Certainties and doubts about sublingual and oral immunotherapy in children. Curr Opin Allergy Clin Immunol. 2009;9(6):558-67.
52. Di Rienzo V, Cadario G, Grieco T, Galluccio AG, Caffarelli C, Liotta G, et al. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, open, parallel-group study. Ann Allergy Asthma Immunol. 2014;113(6):671-3.
53. Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018;32(5):850-78.
54. Deleanu D, Nedelea I. Novel targeted therapies for atopic dermatits. Experimental and Therapeutic Medicine. 2019;17:1061-7.
55. Souza Lima IPMC, Aarestrup BJ, Souza Lima EM, Souza Lima MC, Souza Lima ECSL, Aarestrup FM. Brazilian experience with atopy patch tests for Dermatophagoides pteronyssinus, Dermatophagoides farinae and Blomia tropicalis. World Allergy Organization Journal. (2018);11:27.
56. Schmitt J. After the approval of dupilumab for moderate-to-severe atopic dermatitis: what is next on the research agenda? Br J Dermatol. 2018;178:992-3.
57. Megna Matteo, Napolitano Maddalena, Patruno Cataldo, Villani Alessia, Balato Anna, Monfrecola Giuseppe, et al. Systemic Treatment of adult atopic dermatitis: a review. Dermatology and Therapy. 2016;7(1):1-23.
58. Seegräber M, Srour J, Walter A, Knop M, Wollenberg A. Dupilumab for treatment of atopic dermatitis. Expert Rev Clin Pharmacol. 2018;11:467-74.
59. Bao L, Zhang H, Chan LS. The involvement of the JAK-STAT signaling pathway in chronic inflammatory skin disease atopic dermatitis. Jakstat. 2013;2:e24137.
60. US FDA. Dupixent (dupilumab) injection, for subcutaneous use: US prescribing information. 2017. Disponível em: https://www.fda.gov.
61. Wenzel S, Ford L, Pearlman D, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368:2455-66.
62. Simpson EL, Bieber T, Guttman-Yassky E, Beck LA, Blauvelt A, Cork MJ, et al. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335-48.
63. Blauvelt A, de Bruin-Weller M, Gooderham M, Cather JC, Weisman J, Pariser D, et al. Long-term management of moderate-to-severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AD CHRONOS): a 1-year, randomised, double-blinded, placebo-controlled, phase 3 trial. Lancet. 2017;389:2287-303.
64. de Bruin-Weller M, Thaçi D, Smith CH, Reich K, Cork MJ, Radin A, et al. Dupilumab with concomitant topical corticosteroid treatment in adults with atopic dermatitis with an inadequate response or intolerance to ciclosporin A or when this treatment is medically inadvisable: a placebo-controlled, randomized phase III clinical trial (LIBERTY AD CAFÉ) Br J Dermatol. 2018;178:1083-101.
65. Wollenberg A, Ariens L, Thurau S, van Luijk C, Seegräber M, de Bruin-Weller M. Conjunctivitis occurring in atopic dermatitis patients treated with dupilumab - clinical characteristics and treatment. J Allergy Clin Immunol Pract. 2018;18:30089-8.
66. Mennini M, Dahdah L, Fiocchi A. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis. N Engl J Med. 2017;376:1090.
67. Barnes AC, Blandford AD, Perry JD. Cicatricial ectropion in a patient treated with dupilumab. Am J Ophthalmol Case Rep. 2017;7:120-2.
68. Shirley Matt. Dupilumab: first global approval. Drugs. 2017;77(10):1115-21.
69. Blakely K, Gooderham M, Papp K, Dupilumab A. Monoclonal antibody for atopic dermatitis: a review of current literature. Skin Therapy Lett. 2016;21:1-5.
70. Pauwels B, Jonstam K, Bachert C. Emerging biologics for the treatment of chronic rhinosinusitis. Expert Rev Clin Immunol. 2015;11(3):349-61.
71. Tavakolpour S, Tavakolpour V. Interleukin 4 inhibition as a potential therapeutic in pemphigus. Cytokine. 2016;77:189-95.
72. Wollenberg A, Howell MD, Guttman-Yassky E, Silverberg JI, Kell C, Ranade K, et al. Treatment of atopic dermatitis with tralokinumab, an anti-IL-13 monoclonal antibody. J Allergy Clin Immunol. 2018;18:30850-9.
73. Hamann CR, Thyssen JP. Monoclonal antibodies against interleukin 13 and interleukin 31RA in development for atopic dermatitis. J Am Acad Dermatol. 2018;78:S37-S42.
74. Kim BE, Leung DY, Boguniewicz M, Howell MD. Loricrin and involucrin expression is down-regulated by Th2 cytokines through STAT-6. Clin Immunol. 2008;126:332-7.
75. Ungar B, Garcet S, Gonzalez J, Dhingra N, da Rosa JC, Shemer A, et al. An integrated model of atopic dermatitis biomarkers highlights the systemic nature of the disease. J Invest Dermatol. 2017;137:603-13.
76. Tazawa T, Sugiura H, Sugiura Y, Uehara M. Relative importance of IL-4 and IL-13 in lesional skin of atopic dermatitis. Arch Dermatol Res. 2004;295:459-64.
77. Simpson EL, Flohr C, Eichenfield LF. Efficacy and safety of lebrikizumab (an anti-IL-13 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by topical corticosteroids: a randomized, placebo-controlled phase II trial (TREBLE) J Am Acad Dermatol. 2018;78(863-71).
78. Gittler JK, Shemer A, Suarez-Farinas M, Judilyn Fuentes D, Gulewics KJ, Wang CQF. Progressive activation of T(H)2/T(H)22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis. J Allergy Clin Immunol. 2012;130:1344-54.
79. Guttman-Yassky E, Brunner PM, Neumann AU, Khattri,S, Pavel AB, Malik k. Efficacy and safety of fezakinumab (an IL-22 monoclonal antibody) in adults with moderate-to-severe atopic dermatitis inadequately controlled by conventional treatments: a randomized, double-blind, phase 2a trial. J Am Acad Dermatol. 2018;78:872-81.
80. Hamann CR, Thyssen JP. Monoclonal antibodies against interleukin 13 and interleukin 31RA in development for atopic dermatitis. J Am Acad Dermatol. 2018;78:S37-S42.
81. Szegedi K, Kremer AE, Kezic S, Teunissen MB, Bos JD, Luiten RM et al. Increased frequencies of IL-31-producing T cells are found in chronic atopic dermatitis skin. Exp Dermatol. 2012;21:431-6.
82. Sonkoly E, Muller A, Lauerma AI, Pivarcsi A, Soto H, Kemeny L, et al. IL-31: a new link between T cells and pruritus in atopic skin inflammation. J Allergy Clin Immunol. 2006;117:411-7.
83. Ruzicka T, Hanifin JM, Furue M, Pulka G, Mlynarczyk I, Wollenberg A, et al. Anti-Interleukin-31 receptor A antibody for atopic dermatitis. N Engl J Med. 2017;76:826-35.
84. Kabashima K, Furue M, Hanifin JM, Pulka G, Wollenberg A, Galus R, et al. Nemolizumab in patients with moderate-to-severe atopic dermatitis: randomized, phase II, long-term extension study. J Allergy Clin Immunol. 2018;10(18):30698-5.
85. Davis BP, Ballas ZK. Biologic response modifiers: Indications, implications, and insights. J Allergy Clin Immunol. 2017;139:1445-56.



