Número Atual: Janeiro-Março 2019 - Volume 3 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Dermatite de contato por corticoide em pacientes com dermatite atópica
Corticosteroid contact dermatitis in patients with atopic dermatitis
Vanessa Bosi Bissi Denadai; Lara Tawil; Marina França de Paula Santos; Ana Flávia Faria de-Camargos; Ana Luísa Barbosa Belarmino; Paula Savioli Silveira; Veridiana Aun Rufino Pereira; Fátima Rodrigues Fernandes
DOI: 10.5935/2526-5393.20190012
Hospital do Servidor Público Estadual de São Paulo, Serviço de Alergia e Imunologia - São Paulo, SP, Brasil
Endereço para correspondência:
Vanessa Bosi Bissi Denadai
E-mail: vanessatete@yahoo.com.br
Submissão em: 04/02/2019
Aceite em: 20/03/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVO: Avaliar a sensibilização a corticoides tópicos e substâncias do teste de contato padrão e cosméticos em pacientes com dermatite atópica (DA) no Serviço de Alergia e Imunologia do HSPE-SP.
MÉTODO: Estudo retrospectivo com análise de prontuário de pacientes com DA, classificados de acordo com o SCORing Atopic Dermatitis (SCORAD) em leve, moderada e grave, que foram atendidos no ambulatório de Alergia e Imunologia do HSPE-SP, submetidos a teste de contato com baterias padrão, cosméticos, corticoides, incluindo furoato de mometasona.
RESULTADOS: Após análise estatística dos dados de 51 pacientes portadores de DA, foi identificada maior prevalência no gênero feminino (73%). Pacientes com DA moderada/grave apresentaram maior positividade (62%) para pelo menos uma substância. Foram mais propensos a positivar para teste de contato, pacientes maiores de 18 anos. As substâncias que foram mais positivas na bateria padrão foram: sulfato de níquel (33%), neomicina (10%), e bicromato de potássio e cloreto de cobalto (8% cada). O sulfato de níquel foi mais positivo no gênero feminino. Três (5,9%) pacientes apresentaram positividade para teste de contato com bateria de corticoides, sendo positivas substâncias betametasona 1%, budesonida 0,01% e butirato de hidrocortisona 1%, e todos eram portadores de DA leve. Foi identificada relação entre positividade para bateria de corticoides e sulfato de níquel.
CONCLUSÃO: Os testes de contato foram mais positivos em adultos. Houve maior sensibilidade para o sulfato de níquel no gênero feminino. Sensibilidade importante à neomicina na DA moderada/grave. Pacientes com alergia de contato por corticoides podem apresentar alergia a sulfato de níquel. Esse trabalho chama atenção para a porcentagem importante de pacientes com DA acometidos por alergia de contato por corticoides, sendo esse tipo alergia um problema emergente e que tem sido cada vez mais relatado na última década; porém, ainda são escassos os estudos envolvendo esse assunto.
Descritores: Dermatite atópica, dermatite de contato, corticosteroides.
A dermatite atópica (DA) é uma dermatose inflamatória crônica de etiologia multifatorial, caracterizada por erupção eczematosa pruriginosa, recorrente, desencadeada por alérgenos ambientais, como ácaros, acometendo principalmente crianças com antecedentes pessoais e familiares de atopia1.
A fisiopatologia das lesões de DA baseia-se em defeitos na barreira cutânea com redução de ceramidas, ácidos graxos de cadeia longa, filagrinas e lipídeos intracelulares da camada córnea, que facilitam a perda transepitelial de água e penetração de alérgenos e irritantes. A resposta imunológica na fase aguda é predominantemente Th2 e Th22 com síntese de IL-4, IL-5, IL-13 e IL-16 que, entre outras ações, recrutam eosinófilos e estimulam a produção de linfócitos B e imunoglobulina E (IgE). Na fase crônica, a resposta é desviada para linfócitos Th1 e Th17 e promovem infiltração de macrófagos e, consequentemente, sequelas na pele1.
A dermatite de contato (DC) é um dos diagnósticos diferenciais da dermatite atópica, com lesões de pele também eczematosas e pruriginosas, podendo acometer qualquer local da pele a depender do alérgeno envolvido. É uma reação do tipo IVa de Gell e Coombs de resposta Th1 com liberação de IFN-γ, IL-2, TNF-α e ativação de macrófagos2. O diagnóstico geralmente é feito através da história clínica e teste de contato ou patch test com leitura tardia. O teste de contato pode ser feito com substâncias isoladas ou com baterias padronizadas, entre elas, padrão (30 substâncias), cosméticos (10 substâncias) e corticoides (7 substâncias)3.
A associação entre DA e DC deve ser considerada, tendo em vista que muitos pacientes portadores de DA podem apresentar sensibilização a substâncias do teste de contato padrão e cosméticos e até mesmo corticosteroides, sendo indicado o teste de contato em qualquer paciente com uma dermatite aguda ou crônica, pruriginosa, eczematosa ou liquenificada, na suspeita de dermatite alérgica de contato subjacente ou secundária, especialmente aqueles cuja dermatite atópica não responde bem ao tratamento, o que leva a pensar na possibilidade de um eczema alérgico de contato associado3.
Os corticoides são amplamente indicados no tratamento de doenças alérgicas, no entanto, alguns indivíduos podem desenvolver DC com o uso de corticoides tópicos, seja pelo princípio ativo ou também pelos excipientes presentes no produto, como os parabenos, antibióticos, fragrâncias, etc. Por isso, o diagnóstico correto de alergia de contato por corticosteroides exige conhecimento, correta indicação e interpretação do teste de contato4.
Os fatores de risco mais importantes para o desenvolvimento da DC por corticoides parecem ser dermatoses inflamatórias crônicas, longa duração da doença, uso prolongado de corticosteroides, pacientes que apresentam dois ou mais resultados positivos do teste de contato aos sais metálicos e para outros haptenos não-esteroides4.
Com o intuito de chamar a atenção para a porcentagem importante de pacientes com DA acometidos por alergia de contato por corticoides, este estudo teve como objetivo identificar a sensibilização a corticoides tópicos e substâncias do teste de contato padrão e cosméticos em pacientes com DA no Serviço de Alergia e Imunologia do HSPE-SP, uma vez que esse tipo de alergia é um problema emergente e que tem sido cada vez mais relatado na última década.
MATERIAL E MÉTODOS
Foi realizado um estudo retrospectivo, no qual foi realizada a análise de prontuário de pacientes com diagnóstico comprovado de dermatite atópica, através dos critérios de Hanifin e Radjka7. Os pacientes foram classificados de acordo com o Scoring Atopic Dermatitis (SCORAD) em portadores de dermatite leve (score até 15), moderada (score entre 15 e 40) e grave (score maior que 40)10. Esse score leva em consideração o tamanho da área acometida, eritema, edema, liquenificação da pele e sintomas subjetivos, como distúrbio do sono e intensidade do prurido.
Esses pacientes foram atendidos no ambulatório de Alergia e Imunologia do HSPE-SP no período de julho a novembro de 2017, e realizaram teste de contato com as baterias padrão 30 substâncias, cosméticos 10 substâncias, corticoides 7 substâncias (betametasona 1%, budesonida 0,01%, clobetasol 1%, dexametasona 1%, acetato de hidrocortisona 25%, butirato de hidrocortisona 1%, triancinolona acetonida 1%), incluindo furoato de mometasona 0,1%. As câmaras em fita adesiva comumente utilizadas no Serviço de Alergia e Imunologia do HSPE-SP é da AlergoChamber. A leitura tardia do teste de contato é realizada em 48 e 96 horas, e a interpretação conforme preconizada pelo International Contact Dermatitis Research Group. A análise estatística dos dados foi realizada através do programa Microsoft Excel 2013; The R Project for Statistical Computing, método Pearson's Chi-squared test, com intervalo P95.
RESULTADOS
No presente estudo, foram incluídos 51 pacientes, sendo observada maior ocorrência de dermatite atópica no gênero feminino, com 37 (73%) pacientes, enquanto no gênero masculino 14 (27%) pacientes eram acometidos pela doença.
Após análise dos dados, não foi identificada relação da gravidade da DA e o gênero, conforme visto na Tabela 1.
De acordo com classificação da gravidade da DA, dos 51 pacientes, 30 (59%) tinham DA leve, 16 (31%) moderada, e 5 (10%) grave. Para melhor análise estatística dos dados, os pacientes foram divididos em dois grupos, um com pacientes portadores de dermatite leve, e outro com dermatite moderada/grave.
Do total de 51 pacientes envolvidos, 35 (68,6%) tinham menos de 18 anos, enquanto que 15 (29,4%) tinham entre 18 e 59 anos, sendo apenas 1 (2%) acima de 60 anos.
Esse estudo mostrou que 55% (28) dos pacientes apresentaram algum teste de contato positivo. Em pacientes com DA leve, 44% (13) apresentaram positividade para pelo menos uma substância do teste de contato, enquanto que pacientes com DA moderada/grave, 62% (10) apresentaram essa positividade.
Por esse estudo, foi identificada relação entre a positividade para os testes de contato em relação à faixa etária, sendo mais propensos a positivar pacientes maiores de 18 anos, conforme visto na Tabela 2.
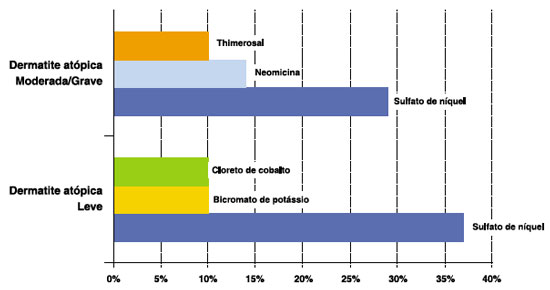
De acordo com os resultados obtidos nesse estudo, as substâncias mais positivas no teste de contato com bateria padrão estão representadas na Figura 1, sendo a mais frequente sulfato de níquel (33%), independente da gravidade da DA.
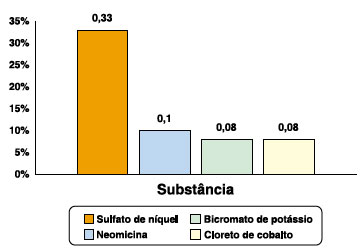
Figura 1 Prevalência de positividade das principais substâncias da bateria padrão, em todos os pacientes com dermatite atópica
Foi identificada relação entre a positividade ao sulfato de níquel e o gênero, sendo o gênero feminino mais propenso a positivar para este alérgeno, conforme visto na Tabela 3.
De acordo com os resultados obtidos nos testes de contato com bateria padrão, as substâncias mais positivas em relação à gravidade da DA estão representadas na Figura 2.
Não foi identificada relação entre a positividade dos testes de contato bateria padrão e a gravidade de DA (p = 0,76).
Nesse estudo, foi observado que apenas 2 (3,9%) pacientes foram positivos para bateria de cosméticos, apresentando positividade para resina tonsil/formal (2%) e armechol L-101 (2%), sendo todos classificados com DA leve.
Após análise dos dados, foi visto que 3 (5,9%) pacientes apresentaram positividade para o teste de contato com bateria de corticoides, sendo positivas as substâncias betametasona 1%, budesonida 0,01% e butirato de hidrocortisona 1%. Todos esses pacientes eram pertencentes ao grupo de portadores de DA leve. Nesse estudo, não foi observado teste positivo para furoato de mometasona.
Foi identificada relação entre a positividade do teste de contato com bateria de corticoides e sulfato de níquel da bateria padrão, conforme mostrado na Tabela 4.
DISCUSSÃO
O gênero influencia na prevalência de DA, sendo que durante os primeiros dois anos de vida ela afeta mais frequentemente os homens12, mas na puberdade e na idade adulta, o sexo feminino tem maior prevalência6; não há diferença significativa durante o período da idade escolar. Esse dado referente à prevalência de DA também foi visto no nosso estudo, no qual houve predominância de mulheres sendo acometidas por essa doença, uma vez que nossa amostra apresenta maioria de pacientes acima da idade escolar. Nesse trabalho, não foi identificada relação entre gravidade da DA e o gênero, conforme encontrado na literatura, onde a maioria dos artigos não destaca diferença na gravidade da doença entre os gêneros13,15. Entretanto, o estudo australiano de Marks et al. encontrou uma maior proporção de meninos com DA moderada a grave14.
Com esse estudo, observou-se que pacientes com dermatite atópica acima de 18 anos apresentaram mais propensão a positivar para os testes de contato, o que diverge da literatura onde é relatado que as crianças são mais vulneráveis a positivar para os alérgenos, devido à função prejudicada e imatura da barreira cutânea, uma característica que permite a penetração mais profunda de potenciais haptenos. Além disso, a pele das crianças contém menor quantidade de lipídios em relação aos adultos; portanto, a função da barreira lipídica acaba sendo prejudicada2.
Estudos brasileiros e europeus sobre testes epicutâneos em pacientes com suspeita de DC revelam uma positividade dos testes entre 37 a 73%11, o que foi compatível com nosso estudo em que, no geral, foi encontrada uma positividade de 55% para os testes de contato, o que reforça a eficácia da utilização de baterias padronizadas como métodos de auxílio na investigação da etiologia das dermatites de contato.
Historicamente, pensava-se que os pacientes com DA não poderiam ou não desenvolviam DC devido a vários estudos em que os pacientes com DA não desenvolviam sensibilização aos haptenos em relação aos pacientes sem DA. No entanto, evidências mais recentes dos Estados Unidos e da Europa mostraram que os pacientes com DA têm taxas similares, ou até maiores, de resultados positivos em testes de contato, incluindo metais e fragrâncias, do que aqueles sem DA16.
No nosso estudo, as principais substâncias com positividade no teste de contato padrão foram: sulfato de níquel (33%), neomicina (10%), bicromato de potássio e cloreto de cobalto (8% cada). Essa alta positividade para o níquel é corroborada pela literatura, com prevalência de 20,1% para esse metal em adultos2. O estudo de Giordano et al. (1999) cita que os alérgenos de contato mais frequentes em pacientes com dermatite atópica são: metais (19,1%), fragrância (4,4%), bálsamo do Peru (2,6%), lanolina (4,4%), neomicina (2,6%) e emolientes (2,6%)8.
No nosso estudo, foi encontrada uma positividade importante para neomicina no teste de contato dos pacientes com DA moderada/grave, o que também foi visto no estudo de Sharma (2005), porém sem correlação com a gravidade, onde relata positividade importante para neomicina seguida da gentamicina. A neomicina é um potente sensibilizador em todo o mundo, e a incidência relatada varia entre 2,5 a 6%17. A incidência de alergia de contato devido à gentamicina foi de 8,3% na Índia, enquanto que no Reino Unido, a incidência é muito maior (31%). Isso ocorre, provavelmente, porque a gentamicina é usada mais do que a neomicina no Reino Unido. A reatividade cruzada entre gentamicina e neomicina foi observada em 40% em diferentes estudos17. Outro estudo, como o de Samahy (1997), também encontrou que os pacientes com dermatite atópica eram mais frequentemente sensíveis à neomicina do que os não atópicos9.
Nesse estudo, foi identificada relação entre a positividade do sulfato de níquel e o gênero, sendo o feminino mais propenso a positivar para esse alérgeno, conforme foi visto no estudo de Kot M et al. (2017), na qual foi observado DC por metais sendo mais comum nas mulheres (73,7%), enquanto que em homens foi de 37,5%4.
Não foi observada relação entre a positividade dos testes de contato e a gravidade de DA, bem como a positividade para sulfato de níquel do patch test padrão e a gravidade de DA.
Foi demonstrada relação entre a positividade da bateria de corticoides e o sulfato de níquel da bateria padrão, conforme visto no estudo de Kot M et al., em que 63% dos pacientes com hipersensibilidade aos corticosteroides também eram alérgicos a sais metálicos4.
De acordo com estudo de Kot M et al. (2017), o alérgeno não esteroide mais sensibilizante em indivíduos atópicos foi o sulfato de níquel (51,8%)4. De acordo com o artigo de Lul L et al. (2013), os íons de níquel também são influenciados pelo pH da pele. Em geral, as associações iônicas estão dispostas a dissociar-se em ambientes ácidos, aumentando previsivelmente o número de íons livres. Os íons de níquel são reversivelmente ligados a proteínas de uma maneira sensível pelo pH. Especificamente em ambientes básicos, o níquel conseguiu se ligar à resíduos de histidina, criando um epítopo antigênico que ativava os receptores de células T. O aumento do pH do estrato córneo, como encontrado nos pacientes com DA, pode fazer com que os íons de níquel se conjuguem de forma mais eficiente com as principais moléculas do complexo de histocompatibilidade que iniciam a cascata imunológica2.
Estudos clínicos indicam que a dermatite de contato (DC) por glicocorticoides não é rara, e tem sido cada vez mais relatada na última década4. Entre os fatores de risco para desenvolver a hipersensibilidade de contato para corticoide tópico, as doenças inflamatórias crônicas da pele e alergia de contato polivalente parecem ser mais importantes. Além disso, destaca-se a longa duração da doença, uso prolongado de corticoides tópicos e pacientes com 2 ou mais resultados de patch test positivo para sais de metais, conforme observado no nosso estudo, e outros haptenos não esteroides4.
No nosso estudo, foi encontrada sensibilidade para budesonida e betametasona, sendo estes os alérgenos mais sensíveis de acordo com estudo de Kot et al. (2017), onde a budesonida corresponde a 77,8%, e betametasona e clobetasol a 55,5% cada4. Um total de 77,8% dos pacientes alérgicos ao glicocorticoide também apresentaram sensibilidade a pelo menos um alérgeno não esteroide da European Baseline Series4, conforme visto em nosso estudo, em que houve sensibilidade concomitante para sulfato de níquel.
A alergia de contato com glicocorticoides pode afetar 12,8% dos pacientes com DA5. No estudo de Weller et al. (2013), realizaram patch com 3.547 pacientes portadores de DA, e 2% (72 pacientes) tinham alergia por corticoide10. No nosso estudo, foi encontrada uma maior porcentagem, onde 5,9% dos pacientes com DA apresentaram sensibilização por corticoides.
CONCLUSÃO
Os testes de contato foram mais positivos em adultos. Houve maior sensibilidade para o sulfato de níquel no gênero feminino, e sensibilidade importante à neomicina na DA moderada/grave. Pacientes com alergia de contato por corticoides podem apresentar alergia a sulfato de níquel. Esse trabalho chama atenção para a porcentagem importante de pacientes com DA acometidos por alergia de contato por corticoides, sendo esse tipo de alergia um problema emergente e que tem sido cada vez mais relatado na última década, porém ainda são escassos os estudos envolvendo esse assunto.
REFERÊNCIAS
1. Addor FAZ, Aoki V. Barreira cutânea na dermatite atópica. An Bras Dermatol. 2010;85(2):184-94.
2. Rundle CW, Bergman D, Goldenberg A, Jacob SE. Contact dermatitis considerations in atopic dermatitis. Clin Dermatol. 2017;35:367-74.
3. Fonacier L. A Pratical Guide to Patch Testing. J Allergy Clin Immunol Pract. 2015;3(5):669-75.
4. Kot M, Bogaczewicz J, Krecisz B, Wozniacka A. Contact allergy in the population of patients with chronic inflammatory dermatoses and contact hypersensitivity to corticosteroids. Postepy Dermatol Alergol. 2017;34(3):253-9.
5. Zmudzinska M, Czarnecka-Operacz M, Silny W. Contact allergy to glucocorticosteroids in patients with chronic venous leg ulcers, atopic dermatitis and contact allergy. Acta Dermatovenerol Croat. 2008;16(2):72-8.
6. Chen W, Mempel M, Schober W, Behrendt H, Ring J. Gender difference, sex hormones, and immediate type hypersensitivity reactions. Allergy. 2008;63(11):1418-27.
7. Rothe MJ, Grant-Kels JM. Diagnostic criteria for atopic dermatitis. Lancet. 1996; 348:769-70.
8. Giordano-Labadie F, Rancé F, Pellegrin F, Bazex J, Dutau G, Schwarze HP. Frequency of contact allergy in children with atopic dermatitis: results of a prospective study of 137 cases. Contact Dermatitis. 1999;40(4):192-5.
9. Samahy MH, Kerdani T. Value of patch testing in atopic dermatitis. Am J Contact Dermat. 1997;8(3):154-7.
10. de Bruin Weller MS, Rockmann H, Knulst AC, Bruijnzeel-Koomen CA. Evaluation of the adult patient with atopic dermatitis. Clin Exp Allergy. 2013;43(3):279-91.
11. Grupo Brasileiro de Estudo em Dermatite de Contato. Estudo multicêntrico para elaboração de uma bateria-padrão brasileira de teste de contato. An Bras Dermatol. 2000;75(2):147-56.
12. Dirven-Meijer PC, Glazenburg EJ, Mulder PG, Oranje AP. Prevalence of atopic dermatitis in children younger than 4 years in a demarcated area in central Netherlands: the West Veluwe Study Group. Br J Dermatol. 2008;158:846-7.
13. Holm EA, Esmann S, Jemec GB. Does visible atopic dermatitis affect quality of life more in women than in men? Gend Med. 2004;1:125-30.
14. Marks R, Kilkenny M, Plunkett A, Merlin K. The prevalence of common skin conditions in Australian school students: 2. Atopic dermatitis. Br J Dermatol. 1999;140(3):468-73.
15. Ziyab AH, Raza A, Karmaus W, Tongue N, Zhang H, Matthews S, et al. Trends in eczema in the first 18 years of life: results from the Isle of Wight 1989 birth cohort study. Clin Exp Allergy. 2010;40:1776-84.
16. Aquino M, Fonacier L. The role of contact dermatitis in patients with atopic dermatitis. The J Allergy Clin Immunol Pract. 2014;4(2):382-7.
17. Sharma AD. Allergic contact dermatitis in patients with atopic dermatitis: A clinical study. Indian J Dermatol Venereol Leprol. 2005;71:96-8.