Número Atual: Janeiro-Março 2019 - Volume 3 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Omalizumabe no tratamento da urticária crônica espontânea: análise de custo-efetividade e impacto orçamentário
Omalizumab in the treatment of chronic spontaneous urticaria: cost-effectiveness analysis and budgetary impact
Luis Felipe Ensina1; Flavio Sano2; Edina Koga Silva3; Norma de Paula Motta Rubini4; Dirceu Solé5
DOI: 10.5935/2526-5393.20190010
1. Doutor em Ciências e Pesquisador Associado à Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria, Escola Paulista de Medicina-Universidade Federal de São Paulo (EPM-UNIFESP) - São Paulo, SP, Brasil
2. Doutor em Ciências, Chefe do Setor de Pediatria do Hospital Nipo Brasileiro - São Paulo, SP, Brasil
3. Professora Associada da Disciplina de Medicina de Urgência e Medicina Baseada em Evidências; EPM-UNIFESP e Pesquisadora do Centro Cochrane do Brasil - São Paulo, SP, Brasil
4. Professora Titular de Alergia e Imunologia da Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro (UNIRIO), RJ, Brasil
5. Professor Titular da Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria, EPM-UNIFESP - São Paulo, SP, Brasil
Endereço para correspondência:
Dirceu Solé
E-mail: alergiaimunologiareumatologia@unifesp.br
Submetido em: 08/03/2019
Aceito em: 18/03/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVOS: Determinar a relação custo-efetividade da adição do omalizumabe (Oma) no tratamento da urticária crônica espontânea (UCE) refratária aos tratamentos convencionais, bem como o impacto orçamentário no contexto da saúde suplementar (SS) no Brasil.
MÉTODOS: Na análise econômica, utilizou-se o modelo de Markov baseado no Urticaria Activity Score for 7 days (UAS7), considerando-se os desfechos clínicos: anos de vida salvos com doença controlada (UAS7 = 0 ou UAS7 ≤ 6), e anos de vida ajustados à qualidade (QALY). Três razõesde custo-efetividadeincremental (RCEI) foram calculadas. O impacto orçamentário foi calculado com base em dados da SS, população elegível e o horizonte de 5 anos.
RESULTADOS: As RCEI calculadas para o desfecho anos de vida salvos com doença controlada nos horizontes de 3 e 5 anos foram R$ 108.935,42 e R$ 166.977,29, respectivamente. O impacto orçamentário, do primeiro ao quinto ano, da incorporação do Oma à SS para o tratamento de pacientes com UCE refratária variou entre R$ 65 milhões e R$ 157 milhões, que equivaleria a R$ 1,38/assistido no primeiro ano incorporação. Sendo assim, ao analisar os custos adicionais por desfecho adicional salvo, nota-se que a RCEI também se mostrou menor que três vezes o PIB per capita no Brasil, podendo-se dizer que o tratamento com Oma é custo-efetivo em comparação ao tratamento atual também neste desfecho.
CONCLUSÃO: A análise econômica demonstrou que o tratamento com Oma da UCE refratária ao tratamento com anti-histamínicos H1 em doses elevadas é custo-efetivo no cenário nacional, e a sua incorporação na SS é viável.
Descritores: Urticária crônica espontânea, omalizumabe, anti-histaminico H1, custo-efetividade, QALY.
INTRODUÇÃO
A urticária crônica espontânea (UCE), segundo estudos epidemiológicos internacionais, tem prevalência variável entre 0,5% e 1%, incidência de 0,10 a 1,5 por 100.000 habitantes e predomina em pacientes adultos do sexo feminino1,2. Tem impacto significativo sobre a qualidade de vida, comprometendo a saúde mental, o sono, as atividades profissionais, de lazer e as com familiares3.
As recomendações atuais no manejo da UCE objetivam controlar totalmente os sintomas da forma mais segura possível. Os anti-histamínicos H1 de segunda geração (não sedantes) são a primeira linha de tratamento e podem ter a sua dosagem aumentada em até quatro vezes a dose habitual. Nos casos refratários aos anti-histamínicos, a primeira opção terapêutica é o anticorpo monoclonal anti-IgE – omalizumabe (Oma)4. O advento do Oma para o tratamento da UCE representou grande avanço no seu manejo, possibilitando o controle eficaz da doença, com maior segurança5-10. Entretanto, o alto custo do Oma é fator limitante para o seu uso na prática clínica em nosso país. Assim, são necessários esforços para a incorporação do Oma no tratamento de pacientes com UCE refratária aos anti-histamínicos no Sistema Único de Saúde (SUS) e na Saúde Suplementar (SS). Temos, então, o desafio de viabilizar esta incorporação de forma criteriosa em um cenário de recursos finitos.
Há um conflito crescente entre a necessidade de incorporação de novas tecnologias na atenção à saúde e a necessidade de adequar o uso de novas tecnologias a recursos financeiros limitados. A incorporação de tecnologias da saúde de alto custo na saúde pública e suplementar implica na necessidade de análises econômicas que avaliem não somente a custo-efetividade, mas também o impacto orçamentário em diferentes cenários. Análises econômicas constituem instrumentos úteis para a tomada de decisão dos gestores de sistemas de saúde e são utilizadas em diversos países, tais como Canadá, Inglaterra e Austrália. No Brasil, estas ferramentas de apoio também são empregadas pelos gestores, tanto na Comissão Nacional de Incorporação de Tecnologias do SUS (CONITEC), quanto pela Agência Nacional de Saúde Suplementar (ANS)11.
Considerando a importância do emprego do Oma no tratamento da UCE e a ausência de estudos nacionais de sua avaliação econômica no cenário nacional, conduzimos o presente estudo com o objetivo de avaliar a relação custo-efetividade da sua adição no tratamento da UCE refratária ao tratamento convencional, bem como o impacto orçamentário no contexto da SS no Brasil.
MÉTODO
População-alvo
Para a avaliação da relação custo-efetividade do Oma como terapêutica adicional no tratamento de pacientes com UCE refratária ao tratamento convencional, foram avaliados indivíduos maiores de 12 anos4. Considerando-se que pode ocorrer remissão dos sintomas entre 5 e 10 anos após o início do tratamento bem sucedido, foi analisado o horizonte de tempo de 10 anos5,6. Adotou-se a perspectiva do Sistema de SS do Brasil.
Comparadores
Foram comparados os tratamentos: Oma adicionado ao tratamento convencional (SoC) com anti-histamínico H1 em dose padrão (Oma+SoC) e o tratamento convencional com anti-histamínico H1 em doses altas (SoC*). Este foi considerado o comparador padrão por ser a alternativa mais utilizada na prática clínica como conduta anterior à associação de outra droga7. Foi aplicada uma taxa de desconto anual de 5% para custos e desfechos a partir do segundo ano da análise.
Desfechos considerados
Os desfechos de saúde considerados para análise foram: anos de vida com UAS7 ≤ 6 e Quality-adjusted Life Years (QALY) salvos. Os pacientes com UAS7 ≤ 6 são aqueles com a doença adequadamente controlada, seguindo o modelo econômico de Oma em UCE7. O QALY é uma medida genérica do ônus da doença, incluindo tanto a qualidade quanto a quantidade de vida vivida, usado na avaliação econômica para obter-se a relação custo-benefício das intervenções médicas8. Um QALY equivale a um ano em perfeita saúde8.
Os desfechos econômicos computados foram custos médicos diretos, incluindo os utilizados diretamente para o tratamento do paciente: custos de medicamentos, hospitalizações por complicações da doença, além de procedimentos relacionados a tais eventos. Os custos indiretos e custos não médicos diretos não foram incluídos na análise.
Estrutura do modelo
Para a estimativa dos custos e desfechos dos tratamentos foi elaborado um modelo de Markov9 com ciclos semestrais, e a cada 6 meses foram consideradas transições dos pacientes entre os estados de saúde, conforme representado na Figura 1.
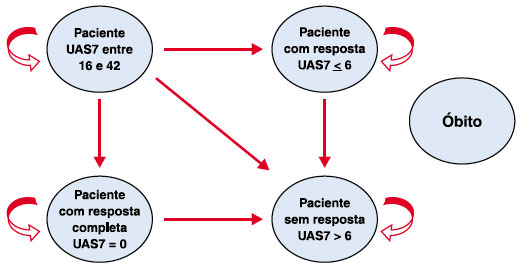
Figura 1 Estrutura do modelo de Markov
Cinco principais estados de transição foram considerados: paciente com UCE cujo escore UAS7 é igual ou superior a 16 pontos; paciente com UCE com resposta ao tratamento (UAS7 ≤ 6); paciente com UCE com resposta completa (UAS7 = 0); paciente sem resposta ao tratamento (UAS7 > 6); e morte.
Dados de eficácia clínica
A distribuição dos pacientes ao longo dos diferentes estados de saúde foi baseada nos dados de metanálise ainda não publicada, e que reuniu vários estudos10-16. Os resultados foram apresentados para os primeiros três meses e houve extrapolação para viabilizar a análise até completar cinco anos. Os riscos relativos para os estados de saúde UAS7 = 0 e UAS7 ≤ 6 foram convertidos em percentuais. Resposta ao tratamento (UAS7 ≤ 6) Oma+SoC (55,75%) vs. SoC* (15,19%) – Risco relativo [RR] = 3,85; Intervalo de confiança de 95% [IC95%] = 3,85 a 5,10; p < 0,001) e Resposta completa (UAS7 = 0) Oma+Soc (26,44%) vs. SoC* (4,07%) – RR = 6,01 (IC95%= 3,29 a 10,98;p < 0,001).Tais probabilidades foram convertidas para probabilidades semestrais, utilizadas no modelo econômico.
Os eventos adversos em ambos os tratamentos não foram considerados na análise, uma vez que correspondem a eventos que são abordados em âmbito ambulatorial, e desse modo, não haveria impacto ou relevância no modelo.
Dados de qualidade de vida
Na avaliação da qualidade de vida foram avaliados os dados de utilities (serviços públicos) para pacientes de acordo com os estados de saúde considerados no modelo (Tabela 1) e serviram de base para o principal desfecho da análise, o QALY. Estes dados foram obtidos a partir de dados coletados17.

Dados de mortalidade
A taxa de mortalidade aplicada no modelo foi a por causas gerais em homens e mulheres no Brasil, e média de idade de acordo com a população dos estudos de Oma de 43 anos, segundo os dados do IBGE 201818.
Uso de recursos e custos
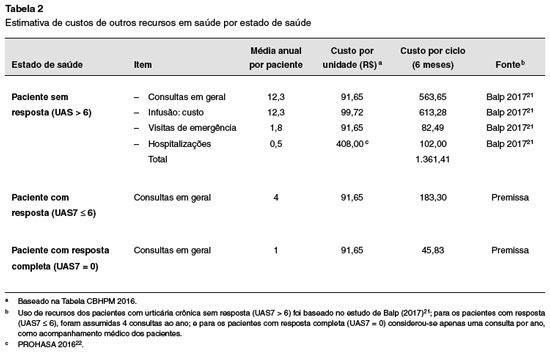
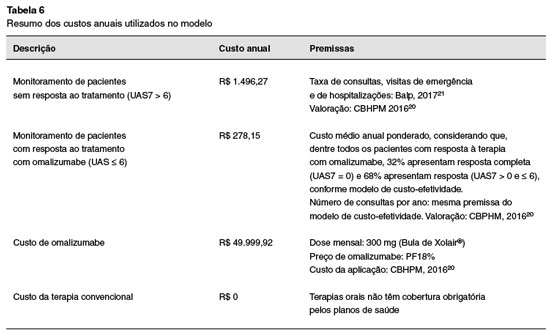
Entre os recursos de saúde foram computados: custos associados ao tratamento medicamentoso, realização de procedimentos e tratamento das complicações da UCE. A estimativa de custo de Oma foi baseada no esquema de doses recomendadas em bula para o tratamento da UCE, o que equivale a 300 mg (duas injeções por aplicação) a cada quatro semanas. O custo unitário de Oma adotado foi de R$ 2.033,47 por frasco de 150 mg. Tal dado foi obtido a partir da tabela de preços da CMED (Câmara de Regulação do Mercado de Medicamentos), considerando o Preço Fábrica com ICMS de 18% (CMED 2018)19. Assumiu-se, ainda, o custo da aplicação do medicamento, equivalente ao procedimento “Terapia imunobiológica subcutânea (por sessão) ambulatorial” constante na tabela CBHPM (Classificação Hierarquizada de Procedimentos Médicos; R$ 99,72 por aplicação)20.
O custo do SoC sob a perspectiva do Sistema de SS é equivalente a zero, por se tratar de terapia oral não oncológica, não há obrigatoriedade de cobertura por parte dos planos de saúde no Brasil.
Para a estimativa dos gastos com uso de recursos no Sistema de SS foi considerado o resultado obtido em estudo de impacto da doença sob a perspectiva de pacientes brasileiros21, determinando também a prevalência da UCE no Brasil, além do impacto da doença na qualidade de vida e uso de recursos no sistema de saúde de pacientes adultos (Tabela 2).
Resultados do caso base
Os resultados comparativos das estratégias alternativas de tratamento foram medidos pela razão de custo-efetividade incremental (RCEI). Esta é definida, para duas alternativas de tratamento específicas, como o custo adicional proporcionado pelo medicamento em análise dividido pelo ganho adicional em saúde alcançado pelo mesmo.
Análise de sensibilidade univariada
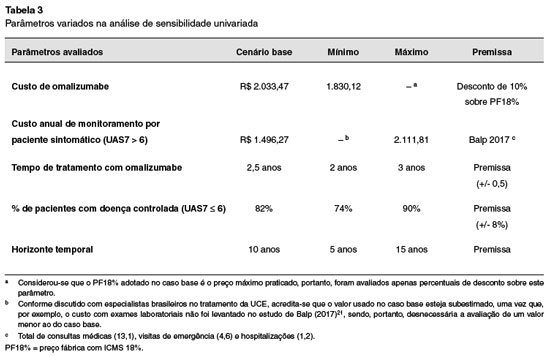
A fim de mensurar as incertezas envolvidas nos resultados da presente análise e a identificação das variáveis que mais afetam este modelo, foi realizada uma análise de sensibilidade univariada. Análises de sensibilidade univariadas consideram variações de um único parâmetro por vez, mantendo os demais parâmetros constantes. Os parâmetros variados na análise de sensibilidade univariada e seus respectivos valores no cenário base estão na Tabela 3.
Adicionalmente, foi desenvolvida análise para projetar o impacto financeiro estimado para o Sistema de SS com a incorporação do Oma para tratamento de pacientes com UCE, refratários ao tratamento padrão. O impacto orçamentário foi estimado pela comparação do cenário atual (sem Oma) versus cenário pós incorporação de Oma (com Oma).
População elegível
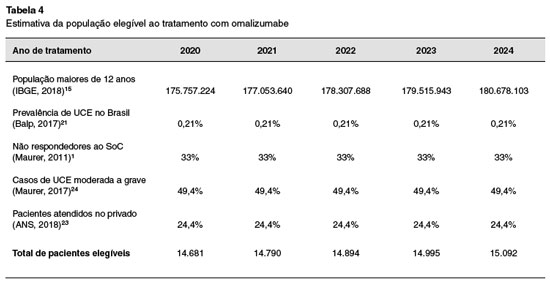
A população elegível ao tratamento com Oma no Sistema de SS foi calculada projetando-se o tamanho da população acima de 12 anos coberta. Esta projeção foi realizada considerando-se a projeção de crescimento da população brasileira realizada pelo IBGE (2018)18 e aplicando a taxa de cobertura da SS de 24,4% obtida a partir da base de dados da ANS em maio de 201823. Adicionalmente, considerou-se que 0,21% desta população tem urticária crônica diagnosticada e tratada21. De acordo com a literatura, aproximadamente 33% dos pacientes são refratários ao tratamento convencional1 e 49,4% dos casos correspondem à forma moderada a grave da doença (UAS7 ≥ 16)24. O cálculo da população elegível está detalhado na Tabela 4.
Distribuição de pacientes
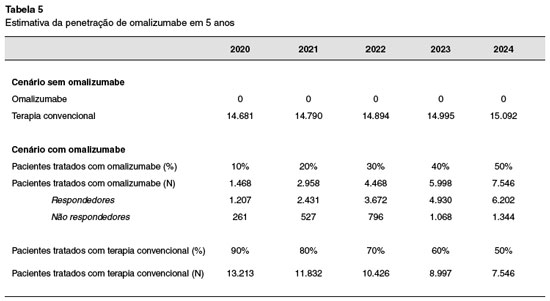
Dentre os indivíduos com UCE elegíveis ao tratamento com Oma, o modelo assume que a proporção de pacientes utilizando este medicamento seja crescente, ao longo dos cinco anos, variando de 10% no primeiro ano após a incorporação, até 50%, como apresentado na Tabela 5.
Custos de tratamento
Os custos de tratamento e de acompanhamento foram obtidos do modelo de custo-efetividade como apresentado na Tabela 6.
Assim como no modelo de custo-efetividade, pacientes sem resposta interrompem a terapia com Oma e subsequentemente voltam a tomar terapia convencional ao longo do horizonte temporal. Já os pacientes com resposta continuam a terapia com Oma até completar 2,5 anos de tratamento.
RESULTADOS
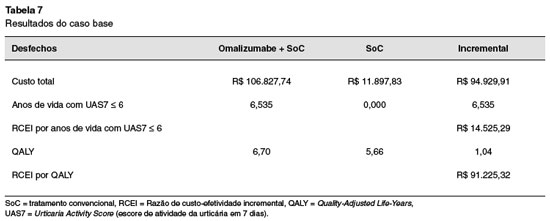
A Tabela 7 apresenta os resultados comparativos das estratégias alternativas de tratamento medidos pela razão de custo-efetividade incremental (RCEI).
De acordo com os resultados, observa-se que o procedimento utilizando Oma proporcionou benefícios adicionais tanto em termos de anos de vida com UAS7 ≤ 6 como em QALY, durante o horizonte de tempo de 10 anos.
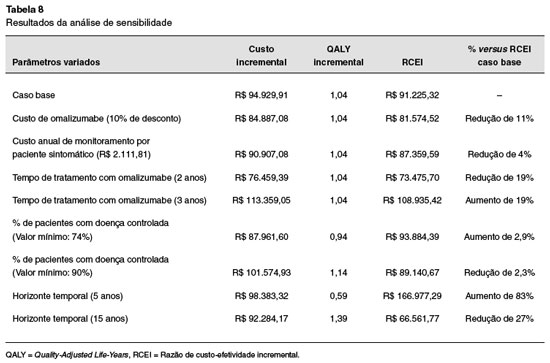
A Tabela 8 apresenta os impactos dos cenários propostos na análise de sensibilidade univariada, sobre os resultados de RCEI por QALY. A menor RCEI por QALY (R$ 66.562,00) foi obtida no cenário com horizonte temporal de 15 anos, o que representou uma redução de 27% em relação ao resultado de RCEI do caso base. Já a maior RCEI por QALY (R$ 166.977,00) foi observada no cenário com horizonte temporal de 5 anos, representando um aumento de 83% com relação à RCEI do caso base. É importante salientar que, se considerado o limiar de custo-efetividade estabelecido pela Organização Mundial de Saúde (intervenção custo-efetiva: RCEI < 3 x Produto Interno Bruto [PIB] per capita/QALY ganho; 1PIB per capita 2017: R$ 31.587,00), a adição de Oma foi custo-efetiva em todos os cenários, exceto em dois casos: quando variado o tempo de tratamento com Oma para 3 anos, e o horizonte temporal para 5 anos, conforme mostrado na Tabela 8.
Resultados de impacto orçamentário
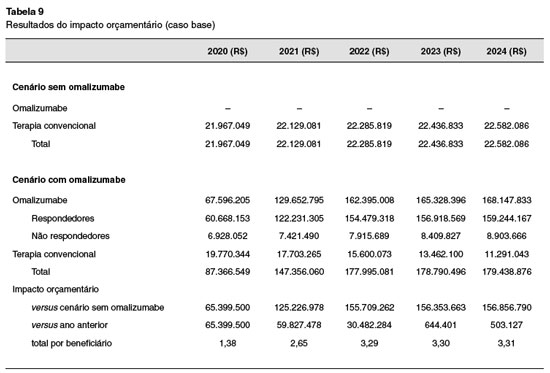
De acordo com as premissas adotadas no modelo, estima-se um investimento de R$ 65 milhões a R$ 157 milhões, do primeiro ao quinto ano após a incorporação do Oma à SS para tratamento de pacientes com UCE refratária ao tratamento convencional. Considerando o total de beneficiários da SS de 47.341.036 (set/2018), o investimento médio por beneficiário seria equivalente a R$ 1,38 no primeiro ano incorporação, como mostrado na Tabela 9.
Análise de sensibilidade
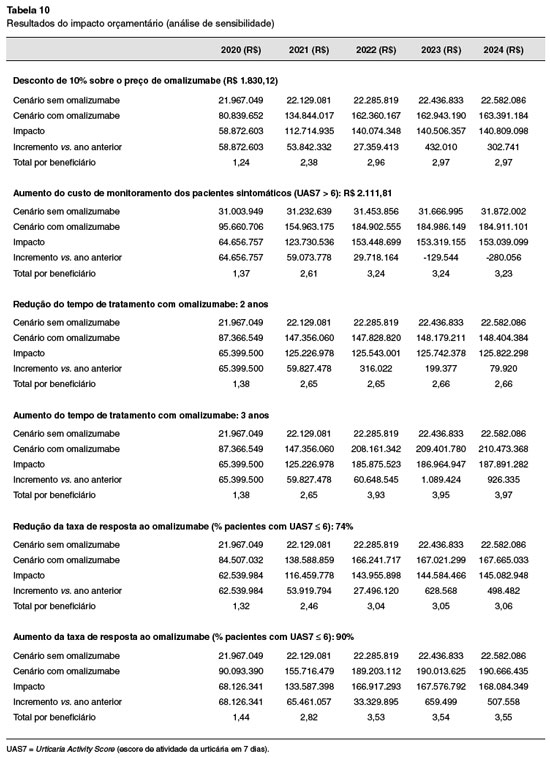
As incertezas sobre os resultados foram estimadas pela análise de sensibilidade univariada, onde os mesmos parâmetros testados na análise de custo-efetividade foram considerados, conforme apresentados anteriormente e resumidos novamente a seguir: Custo de Oma com desconto de 10% (R$ 1.830,12); Custo anual de monitoramento por paciente sintomático (UAS7 > 6): R$ 2.111,81; Tempo de tratamento com Oma: 2 e 3 anos; Taxa de resposta ao tratamento com Oma (% pacientes com UAS7 ≤ 6): 74% a 90%.
Os resultados da análise de sensibilidade são resumidos na Tabela 10. Todos os cenários apontam para um incremento no orçamento do Sistema de SS, que pode variar de R$ 59 milhões a R$ 68 milhões no primeiro ano da incorporação de Oma, respectivamente, no cenário em que se considera desconto de 10% sobre o valor de aquisição de Oma e no cenário com aumento da taxa de resposta ao Oma (90%).
DISCUSSÃO
Foram objetivos deste estudo avaliar a relação custo-efetividade e o impacto orçamentário do Oma como tratamento aditivo em pacientes com UCE refratária ao tratamento convencional. O modelo econômico aqui empregado permitiu realizar uma avaliação sobre as estratégias medicamentosas para o tratamento da UCE no cenário do Sistema de SS no Brasil. Avaliou-se o custo adicional proporcionado pelo uso do Oma em comparação ao tratamento convencional (dose elevada de anti-histamínico), aferindo-se o ganho clínico esperado, em termos de anos de vida salvos e QALY salvo.
O Oma tem se mostrado um tratamento promissor para a UCE, reduzindo principalmente os escores UAS7 que estão associados aos sinais e sintomas mais prevalentes e de maior impacto da doença, que resultam em melhor qualidade de vida dos pacientes1,10-16,24. Tendo como base os resultados dos estudos clínicos avaliados e levando-se em consideração a qualidade da evidência disponível até o presente momento, o Oma mostra-se adequado em termos de efetividade e segurança para o tratamento da UCE refratária ao tratamento convencional1,10-16,24.
O método aqui empregado foi utilizado em outros estudos que avaliaram o custo-efetividade do Oma no tratamento da UCE refratária a doses elevadas de anti-histamínicos, o modelo de Markov25-27.
Considerando-se que o cenário de avaliação era o Brasil, os dados empregados no modelo de análise foram extraídos de estudo de Balp et al.21. Esse estudo retrospectivo considerou dados de 201128, 201229 e 201530 obtidos a partir da Pesquisa Nacional de Saúde e Bem-Estar (Kantar’s Health National Health and Wellness Survey - Brazil ) e incluiu 36.000 participantes. É uma base de dados que contém acervo internacional importante de informações relatadas pelos próprios pacientes no setor da saúde e inclui mais de 165 condições clínicas21. O estudo avaliou dois grupos de pacientes, identificados como tendo UCE (127 pacientes tratados), e grupo controle (508 pacientes que nunca haviam sofrido com sintomas de UCE). Dados referentes aos números de consultas realizadas, bem como o tipo de atendimento recebido foram determinados em ambos os grupos. O modelo assumiu que esses dados, ao início do tratamento, eram iguais para ambos os grupos de pacientes com UCE. No entanto, a diferença entre o uso de recursos se relacionou diretamente com os escores UAS26. No caso do custo com a administração do Oma, assumiu-se custo semelhante ao procedimento “Terapia imunobiológica subcutânea (por sessão) ambulatorial” constante na tabela da CBHPM20.
Quando comparado ao tratamento convencional isolado, o Oma mostrou ser uma alternativa melhor e de maior custo em relação ao seu comparador, considerando as premissas adotadas no nosso modelo econômico. Os resultados do caso base e a maioria dos cenários avaliados na análise de sensibilidade geraram resultados custo-efetivos, cujas RCEI foram inferiores a três vezes o PIB per capita do Brasil.
De acordo com estudos de impacto da doença em pacientes com UCE, certamente outros desfechos são importantes para serem considerados em análises econômicas como esta, principalmente levando-se em conta a perspectiva da sociedade, que incluem taxas de absenteísmo no trabalho ou no estudo, prejudicando a produtividade, além de afetar aspectos psicológicos e bem-estar geral21. No entanto, dada a perspectiva adotada no modelo, os custos indiretos e custos não-médicos diretos não foram incluídos na análise.
Além disso, os eventos adversos em ambos os grupos de tratamento não foram considerados na análise, uma vez que correspondem a eventos que são abordados em âmbito ambulatorial, e desse modo, não haveria impacto ou relevância no modelo.
Dados sugerem que pacientes que apresentam UCE grave também apresentam comorbidades como depressão, ansiedade e problemas com o sono. Tais pacientes também possuem hábitos distintos que podem gerar outras morbidades adicionais, como maiores índices de obesidade e tabagismo em pacientes com UAS7 > 2821. Uma vez que tais elementos não puderam ser incluídos no modelo, é possível prever que os gastos, principalmente no grupo do tratamento convencional, estão subestimados. Assim, RCEI ainda menores podem ser esperadas em cenários de maior detalhamento, se caso dados adequados fossem disponíveis.
Resultados semelhantes foram observados por outros autores em localidades diferentes. Estudo comparativo entre Oma e ciclosporina em pacientes holandeses com UCE refratária a tratamento convencional empregou também o modelo de Markov. As variáveis contabilizadas foram semelhantes às empregadas no presente estudo. O Oma mostrou-se mais efetivo que a ciclosporina com custo incremental de € 51.052, QALY incremental de 11,3 e RCEI de € 4.510 por QALY ganho. Comparado ao tratamento convencional (quatro vezes a dose de anti-histamínico) o custo incremental do Oma foi € 161.342, o QALY incremental 9,2 e a RCEI € 17.502 por QALY ganho). Assim, concluem os autores ser o Oma custoefetivo em comparação à ciclosporina e o tratamento convencional25.
Em estudo posterior, com a mesma base de dados e pacientes e complementando com outros dados a re-análise confirmou os resultados anteriormente observados e verificou-se ter havido custo pela perda de produtividade resultante de RCEI de € 85.310 por QALY27. Resultados similares foram observados em pacientes do Reino Unido com UCE26.
Já a partir da análise de impacto orçamentário, estimou-se o investimento necessário para viabilizar a inclusão do procedimento com Oma no Sistema de SS do Brasil para o tratamento da UCE. De acordo com os resultados, estima-se que seja necessário um investimento de aproximadamente R$ 65 milhões no primeiro ano da incorporação, o que equivale a um incremento de R$ 1,38 por beneficiário atualmente que tenha plano de saúde no Brasil.
A contribuição dos modelos econômicos baseados em dados de custos e padrões de tratamento da prática médica local é auxiliar os formuladores de políticas de saúde e gestor de saúde na tarefa de estimar o impacto do uso do Oma no tratamento da UCE refratária ao tratamento convencional e avaliar a viabilidade da sua incorporação.
A incorporação do Oma como alternativa terapêutica para pacientes com UCE refratária aos tratamentos convencionais está sendo aprovada por vários sistemas de Saúde. O National Institute for Health and Care Excellence (NICE) recomenda o uso de Oma no Reino Unido como terapia adicional ao tratamento da UCE grave em pacientes maiores do que 12 anos e que não respondem ao tratamento com anti-histamínicos H1 e anti-leucotrienos31.
A Canadian Agency for Drugs and Technologies in Health (CADTH) incorporou o omalizumabe no sistema de saúde canadense em 2017. O Canadian Drug Expert Committee listou o tratamento para adultos e adolescentes com UCE que permanecem sintomáticos moderados a severos, apesar do tratamento com anti-histamínicos H132. O Pharmaceutical Benefits Scheme of Australia (PBS), sistema de saúde da Austrália, também incorporou o Oma no tratamento da UCE refratária a partir de 201733.
De acordo com as premissas adotadas no modelo, estima-se um investimento de R$ 65 milhões a R$ 157 milhões, do primeiro ao quinto ano após a incorporação do Oma à SS para tratamento de pacientes com UCE refratária ao tratamento convencional. Considerando o total de beneficiários da SS de 47.341.036 (set/2018), o investimento médio por beneficiário seria equivalente a R$ 1,38 no primeiro ano incorporação, como mostrado na Tabela 9.
Entre nós, a CONITEC no SUS não disponibiliza o Oma para o tratamento da UCE refratária ao tratamento habitual, e não há Protocolo Clínico e Diretrizes de Tratamento (PCDT) da UCE no SUS até o presente momento.
A análise econômica sobre o uso de Oma no tratamento de pacientes com UCE refratários ao tratamento convencional é custo-efetivo sob a perspectiva do Sistema de SS (RCEI = R$ 91.225,32/QALY), baseado no limiar de custo-efetividade estabelecido pela OMS. A análise de sensibilidade univariada confirma o custo-efetividade de Oma em quase todos os cenários avaliados. De acordo com os resultados da análise de impacto orçamentário, estima-se que seja necessário um investimento de aproximadamente R$ 65 milhões no primeiro ano da incorporação. Os cenários avaliados na análise de sensibilidade, confirmaram os resultados de incremento no orçamento decorrente da inclusão do procedimento em questão, variando de R$ 59 milhões a R$ 68 milhões no primeiro ano.
Em conclusão, tendo como base os resultados dos estudos clínicos avaliados e levando-se em consideração a qualidade de evidências disponíveis, o Oma mostra-se adequado em termos de eficácia e segurança para o tratamento da UCE refratária ao tratamento habitual10-16,34,35, custo-efetivo e com impacto orçamentário que possibilita a incorporação desta nova tecnologia.
REFERÊNCIAS
1. Maurer M, Weller K, Bindslev-Jensen C, Giménez-Arnau A, Bousquet PJ, Bousquet J, et al. Unmet clinical needs in chronic spontaneous urticaria. A GA(2)LEN task force report. Allergy. 2011;66(3):317-30.
2. Lapi F. Cassano N, Pegoraro V, Cataldo N, Heiman F, Cricelli I, et al. Epidemiology of chronic urticaria: results from a Nationwide, population-based study in Italy. Br J Dermatol. 2016;174:996-1004.
3. Dias GA, Pires GV, Valle SO, Dortas SD Júnior, Levy S, França AT, et al. Impact of chronic urticaria on the quality of life of patients followed up at a university hospital. An Bras Dermatol. 2016;91:754-9.
4. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer- Weber B, et al. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73(7):1393-414.
5. Beltrani VS. An overview of chronic urticaria. Clin Rev Allergy Immunol. 2002;23(2):147-69.
6. Toubi E, Kessel A, Avshovich N, Bamberger E, Sabo E, Nusem D, et al. Clinical and laboratory parameters in predicting chronic urticaria duration: a prospective study of 139 patients. Allergy. 2004;59(8):869-73.
7. Graham J, McBride D, Stull D, Halliday A, Alexopoulos ST, Balp MM, et al. Cost Utility of Omalizumab Compared with Standard of Care for the Treatment Of Chronic Spontaneous Urticaria. Pharmacoeconomics. 2016;34(8):815-27.
8. National Institute for Health and Care Excellence. Judging whether public health interventions offer value for money. September 2013. Disponível em: https://www.nice.org.uk/advice/lgb10. Acessado em: 20 de abril de 2018.
9. Sato RC, Zouain DM. Modelos de Markov aplicados à saúde. Einstein. 2010;8(3 Pt 1):376-9.
10. Saini S, Rosen KE, Hsieh HJ, Wong DA, Conner E, Kaplan A, et al. A randomized, placebo-controlled, dose-ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticaria. J Allergy Clin Immunol. 2011;128(3):567.
11. Kaplan A, Ledford D, Ashby M, Canvin J, Zazzali JL, Conner E, et al. Omalizumab in patients with symptomatic chronic idiopathic/ spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013;132:101-9.
12. Maurer M, Rosen K, Hsieh HJ, Saini S, Grattan C, Gimenez-Arnau A, et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med. 2013;368:924-35.
13. Saini SS, Bindslev-Jensen C, Maurer M, Grob JJ, Bulbul Baskan E, Bradley MS, et al. Efficacy and safety of omalizumab in patients with chronic idiopathic/spontaneous urticaria who remain symptomatic on H1 antihistamines: a randomized, placebo-controlled study. J Invest Dermatol. 2015;135:925.
14. Staubach P, Metz M, Chapman-Rothe N, Sieder C, Bräutigam M, Canvin J, et al. Effect of omalizumab on angioedema in H1 -antihistamine-resistant chronic spontaneous urticaria patients: results from X-ACT, a randomized controlled trial. Allergy. 2016;71(8):1135-44.
15. Hide M, Park HS, Igarashi A, Ye YM, Kim TB, Yagami A, et al. Efficacy and safety of omalizumab in Japanese and Korean patients with refractory chronic spontaneous urticaria. J Dermatol Sci. 2017;87(1):70-8.
16. Metz M, Staubach P, Bauer A, Brehler R, Gericke J, Ashton-Chess J, et al. Omalizumab normalizes levels of high affinity immunoglobulin E receptor-positive skin mast cells in patients with chronic spontaneous urticaria: a randomized, double-blind, placebo-controlled study. J Invest Dermatol. 2014;134:S30-8.
17. Hawe E, McBride D, Balp M-M, Tian H, Halliday A, Stull DE. EQ-5D utilities in chronic spontaneous/idiopathic urticaria. Pharmacoeconomics. 2016;34(5):521-7.
18. IBGE - Instituto Brasileiro de Geografia e Estatística. Síntese de indicadores sociais 2015. http://biblioteca.ibge.gov.br/visualizacao Acessado em: 20 de abril de 2018.
19. CMED - Câmara de Regulação do Mercado de Medicamentos. Anvisa 2018. Disponível em: http://portal.anvisa.gov.br/listas-deprecos. Acessado em: 10 de abril de 2018.
20. CBHPM - Classificação Brasileira Hierarquizada de Procedimentos Médicos 2016. Custos dos procedimentos sob a perspectiva da Saúde Suplementar. Disponível em: http://amb.org.br/formulariocbhpm-pessoa-juridica-fisica/. Acessado em: 10 de abril de 2018.
21. Balp MM, Lopes da Silva N, Vietri J, Tian H, Ensina LF. The Burden of Chronic Urticaria from Brazilian Patients' Perspective. Dermatol Ther (Heidelb). 2017;7(4):535-45.
22. PROHASA - Programa de Estudos Avançados em Administração Hospitalar e Sistemas de Saúde 2016. Custo médio de internação por causas gerais. Disponível em: http://www.hc.fm.usp.br/index.php?option=com_content&view=article&id=446:proahsa-indicadores&catid=20:conteudo Acessado em: 10 de abril de 2018.
23. ANS - Agência Nacional de Saúde Suplementar. Usuários do Sistema de Saúde Suplementar. Disponível em: http://www.ans.gov.br/perfil-do-setor/dados-e-indicadores-do-setor Acessado em: 10 de abril de 2018.
24. Maurer M, Staubach P, Raap U, Richter-Huhn G, Bauer A, Oppel EM, et al. H1-antihistamine-refractory chronic spontaneous urticaria: it's worse than we thought - first results of the multicentre real-life AWARE study. Clin Exp Allergy. 2017;47(5):684-92.
25. Kanters TA, Gertsen K, Hakkaart L. Cost- effectiveness of Omalizumab in Chronic spontaneous urticaria in The Netherlands. Value Health. 2015;18(7):A423.
26. Graham J, McBride D, Stull D, Halliday A, Alexopoulos ST, Balp MM, et al. Cost Utility of Omalizumab Compared with Standard of Care for the Treatment Of Chronic Spontaneous Urticaria. Pharmacoeconomics. 2016;34(8):815-27.
27. Kanters TA, Thio HB, Hakkaart L. Cost-effectiveness of omalizumab for the treatment of chronic spontaneous urticaria. Br J Dermatol. 2018 Feb 24. doi: 10.1111/bjd.16476. [Epub ahead of print].
28. Kantar Health’s National Health and Wellness Survey (NHWS)- Patient-Reported Outcomes in Brazil. 2011. Disponível em: http://www.evidencias.com.br/en/portfolio/national-health-and-wellnesssurvey/. Acessado em: abril de 2018.
29. Kantar Health’s National Health and Wellness Survey (NHWS) - Patient-Reported Outcomes in Brazil. 2012. Disponível em: http://www.evidencias.com.br/en/pdf/portfolio/d22eecf1434bee01e6a7f85cb8542783.pdf. Acessado em: abril de 2018.
30. Kantar Health’s National Health and Wellness Survey (NHWS) - National Health and Wellness Survey Patient-reported outcomes in Brazil. 2015. Disponível em: http://www.kantarhealth.com/docs/datasheets/kh-national-health-and-wellness-survey-brazil. Acessado em: abril de 2018.
31. NICE - National Institute for Health and Care Excellence in UK 2015. Disponível em: https://www.nice.org.uk/guidance/ta339/resources/omalizumab-for-previously-treated-chronic-spontaneous-urticariapdf-82602555773893. Acessado em: 21 de abril de 2018.
32. CADTH – Canadian Agency for Drugs and Technologies in Health. Disponível em: http://www.inahta.org/members/cadth/. Acessado em: 18 de abril de 2018.
33. PBS - Pharmaceutical Benefits Scheme of Australia 2017. Disponível em: https://www.humanservices.gov.au/organisations/healthprofessionals/enablers/severe-chronic-spontaneous-urticaria. Acessado em: 21 de abril de 2018.
34. Finlay AY, Kaplan AP, Beck LA, Antonova EN, Balp MM, Zazzali J, et al. Omalizumab substantially improves dermatology-related quality of life in patients with chronic spontaneous urticaria. J Eur Acad Dermatol Venereol. 2017;31(10):1715-21.
35. Staubach P, Metz M, Chapman-Rothe N, Sieder C, Bräutigam M, Maurer M, et al. Omalizumab rapidly improves angioedema-related quality of life in adult patients with chronic spontaneous urticaria: X-ACT study data. Allergy. 2018;73(3):576-84.