Número Atual: Janeiro-Março 2019 - Volume 3 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Avaliação de custo-efetividade e impacto orçamentário do tratamento adicional de omalizumabe em pacientes com asma alérgica grave não controlada
Cost-effectiveness and budget impact analysis of additional treatment of omalizumab in patients with severe uncontrolled allergic asthma
Flavio Sano1; Luís Felipe C. Ensina2; Norma P. Motta Rubini3; Dirceu Solé4
DOI: 10.5935/2526-5393.20190009
1. Doutor em Ciências e Chefe do Departamento de Pediatria, Hospital Nipo-Brasileiro, São Paulo, SP, Brasil
2. Doutor em Ciências e Pesquisador Associado à Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria, Escola Paulista de Medicina, Universidade Federal de São Paulo (EPM-UNIFESP), São Paulo, SP, Brasil
3. Professora Titular de Alergia e Imunologia da Escola de Medicina e Cirurgia da Universidade Federal do Estado do Rio de Janeiro (UNIRIO), RJ, Brasil
4. Professor Titular da Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria, EPM-UNIFESP, São Paulo, SP, Brasil
Endereço para correspondência:
Dirceu Solé
E-mail: alergiaimunologiareumatologia@unifesp.br
Submetido em: 15/03/2019
Aceito em: 21/03/2019
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVO: Avaliar a custo-efetividade e o impacto orçamentário da adição do omalizumabe (Oma) ao tratamento padrão [corticosteroide inalatório [CI] em dose média/alta e agente beta 2-agonista de longa ação (LABA)] no tratamento da asma alérgica grave não controlada, sob a perspectiva do sistema privado de saúde no Brasil.
MÉTODO: Na análise econômica, utilizou-se o modelo de Markov baseado na evolução da asma, considerando os seguintes desfechos clínicos: exacerbações graves clinicamente significantes (EGCS) e exacerbações não graves clinicamente significantes (ECS), além de taxa de mortalidade por asma e uso de recursos e custos com o tratamento. Calculou-se razões de custo-efetividade incremental (RCEI) e o impacto orçamentário, com base em dados da saúde suplementar sobre população elegível e horizonte de 5 anos.
RESULTADOS: A análise de custoefetividade realizada mostrou que o tratamento com Oma teve maior benefício, se comparado ao tratamento padrão, e gerou uma RCEI de R$ 60.293,00 por ano de vida salvo, que é três vezes inferior ao produto interno bruto (PIB) per capita no Brasil. A análise de sensibilidade, para avaliar o impacto da incerteza dos parâmetros sobre o resultado encontrado, demonstrou que os resultados permanecem estáveis a favor do Oma. A análise do impacto orçamentário apontou um custo por beneficiário de R$ 0,40 no primeiro ano, chegando a R$ 1,80 no quinto ano.
CONCLUSÃO: A análise econômica demonstrou que a combinação do tratamento com Oma com o padrão para asma alérgica grave não controlada é custo-efetivo no cenário nacional, e a sua incorporação na saúde suplementar é viável.
Descritores: Asma grave, omalizumabe, custo-efetividade, impacto orçamentário.
INTRODUÇÃO
A asma é doença crônica de alta prevalência, gravidade diversa, com alto impacto econômico, sendo associada a significativa morbidade e mortalidade1. Está associada a gastos com saúde, perda de lucros relacionados à morbidade e mortalidade, e também a despesas com custos diretos relativos a consultas médicas, hospitalizações, equipamentos e tratamento medicamentoso, e custos indiretos representados pelo absenteísmo no trabalho e na escola, perda de produtividade, aposentadoria precoce e morte, que juntos ocasionam grande impacto aos sistemas de saúde público e privado2.
É importante ressaltar que o custo da asma varia de acordo com a gravidade da doença2. Embora apenas 5 a 10% dos pacientes com asma a tenham na forma grave, apresentam maior morbimortalidade relativa e são responsáveis por um consumo elevado de recursos de saúde, quando comparados aos grupos de menor gravidade3. Pacientes com asma grave não controlada procuram mais as unidades de emergência médica e são hospitalizados com maior frequência em comparação aos com a forma moderada da doença3,4. Fatores como exposição ocupacional, rinossinusite, doença do refluxo gastroesofágico, aspectos psicológicos e má adesão ao tratamento podem contribuir para a gravidade da asma3.
Omalizumabe (Oma), um anticorpo monoclonal humanizado recombinante que se liga ao anticorpo IgE circulante, é uma opção terapêutica para o tratamento de asma alérgica grave em pacientes com a doença inadequadamente controlada com o tratamento padrão - corticosteroide em dose média/ alta e agente beta 2-agonista de ação longa (LABA) inalados (GINA)5. Aprovado para uso clínico em 2003, tem sido utilizado em crianças maiores de seis anos, adolescentes e adultos e demostrado diminuição na incidência de exacerbações, hospitalização por asma nestes pacientes, bem como melhorado a sua qualidade de vida6,7.
O custo elevado do Oma tem impedido a sua utilização de modo mais amplo em pacientes com asma alérgica grave não controlada com tratamento padrão. Os objetivos desse estudo foram realizar a análise de custo-efetividade e o impacto orçamentário do uso de Oma associado ao tratamento padrão versus tratamento padrão no controle da asma alérgica grave, sob a perspectiva do Sistema Privado de Saúde no Brasil.
MÉTODO
População-alvo
Pacientes com asma alérgica grave não controlada apesar do uso de tratamento com dose média/alta de CI associado a um LABA8. Optou-se por modelo que simule a progressão da asma por alguns estágios evolutivos, baseado em estados de Markov9 diretos e os desfechos de saúde envolvidos no tratamento da asma grave com Oma+CI+LABA versus CI+LABA em doses recomendadas8.
Estrutura do modelo
Empregou-se o modelo de Markov9, e os estados de saúde descritos incluíram as seguintes condições: “em tratamento da asma (sintomas diários)”, “exacerbação grave clinicamente significante (EGCS)”, “exacerbação não grave clinicamente significante (ECS)”, “morte por qualquer causa” e “morte pela exacerbação grave” (Figura 1).
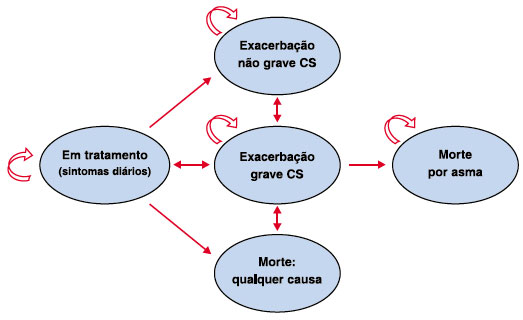
Figura 1 Estrutura do Modelo de Markov
CS = clinicamente significante.
Os pacientes iniciam o modelo no estado “em tratamento da asma (sintomas diários)” usando Oma ou tratamento padrão, dependendo do esquema proposto. Nos ciclos subsequentes, os pacientes podem mudar para outros estados de saúde ou permanecer no estado de saúde atual. Os dois níveis de exacerbação clinicamente significantes foram definidos com base em estudo prévio10. Definiu-se ECS como “piora da asma necessitando de tratamento com medicação de resgate (corticosteroide oral ou venoso)”, associado a pelo menos um dos critérios predefinidos a seguir11: (a) de 2 a 3 despertares noturnos consecutivos; (b) pico de fluxo expiratório (PFE) ou volume expiratório forçado em um segundo (VEF1) < 80% do melhor valor pessoal; (c) queda de 20% do PFE em 2 de 3 dias; (d) > 50% de aumento no uso de terapia de resgate em 2 de 3 dias; (e) outra razão clínica (específico). A EGCS foi definida como PFE/VEF1 < 60% do melhor valor pessoal em associação ao tratamento de resgate com corticosteroide, tratamento em emergência ou hospitalização.
No modelo, os pacientes transitam entre os estados de exacerbação (ECS e EGCS) e o estado em tratamento (Oma versus terapia padrão) conforme manifestem uma exacerbação e se recuperam da mesma. Os pacientes podem apresentar exacerbações em ciclos subsequentes e podem permanecer sem exacerbações em ciclos subsequentes; isto é determinado pelas probabilidades de transição. Os estados de morte são separados em morte por qualquer causa e morte relacionada à asma devido as exacerbações. O ciclo do modelo é de duas semanas, e o horizonte de tempo da análise é lifetime.
Admitiu-se que a população com asma persistente grave no Brasil é semelhante à do estudo clínico eXpeRience12, e que as diferenças clínicas entre os grupos de tratamento observadas naquele estudo também ocorreriam na população brasileira com asma persistente e que a taxa de exacerbação observada durante o estudo clínico pode ser extrapolada para o horizonte de 5 anos.
Dados de eficácia clínica
Tomando-se como base estudos anteriores, a redução da taxa de EGCS e ECS foram os principais desfechos a observar10,12.
Taxa de exacerbações
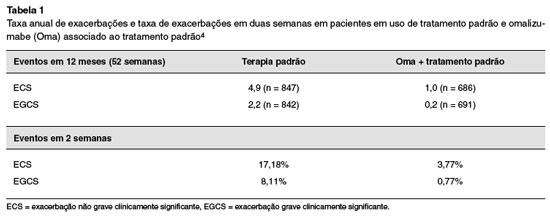
As taxas anuais de ECS e de EGCS foram baseadas no estudo clínico eXpeRience12. As probabilidades de exacerbação em duas semanas foram obtidas a partir da taxa de exacerbação anual, que foi convertida em probabilidade de exacerbação em 12 meses e, em seguida, em probabilidade de exacerbação em duas semanas (conforme a fórmula): Probabilidade de exacerbação em duas semanas = 1-(1-(1-EXP(-taxa de exacerbação em 52 semanas*1)))^(2/52); tendose como base o observado no estudo INNOVATE10 (Tabela 1).
Taxa de mortalidade por todas as causas
Morte por todas as causas foi incluída no modelo com base nos dados do Instituto Brasileiro de Geografia e Estatística (IBGE)13. Nenhuma redução na taxa de mortalidade por qualquer causa foi feita para descontar as mortes por asma.
Taxa de mortalidade por asma
Considerando a baixa taxa de mortalidade por asma e a ausência de estudos documentando este dado, o risco de morte por asma durante EGCS foi estimado ao redor de 2%12,14-18. Esse risco de morte foi aplicado, independentemente do tratamento, apenas para EGCS.
Uso de recursos e custos
Foram computados os recursos utilizados pelos pacientes, a saber: consultas médicas, visitas ambulatoriais, visitas de emergência, hospitalização, medicação de resgate e dias em centros de reabilitação. Incluiu-se também os custos com as exacerbações, com consultas de rotina e com medicamentos10. Os dois primeiros foram aplicados igualmente para ambos os grupos de tratamento, sendo a única diferença relacionada ao custo de exacerbação ocasionada por conta das diferentes taxas deste evento entre os grupos de tratamento. O custo com os medicamentos foi diferente entre os grupos, pois no braço Oma o custo deste medicamento foi adicionado ao custo do tratamento padrão. Todos os custos foram descontados à taxa de 5% ao ano.
Custo da exacerbação
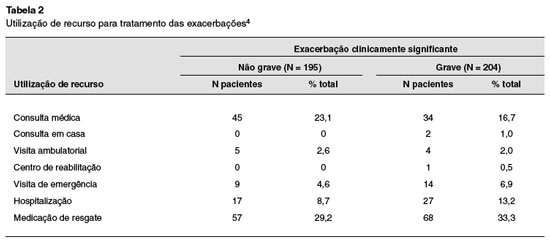
Para efetuar o cálculo dos custos com as exacerbações, tomou-se como base a utilização de recursos observada no estudo INNOVATE, admitindo-se que em média a exacerbação dura 12,5 dias10. Na Tabela 2 temos a distribuição dos pacientes segundo o recurso consumido. Assim, foi possível calcular o percentual de pacientes que utilizaram cada um dos recursos.
Para medicação de resgate considerou-se o salbutamol como agente beta 2-agonista de curta ação (SABA), empregado na dose recomendada para o tratamento da crise: Salbutamol - Aerossol 100 µg/dose: 4 a 8 inalações, por via oral, a cada 20 minutos, até 3 doses, seguido da mesma dose a cada 1 a 4 horas conforme necessário19. Consideramos 8 inalações por aplicação.
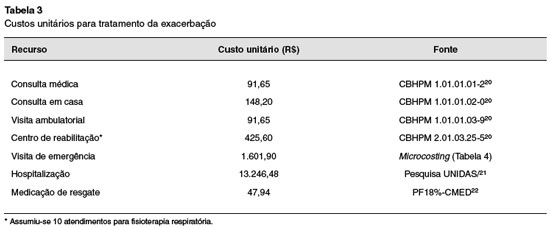
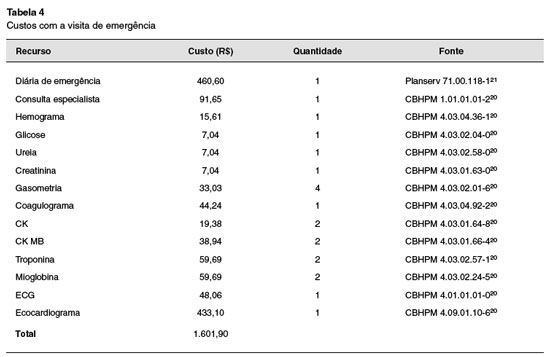
Os custos unitários de exames, procedimentos e consultas médicas foram obtidos da Classificação Brasileira Hierarquizada de Procedimentos Médicos (CBHPM) 2015 (atualização de 2018)20, e o da diária de hospitalização da Pesquisa UNIDAS de 2017 (R$ 43.311,62), considerando o tempo médio de internação de quatro dias21. O custo com medicamentos foi obtido da Câmara de Regulação do Mercado de Medicamentos (CMED), com base no preço fábrica (18% ICMS). A Tabela 3 apresenta o custo unitário de cada recurso incluído no modelo para tratamento da exacerbação. Na Tabela 4 são apresentados os custos com a ida à Urgência pela exacerbação.
A utilização de recurso foi custeada com base nos valores unitários de cada item. O custo da exacerbação foi a mesma, independentemente do tratamento que está sendo utilizado. O custo médio de uma ECS foi estimado em R$ 1.266,27, e de uma EGCS em R$ 1.899,71.
Custo com medicamento
Tratamento padrão
No tratamento padrão assumiu-se que todos os pacientes utilizam a associação corticosteroide+LABA inalados. Como muitos pacientes utilizam outros medicamentos para a asma, baseou-se na descrição das características dos pacientes à admissão no estudo clínico INNOVATE10 (Tabela 5).
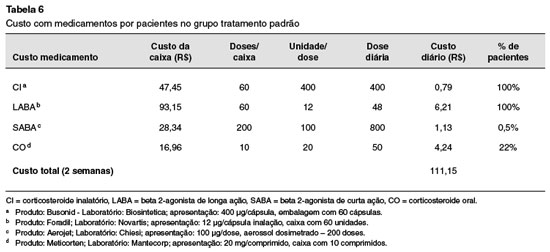
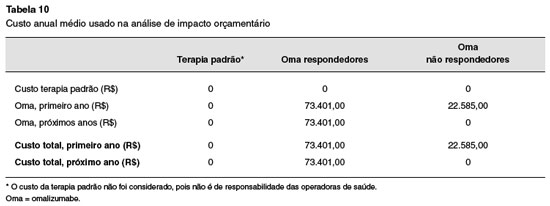
Para os dois grupos de tratamento calculou-se a média ponderada para identificar o percentual de utilização das medicações concomitantes. O custo com medicamentos foi obtido da CMED, com base no preço fábrica (PF)22. Para os medicamentos isentos de ICMS utilizou-se o Preço Máximo de Venda ao Governo (PMVG), com 0% de ICMS, e para os demais medicamentos utilizou-se o PMVG, com 18% de ICMS (Tabela 6). Os medicamentos antileucotrieno e teofilina não foram incluídos na análise. Todos estes custos referentes à terapia padrão não são arcados pelas operadoras de saúde, eles não foram considerados no caso base da análise, sendo apontado como custo zero.
Omalizumabe mais tratamento padrão
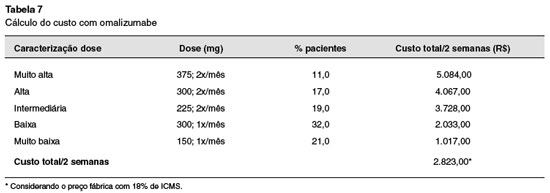
Para a determinação do custo com o Oma, empregou-se a mesma dose observada pelos estudos INNOVATE4 e eXpeRience2 (Tabela 7).
Análise de custo-efetividade
Para a análise de custo-efetividade empregou-se modelo que calcula os custos e desfechos incrementais dos dois grupos de tratamento, com base na fórmula:
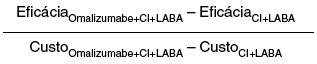
onde CustoOma+CI+LABA e CustoCI+LABA representam os custos associados ao tratamento padrão associado ao Oma e o tratamento padrão isolado, respectivamente, e EficáciaOma+CI+LABA e EficáciaCI+LABA representam os desfechos de interesse para os dois grupos.
O desfecho clínico do modelo é o número de exacerbações por paciente, e o desfecho econômico é o custo médico direto. No caso base, os custos e desfechos foram considerados para o horizonte de tempo lifetime sob a perspectiva do pagador (apenas custos médicos diretos foram considerados). Considerou-se para o horizonte de tempo 5 anos: respondedores mantêm o tratamento por esse tempo, e os não respondedores descontinuam após a 16ª semana e seguem o tratamento padrão. Todos os custos e benefícios foram descontados a uma taxa de 5% ao ano (Tabela 8).
Análise de sensibilidade
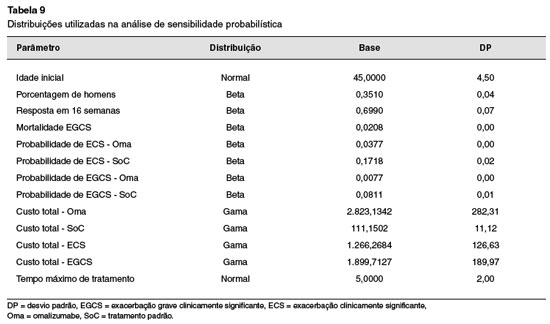
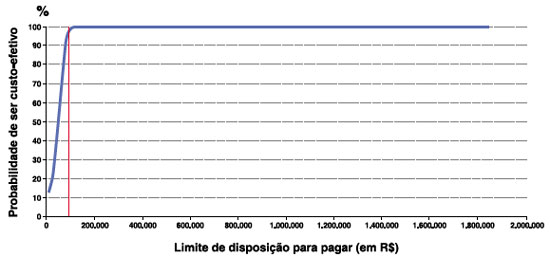
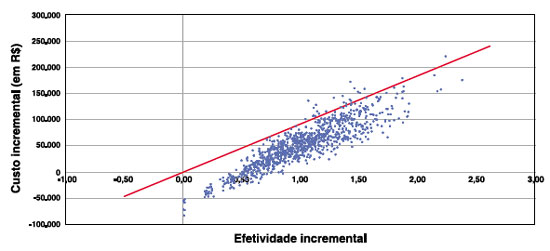
Avalia a incerteza envolvida na tomada de decisões e na identificação das variáveis que mais afetam essa incerteza. Para tanto, foi realizada a análise de sensibilidade probabilística. O modelo foi desenhado para apresentar os resultados de forma determinística (caso base) e também como um modelo probabilístico (análise de sensibilidade probabilística). Para a análise de sensibilidade probabilística a distribuição de probabilidade foi atribuída aos custos e probabilidades para refletir a incerteza associada à estimativa destes valores. Isto permitirá o cálculo do intervalo de confiança para custos e benefícios. A Tabela 9 apresenta a distribuição de probabilidade de todas as variáveis que podem ser variadas na análise de sensibilidade probabilística (Figuras 2 e 3).
Os custos unitários são variados de acordo com ter distribuição normal com um desvio padrão igual a 10% do valor médio. Considerou-se um limite de disposição a pagar de R$ 91.761,00 (três vezes o PIB per capita do Brasil), pois segundo a Organização Mundial de Saúde (OMS)23 esse valor em questão deve ser usado para se avaliar a custo-efetividade de uma intervenção.
Impacto orçamentário
O impacto orçamentário permite que o financiador consiga estimar, a partir do número de pacientes com asma alérgica persistente grave elegíveis ao tratamento com Oma, qual será a necessidade de comprometimento de recursos para viabilizar a incorporação do tratamento com este medicamento.
População elegível
A população total para o Brasil com acesso a plano de saúde no ano de 2017 foi estimada pela Agência Nacional de Saúde (ANS) em 47.118.945 habitantes24. Estimando-se que a prevalência de asma seja 10%, teríamos 4.711.895 pacientes25. Desse total, 93% (4.384.324) pertencem à faixa etária maior do que 5 anos de idade25. Este percentual de 93% foi calculado com base na quantidade de indivíduos no Brasil acima de 5 anos de idade dividido pelo total de indivíduos no Brasil26. Em termos de etiologia, 69% destes pacientes seriam classificados como tendo asma alérgica (3.025.183)27. Desse total, 19% seriam efetiva e adequadamente diagnosticados como tendo asma (premissa). Destes pacientes, 2,4% (13.795)estariam na etapa 5 do tratamento da asma, e por isso, segundo a GINA, seriam elegíveis ao uso de Oma8. Por fim, 51% destes pacientes (7.035) teriam níveis plasmáticos de IgE compatíveis (IgE ≥ 30 e IgE ≤ 1500) com a indicação para o uso do Oma28-30. Tendo em vista o número acima, teríamos um total de 7.035 pacientes que seriam potencialmente elegíveis para o uso de Oma.
Custos para análise de impacto orçamentário
Os custos médios por ano de acompanhamento foram obtidos do modelo de custo-efetividade e estão apresentados na Tabela 10, sem desconto a valor presente.
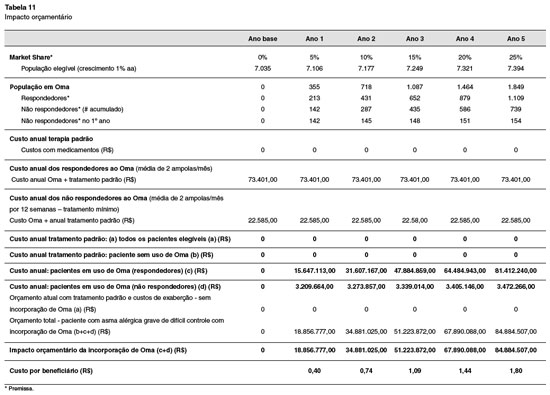
A Tabela 11 apresenta o custo total estimado no cenário atual, em que 100% dos pacientes são tratados com terapia padrão, e os custos anuais nos anos seguintes onde os pacientes passariam a ser tratados com Oma. Os custos médios anuais foram multiplicados pelo número de pacientes elegíveis ao tratamento com Oma associado ao padrão ou tratamento padrão a cada ano. Para pacientes diagnosticados no ano de 2018, foi atribuído o custo do primeiro ano de tratamento em 2018, do segundo ano de tratamento em 2019 e assim por diante, até o quinto ano de tratamento. Para pacientes diagnosticados em 2019, foi atribuído o custo do primeiro ano de tratamento em 2019, do segundo ano de tratamento em 2020, e assim por diante até o quarto ano de tratamento.
O mesmo raciocínio foi repetido para todos os anos e foram calculados os custos totais anuais para os próximos 5 anos, para cada uma das alternativas de tratamento. Considera-se, ainda, que atualmente 100% dos pacientes elegíveis são tratados com tratamento padrão e que, em um cenário futuro, Oma chegaria a 25% do mercado em 5 anos.
RESULTADOS
Na Tabela 6 são apresentados os custos com o tratamento padrão. Como cada princípio ativo possui mais de um produto disponível no Brasil, selecionouse um medicamento de referência de cada princípio ativo para servir de base para a precificação.
O custo médio do tratamento com Oma foi calculado com base no número de miligramas utilizado por paciente, considerando o aproveitamento da ampola (Tabela 7).
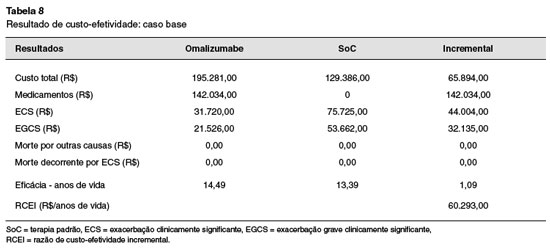
A Tabela 8 resume a relação custo-efetividade do caso base. Se considerarmos que o custo do tratamento padrão não existe (não é coberto pelas operadoras de saúde), a razão custo-efetividade incremental cai para R$ 43.726,00 por ano salvo.
As Figuras 2 e 3 apresentam a curva de aceitabilidade de custo-efetividade (Cost-effectiveness acceptability curve) e o plano de custo-efetividade incremental, respectivamente. A curva de aceitabilidade mostra para diferentes limites de disposição a pagar (eixo x) a proporção de resultados com base na análise probabilística (eixo y) que resultaram em razões de custo-efetividade incremental inferiores à disposição a pagar. O plano de custo-efetividade mostra todos os resultados incrementais de custo e benefício de cada uma das 1.000 análises rodadas pela análise probabilística, assim é possível avaliar e classificar os resultados em: Quadrante 1 (efetividade incremental > 0 e custo incremental > 0); Quadrante 2 (efetividade incremental < 0 e custo incremental > 0); Quadrante 3 (efetividade incremental < 0 e custo incremental < 0); e Quadrante 4 (efetividade incremental > 0 e custo incremental < 0). Observa-se pela figura que em 100% dos resultados Oma associado ao tratamento padrão teve um melhor benefício clínico com maior custo que o tratamento padrão isolado, e em 10,9% dos resultados Oma associado ao tratamento padrão teve um melhor benefício clínico com menor custo, sendo cost-saving.
A Tabela 11 apresenta o custo total estimado no cenário atual, em que 100% dos pacientes são tratados com tratamento padrão e os custos anuais nos anos seguintes onde os pacientes passariam a ser tratados com Oma. Importante ressaltar que o impacto orçamentário representa um custo por beneficiário de R$ 0,40 no primeiro ano, chegando a R$ 1,80 no quinto ano, considerando um total de 47.118.945 habitantes com acesso à plano de saúde no ano de 2017 (Agência Nacional de Saúde)24.
O resultado de impacto orçamentário encontrado considerou que Oma alcançaria um total de 25% de mercado em 5 anos. Uma análise complementar foi realizada considerando um cenário pior e um melhor para avaliar o impacto no resultado. Considerando que Oma alcançaria 5% de mercado em 5 anos, o impacto orçamentário cairia para R$ 16.976.901,00 ao final do quinto ano (custo por beneficiário de R$ 0,36). Considerando que o Oma alcançaria 50% de mercado em 5 anos, o impacto orçamentário aumentaria para R$ 169.769.013,00 ao final do quinto ano (custo por beneficiário de R$ 3,60).
DISCUSSÃO
As análises econômicas em saúde como, por exemplo, as análises de custo-efetividade, são ferramentas eficientes utilizadas por formuladores de políticas de saúde e financiadores de saúde para a alocação de recursos e seleção dos melhores investimentos no cenário de recursos financeiros limitados, porém, não são capazes de responder às questões específicas de financiamento para o objeto da análise.
Na avaliação da relação custo-efetividade foi empregado o modelo de Markov9. Este tipo de modelo é indicado para representar processos aleatórios que evoluem no tempo, e é particularmente útil para se modelar a evolução de doenças com recorrência de eventos, como a asma, uma vez que as exacerbações podem ser frequentes. Modelos desse tipo têm dois componentes: estrutura e parâmetros. A “estrutura” refere-se aos estados de saúde representados no modelo e as transições possíveis entre eles. Os “parâmetros” do modelo incluem os valores de probabilidades atribuídos às transições entre estados de saúde9.
Como a asma é uma doença crônica, embora a análise econômica tenha se baseado nos dados do estudo eXpeRience12, que acompanhou os pacientes por 2 anos, não é adequado analisar os desfechos desta doença apenas durante o curto período de tempo analisado no estudo. Guias de farmacoeconomia aconselham que o horizonte de tempo da análise deva ser suficiente para refletir os custos e as diferenças, em termos de benefício clínico, entre os tratamentos comparados. Uma análise de longo prazo é necessária para capturar desfechos relevantes e custos contínuos, sendo mais apropriada para doenças como a asma, onde medicações de controle são usadas no longo prazo.
De forma conservadora, assumiu-se o efeito do Oma apenas por 5 anos, após este período todos os pacientes passariam a usar apenas tratamento padrão. Supõe-se que o efeito do Oma permaneça constante ao longo dos 5 anos de tratamento e que a taxa de exacerbações futuras é independente das exacerbações que ocorreram durante os ciclos anteriores. Após 5 anos, a probabilidade de exacerbações é a mesma para todos os pacientes e, portanto, não há diferença em custo e qualidade de vida entre os tratamentos analisados.
Assumimos que a população com asma persistente grave no Brasil é semelhante à população do estudo clínico eXpeRience12, e que as diferenças clínicas entre os grupos de tratamento observadas no estudo clínico seriam também observadas na população brasileira com asma persistente grave. Também assumimos que a taxa de exacerbação observada durante o estudo clínico pode ser extrapolada para o horizonte de 5 anos. Além disso, admitimos que: a média de idade dos pacientes que entram no modelo é de 45 anos e 35,1% dos pacientes são homens, todos os pacientes usam um mix de medicamentos que é custeado como se os pacientes fossem aderentes ao tratamento. O mix de medicamentos inclui CI associado a LABA para todos, e também CO e SABA, ponderados pela proporção estimada de pacientes em uso dessas drogas no estudo clínico INOVATE, respeitando-se as doses recomendadas10,31. Os custos com exacerbações foram incluídos no modelo. Custos diferentes foram atribuídos para cada exacerbação, de acordo com sua gravidade.
Como observado no estudo eXpeRience12, o tratamento com Oma diminui o risco de exacerbação clinicamente significante e também muda a proporção de ECS e EGCS: há menos exacerbação grave clinicamente significante, assim assumiu-se que o efeito do Oma é constante durante o uso do medicamento.
Os resultados do estudo eXpeRience indicaram que 69,9% dos pacientes respondem ao tratamento (têm resposta excelente ou boa ao tratamento) com 16 semanas, e os não respondedores interrompem o tratamento com Oma e continuam o tratamento apenas com medicação padrão ao longo do resto do modelo. O tratamento com Oma é usado por no máximo 5 anos. Após esse período, todos os pacientes têm os custos e desfechos referentes ao tratamento com terapia padrão.
Devido à pequena prevalência de morte por asma, o curto período de tempo dos estudos clínicos e a melhora global da saúde dos pacientes que participam de estudos clínicos, não há dados disponíveis em estudos clínicos que evidenciem o efeito do tratamento com Oma em eventos fatais. A observação de eventos fatais em estudos com Oma é improvável devido aos cuidados de acompanhamento como 2/4 visitas médicas por semana para administração do placebo ou Oma. Tough e colaboradores descobriram que os indivíduos que morrem por asma são mais propensos a terem tido asma grave com sintomas noturnos, terem necessitado ressuscitação cardiopulmonar ou intubação, maior utilização dos recursos de saúde no ano anterior, e maior utilização de medicação15.
Os dados clínicos de Oma demonstraram redução significante nos preditores de eventos fatais14,16. Uma metanálise de sete estudos com um total de mais de 4.300 pacientes com asma alérgica moderada e grave encontrou redução significativa no número de exacerbações, taxa de visita de emergência, hospitalização e visitas não programadas14. O GINA sugere que a existência de exacerbação com risco de vida e admissão hospitalar no ano anterior são fatores associados com aumento do risco de morte por asma. Assim, incluímos um risco de morte por asma em pacientes com exacerbação8.
Identificamos na literatura a taxa de letalidade por asma em pacientes com EGCS15. Este estudo estimou o impacto de um serviço de ambulância ao invés do paciente ir por conta própria à consulta médica ou visita de emergência, um alto padrão de cuidado em comparação ao que temos hoje. Duzentos e quarenta pacientes com asma foram incluídos. Ao longo do estudo foram relatadas 367 exacerbações, sendo que 351 foram moderadas (158-45%) ou graves (193-55%). Seis pacientes morreram devido a uma exacerbação. Então, a taxa de letalidade associada a exacerbação grave clinicamente significante foi estimada em 3,1%.
Além disso, dados de um estudo de registro de internações do Reino Unido25 observou ser 2,48% a probabilidade de morte associada à asma aguda grave entre os pacientes internados com asma aguda grave com de 45 anos ou mais, refletindo a idade da população do estudo eXpeRience12. Este risco de morte engloba pacientes com asma que vão para o hospital, e não incluem as mortes que ocorrem na comunidade. Por fim, Dewilde e colaboradores relataram que a taxa de letalidade por exacerbação grave clinicamente significante é de 2,1%18. Esse risco de morte foi aplicado, independentemente do tratamento, apenas para exacerbação grave clinicamente significante.
É importante ressaltar que há já sólida evidência em favor dos benefícios do Oma como tratamento adicional ao padrão, tanto para crianças quanto para adolescentes e adultos, incluindo estudos de longo prazo, em uma etapa do tratamento em que poucas alternativas terapêuticas com perfil adequado de segurança e acúmulo de evidências clínicas de eficácia estão disponíveis.
De acordo com a revisão de estudos econômicos, a adição de Oma ao tratamento padrão foi associado a melhora nos desfechos clínicos; contudo, para alguns dos cenários avaliados, os resultados não se mostraram custo-efetivos.
A análise de custo-efetividade realizada mostrou que o tratamento com Oma tem maior benefício comparado ao tratamento padrão e gerou uma razão de custo-efetividade incremental (RCEI) de R$ 60.293,00 por ano de vida salvo.
Análise de sensibilidade também foi desenvolvida para avaliar o impacto da incerteza dos parâmetros sobre o resultado encontrado, e demonstraram que os resultados permanecem estáveis a favor do Oma.
A análise de impacto orçamentário estimou qual será a necessidade de comprometimento de recursos para viabilizar a incorporação do tratamento com Oma. Foi estimado um impacto anual de R$ 18 milhões no primeiro ano após a incorporação, considerando a prevalência estimada de asma alérgica persistente moderada a grave e uma população elegível ao uso do tratamento de 7.035 pacientes por ano.
Concluindo, as análises econômicas em saúde são ferramentas eficientes para suporte à alocação de recursos para formuladores de políticas de saúde e financiadores do Sistema Privado de Saúde Brasileiro, pois oferecem projeções no longo prazo. A contribuição deste modelo econômico, que utilizou dados de custos e padrões de tratamento da prática médica local, é auxiliar aos formuladores de políticas de saúde e gestores de saúde na tarefa de estimar o impacto no orçamento do uso de Oma no tratamento da asma alérgica persistente moderada a grave, e avaliar a viabilidade da sua incorporação.
REFERÊNCIAS
1. Cerci Neto A, Franco O, Filho F, Bueno T. Exemplos brasileiros de programas de controle de asma. J Bras Pneumol. 2008;34(2):103-6.
2. Serra-Batlles J, Plaza V, Morejón E, Comella A, Brugués J. Costs of asthma according to the degree of severity. Eur Respir J. 1998;12(6):1322-6.
3. Ministério da Saúde (Brasil). Portaria no 1.317 de 2013: Aprova o Protocolo Clínico e Diretrizes Terapêuticas da Asma. Brasília: Ministério da Saúde; 2013. p. 6.
4. Ponte E, Franco RA, Souza-Machado A, Souza-Machado C, Cruz ÁA. Impacto de um programa para o controle da asma grave na utilização de recursos do Sistema Único de Saúde. J Bras Pneumol. 2007;33(1):15-9.
5. Thomson NC, Chaudhuri R. Omalizumab: clinical use for the management of asthma. Clin Med Insights. 2011;6(1):27-40.
6. Novartis Biociências S.A. Xolair (omalizumabe) [Bula]. 2015. p. 1-13.
7. Lai T, Wang S, Xu Z, Zhang C, Zhao Y, Hu Y, et al. Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma: A systematic review and meta-analysis. Sci Rep. 2015;5:8191.
8. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention - Updated 2018 [Internet]. 2018. p. 162. Disponível em: http://www.ginasthma.org/. Acessado em: em maio de 2018.
9. Sato RC, Zouain DM. Modelos de Markov aplicados à saúde. Einstein. 2010;8(3 Pt 1):376-9.
10. Humbert M, Beasley R, Ayres J, Slavin R, Hébert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60(17):309-16.
11. Busse W, Corren J, Lanier B, McAlary M, Fowler-Taylor A, Cioppa G, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108:184-90.
12. Braunstahl GJ, Chen CW, Maykut R, Georgiou P, Peachey G, Bruce J. The eXpeRience registry: The “real-world” effectiveness of omalizumab in allergic asthma. Respir Med. 2013;107(8):1141-51.
13. Instituto Brasileiro de Geografia e Estatítica (IBGE). Instituto Brasileiro de Geografia e Estatística (IBGE) [Internet]. Disponível em: http://www.ibge.gov.br/home/
14. Bousquet J, Cabrera P, Berkman N, Buhl R, Holgate S, Wenzel S, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy. 2005;60(20):302-8.
15. Tough SC, Hessel PA, Ruff M, Green FH, Mitchell I, Butt JC. Features that distinguish those who die from asthma from community controls with asthma. J Asthma. 1998;35(8):657-65.
16. Holgate S, Bousquet J, Wenzel S, Fox H, Liu J, Castellsague J. Efficacy of omalizumab, an anti-immunoglobulin E antibody, in patients with allergic asthma at high risk of serious asthma-related morbidity and mortality. Curr Med Res Opin. 2001;17(4):233-40.
17. Löwhagen O, Ekström L, Holmberg S, Wennerblom B, Rosenfeldt M. Experience of an emergency mobile asthma treatment programme. Resuscitation. 1997;35(3):243-7.
18. Dewilde S, Turk F, Tambour M, Sandström T. The economic value of anti-IgE in severe persistent, IgE-mediated (allergic) asthma patients: adaptation of INNOVATE to Sweden. Curr Med Res Opin. 2006;22:1765-76.
19. Ministério da Saúde (Brasil). Relação nacional de medicamentos essenciais: RENAME. Série B. Textos Básicos de Saúde. Brasília: Ministério da Saúde; 2010. 250 p.
20. CBHPM - Classificação Brasileira Hierarquizada de Procedimentos Médicos 2016. Custos dos procedimentos sob a perspectiva da Saúde Suplementar. Disponível em: http://amb.org.br/formulariocbhpm-pessoa-juridica-fisica/. Acessado em: 10 de abril de 2018.
21. Costa E, Caetano R, Werneck GL, Bregman M. Estimativa de custo da asma em tratamento ambulatorial: estudo com dados de mundo real. Rev da Saúde Pública. 2018;52:27.
22. Ministério da Saúde (Brasil). Agência Nacional de Vigilância Sanitária (Anvisa). Câmara de Regulação do Mercado de Medicamentos (CMED). Disponível em: http://portal.anvisa.gov.br/cmed
23. Organização Mundial de Saúde (OMS) [Internet]. Disponível em: http://www.who.int/choice/costs/CER_thresholds/en/index.html. Acessado em: outubro de 2018.
24. Ministério da Saúde (Brasil). Agência Nacional de Saúde Suplementar (ANS). Portal Agência Nacional de Saúde Suplementar (ANS) [Internet]. Disponível em: http://www.ans.gov.br/. Acessado em: maio de 2018.
25. Brazilian Society of Pneumology and Tisiology. [IV Brazilian Guidelines for the management of asthma]. J Bras Pneumol. 2006;32(Supl. 7):s447-74.
26. The ENFUMOSA Study Group. The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. European Network for Understanding Mechanisms of Severe Asthma.Eur Respir J. 2003 Sep;22(3):470-7.
27. Hoskins G, McCowan C, Neville RG, Thomas GE, Smith B, Silverman S. Risk factors and costs associated with an asthma attack. Thorax. 2000;55(1):19-24.
28. Omalizumab is an effective add-on therapy in moderate-to-severe allergic asthma. Drugs Ther Perspect. 2005;21:1-4.
29. Official reprint from UpToDate® www.uptodate.com ©2017 UpToDate®. 2017. p. 1–20.
30. Dolan CM, Fraher KE, Bleecker ER, Borish L, Chipps B, Hayden M Lou, et al. Design and baseline characteristics of The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens (TENOR) study: a large cohort of patients with severe or difficultto- treat asthma. Ann Allergy, Asthma Immunol. 2004;92(1):32-9.
31. GlaxoSmithKline Brasil Ltda. Serevent Spray (xinafoato de salmeterol) [Bula]. Rio de Janeiro; p. 1-12.