Número Atual: Outubro-Dezembro 2018 - Volume 2 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
PET-CT como biomarcador da mastocitose sistêmica agressiva
PET-CT as a biomarker of the aggressive systemic mastocytosis
Henrikki Gomes Antila; Laís Souza Gomes; Grazielly de Fatima Pereira; Iandra Leite Perez; Danilo Gois Gonçalves; Rafael Bonamichi-Santos; Jorge Kalil; Pedro Giavina-Bianchi
DOI: 10.5935/2526-5393.20180064
Faculdade de Medicina da Universidade São Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - São Paulo, SP
Endereço para correspondência:
Pedro Giavina-Bianchi
E-mail: pbianchi@usp.br
Submetido em: 27/09/2018
Aceito em: 29/09/2018
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Relato de caso ilustrando como a tomografia computadorizada por emissão de pósitrons (PET-CT) pode ser um biomarcador dos casos agressivos de mastocitose.
Descritores: Tomografia computadorizada por emissão de pósitrons (PET-CT), mastociose sistêmica agressiva, biomarcadores.
INTRODUÇÃO
Os mastócitos são células provenientes de células hematopoiéticas que estão presentes na maioria dos tecidos. São estimulados pelo fator de célula tronco através de seu receptor transmembrânico tipo tirosinaquinase (KIT - CD117). Os mastócitos são os principais efetores da fase imediata das reações de hipersensibilidade tipo-I, sendo ativados principalmente pela exposição aos alérgenos, que promovem ligação cruzada entre duas moléculas de IgE específicas, previamente ligadas a seu receptor de alta afinidade (FcεRI)1.
A mastocitose é definida como uma expansão clonal anormal de mastócitos e seu acúmulo em diversos tecidos, como a medula óssea e a pele. A prevalência exata dessa doença é desconhecida, mas é estimada em 1 a cada 10.000 pessoas. É dividida primariamente em cutânea e sistêmica. A primeira, mais comum, previamente chamada de urticária pigmentosa, pode ser dividida em formas maculopapular monomórfica ou polimórfica, cutânea difusa e mastocitoma. A forma sistêmica é mais rara, sendo classificada em quatro subtipos: indolente, associada a neoplasia hematológica, agressiva e leucêmica (Tabela 1)2.

A forma sistêmica agressiva é caracterizada por lesão orgânica com repercussão clínica em decorrência do infiltrado mastocitário1. Em um estudo com 342 pacientes adultos com mastocitose sistêmica, esta foi a terceira mais comum das apresentações sistêmicas, representando 12% dos casos. Não existem ferramentas bem estabelecidas para acompanhamento dessa doença e avaliação de resposta terapêutica. A tomografia computadorizada por emissão de pósitrons (PET-CT) é utilizada amplamente em doenças linfoproliferativas com esses objetivos, mas não existem muitos estudos da sua utilidade em pacientes com mastocitose sistêmica4,5.
RELATO DE CASO
Paciente feminina de 54 anos, há 12 anos com história de manchas hipercrômicas difusas pelo corpo (Figura 1), que se tornam eritematosas após fricção da lesão, ou após outros estímulos como estresse e infecções, associadas a prurido difuso importante. Realizou-se tratamento para pitiríase versicolor, sem sucesso ou mudança do quadro. Há oito anos, paciente iniciou clínica de astenia e dor em membros inferiores, sendo então diagnosticada com anemia, não realizando, no entanto, tratamento específico. Há três anos, paciente evoluiu com diarreia crônica, apresentando 4 a 5 episódios por dia, com piora ao estresse e associada a perda ponderal de 22 kg em 1 ano. Apresentou também piora das dores em membros inferiores, principalmente em membro inferior esquerdo, refratária a analgésicos comuns.
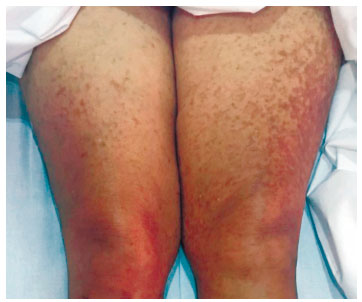
Figura 1 Máculas eritêmato-acastanhadas
Paciente então foi investigada com biópsia e aspirado de medula óssea, colonoscopia, cintilografia óssea e triptase. Os exames iniciais mostraram triptase sérica maior que 200 ng/mL (nl: 11,5 ng/mL), biópsia de medula óssea mostrando agregados mastocitários (mais de 15 células) e presença de mastócitos fusiformes atípicos, CD25 positivos. Na colonoscopia também foram evidenciados agregados mastocitários com mais de 15 mastócitos por campo de grande aumento, em mais de uma biópsia, em locais diferentes do intestino. Já na cintilografia óssea, foi visualizado acometimento ósseo difuso. Com esses achados, confirmou-se o diagnóstico de mastocitose sistêmica agressiva (MSA) conforme critérios da OMS2 e indicada terapia citorredutora, além de anti-histamínicos, inibidor de bomba de próton e analgésicos mais potentes.
Optado por tratamento com imatinibe 400 mg ao dia por 6 meses, sendo suspenso por indisponibilidade da medicação e ausência de melhora do quadro clínico. Realizada troca para Interferon alfa 2a ou 2b 3 milhões de unidades, três vezes por semana. Paciente evoluiu com melhora dos sintomas cutâneos, das dores ósseas e da diarreia crônica, apresentando ainda ganho de peso. No entanto, manteve pancitopenia, evoluindo com necessidade frequente de suporte transfusional por anemia e plaquetopenia.
Foi realizada nova investigação para avaliar extensão da doença. Optado por nova avaliação de medula óssea e realizado PET-CT. A biópsia de medula óssea caracterizou-se como paucicelular, não sendo identificados mastócitos na amostra ou a mutação no gene c-KIT. O PET-CT com análogo da glicose (18FDG) mostrou aumento do metabolismo glicolítico em linfonodos e linfonodomegalias supra e infradiafragmáticas, lesões ósseas líticas de permeio, mais evidente nos tornozelos e lesão lítica de maior extensão localizando-se no ílio direito, e esplenomegalia com inversão do metabolismo hepatoesplênico (Figura 2).
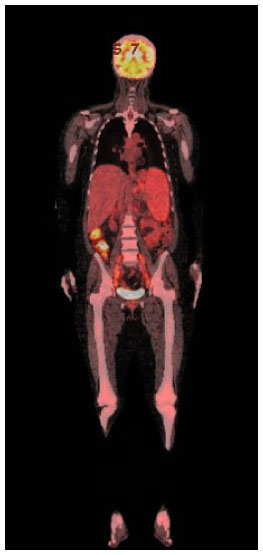
Figura 2 Tomografia computadorizada por emissão de pósitrons (PET-CT)
Através dos resultados dos exames, foi interpretado que a paciente ainda apresenta atividade da doença, sendo então necessária alteração da terapia citorredutora, além da manutenção do suporte transfusional. A opção disponível no Brasil é a cladribina (um quimioterápico utilizado em tricoleucemia) e a midostaurina, um inibidor da multiquinase PKC412, que ainda não está disponível no país para tratamento de MSA.
DISCUSSÃO
O diagnóstico de mastocitose sistêmica é feito pela presença de um critério principal e um critério secundário ou três critérios secundários. O critério principal é a presença de agregados com mais de 15 mastócitos na medula óssea, ou outro órgão extracutâneo (como trato gastrointestinal, linfonodos, fígado ou baço). Os critérios secundários são: morfologia atípica (fusiforme) em mais de 25% dos mastócitos na medula óssea ou órgãos extracutâneos; mutação do gene c-KIT (em 90-95% das vezes - D816V); mastócitos que expressam CD2, CD25 ou ambos; e triptase sérica maior que 20 ng/mL (Tabela 2)2.
Para realizar o diagnóstico de MSA, além dos critérios de mastocitose sistêmica, o paciente precisa apresentar os Achados-B (hepatomegalia, esplenomegalia e linfonodomegalia) e os Achados-C, que são alterações funcionais em órgãos afetados pela invasão mastocitária, como citopenias, alteração de função hepática, hiperesplenismo, síndrome de máabsorção e fraturas patológicas (Tabela 3)2.
A avaliação por PET-CT da mastocitose sistêmica é pouco estudada e apresenta um pequeno número de pacientes avaliados, principalmente na diferenciação de mastocitose sistêmica indolente da forma agressiva4,5. No caso objeto deste relato, o PET-CT constatou alterações ósseas, esplenomegalia e linfonodomegalia com aumento do consumo de glicose, que pode ser compatível com atividade da doença, no entanto, não sendo possível estabelecer a distinção desse padrão com outras doenças linfoproliferativas.
O tratamento da MSA envolve o controle dos sintomas apresentados como prurido, manifestações gastrointestinais e dor óssea, o suporte transfusional e a terapia citorredutora2,6. Atualmente está disponível como primeira linha o imatinibe, no entanto, este apresenta efeito limitado a uma pequena parcela dos pacientes com ausência da mutação no kit D816V. Outras alternativas incluem o uso de interferon alfa e cladribina; entretanto, o tratamento mais promissor é com novos inibidores multiquinase, como a midostaurina7,8, que demonstrou bons resultados nos ensaios clínicos e recentemente aprovada pela ANVISA para arsenal terapêutico da leucemia mieloide aguda.
Diante do que foi exposto, é importante ressaltar a necessidade de realizar o diagnóstico diferencial das mastocitoses cutâneas com os quadros sistêmicos, principalmente da forma agressiva que apresenta tratamento diferenciado. É possível que num futuro próximo, com acesso a midostaurina como uma nova forma de controle da doença, a mastocitose sistêmica agressiva tenha melhor prognóstico, inclusive com redução da mortalidade. Novos estudos, com um maior número de pacientes, poderão confirmar o uso do PET-CT como um biomarcador na mastocitose sistêmica, avaliando a extensão do comprometimento dos pacientes e a resposta terapêutica.
REFERÊNCIAS
1. Theoharides TC, Valent P, Akin C. Mast Cells, Mastocytosis, and related disorders. N Engl J Med. 2015;373(2):163-172. doi:10.1056/ NEJMra1409760.
2. Valent P, Akin C, Metcalfe DD. Review Article Mastocytosis: 2016 updated WHO classification and novel emerging treatment concepts. Blood. 2017;129(11):1420-8. doi:10.1182/blood-2016-09-731893. effective.
3. Lim KH, Tefferi A, Lasho TL, Finke C, Patnaik M, Butterfield JH, et al. Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors Systemic mastocytosis in 342 consecutive adults: survival studies and prognostic factors. Blood. 2009 Jun 4;113(23):5727-36.
4. Djelbani-Ahmed S, Chandesris MO, Mekinian A, Canioni D, Brouzes C, Hanssens K, et al. FDG-PET/CT findings in systemic mastocytosis: a French multicentre study. Eur J Nucl Med Mol Imaging. 2015;42(13):2013-20. doi:10.1007/s00259-015-3117-3.
5. Tomihama RT, McEachen JC, Kuo PH. Imaging of systemic mastocytosis by FDG-PET/CT demonstrates increased activity in cortical bone. Clin Nucl Med. 2008;33(3):220-3. doi:10.1097/RLU.0b013e3181638e5e.
6. Valent P, Akin C, Hartmann K, Nilsson G, Reiter A, Hermine O, et al. Advances in the classification and treatment of mastocytosis: Current status and outlook toward the future. Cancer Res. 2017;77(6):1261-70.
7. Stone RM, Manley PW, Larson RA, Capdeville R. Midostaurin: its odyssey from discovery to approval for treating acute myeloid leukemia and advanced systemic mastocytosis. Blood Adv. 2018;2(4):444-53. doi:10.1182/bloodadvances.2017011080.
8. Gotlib J, Kluin-Nelemans HC, George TI, Akin C, Sotlar K, Hermine O, et al. Efficacy and Safety of Midostaurin in Advanced Systemic Mastocytosis. N Engl J Med. 2016;374(26):2530-41. doi:10.1056/NEJMoa1513098.





