Número Atual: Outubro-Dezembro 2018 - Volume 2 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Alergia alimentar e a ácaros em crianças com dermatite atópica
Food and dust mite allergy in children with atopic dermatitis
Simone Nabuco Senna1; Livia Isabela Oliveira2; Luiza Delfim1; Marlecy Will1; Wilson Rocha Filho1
DOI: 10.5935/2526-5393.20180060
1. Hospital Infantil João Paulo II e Hospital Felício Rocho, Serviço de Alergia de Pneumologia Pediátrica - Belo Horizonte, MG
2. Residente do Hospital Infantil João Paulo II e Hospital Felício Rocho, Serviço de Alergia de Pneumologia Pediátrica - Belo Horizonte, MG
Endereço para correspondência:
Livia Isabela Oliveira
E-mail: livia_isabelaoliveira@yahoo.com.br
Submissão em: 12/12/2018
Aceite em: 18/12/2018
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
OBJETIVO: Avaliar a incidência de alergia alimentar e a ácaros em crianças com dermatite atópica acompanhadas no ambulatório de alergia alimentar, em um hospital público de Belo Horizonte.
MÉTODOS: Foram selecionadas, prospectivamente, crianças com dermatite atópica acompanhadas no nosso serviço e que preenchiam os critérios diagnósticos de Hanifin e Lobtiz, independente da sua gravidade. Pacientes foram submetidos a teste alérgico por punctura para alimentos, D. farinae, D. pteronyssinus e B. tropicalis. Crianças com teste alérgico positivo para um ou mais alimentos foram submetidas a teste de provocação duplo-cego placebo controlado para o alimento suspeito, seguindo critérios previamente estabelecidos pela American Academy of Allergy, Asthma and Immunology (AAAAI).
RESULTADOS: Um total de 56 crianças foram avaliadas com idade média de 5 anos; 27 (48,2%) do sexo masculino, e 29 (51,8%) do sexo feminino. Teste alérgico para alimentos foi positivo em 33 pacientes (58,9%), e, destes, 8 (24,2%) tiveram o teste de provocação duplo-cego placebo controlado positivo para o alimento suspeito. A incidência de alergia alimentar na população estudada foi de 14,3%. Teste alérgico positivo para ácaros ocorreu em 30 pacientes, que corresponde a 53,6% da população estudada.
CONCLUSÃO: Segundo o nosso estudo, a incidência de alergia alimentar nas crianças com dermatite atópica foi de 14,3%. Leite e ovo foram os únicos alimentos relacionados com dermatite atópica neste estudo. Teste alérgico para inalantes foi positivo para Dermatofagoide em 53,6% destes pacientes.
Descritores: Dermatite atópica, hipersensibilidade alimentar, ácaros, pediatria.
INTRODUÇÃO
Dermatite atópica (DA) é uma dermatose inflamatória crônica, recidivante, comum na infância, com períodos de exacerbação, remissão e acalmia. É caracterizada por erupção papulovesicular, eritematosa, com prurido intenso e que frequentemente precede rinite alérgica e/ou asma. Com etiopatogenia complexa e multifatorial, recentes estudos têm demonstrado inter-relação de fatores genéticos, ambientais, farmacológicos, psicológicos e imunológicos, contribuindo para seu desenvolvimento e gravidade1,2. Achados laboratoriais sugerem alterações de linfócitos T helper (TH2), aumento de interleucina 4 (IL-4), IL-5, IL-2, eosinófilos, basófilos, ativação de mastócitos com liberação de histamina e aumento nos níveis séricos de IgE nesta complexa patogenia1.
Apresenta distribuição clínica peculiar e variável de acordo a faixa etária. Mais de 85% dos pacientes apresentam as manifestações clínicas iniciais nos primeiros 5 anos de vida, afeta de 10 a 20% das crianças nos países desenvolvidos, e estimase que corresponda a 1% de todas as consultas pediátricas3-5. A duração da doença é variável, com regressão clínica frequente entre a idade escolar e a adolescência. Muitos estudos realizados com membros de uma mesma família têm demonstrado que a dermatite atópica tem um caráter hereditário. Recentemente, novas tecnologias de sequenciamento genético proporcionaram a identificação de genes associados à dermatite atópica, sendo mutações ligadas ao gene da filagrina as mais estudadas5. Quanto aos antecedentes familiares, se um dos pais for afetado, o risco da criança desenvolver alguma forma de atopia varia de 50 a 60%, podendo se elevar para 80% se pai e mãe forem atópicos6,7.
Estudos mostram que fatores ambientais, como aeroalérgenos e antígenos alimentares, estariam envolvidos com a expressão e exacerbação da doença, e mecanismos IgE-mediados nos ajudam na compreensão desta inter-relação8-10. O objetivo deste estudo foi avaliar a incidência de alergia alimentar e a ácaros em crianças brasileiras portadoras de dermatite atópica.
MATERIAIS E MÉTODOS
Trata-se de um estudo prospectivo, realizado no período de um ano. Estavam elegíveis para o estudo crianças atendidas no nosso serviço com diagnóstico de dermatite atópica, segundo os critérios de Hanifin e Lobtiz11, independente da sua gravidade. Após obter termo de consentimento assinado pelos pais, os pacientes eram submetidos a teste alérgico por punctura com os seguintes antígenos: leite de vaca, ovo, soja, trigo, peixe, amendoim, Dermatophagoides pteronyssinus, Dermatophagoides farinae e Blomia tropicalis.
Crianças com teste alérgico positivo ou com teste cutâneo negativo mas com história fortemente sugestiva de alergia alimentar foram submetidas a teste de provocação duplo-cego, placebo controlado (TPDCPC) para o alimento suspeito, seguindo critérios previamente estabelecidos pela American Academy of Allergy, Asthma and Immunology (AAAAI)12. Foram excluídas crianças com história sugestiva de reação anafilática ao alimento suspeito.
RESULTADOS
Dos 56 estudados, 27 (48,2%) eram do sexo masculino e 29 (51,8%) do sexo feminino; a média de idade foi de 5 anos (Tabela 1). Trinte e três crianças (58,9%) apresentaram teste alérgico positivo para alimentos, e destas, 8 (24,2%) tiveram o teste de provocação duplo-cego placebo controlado positivo para o alimento suspeito. Observou-se, então, uma incidência de alergia alimentar de 14,28% nas crianças estudadas, sendo que leite e ovo foram os únicos alimentos relacionados com dermatite atópica neste estudo. Teste alérgico positivo para ácaros ocorreu em 30 pacientes, que corresponde a 53,6% da população estudada (Tabela 2 e Figura 1).
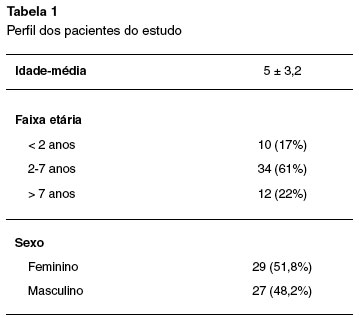
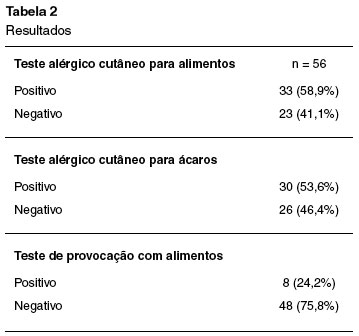
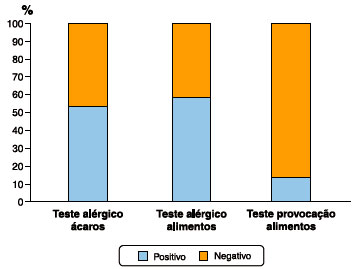
Figura 1 Teste alérgico positivo para ácaros ocorreu em 53,6% da população estudada.Teste alérgico para alimentos foi positivo em 58,9% dos pacientes, e 14,3% dos pacientes tiveram o teste de provocação duplo-cego placebo controlado positivo para o alimento suspeito
DISCUSSÃO
A dermatite atópica (DA) é uma doença inflamatória crônica da pele, recorrente e altamente pruriginosa, acarretando em morbidade significativa para o paciente e sua família. Afeta a qualidade de vida, acarretando absenteísmo escolar e alteração na qualidade do sono.
O termo dermatite atópica foi introduzido em 1930, quando foi reconhecida sua associação com alergia respiratória e o papel da exposição aos alérgernos na exacerbação da doença. Dentre os alérgenos ambientais, o ácaro da poeira doméstica apresenta maior destaque na exacerbação da doença, participando como indutor da resposta inflamatória tanto na fase imediata (estimulando a síntese de IgE), como na fase tardia (com proliferação de linfócitos), comprovada por positividade de testes de contato13. Em nosso estudo, este dado também é observado, estando a alergia a dermatofagoide presente em 53,6% das crianças estudadas, havendo, então, concordância com a literatura. A inalação de alérgenos exacerba as lesões da DA, e as queixas dos pacientes com DA diminuem nos ambientes em que haja redução do nível de ácaros da poeira, revelando a importância dos alérgenos inalantes14. Os aeroalérgenos mais comumente relacionados à DA são derivados de ácaros da espécie D. pteronyssinus e D. farinae. Também a exposição ao mofo e ambiente úmido foi associada a aumento do risco de eczema15,16. Estudo em crianças entre 2 e 15 anos de idade com DA verificou que os com reatividade intensa aos ácaros em teste cutâneo de leitura imediata (TCLI) apresentavam maior SCORAD (Scoring atopic dermatitis), e os pacientes com teste de contato positivo aos ácaros apresentaram, em geral, maiores parâmetros de SCORAD30.
A verdadeira relação entre dermatite atópica e alergia alimentar já foi tema de muitos estudos, no entanto, divergências ocorrem neste âmbito. Dermatologistas americanos renomados alegam que alergia alimentar afeta somente uma minoria de pacientes com dermatite atópica18, porém, vários outros estudos têm sedimentado a coerência da relação entre alergia alimentar e dermatite atópica. Hanifin estimou que somente 10% das crianças com dermatite atópica teria alergia alimentar contribuindo para sua doença2. Eigenman e cols. demostraram que alergia alimentar era a causa ou o fator agravante da dermatite atópica moderada a grave em 37% das crianças19. Oehling e cols. e Sampson também descrevem bem esta relação, demonstrando que ovo, leite, amendoim, soja e trigo perfizeram 75% de positividade entre os alimentos testados e dermatite atópica20,21. Sampson relatou ainda que 74% das crianças com dermatite atópica melhoraram seus sintomas quando houve mudanças alimentares rigorosas21.
Estima-se que um terço das DA moderadas a graves sejam associadas a alergia alimentar. A sensibilização ao alimento habitualmente ocorre pelo trato gastrintestinal, porém a via cutânea também já foi comprovada. Estudos longitudinais documentam que 15% dos lactentes com DA leve a moderada desenvolveram alergia alimentar. Metanálise recente confirmou forte associação entre DA, sensibilização para alérgenos alimentares e alergia. Os alimentos mais apontados na alergia alimentar, entre indivíduos com DA, têm sido ovo, leite e amendoim, e os dados nacionais são escassos3,4.
Os mecanismos pelos quais os alimentos levam à piora da dermatite atópica relacionam-se a um estímulo contínuo na pele através da produção constante de IgE específica, com perpetuação da lesão. Têm sido descritas alterações na permeabilidade intestinal destes pacientes, o que facilitaria a penetração do alérgeno.
O papel da hipersensibilidade mediada por IgE ajuda a esclarecer algumas destas dúvidas, e é fundamental para compreensão de tal atopia: IgE total sérica se encontra elevada em aproximadamente 90% das crianças com dermatite atópica23; a maioria das crianças apresenta teste alérgico positivo para alimentos e aeroalérgenos; 2/3 das crianças possui história familiar positiva para alergia24,25; e 50 a 80% delas desenvolvem rinite alérgica e/ou asma2. Há autores que correlacionam estes títulos de IgE com a gravidade das manifestações clínicas, porém, tal fato ainda não está bem definido26-29. Indivíduos atópicos em contato com o alérgeno produzem IgE, a qual sensibiliza os mastócitos locais com liberação de histamina. IgE sérica liga-se, também, aos basófilos circulantes e mastócitos teciduais, desencadeando reação sistêmica11,30,31.
Além de uma história clínica detalhada, os testes cutâneos e avaliação laboratorial (com pesquisa de IgE específica) são utilizadas na investigação etiológica da dermatite atópica. O teste de provocação oral duplo-cego placebo controlado é tido como padrão ouro para o diagnóstico de alergia alimentar, porém devemos lembrar que reações clínicas graves a certos alimentos como anafilaxia contraindicam a realização deste.
Observamos, então, neste presente estudo, que há relação entre dermatite atópica, hipersensibilidade alimentar e sensibilização à ácaros. Consequentemente, evitar tais alérgenos é importante no controle da doença19. Porém, os estudos ainda são controversos quanto à incidência da alergia alimentar em pacientes com dermatite atópica. Novos trabalhos com metodologia diagnóstica adequada na detecção da alergia alimentar ainda são necessários.
CONCLUSÃO
A incidência de alergia alimentar em pacientes com dermatite atópica foi de 14,8%, e alergia a dermatofagoide estava presente em 53,6% da população estudada. Leite e ovo foram os únicos alimentos relacionados com dermatite atópica neste estudo.
REFERÊNCIAS
1. Leung DYM. Atopic dermatitis: new insights and apportunities for therapeutic intervention. J Allergy Clin Immunol. 2000;105:860-76.
2. Hanifin JM, Cooper KD, Kang S, Krafchik BR, Margolis DJ, Schachner LA, et al. Guidelines of Care for Atopic Dermatitis. J Am Acad Dermatol. 2004;50(3):391-404.
3. Antunes AA, Solé D, Carvalho VO, Bau AE, Kuschnir F, Mallozi MC, et al. Guia prático de atualização em dermatite atópica - Parte I: etiopatogenia, clínica e diagnóstico. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma Alerg Imunol. 2017;1(2):131-56.
4. Carvalho VO, Solé D, Antunes AA, Bau AE, Kuschnir FC, Mallozi MC, et al. Guia prático de atualização em dermatite atópica - Parte II: abordagem terapêutica. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma Alerg Imunol. 2017;1(2):157-82.
5. Eichenfield LF, Hanifin JM, Beck LA, Lemanske RF, Sampson HÁ, Weiss ST. Atopic dermatitis and asthma parallels in the evaluation of treatment. Pediatrics. 2003;111:608-16.
6. Harper JI, Ahmed I, Barclay G, Lacour M, Hoeger P, Cork MJ, et al. Cyclosporin for severe childhood atopic dermatitis: short course versus continuous therapy. Br J Dermatol. 2000;142:52-8.
7. Kay J, Gawkrodger DJ, Mortimer MJ, Jaron AG. The prevalence of childhood atopic eczema in a general population. J Am Dermatol. 1994;30:35-9.
8. Werfel T, Breuer K. Role of food allergy in atopic dermatitis. Curr Opin Allergy Clin Immunol. 2004;4(5):379-85.
9. Breuer K, Kapp A, Werfel T. The impact of food allergy in patients with atopic dermaitis. Hautarzt. 2003;54(2):121-9.
10. Lau S. Allergen avoidance as primary prevention:con. Clin Rev Allergy Immunol. 2005;28(1):17-23.
11. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derma Venereol. 1980;92(Suppl):44-7.
12. Sampson HA, Gerth van Wijk R, Bindslev-Jensen C, Sicherer S, Teuber SS, Burks AW, et al. Standardizing double-blind, placebocontrolled oral food challenges: American Academy of Allergy, Asthma & Immunology-European Academy of Allergy and Clinical Immunology PRACTALL consensus report. J Allergy Clin Immunol. 2012;130:1260-74.
13. Castro AP. Dermatite Atópica. In: Grumach AS, ed. Alergia e Imunologia na Infância e na Adolescência. São Paulo: Atheneu; 2001. p.185-99.
14. Herbarth O, Fritz GJ, Rehwagen M, Richter M, Röder S, Schlink U. Association between indoor renovation activities and eczema in early childhood. Int J Hyg Environ Health. 2006;209:241-7.
15. Scalabrin DM, Bavbek S, Perzanowski MS, Wilson BB, Platts-Mills TA, Wheatley LM. Use of specific IgE in assessing the relevance of fungal and dust mite allergens to atopic dermatitis: a comparison with asthmatic and nonasthmatic control subjects. J Allergy Clin Immunol. 1999;104:1273-9.
16. Guillet G, Guillet MH. Natural history of sensitizations in atopic dermatitis. A 3-year follow-up in 250 children: food allergy and high risk of respiratory symptoms. Arch Dermatol. 1992;128:187-92.
17. Kutlua A, Karabacak E, Aydinc E, Ozturka S, Taskapan O, Aydinoz S, et al. Relationship between skin prick and atopic patch test reactivity to aeroallergens and disease severity in children with atopic dermatites. Allergol Immunopathol (Madr). 2013;41(6):369-73.
18. Halbert AR, Weston WL, Morelli JG. Atopic dermatitis: is it na allergic disease? J Am Acad Dermatol. 1995;33:1008-18.
19. Muraro A, Dreborg S, Halken S, Høst A, Niggemann B, Aalberse R, et al. Dietary prevention of allergic diseases in infants and small children. Part II. Evaluation of methods in allergy prevention studies and sensitization markers. Definitions and diagnostic criteria of allergic diseases. Pediatr Allergy Immunol. 2004;15(3):196-205.
20 Oehling A, Resamo A, Sanz ML, Fernadez-Benitez M. Importance of food in atopic dermatitis. Allergy. 1998;53(Suppl 46):139-42.
21. Sampson HÁ. Food hipersensitivity and dietary management of atopic dermatitis. Pediatr Dermatol. 1992;9:376-9.
22. Fiocci A, Bouygue GR, Martelli A, Terracciano L, Sarratud T. Dietary treatment of childhood atopic eczema/syindrome (AEDS). Allergy. 2004;59(Suppl 78):78-85.
23. Sampson HÁ, Mc Caskill CC. Food hypersensitivity and atopic dermatitis evaluation of 113 patients. J Pediatr. 1985 Nov;107(5):669-75.
24. Johnson E, Irons J, Patterson R, Roberts M. Serum IgE concentration in atopic dermatitis. J Allergy Clin Immunol. 1974;54:94-9.
25. Sampson HA. Atopic dermatitis. Ann Allergy. 1992;69:469-81.
26. Laske N, Niggermann B. Does the severuty of atopic dermatitis correlate with serum IgE levels? Pediatric Allergy Immunol. 2004;15:86-8.
27. Carsten F, Carl-Fredrik W, Hywel W. How atopic es atopic dermatitis? J Allergy Clin Immunol. 2004;114:150-8.
28. Hill DJ, Sporik R, Thorburn J, Hosking SC. The association of atopic dermatitis in infancy with immunoglobulin E food sensitization. J Pediatr. 2000;137:475-9.
29. Hill DJ, Hosting CS. Food allergy and atopic dermatitis in infancy: na ipidemiologic study. Pediatr Allergy Immunol. 2004 Oct;15(5):421-7.
30. Koblenzer CS. Itching and the atopic skin. J Allergy Clin Immunolog. 1999;104:S109-13.
31. Lawrence FE. Dermatite atópica e asma: paralelismo na evolução do tratamento. Pediatrics [ed.bras.] 2003;7(6):301-11.



