Número Atual: Outubro-Dezembro 2018 - Volume 2 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Biomarcadores e imunobiológicos na asma
Biomarkers and immunobiological agents in asthma
Ataualpa Pereira dos Reis; Jose Augusto Nogueira Machado
DOI: 10.5935/2526-5393.20180054
Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, Imunologia - Belo Horizonte, MG
Endereço para correspondência:
Ataualpa Pereira dos Reis
E-mail: ataualpapreis@gmail.com
Submetido em: 17/04/2018
Aceito em: 18/12/2018
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A maioria dos asmáticos é bem controlada com o uso de corticosteroides inalados e beta-agonistas de ação prolongada; contudo, uma proporção de pacientes não responde a esta terapia, e mantém controle limitado da doença. Este grupo experimenta exacerbações frequentes, e requer admissão hospitalar. O desenvolvimento de novos agentes biológicos e biomarcadores da doença abre novas avenidas para o tratamento. Nós revisamos as últimas informações pertinentes aos biomarcadores e agentes biológicos, e demonstramos como os pacientes podem ser identificados e se beneficiar destes tratamentos. As fontes de dados incluíram artigos originais, revisões e publicações indexados nos bancos de dados PubMed, MEDLINE, LILACS, SciELO e publicações on-line, nos últimos 15 anos. As informações mais recentes da medicina personalizada com análise genética e biomarcadores da inflamação Th2 permitiram identificar fenótipos de asma que incluem um fenótipo T2 alto. Estudos recentes dirigidos para IgE, IL-5, IL-13, IL-17 e para os receptores de cadeias alfa de IL-4 mostraram alguma eficácia em alguns pacientes fenotipados. Para aqueles sem evidência de inflamação Th2, nenhuma terapia específica foi identificada. A disponibilidade de biomarcadores e agentes bioterapêuticos que são dirigidos para IgE, interleucinas IL-5, IL-4, IL-13 e IL-17, são uma excitante modalidade de medicina molecular. Contudo, estes agentes bioterapêuticos somente são efetivos quando dirigidos para pacientes com fenótipos de asma específicos.
Descritores: Medicina de precisão, asma, doença pulmonar obstrutiva crônica, biomarcadores.
INTRODUÇÃO
A asma tem sido considerada uma doença única por anos, mas cada vez mais a sua heterogeneidade em relação as características do paciente (fenótipos), os mecanismos patogênicos subjacentes (endótipos), e as respostas clínicas e terapêuticas necessitam um melhor conhecimento para uma terapia mais efetiva. Alguns pacientes respondem a um determinado tipo de tratamento, enquanto outros não, e alguns falham a responder a todos os tipos de tratamento disponíveis. A identificação de biomarcadores tem levado à possibilidade de distinguir mecanismos fisiopatológicos consistentes com grupos diferentes de pacientes. Biomarcadores celulares e solúveis, como os eosinófilos circulantes e citocinas, são referenciados para predizer resposta favorável ao uso de corticosteroides inalados (CI) ou anticorpos monoclonais anti-interleucina 5 (anti-IL-5); a titulação de óxido nítrico exalado para monitorar terapia com CI; e periostina ou dipepdil peptidase 4 como preditores de terapia com anticorpo monoclonal anti-IL-13. São biomarcadores1:
– Eosinofilia sanguínea > 300/mm3 e associada com exacerbações graves ou > 400/mm3;
– Eosinofilia no escarro > 2%;
– Periostina sérica (estimulada por IL-13) > 50 ng/mL;
– FeNO > 30 partes por bilhão ppb;
– Dipeptidil peptidase IV (DPP4) (estimulada por IL13) - níveis de cut-off ainda não estabelecidos.
Múltiplos modificadores da resposta imune estão sendo avaliados na asma denominada T2 alta e ligados a bloqueio das interleucinas IL-5, IL-13, imunoglobulina E e outras vias. Assim, muitas destas terapias visando a asma T2 alta têm demonstrado melhor eficácia quando certos biomarcadores estão elevados, especialmente os eosinófilos. Já o tipo de asma T2 baixo, que não apresenta biomarcadores apreciáveis, é geralmente diagnosticada pela ausência de biomarcadores para T2 alta. Estes pacientes tendem a ter mais resistência a tratamento com esteroides, e, a despeito do correto uso destas medicações, aproximadamente 10% dos asmáticos tem doença grave sem controle, e o desenvolvimento de novas terapias são desejadas2.
Intervenções dirigidas às atividades das citocinas na asma têm gerado um interesse considerável após o sucesso clínico de omalizumabe, mepolizumabe, reslizumabe e benralizumabe3-10. Contudo, as melhoras clínicas e espirométricas foram notadas apenas em uma proporção de asmáticos graves, especialmente aqueles com o fenótipo eosinofílico. Isto demonstra a necessidade de uma seleção apropriada de pacientes para o tratamento, e enfatiza o papel dos biomarcadores para identificar estes respondedores. Nesta revisão, pretendemos discutir o papel dos biomarcadores na identificação destes pacientes, e os novos compostos, focando as citocinas do mecanismo molecular da asma.
BIOMARCADORES EM ASMA
O mecanismo patogenético da asma alérgica pode ser caracterizado como mediado por células T helper-2 (Th2). As citocinas geradas desta inflamação Th2, incluindo interleucinas IL-4,IL-5,IL-13, são reconhecidas como intimamente associadas aos mecanismos patogenéticos da asma11-15. Durante este processo complexo, interações entre fatores ambientais, as respostas inflamatórias e o sistema imune do indivíduo levam ao padrão de produção destas citocinas, tais como as IL-4, IL-5, IL-13, e também a intervenção do sistema inato de células linfoides tipo 2 (ILC-2), responsáveis pela asma eosinofílica produtora das citocinas semelhantes às da células Th2, incluindo IL-4,IL-5, IL-9 e IL-13. As ILC-2 podem ser também ativadas por citocinas produzidas no epitélio respiratório, tais como as IL-33, IL-25 e as linfopoetinas estrômicas tímicas TLSP16 (Figura 1). As ações centrais da IL-4 incluem a diferenciação das células Th0 para células Th2 e switch da produção de imunoglobulinas das células B, com predominância da produção de IgE15,17. IgE se liga a receptores de alta afinidade (FceRI) presentes em mastócitos e basófilos, e na presença de antígenos específicos, degranulam e liberam mediadores inflamatórios, incluindo histamina, prostaglandinas e citocinas IL-4, IL-5, IL-1311,15,18. Nas vias respiratórias inferiores, esta atividade resulta em eosinofilia, aumento da produção de muco e aumento da contratilidade da musculatura lisa15,19. A IL-5 é uma citocina central para o crescimento, diferenciação, recrutamento, ativação e sobrevida dos eosinófilos19,20. Esta citocina também trabalha em sintonia com IL-9 para recrutar mastócitos e eosinófilos para os tecidos afetados21,22. Embora a IL-5 tenha papel central nas asma grave, as estratégias anti-IL-5 em grupos de asmáticos não selecionados foram desapontadoras23. IL-13 está bastante ligada a IL-4, pois seus receptores são próximos (IL-4Ra/IL-13Ra1), e bloquear IL-4Ra bloqueia os efeitos de IL-4 e IL-1324. Os pacientes com T2 alta tipicamente têm inflamação eosinofílica mediada pelas citocinas IL-4, IL-5 e IL-13 e podem ter IgE elevada. Por outro lado, os pacientes T2 baixa têm uma asma caracterizada principalmente por uma inflamação neutrofílica e, em alguns casos, paucigranulocítica25-28. IL-8 também está aumentada nas vias aéreas de pacientes com asma não eosinofílica28. Não existem atualmente biomarcadores para identificar os asmáticos T2 baixo, mas este processo patológico pode estar envolvido com Th-17 e Th-1. As Th-17 são parte da diferenciação das células T CD-4, e produzem um número de citocinas, incluindo IL-17A, IL-17E, IL-17F e IL-2211,29-32. As IL-17A e as IL-17F estimulam as células epiteliais das vias aéreas a secretar quimiocinas que atraem neutrófilos, tais como as CXCL8 (IL-8), que mediam a infiltração de neutrófilos e aumentam a inflamação das vias aéreas32. Células Th-1 também produzem fator de necrose de tumor (TNF)-α, um mediador importante na asma grave, já que induz inflamação das vias aéreas, hipersecreção de muco e ativação de macrófagos11. É importante notar que uma proporção significativa de asmáticos graves (30 a 50%) não tem a asma T2 alta27,33,34. Estas limitações são bastante claras e colocam ênfase na necessidade de biomarcadores para identificar asmáticos que respondem ao tratamento.
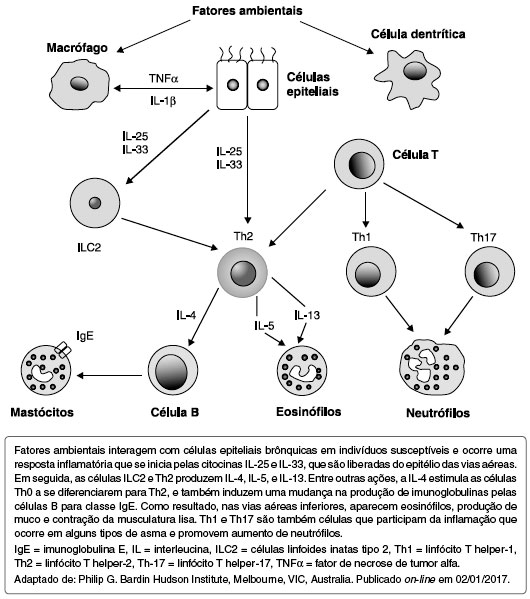
Figura 1 Interleucinas que podem ser alvos de imunobiológicos
BIOMARCADORES QUE PODEM SER USADOS NA PRÁTICA MÉDICA DA ASMA
A identificação de biomarcadores é uma informação muito valiosa e um guia para a seleção de terapia de alguns asmáticos que podem responder bem ao tratamento. Contudo, para que esta informação seja utilizável, ela deve ser suficientemente sensitiva e específica. Também estar disponível, não ser invasiva e o custo viável para o paciente ou para o sistema de saúde são condições essenciais para a viabilidade do teste.
O diagnóstico de asma através da combinação da história clínica com os testes de função pulmonar ou com o teste de provocação com metacolina ou o teste do exercício padronizado35 não especificamente caracteriza ou quantifica a inflamação das vias aéreas. Broncoscopia com biópsia e lavado broncoalveolar continuam sendo úteis para o acesso a asma do paciente e para a detecção de biomarcadores, e são seguros mesmo em asmáticos graves, desde que algumas precauções sejam tomadas36-39. No entanto, a natureza invasiva destes exames limitam o seu uso e principalmente com o propósito de monitoramento. De uma maneira geral, o protocolo para estes pacientes com asma moderada a grave ou de difícil controle deveria ainda incluir os seguintes exames:
– testes cutâneos por técnica de Prick para os aeroalérgenos;
– testes para IgEs específicas para os aeroalérgenos;
– IgE total;
– exame de sangue para a contagem diferencial de leucócitos, incluindo os eosinófilos.
Os testes cutâneos por técnica de Prick para os aeroalérgenos estão extensamente disponíveis, de custo acessível, simples, minimamente invasivos e bons para se avaliar o padrão alérgico do paciente em relação aos aeroalérgenos indutores de IgE40,41. Outra vantagem é que os testes têm leitura em 15-20 minutos, e são bastante sensíveis e reprodutíveis quando realizados por médico experiente e utilizando extratos padronizados40-42. Existe em nosso meio ainda uma grande necessidade de reprodutibilidade e utilização de alérgenos com bom padrão de estandardização para estes testes entre diferentes profissionais, a exemplo de iniciativas em outros países43.
Exame de sangue para a dosagem do nível de IgE e contagem diferencial de eosinófilos devem ser utilizados para se identificar a sensibilidade alérgica e são importante componente no diagnóstico de asma. Os níveis de IgE específica contra determinados alérgenos e a contagem de eosinófilos foram confirmados como sendo consistentes biomarcadores para se medir o risco de asma em crianças44. A concordância entre os testes in vitro para IgEs específicas e o testes cutâneos por técnica de Prick é de 85-90%, dependendo dos alérgenos e do método de teste41, sendo os testes cutâneos por Prick considerados mais sensíveis, e os IgEs mais específicos45. As medidas da IgE total e das IgEs específicas são úteis no diagnóstico de asma e para distinguir entre asma alérgica e asma não alérgica46-49. A dosagem da IgE total é também útil na seleção de candidatos a tratamento por omalizumabe, assim como também para estabelecer as doses apropriadas, e as dosagens de IgEs específicas são úteis em pacientes pediátricos com risco de anafilaxia, para aqueles que têm lesões cutâneas extensas, ou para aqueles que não cooperam bem para os testes cutâneos39. A concentração média de IgE total para indivíduos adultos normais é de 156,0 KU/L. Os níveis são dependente da idade do paciente e diminuem com a idade mais avançada do paciente com asma50-53.
A contagem dos eosinófilos no sangue circulante é também um indicador de asma eosinofílica leve, moderada ou grave54-57. Elevação de eosinófilos ou das proteínas eosinofílicas no sangue circulante são indicadores de aumento no curto prazo de sintomas de asma, hiper-reatividade brônquica, redução do FEV1 e necessidade de uso de tratamento com corticoide em pacientes com asma leve a moderada58. Um estudo em grande escala utilizando a contagem de eosinófilos, concluiu que esta contagem pode ser um fator independente para risco de exacerbação de asma e de atendimento em serviço de emergência ou hospitalizações59.
Outras avaliações muito importantes são:
– periostina sérica;
– exame do escarro induzido;
– dosagem do óxido nítrico exalado.
Níveis elevados de periostina estão associados com atividade asmática, gravidade de asma e presença de asma eosinofílica60,61. Um trabalho extenso determinou que a periostina sérica foi um melhor preditivo de presença de eosinofilia na arvore brônquica do que outros biomarcadores testados, incluindo IgE, eosinófilos no sangue periférico, óxido nítrico exalado e YKL-40. Além disto, a periostina é potencialmente útil na seleção de pacientes com inflamação Th2, e mais consistente do que a eosinofilia sanguínea62. Um nível preciso indicativo de alta quantidade de periostina não foi ainda estabelecido, e a necessidade de ensaio enzimático imunoabsorvente na dosagem da periostina faz com que o teste seja limitado a pesquisa e não a rotina clínica63.
O escarro induzido é um método efetivo e não invasivo que serve como biomarcador para asma de pacientes de 6 anos de idade para mais64,65. O teste realiza a contagem diferencial de 400 células, incluindo eosinófilos, neutrófilos, macrófagos, linfócitos e células epiteliais. O exame tem boa reprodutibilidade e validade confirmada66,67. O exame tem sido ainda capaz de identificar quatro fenótipos inflamatórios: eosinofílico, neutrofílico, paucigranulocítico e granulacítico misto (neutrófilos e eosinófilos elevados)65. Asmáticos, em comparação com indivíduos saudáveis e fumantes com bronquite, apresentaram maior proporção de eosinófilos de escarro (porcentagem média de 5,2 versus 0,5 e 0,3), células metacromáticas (0,3 contra 0,07 e 0,08). Os asmáticos diferiram de indivíduos saudáveis, mas não de fumantes com bronquite, na proporção de neutrófilos (46,9% contra 24,1%). Fumantes com bronquite apresentaram tendência para uma maior contagem de neutrófilos do que indivíduos saudáveis. Em asmáticos, a IL-5 correlacionou-se com a contagem de eosinófilos. Houve uma correlação negativa significativa entre os índices de escarro e os fluxos expiratórios e a metacolina PC20. O escarro induzido pode, portanto, ser usado para medir de forma confiável esses índices de inflamação das vias aéreas66. Infelizmente, no Brasil o alto custo, a demanda de qualificação técnica e o tempo consumido com o exame, limitam a sua utilização na prática clínica.
O óxido nítrico exalado pelas vias aéreas é um indicativo de inflamação Th268,69. A determinação do óxido nítrico exalado pode predizer queda acelerada da função pulmonar70. A quantidade de óxido nítrico exalado pode predizer a inflamação das vias aéreas com eficácia comparável à análise do escarro induzido, e pode também predizer volta da asma em crianças assintomáticas após tratamento com corticoide inalado, e antecede em 30 dias os sintomas70,71. A dosagem do óxido nítrico é fácil de ser realizada, muito útil em crianças, e os resultados são imediatos; contudo, a sua sensibilidade e especificidade para a inflamação eosinofílica não é certa e pode ser confundida pelo hábito de fumo, padrão de atopia e uso de CI, portanto não existindo recomendação formal pela maioria dos consensos sobre asma72,73. No Brasil o seu uso é ainda muito limitado.
IMUNOBIOLÓGICOS EM ASMA
O advento dos imunobiológicos tem revolucionado o tratamento de pacientes com asma grave refratária. Estes agentes atuam em diferentes componentes da cascata inflamatória, e são indicados para fenótipos específicos (Figura 1).
ANTI-IMUNOGLOBULINA E OU OMALIZUMABE
O omalizumabe é o primeiro deles, e aprovado pelas agências de saúde para uso na prática clínica, já com mais de uma década de uso. É um anticorpo IgG1 monoclonal humanizado dirigido para IgE, com a finalidade de reduzir os níveis de IgE e usado para asma grave e urticária crônica. O omalizumabe se liga a IgE no domínio ou região Cε3 da IgE, bloqueia a interação desta com os receptores FcεRI e FcεRII existentes na membrana dos basófilos e dos mastócitos, e impede a degranulação destas células e a liberação de mediadores da reação inflamatória74. Diversos estudos mostram a eficácia e segurança de omalizumabe na redução do efeito dos alérgenos nas vias aéreas, um melhor controle dos sintomas da asma e uma redução do número de exacerbações75,76. Outros estudos mostram ainda benefícios em crianças asmáticas alérgicas e redução da dose de corticosteroide sistêmico em pacientes com doença refratária77. Uma revisão Cochrane em 2014 examinou 25 trabalhos e encontrou que omalizumabe é efetivo em reduzir exacerbações de asma moderada a grave, e que reduz a terapia com CI, além de reduzir as hospitalizações78. Um estudo duplo-cego, multicêntrico, controlado e em paralelo, estudou pacientes com asma grave não controlada e que usaram omalizumabe ou placebo, e observou que pacientes com três biomarcadores positivos tiveram maior redução de exacerbações no grupo omalizumabe79.
Uma análise post hoc de ensaios com omalizumabe sugere que ele possa atuar predominantemente nas asmas Th2, e que a contagem de eosinófilos circulantes e o óxido nítrico exalado podem ser bimarcadores de resposta melhor que IgE, existindo também evidências de resposta ao omalizumabe em pacientes não atópicos com asma eosinofílica79. No Brasil, atualmente, o omalizumabe (Xolair®) é licenciado pela ANVISA para pacientes com asma alérgica grave para uso por via subcutânea em crianças de 6 anos de idade ou maiores e adultos, como terapêutica de manutenção adicional naqueles pacientes com asma alérgica grave que permanecem não controlados após as terapias recomendadas no passo 4 da GINA40. Entretanto, ainda não foi incorporado pela Comissão Nacional de Incorporação de Tecnologias no SUS, a CONITEC. Em julho de 2016 foi publicado parecer da CONITEC contrário à incorporação do omalizumabe para o tratamento de pacientes com asma grave não controlada. O Relatório de Recomendação da CONITEC N° 219, de julho de 2016, está disponível em: http://conitec.gov.br/images/Relatorios/2016/Relatorio_Omalizumabe_Asma_Grave_final.pdf. Dentre as razões para a não incorporação, destaca que as recomendações e uso do omalizumabe por experts no Brasil e exterior são diferentes das recomendações em bula, sendo utilizado em nosso meio para pacientes com maior gravidade do que o indicado na bula do produto na prática clínica, quando comparados aos pacientes dos ensaios clínicos que demonstraram a eficácia do omalizumabe. Especialistas da ASBAI reconhecem que o uso do omalizumabe deve ser recomendado mediante protocolo detalhado, com indicação precisa, preferencialmente com aprovação por Centro de Referência para pacientes com asma grave, alinhado com as recomendações da GINA 2016. Pacientes com asma grave em uso de CI em altas doses, associado à LABA (broncodilatadores de ação prolongada), e à terceiro medicamento de controle quando possível (tiotrópio, antileucotrienos, teofilina de longa duração), com adesão adequada e técnica correta de uso das medicações inalatórias, excluídas e/ou tratadas comorbidades, que ainda permanecem sem o controle da doença, têm indicação de usar o omalizumabe, ou outros imunobiológicos (por exemplo, anti-iL-5 para asma grave eosinofílica)80.
ANTI-INTERLEUCINA-5
Recentemente, o anticorpo anti-IL5, mepolizumabe (NUCALA®), foi adicionado na etapa 5 de tratamento da asma na GINA, para pacientes acima de 12 anos de idade com asma grave eosinofílica não controlada na etapa 440. A IL-5 é a principal citocina eosinofilopoiética, com papel importante na inflamação alérgica por estimular a produção, maturação, recrutamento, diferenciação, sobrevivência e ativação de eosinófilos83. A IL-5 é produzida principalmente por linfócitos Th2, Tc2 (células T citotóxicas tipo 2), eosinófilos, mastócitos e células T-ϒδ. Mais recentemente, células linfoides inatas têm se mostrado uma importante fonte de IL-582. Os eosinófilos representam 1 a 6% da série branca sanguínea e são mediadores importantes nas reações alérgicas e participantes na patogênese e gravidade de desordens inflamatórias crônicas das vias aéreas, incluindo a asma. Eosinófilos auxiliam na resposta imune inata desencadeada em vias aéreas por alérgenos ambientais, infecções virais e outros estímulos externos, e a ativação dessas células pode levar a dano tecidual e remodelamento. Potentes mediadores pro-inflamatórios são liberados por eosinófilos teciduais, incluindo proteína básica principal derivada de grânulos, mediadores lipídicos, citocinas e quimiocinas, que podem causar inflamação das vias aéreas, hiper-responsividade brônquica e remodelamento caracterizado por fibrose, angiogênese e espessamento das vias aéreas80,81. Imunobiológico que possa inibir a IL-5 e subsequentemente reduzir os eosinófilos no sangue e nas vias aéreas seria capaz de melhorar o controle de asma e reduzir as exacerbações83. Diversos estudos randomizados e controlados documentaram o benefício de mepolizumabe em pacientes com asma eosinofílica não controlada com eosinófilos sanguíneos > 150 células/µL, reduzindo as exacerbações, diminuindo o uso de corticoides orais, e melhorando o controle da asma81,84-88. Mepolizumabe é um anticorpo monoclonal humanizado IgG1/k de alta afinidade, que inibe a ligação da IL-5 com seu receptor expresso em eosinófilos e promove uma significante redução dos eosinófilos circulantes. Portanto, o mepolizumabe deve ser considerado para uso subcutâneo(SC) na dose de 100 mg para pacientes com asma eosinofílica não controlada e, mais especificamente, naqueles com exacerbações e em uso crônico de corticoides orais86.
O reslizumabe é um anticorpo monoclonal IgG4k contra IL-5 capaz de impedir a ligação com os eosinófilos, e vários ensaios documentaram a sua eficácia e segurança para o uso em asmáticos com hipereosinofilia, e demonstraram um melhor controle da doença, principalmente em relação às taxas de exacerbação81,87-90. O reslizumabe (Cinqair®, Cinqaero®) é indicado como terapia de manutenção adicional para pacientes com asma grave, com idades de 18 anos e maiores, e com fenótipo eosinofílico. O seu uso é recomendado, na dose de 3 mg/kg, uma vez a cada 4 semanas, em infusão endovenosa por 20 a 50 minutos, sendo as ampolas com solução de 100 mg/10 mL (10 mg/mL) em frascos para uso único.
O benralizumabe, um antagonista que se liga aos receptores da IL-5, também demonstrou efeito em diminuir os eosinófilos do sangue e das vias aéreas, e foi capaz de diminuir as taxas de exacerbação e melhorar o VEF1 dos pacientes asmáticos com altas percentagens de eosinófilos no pré-tratamento91-93. Os pacientes com eosinofilia de pelo menos 300 células/µL apresentam uma redução das taxas de exacerbações (40 a 60%) quando em uso de benralizumabe na dose de 20 mg e 100 mg SC, a cada 30 dias. A eficácia do tratamento com anticorpo monoclonal anti-IL-5 está bastante associada à taxa de eosinófilos no sangue circulante e à taxa de exacerbações. A contagem dos eosinófilos no sangue é um melhor biomarcador do que medida direta de eosinófilos na árvore brônquica, tais como contagem no lavado brônquico ou medida de óxido nítrico exalado, sendo que as taxas acima de 300-400 células mm3 indicam provável melhor resposta terapêutica84.
ANTI-INTERLEUCINA-4 / ANTI-INTERLEUCINA-13
IL-13, como IL-4, são partes integrantes da resposta Th2 e, assim como estas células as produzem, também os eosinófilos, as células NK e algumas células inatas podem as produzir. IL-13 trabalha em concerto com IL-4 para influenciar a inflamação das vias aéreas e o remodelamento, para a produção de muco, síntese de IgE, recrutamento de eosinófilos e basófilos e também para a proliferação dos fibroblastos brônquicos e células dos músculos lisos das vias aéreas94. IL-13 induz a produção da periostina, uma proteína envolvida na inflamação das vias aéreas e no remodelamento destas. Lebrikizumabe é um anticorpo monoclonal específico IgG4 para as IL-13, inibindo a sua função. Estudos randomizados com pacientes portadores de asma não controlada, mesmo com uso adequado de corticoides inalados, têm demonstrado melhoras clínicas e do VEF1, principalmente naqueles com mais alto título de periostina sérica95,96. Isto sugere que a periostina pode servir como biomarcador para aqueles pacientes que vão responder a terapia anti-IL-13. Também o nível de óxido nítrico exalado está aumentado na asma como resultado de que IL-13 induz a formação de síntese do óxido nítrico no epitélio das vias aéreas e, portanto, o óxido nítrico também está associado à resposta ao lebriquizumabe97. Ensaios com outros imunobiológicos que bloqueiam individualmente o IL-13 são bastante limitados.
IL-4 ativa receptores tipo I que controlam a diferenciação de células linfoides CD4+ para Th2, induz a formação de IgE, a expressão das moléculas de adesão vascular (VCAM-1), migração dos eosinófilos para os pulmões, inibição de apoptose dos linfócitos T, secreção de muco e inibe ainda a produção de interferon (IFN)-γ 98-99. Os ensaios imunobiológicos tentam reduzir a atividade de IL-4, do receptor solúvel para IL-4, inibição dos fatores de transcrição de IL-4 e antagonistas dos receptores IL-4/IL-1398. AMG317(Amgen) e Dupilumabe (Sanofi/Regeneron) são anticorpos monoclonais humanizados dirigidos para a cadeia alfa (IL-4Rα), que é comum aos receptores da IL-4 e IL-13, impedindo a ligação destas citocinas. Foram estudados em asmáticos com asma de moderada a grave e sintomas não controlados com doses médias ou altas de CI e beta-2 agonista de ação prolongada (LABAs), sendo que alguns estudos demonstraram eficácia em melhorar a função pulmonar, reduzir taxas de exacerbações e outros parâmetros clínicos100,101. O AMG 317 foi estudado em asmáticos com asma moderada a grave e foi seguro e bem tolerado, mas falhou em melhorar os sintomas de asma, embora o tempo da primeira exacerbação tenham sido prolongado e taxas de exacerbações de asma tenham diminuído, mas estes achados foram sem valor estatístico102. Em análise post hoc, os pacientes com sintomas maiores na linha básica tiveram maior benefício, sugerindo o seu potencial em selecionando melhor os pacientes. O anticorpo monoclonal dupilumabe se liga à subunidade alfa do receptor de IL-4 e pode inibir as citocinas IL-4 e IL-13. O dupilumabe foi estudado em pacientes com asma moderada a grave com eosinofilia periférica ou no lavado brônquico e não controlados com as intervenções nível 4 do GINA100. Após estabilização da asma, os pacientes retiraram os CI e os LABAs e os pacientes tratados com dupilumabe tiveram menos exacerbações, diminuíram os marcadores inflamatórios Th2, tais como as eotaxinas 3, e melhoraram a função pulmonar. Nos Estados Unidos, o dupilumabe, dupixent, foi aprovado pelo FDA em março de 2017; na Europa, pelo European Medicine Agency, em setembro; e pela Anvisa, no Brasil, em novembro de 2107, mas para uso em dermatite atópica moderada a grave. Recentemente, em 2018, o dupilumabe também foi aprovado nos EUA para o tratamento da asma grave. Altrakincept (Immunex) é um anticorpo recombinante solúvel para IL-4R e que inibe as ações da IL-4 por inibição de seus receptores98. Os ensaios com este imunobiológico mostram ser seguros e bem tolerados, mas estes estudos, embora demonstrem que, em asma moderada, seja possível a retirada de CI e mantendo a função pulmonar98, não puderam ser reproduzidos em estudos posteriores94. Pascolizumabe é outro imunobiológico humanizado e dirigido contra IL-4 impedindo que se ligue a seu receptor específico103. Embora os estudos tenham demonstrado ser ele seguro e bem tolerado, não mostrou eficácia em pacientes asmáticos sintomáticos ainda sem terem usado corticosteroides98,103. Pitrakinra (Aerovance) é outro anticorpo monoclonal que impede IL-4 e IL-13 de se ligarem a seus receptores. Pode ser usado na forma subcutânea e também em forma de nebulizações, e mostrou redução na queda tardia de VEF1 a desafios com alérgenos, e também reduziu os níveis de óxido nítrico exalado após 4 semanas de uso por nebulização. Não mostrou efetividade na fase imediata aos desafios com alérgenos, e o óxido nítrico exalado aumentou nestes desafios com alérgenos. Esta falha na resposta imediata com desafios com alérgenos sugere que ele possa agir na supressão da inflamação produzida por IL-4 e IL-13, mas não nos efeitos da ação de mastócitos. Também falhou na inibição de aumento da hiper-reatividade brônquica após desafios com alérgenos99,104.
Alguns estudos têm explorado o papel da IL-33, da linfopoetina estrômica tímica (TSLP) e da IL-25 na patogênese da asma105. A IL-33 é uma citocina expressa nas células Th2 e que promove a produção de IL-5 e IL-13. Níveis elevados de IL-33 são encontrados na árvore respiratória de asmáticos adultos, no sangue e no lavado brônquico de crianças asmáticas84,97. Infecçãos respiratórias virais podem aumentar esta citocina em pacientes com asma.
TSLP e IL-17 podem estar aumentadas em lavado brônquico e em biópsias endobronqueais de pacientes com asma, e anticorpo monoclonal anti TSLP diminui a broncoconstrição induzida por alérgenos em pacientes com asma106. AMG 157 (Amgen-tezepelumabe) e tezepelumabe é um anticorpo monoclonal totalmente humanizado que se liga à TSLP e impede sua ligação ao seu receptor. Em pacientes com asma sem controle, a despeito de estarem usando LABAs e CI, ele é eficiente e seguro, e também atenua a resposta da fase imediata e tardia em pacientes com asma induzida por alérgenos e, mais ainda, reduz a eosinofilia no sangue e no lavado brônquico e o óxido nítrico exalado106,107. IL-25 também tem sido implicada na patogênese da asma com Th2 alta, e estudos futuros poderão mostrar efeitos de anti IL-25 em asmáticos108.
Outros fenótipos de asma também estão merecendo pesquisas futuras. A asma neutrofílica pode ser pesquisada em relação às IL-17, IL-24, IL-27. Brodalumabe é um anticorpo monoclonal humanizado anti-IL-17RA que bloqueia a ação da IL-17A, IL-17F, IL-17A/F heterodímero, e IL-25. Um estudo em asmáticos moderado a grave e que recebiam uso regular de CI mostrou resultados de melhora nos índices de qualidade de vida, VEF1, e no número de dias livres de sintomas destes pacientes109.
CONCLUSÕES
Com a heterogeneidade desta doença, possuindo diversos fenotipos e endotipos, a bioterapia visando os agentes mediadores poderia ser uma medicina molecular personalizada de sucesso. Os benefícios destes novos agentes biológicos para tratar a asma dependem da seleção apropriada dos pacientes. Até o momento os resultados dos ensaios sugerem que a opção de bloquear o padrão Th2 da resposta imune é das melhores opções de tratamento, principalmente pela facilidade de usar biomarcadores específicos. Contudo, existe uma proporção de asmáticos que possuem um padrão de inflamação T2 baixa, paucigranulocítica ou neutrofílica em que estes imunobiológicos não funcionam, e novos estudos para aumentar o arsenal de biomarcadores são desejados para identificar os grupos que podem responder ao novo tipo de tratamento.
REFERÊNCIAS
1. Zissler UM, Esser-von Bieren J, Jakwerth CA, Chaker AM, Schmidt- Weber CB. Current and future biomarkers in allergic asthma. Allergy. 2015;71:475-94.
2. Holgate ST, Polosa R. The mechanisms, diagnosis, and management of severe asthma in adults. Lancet. 2006;368(9537):780-93.
3. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children (review). Cochrane Database Syst Rev. 2014;(1):CD003559. doi:10.1002/14651858.CD003559. pub4.
4. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371(13):1198-207.
5. Nair P, Pizzichini MM, Kjarsgaard M, Inman MD, Efthimiadis A, Pizzichini E, et al. Mepolizumab for prednisonedependent asthma with sputum eosinophilia. N Engl J Med. 2009;360(10):985-93.
6. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, et al. Oral glucocorticoid-sparing effect of hospitalizations for severe eosinophiic l a sthma. N Engl J Med. 2014;371(13):1189-97.
7. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multi-centre, double blind,placebo-controlled trial. Lancet. 2012;380(9842):651-9.
8. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicenter, parallel, double-blind, randomized,placebo controlled, phase 3 trials. Lancet Respir Med. 2015;3(5):355-66.
9. Bjermer L, Lemiere C, Maspero J, Weiss S, Zangrilli J, Germinaro M. Reslizumab for inadequately controlled asthma with elevated blood eosinophil levels:a randomized phase 3 study. Chest. 2016;150(4):789-98.
10. Castro M, Wenzel SE, Bleecker ER, Pizzichini E, Kuna P, Busse WW, et al. Benralizumab, an tiinterleukin 5 receptor alpha monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomized dose-ranging study. Lancet Respir Med. 2014;2(11):879-90.
11. Chung KF. Targeting the interleukin pathway in the treatment of asthma. Lancet. 2015;386(9998):1086-96.
12. Woodruff PG, Modrek B, Choy DF, Jia G, Abbas AR, Ellwanger A, et al. T-helper type 2-driven inflammation defines major subphenotypes of asthma. Am J Respir Crit Care Med. 2009;180(5):388-95.
13. Parulekar AD, Diamant Z, Hanania NA. Role of T2 inflammation biomarkers in severe asthma. Curr Opin Pulm Med. 2016;22(1):59-68.
14. van Rijt L, von Richthofen H, van Ree R. Type 2 innate lymphoid cells: at the cross-roads in allergic asthma. Semin Immunopathol. 2016;38(4):483-96.
15. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;(1):CD003559.
16. Morita H, Moro K, Koyasu S. Innate lymphoid cells in allergic and nonallergic inflammation. J Allergy Clin Immunol. 2016;138:1253-64.
17. van Rijt L, von Richthofen H, van Ree R. Type 2 innate lymphoid cells: at the cross-roads in allergic asthma. Semin Immunopathol. 2016;38(4):483-96.
18. Gandhi NA, Bennett BL, Graham NM, Pirozzi G, Stahl N, Yancopoulos GD. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15(1):35-50.
19. Hilvering B, Xue L, Pavord ID. Evidence for the efficacy and safety of antiinterleukin-5 treatment in the management of refractory eosinophilic asthma. Ther Adv Respir Dis. 2015;9(4):135-45.
20. Yamaguchi Y, Suda T, Suda J, Eguchi M, Miura Y, Harada N, et al. Purified interleukin 5 supports the terminal differentiation and proliferation of murine eosinophilic precursors. J Exp Med. 1988;167(1):43-56.
21. Goswami R, Kaplan MH. A brief history of IL-9. J Immunol. 2011;186(6):3283-8.
22. Hilvering B, Pavord ID. What goes up must come down: biomarkers and novel biologicals in severe asthma. Clin Exp Allergy. 2015;45(7):1162-9.
23. Flood-Page PT, Menzies-Gow AN, Kay AB, Robinson DS. Eosinophil’s role remains uncertain as antiinterleukin-5 only partially depletes numbers in asthmatic airway. Am J Respir Crit Care Med. 2003;167(2):199-204.
24. Maes T, Joos GF, Brusselle GG. Targeting interleukin-4 in asthma: lost in translation? Am J Respir Cell Mol Biol. 2012;47(3):261-70.
25. Moore WC, Hastie AT, Li X, Li H, Busse WW, Jarjour NN, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol. 2014;133(6):1557-63.
26. Green RH, Brightling CE, Woltmann G, Parker D, Wardlaw AJ, Pavord ID. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids. Thorax. 2002;57(10):875-9.
27. Schleich F, Brusselle G, Louis R, Vandenplas O, Michils A, Pilette C, et al. Heterogeneity of phenotypes in severe asthmatics. The Belgian Severe Asthma Registry (BSAR). Respir Med. 2014;108(12):1723-32.
28. Gibson PG, Simpson JL, Saltos N. Heterogeneity of airway inflammation in persistent asthma. Chest. 2001;119:1329-36.
29. Al-Ramli W, Préfontaine D, Chouiali F, Martin JG, Olivenstein R, Lemière C, et al. T(H)17-associated cytokines (IL-17A and IL-17F) in severe asthma. J Allergy Clin Immunol. 2009;123:1185-7.
30. Busse WW, Holgate S, Kerwin E, Chon Y, Feng J, Lin J, et al. Randomized, double-blind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma. Am J Respir Crit Care Med. 2013;188(11):1294-302.
31. Halwani R, Al-Muhsen S, Hamid Q. T helper 17 cells in airway diseases: from laboratory bench to bedside. Chest. 2013;143(2):494-501.
32. Newcomb DC, Peebles RS Jr. Th17-mediated inflammation in asthma. Curr Opin Immunol. 2013;25(6):755-60. 33. Douwes J, Gibson P, Pekkanen J, Pearce N. Non-eosinophilic asthma: importance and possible mechanisms. Thorax. 2002;57(7):643-8.
34. Peters MC, Mekonnen ZK, Yuan S, Bhakta NR, Woodruff PG, Fahy JV, et al. Measures of gene expression in sputum cells can identify TH2-high and TH2-low subtypes of asthma. J Allergy Clin Immunol. 2014;133(2):388-94.
35. Comissão de Asma da SBPT, Grupo de Trabalho das Diretrizes para Asma da SBPT. Diretrizes da Sociedade Brasileira de Pneumologia e Tisiologia para o Manejo da Asma - 2012. J Bras Pneumol. 2012;38(supl.1):S1-S46.
36. Good JT Jr, Kolakowski CA, Groshong SD, Murphy JR, Martin RJ. Refractory asthma: importance of bronchoscopy to identify phenotypes and direct therapy. Chest. 2012;141(3):599-606.
37. Connett GJ. Bronchoalveolar lavage. Paediatr Respir Rev. 2000;1(1):52-6.
38. Elston WJ, Whittaker AJ, Khan LN, Flood-Page P, Ramsay C, Jeffery PK, et al. Safety of research bronchoscopy, biopsy and bronchoalveolar lavage in asthma. Eur Respir J. 2004;24(3):375-7.
39. Moore WC, Evans MD, Bleecker ER, Busse WW, Calhoun WJ, Castro M, et al. Safety of investigative bronchoscopy in the Severe Asthma Research Program. J Allergy Clin Immunol. 2011;128(2):328-36.
40. Global Initiative for Asthma. Global strategy for asthma management and prevention. 2016. Disponível em: http://ginasthma.org/2016-gina-report-global-strategy-forasthma-management-andprevention. Acessado em: 03/02/2018.
41. Heinzerling L, Mari A, Bergmann KC, Bresciani M, Burbach G, Darsow U, et al. The skin prick test - European standards. Clin Transl Allergy. 2013;3(1):3.
42. Pesonen M, Kallio MJ, Siimes MA, Ranki A. Allergen skin prick testing in early childhood: reproducibility and prediction of allergic symptoms into early adulthood. J Pediatr. 2015;166(2):401-6.
43. Fatteh S, Rekkerth DJ, Hadley JA. Skin prick/puncture testing in North America: a call for standards and consistency. Allergy Asthma Clin Immunol. 2014;10(1):44.
44. Wandalsen GF, Solé D, Bacharier LB. Identification of infants and preschool children at risk for asthma: predictive scores and biomarkers. Curr Opin Allergy Clin Immunol. 2016;16(2):120-6.
45. Choi IS, Koh YI, Koh JS, Lee MG. Sensitivity of the skin prick test and specificity of the serum-specific IgE test for airway responsiveness to house dust mites in asthma. J Asthma. 2005;42(3):197-202.
46. Platts-Mills TAE. The role of immunoglobulin E in allergy and asthma. Am J Respir Crit Care Med. 2001;164(8 Pt 2):S1-5.
47. Holgate S, Casale T, Wenzel S, Bousquet J, Deniz Y, Reisner C. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. J Allergy Clin Immunol. 2005;115(3):459-65.
48. Simpson A, Soderstrom L, Ahlstedt S, Murray CS, Woodcock A, Custovic A. IgE antibody quantification and the probability of wheeze in preschool children. J Allergy Clin Immunol. 2005;116(4):744-9.
49. Freidhoff LR, Marsh DG. Relationship among asthma, serum IgE levels and skin test sensitivity to inhaled allergens. Int Arch Allergy Immunol. 1993;100(4):355-61.
50. Johansson SGO, Bennich H. Serum immunoglobulin (IgE) levels in asthma. Thorax. 1969;24(4):510.
51. Kerkhof M, Droste JH, de Monchy JG, Schouten JP, Rijcken B; Dutch ECRHS Group. Distribution of total serum IgE and specific IgE to common aeroallergens by sex and age, and their relationship to each other in a random sample of the Dutch general population aged 20-70 years. Allergy. 1996;51(11):770-6.
52. Martins TB, Bandhauer ME, Bunker AM, Roberts WL, Hill HR. New childhood and adult reference intervals for total IgE. J Allergy Clin Immunol. 2014;133(2):589-91.
53. Mediaty A, Neuber K. Total and specific serum IgE decreases with age in patients with allergic rhinitis, asthma and insect allergy but not in patients with atopic dermatitis. Immun Ageing. 2005;2(1):9.
54. Wagener AH, de Nijs SB, Lutter R, Sousa AR, Weersink EJ, Bel EH, et al. External validation of blood eosinophils, FE(NO) and serum periostin as surrogates for sputum eosinophils in asthma. Thorax. 2015;70(2):115-20.
55. Katz LE, Gleich GJ, Hartley BF, Yancey SW, Ortega HG. Blood eosinophil count is a useful biomarker to identify patients with severe eosinophilic asthma. Ann Am Thorac Soc. 2014;11(4):531-6.
56. Malinovschi A, Fonseca JA, Jacinto T, Alving K, Janson C. Exhaled nitric oxide levels and blood eosinophil counts independently associate with wheeze and asthma events in National Health and Nutrition Examination Survey subjects. J Allergy Clin Immunol. 2013;132(4):821-7.
57. Zeiger RS, Schatz M, Dalal AA, Chen W, Sadikova E, Suruki RY, et al. Blood eosinophil count and outcomes in severe uncontrolled asthma: a prospective study. J Allergy Clin Immunol Pract. 2017;5(1):144-53.
58. Lönnkvist K, Hellman C, Lundahl J, Halldén G, Hedlin G. Eosinophil markers in blood, serum, and urine for monitoring the clinical course in childhood asthma: impact of budesonide treatment and withdrawal. J Allergy Clin Immunol. 2001;107(5):812-7.
59. Price DB, Rigazio A, Campbell JD, Bleecker ER, Corrigan CJ, Thomas M, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. Lancet Respir Med. 2015;3(11):849-58.
60. Wardzynska A, Makowska JS, Pawełczyk P, Piechota-Polanczyk A, Kurowski M, Kowalski ML. Periostin in exhaled breath condensate and in serum of asthmatic patients: relationship to upper and lower airway disease. Allergy Asthma Immunol Res. 2017; 9(2):126-32.
61. Nagasaki T, Matsumoto H, Kanemitsu Y, Izuhara K, Tohda Y, Kita H, et al. Integrating longitudinal information on pulmonary function and inflammation using asthma phenotypes. J Allergy Clin Immunol. 2014;133(5):1474-7.
62. Jia G, Erickson RW, Choy DF, Mosesova S, Wu LC, Solberg OD; Bronchoscopic Exploratory Research Study of Biomarkers in Corticosteroid-refractory Asthma (BOBCAT) Study Group. Periostin is a systemic biomarker of eosinophilic airway inflammation in asthmatic patients. J Allergy Clin Immunol. 2012;130(3):647-54.
63. Scheerens H, Arron JR, Zheng Y, Putnam WS, Erickson RW, Choy DF, et al. The effects of lebrikizumab in patients with mild asthma following whole lung allergen challenge. Clin Exp Allergy. 2014;44(1):38-46.
64. Reddel HK, Taylor DR, Bateman ED, Boulet LP, Boushey HA, Busse WW; American Thoracic Society/European Respiratory Society Task Force on Asthma Control and Exacerbations. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med. 2009;180(1):59-99.
65. Simpson JL, Scott R, Boyle MJ, Gibson PG. Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology. 2006;11(1):54-61.
66. Pizzichini E, Pizzichini MM, Efthimiadis A, Evans S, Morris MM, Squillace D, et al. Indices of airway inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements. Am J Respir Crit Care Med. 1996;154(2 Pt 1):308-17.
67. Djukanovic R, Sterk PJ, Fahy JV, Hargreave FE. Standardised methodology of sputum induction and processing. Eur Respir J. 2002;20(37 Suppl):1s-55s.
68. Hanania NA, Wenzel S, Rosén K, Hsieh HJ, Mosesova S, Choy DF, et al. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013;187(8):804-11.
69. Bjermer L, Alving K, Diamant Z, Magnussen H, Pavord I, Piacentini G, et al. Current evidence and future research needs for FeNO measurement in respiratory diseases. Respir Med. 2014;108:830-41.
70. van Veen IH, Ten Brinke A, Sterk PJ, Sont JK, Gauw SA, Rabe KF, et al. Exhaled nitric oxide predicts lung function decline in difficultto- treat asthma. Eur Respir J. 2008;32(2):344-9.
71. Jones SL, Kittelson J, Cowan JO, Flannery EM, Hancox RJ, McLachlan CR, et al. The predictive value of exhaled nitric oxide measurements in assessing changes in asthma control. Am J Respir Crit Care Med. 2001;164(5):738-43.
72. Pijnenburg MW, Hofhuis W, Hop WC, De Jongste JC. Exhaled nitric oxide predicts asthma relapse in children with clinical asthma remission. Thorax. 2005;60(3):215-8.
73. Dweik RA, Boggs PB, Erzurum SC, Irvin CG, Leigh MW, Lundberg JO; American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med. 2011;184(5):602-15.
74. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108:184-90.
75. Sorkness CA, Wildfire JJ, Calatroni A, Mitchell HE, Busse WW, O'Connor GT, et al. Reassessment of omalizumab-dosing strategies and pharmacodynamics in inner-city children and adolescents. J Allergy Clin Immunol Pract. 2013;1:163-71.
76. Busse WW, Morgan WJ, Gergen PJ, Mitchell HE, Gern JE, Liu AH, et al. Randomized trial of omalizumab (anti-IgE) for asthma in inner-city children. N Engl J Med. 2011;364:1005-15.
77. Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and safety of subcutaneous omalizumab vs placebo as add-on therapy to corticosteroids for children and adults with asthma: a systematic review. Chest. 2011;139:28-35.
78. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 014;(1):CD003559.
79. Hanania NA, Wenzel S, Rosén K, Hsieh HJ, Mosesova S, Choy DF, et al. Exploring the effects of omalizamab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013;187(8):804-11.
80. Brom L, Mendonça TN, Oliveira FR, Sarti W, Melo JM, Arruda LK. Novos biológicos para asma: terapia anti-interleucina-5. Braz J Allergy Immunol. 2015;3(5):197-204.
81. Patterson MF, Borish L, Kennedy JL. The past, present, and future of monoclonal antibodies to IL-5 and eosinophilic asthma: a review. J Asthma Allergy. 2015;8:125-34.
82. Hilvering B, Xue L, Pavord ID. Evidence for the efficacy and safety of antiinterleukin-5 treatment in the management of refractory eosinophilic asthma. Ther Adv Respir Dis. 2015;9(4):135-45.
83. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368(26):2455-66.
84. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012;380(9842):651-9.
85. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW; SIRIUS Investigators. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371(13):1189-97.
86. Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5 therapies for asthma. Cochrane Database of Systematic Reviews 2017, Issue 9. Art. No.: CD010834. DOI: 10.1002/14651858.CD010834.pub3
87. Fainardi V, Pisi G, Chetta A. Mepolizumab in the treatment of severe eosinophilic asthma. Immunotherapy. 2016;8(1):27-34.
88. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A; MENSA Investigators. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371(13):1198-207.
89. Castro M, Mathur S, Hargreave F, Boulet LP, Xie F, Young J; Res-5- 0010 Study Group. Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study. Am J Respir Crit Care Med. 2011;184(10):1125-32.
90. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015;3(5):355-66.
91. Castro M, Wenzel SE, Bleecker ER, Pizzichini E, Kuna P, Busse WW, et al. Benralizumab, an anti-interleukin 5 receptor alpha monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose- ranging study. Lancet Respir Med. 2014;2:879-90.
92. Kolbeck R, Kozhich A, Koike M, Peng L, Andersson CK, Damschroder MM, et al. MEDI-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody- dependent cell-mediated cytotoxicity function. J Allergy Clin Immunol. 2010;125:1344-53.
93. Varricchi G, Bagnasco D, Borriello F, Heffler E, Canonica GW. Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders: evidence and unmet needs. Curr Opin Allergy Clin Immunol. 2016;16:186-200.
94. Pelaia G, Vatrella A, Maselli R. The potential of biologics for the treatment of asthma. Nat Rev Drug Discov. 2012 Dec;11(12):958-72. 95. Wills-Karp M. Interleukin-13 in asthma pathogenesis. Immunol Rev. 2004 Dec;202:175-90.
96. Barlow JL, Bellosi A, Hardman CS, Drynan LF, Wong SH, Cruickshank JP, et al. Innate IL-13-producing nuocytes arise during allergic lung inflammation and contribute to airways hyperreactivity. J Allergy Clin Immunol. 2012 Jan;129(1):191-8.
97. Gauvreau GM, Boulet LP, Cockcroft DW, Fitzgerald JM, Carlsten C, Davis BE, et al. Effects of interleukin-13 blockade on allergeninduced airway responses in mild atopic asthma. Am J Respir Crit Care Med. 2011;183(8):1007-14.
98. Steinke JW. Anti-interleukin-4 therapy. Immunol Allergy Clin North Am. 2004 Nov;24(4):599-614.
99. Wenzel S, Wilbraham D, Fuller R, Getz EB, Longphre M. Effect of an interleukin-4 variant on late phase asthmatic response to allergen challenge in asthmatic patients: results of two phase 2a studies. Lancet. 2007 Oct 20;370(9596):1422-31.
100. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368: 2455-66.
101. Stoke JR, Casale TB. Characterization of asthma endotypes: implications for therapy. J Allergy. 2016;117:121-5.
102. Corren J, Busse W, Meltzer EO, et al. A randomized, controlled, phase 2 study of AMG 317, an IL-4Ralpha antagonist, in patients with asthma. Am J Respir Crit Care Med. 2010 Apr 15;181(8):788-96.
103. Hart TK, Blackburn MN, Brigham-Burke M, Dede K, Al-Mahdi N, Zia-Amirhosseini P, et al. Preclinical efficacy and safety of pascolizumab (SB 240683): a humanized anti-interleukin-4 antibody with therapeutic potential in asthma. Clin Exp Immunol. 2002;130(1):93-100.
104. Hanania NA, Noonan M, Corren J, Korenblat P, Zheng Y, Fischer SK, et al. Lebrikizumab in moderate-tosevere asthma: pooled data from two randomised placebo-controlled studies. Thorax. 2015;70:748-56.
105. Byers DE. Defining the roles of IL-33, thymic stromal lymphopoietin, and IL-25 in human asthma. Am J Resp Crit Care Med. 2014;190(7):15-6.
106. Gauvreau GM, O'Byrne PM, Boulet LP, Wang Y, Cockcroft D, Bigler J, et al. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014;370(22):2102-10.
107. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med. 2017;377:936-46.
108. Cheng D, Xue Z, Yi L, Shi H, Zhang K, Huo X, et al. Epithelial interleukin-25 is a key mediator in Th2-high corticosteroid-responsive asthma. Am J Resp Crit Care Med. 2014;190(6):639-48.
109. Busse WW, Holgate S, Kerwin E, Chon Y, Feng J, Lin J, et al. Randomized, doubleblind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma. Am J Respir Crit Care Med. 2013;188(11):1294-302.



