Número Atual: Outubro-Dezembro 2017 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
DRESS: relato de caso com estudo genético
DRESS syndrome: case report with genetic testin
Maria Inês Perelló Lopes Ferreira1; Eduardo Costa de Freitas Silva2; Luís Cristóvao Pôrto3; Maria de Fátima Guimaraes Scotelaro Alves4; Anna Carolina Arraes5; Assunçao de Maria Castro6; Sonia Conte7; Denise Lacerda Pedrazzi8; Gabriela Coelho Dias8
DOI: 10.5935/2526-5393.20170061
1. Coordenadora do Ambulatório de Reaçoes Adversas a Medicamentos (RAM) do Hospital Universitário Pedro Ernesto (HUPE); Médica do Serviço de Alergia e Imunologia da Universidade do Estado do Rio de Janeiro (UERJ) - Rio de Janeiro, RJ, Brasil
2. Chefe do Serviço de Alergia e Imunologia da UERJ - Rio de Janeiro, RJ, Brasil
3. Coordenador do Laboratório de Histocompatibilidade e Criopreservaçao - HLA-UERJ - Rio de Janeiro, RJ, Brasil
4. Professora Associada da UERJ; Responsável pelo Setor de Dermatopatologia - Rio de Janeiro, RJ, Brasil
5. Médica do Serviço de Alergia e Imunologia e do Ambulatório de Alergia a Medicamentos do HUPE/UERJ - Rio de Janeiro, RJ, Brasil
6. Médica do Ambulatório de Reaçoes Adversas a Medicamentos (RAM) do HUPE/UERJ - Rio de Janeiro, RJ, Brasil
7. Médica colaboradora do Ambulatório de Reaçoes Adversas a Medicamentos (RAM) do HUPE/UERJ - Rio de Janeiro, RJ, Brasil
8. Médica do Serviço de Alergia e Imunologia da UERJ - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Maria Inês Perelló Lopes Ferreira
E-mail: alergia.ppc@gmail.com
Submetido em: 14/03/2017
Aceito em: 22/05/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A síndrome de hipersensibilidade a drogas com eosinofilia e sintomas sistêmicos (DRESS) é uma rara reaçao adversa a drogas com potencial de morte e sequelas em longo prazo. Os anticonvulsivantes aromáticos estao entre os medicamentos mais relacionados. Relatamos um caso de DRESS em associaçao com o alelo HLA-A*31:01, destacando aspectos clínico-laboratoriais, abordagem diagnóstica e acompanhamento ambulatorial de sequelas tardias. Homem com 69 anos, natural do Japao, internado com suspeita clínica de DRESS. Havia iniciado carbamazepina 4 semanas antes do rash cutâneo para tratamento de epilepsia. Apresentou biópsia cutânea compatível com farmacodermia. O paciente foi tratado com prednisolona por 4 meses. A tipagem HLA-A-B-DRB1 por PCR-RSSO (ONE LAMBDA) e SSP alelo específico revelou HLA relacionado a reaçoes de hipersensibilidade à carbamazepina. O teste de contato realizado com carbamazepina a 10% no primeiro ano após a reaçao foi positivo. A restriçao futura da classe de anticonvulsivantes aromáticos foi recomendada. Oito meses após a aparente resoluçao clínica da DRESS, o paciente desenvolveu aumento dos anticorpos antitireoideanos e doença de Hashimoto. Treze meses após a o início da reaçao, foi observado aumento nos títulos de FAN, sem manifestaçoes clínicas. Este relato de caso descreve aspectos clínico-laboratoriais típicos de DRESS relativos ao diagnóstico clínico-laboratorial e histopatológico, bem como evoluçao clínica em curto e longo prazos. A abordagem farmacogenética e o teste de contato foram importantes para a confirmaçao da imputabilidade da carbamazepina na etiologia da DRESS.
Descritores: Antígenos HLA, hipersensibilidade a drogas, carbamazepina, DRESS.
INTRODUÇAO
A síndrome de hipersensibilidade a drogas com eosinofilia e sintomas sistêmicos (DRESS) incide em 1/1.000 a 1/10.000 pacientes expostos a anticonvulsivantes, com mortalidade de 10%, e morbidade significativa em curto e longo prazos1. Os anticonvulsivantes aromáticos sao os mais implicados (carbamazepina, fenitoína, fenobarbital e lamotrigina), com reaçoes cruzadas entre eles em até 75% dos casos2. A patogenia relaciona alteraçoes adquiridas ou herdadas nas enzimas que metabolizam os anticonvulsivantes aromáticos, além da reativaçao sequencial de vírus da família herpes e predisposiçao genética determinada por variantes alélicas do HLA3.
O diagnóstico é clínico-laboratorial, baseado em critérios pré-estabelecidos, pois a histopatologia é inespecífica. O envolvimento multissistêmico requer alto índice de suspeiçao e diagnóstico diferencial com outras entidades clínicas. A suspensao imediata da droga e a corticoterapia sao a base do tratamento3. A evoluçao pode ser marcada por reativaçoes clínicas associadas a reativaçoes virais e/ou novas sensibilizaçoes4. O aparecimento de alteraçoes autoimunes nos anos seguintes à reaçao requer acompanhamento clínico prolongado5. Apesar da padronizaçao do teste de contato com medicamentos ainda estar em discussao, este tem sido considerado método seguro, de baixo custo e com boa sensibilidade para casos de DRESS por anticonvulsivantes, especialmente a carbamazepina, permitindo identificar o fármaco envolvido6.
MÉTODOS
Relato de caso acompanhado no Ambulatório de Reaçoes Adversas a Medicamentos (RAM) do Serviço de Alergia e Imunologia de Hospital Universitário, baseado nos dados do prontuário médico. O paciente assinou TCLE para realizaçao de todos os procedimentos descritos no relato do caso. Foi realizado PCR-RSSO para tipagem HLA-A-BDR e SSP alelo específico para identificaçao do alelo A*31:01. O teste de contato com carbamazepina foi preparado nas concentraçoes de 1,5 e 10% em petrolato, com leitura em 96 horas e a classificaçao do resultado segundo o IDCRG (International Contact Dermatitis Research Group)7.
RELATO DO CASO
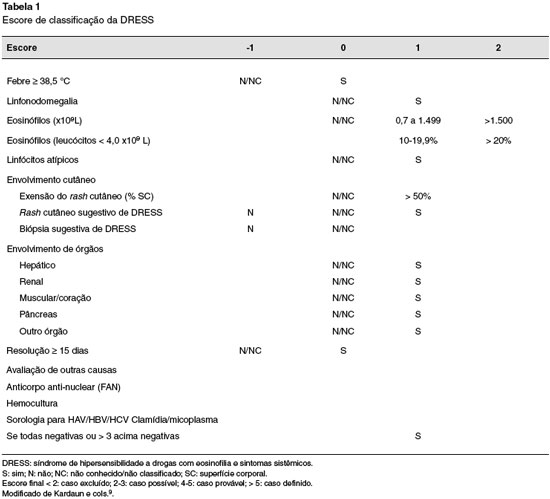
Homem com 69 anos, natural do Japao, aposentado, portador de epilepsia há 12 anos e em uso irregular de ácido valproico, iniciou carbamazepina para controle do quadro. Após 30 dias de uso, procurou pronto-atendimento com quadro de mal estar, febre > 38 °C, rash eritemato-maculopapuloso difuso, com edema centro-facial e linfonodos > 2 cm, móveis, em regiao cervical. A avaliaçao laboratorial revelou eosinofilia sanguínea de 16% (6.200/µL), ALT de 94 U/L e AST de 79 U/L. Foi internado para investigaçao e classificado como caso definido de DRESS (RegiSCAR 7) pelo escore de Kardaun (Tabela 1).
Foi suspensa a carbamazepina, realizada biópsia cutânea e iniciada predinisona 80 mg/dia. Os resultados de amostras coletadas para realizaçao de sorologias para hepatites virais, FAN e hemoculturas foram negativos. As sorologias para detecçao de herpes-vírus solicitadas revelaram infecçao passada para CMV e EBV. A tipagem HLA-A-B-DRB1 por PCR RSSO evidenciou alelos HLA-A*31-24, HLA-B*44-51 e HLA-DRB1*04-04. O laudo histopatológico dos fragmentos de biópsia cutânea foi compatível com farmacodermia (Figura 1). Evoluiu com normalizaçao das enzimas hepáticas e descamaçao cutânea difusa (Figura 2) e recebeu alta após 12 dias em regressao da dose da corticoterapia. Nove dias após a alta, foi reinternado com quadro de dor torácica e dispneia, e recebeu o diagnóstico de pericardite (ECG e ecocardiograma bidimensional com doppler). Permaneceu internado por 15 dias, com boa resposta após aumento das doses de prednisona.
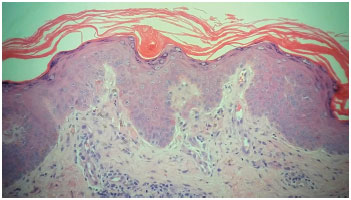
Figura 1 Biópsia cutânea: dermatite de interface com necrose de queratinócitos e infiltrado linfocitário perivascular, sugestivo de farmacodermia
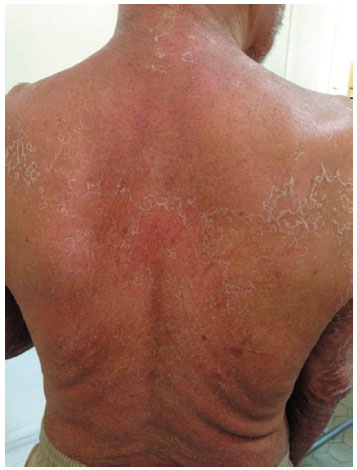
Figura 2 Exantema em fase de descamaçao
Após a alta e durante o seguimento no ambulatório, apresentou lesoes hipo e hipercrômicas residuais. A repetiçao das sorologias identificou reativaçao assintomática do CMV na 10ª semana. A corticoterapia foi suspensa após reduçao lenta da dose durante 120 dias. Após 365 dias desde o início do quadro, foi realizado teste de contato com carbamazepina a 10% em petrolato, cujo resultado foi positivo (+/+++) após 96 horas. Oito meses após o início do quadro, evoluiu com anticorpos antitireoideanos (anti-TPO e anti-TBG) e hipotireoidismo.Treze meses após o início do quadro, apresentou FAN=1/640, padrao nucleolar. Assintomático e sem outras alteraçoes laboratoriais, foi acompanhado ambulatorialmente e apresentou negativaçao do FAN após 6 meses.
O paciente foi orientado a evitar todo o grupo dos anticonvulsivantes aromáticos, pela alta incidência de reaçoes cruzadas entre seus membros. Foi sugerida a tipagem HLA de familiares próximos, se candidatos ao início do uso de anticonvulsivantes.
DISCUSSAO
A DRESS por carbamazepina é uma reaçao de hipersensibilidade imunológica nao imediata, idiossincrásica, considerada imprevisível e nao relacionada à açao farmacológica da droga8. O envolvimento da carbamazepina em reaçoes cutâneas graves, o longo período de latência característico e as manifestaçoes cutâneas com eosinofilia significativa e envolvimento de órgaos sugeriram o diagnóstico de DRESS. A aplicaçao do escore elaborado por Kardaun e cols.9 permitiu a classificaçao e definiçao do caso como DRESS. O laudo histopatológico de infiltrado linfocitário perivascular com dermatite de interface e necrose de queratinócitos, sugestivo de farmacodermia, e a identificaçao do alelo A*31:01 relacionado ao maior risco dessa reaçao com carbamazepina, ajudaram a confirmar o diagnóstico.
A base do tratamento da DRESS consiste na suspensao da droga suspeita e início da corticoterapia (prednisolona) na dose de 1 mg/kg/dia. A DRESS tem curso prolongado, com reativaçoes clínicas, que podem estar relacionadas a reativaçoes virais sequenciais de vírus da família herpes, induzidas pela diminuiçao da defesa antiviral sistêmica consequente ao sequestro de células dendríticas plasmocitoides na pele durante o exantema, além da liberaçao de partículas virais na circulaçao decorrentes da reativaçao do genoma latente dos herpes vírus (HHV6, HHV7, EBV, CMV) presentes nos linfócitos T durante a expansao clonal induzida pela reaçao à droga10. A resposta celular e humoral para o vírus e a desregulaçao imune subsequente perpetuam a reaçao, apesar da suspensao da droga. Outras causas possíveis sao reaçao tipo flare-up após introduçao de novas drogas, motivada pela intensa ativaçao de linfócitos T ou diminuiçao precoce da corticoterapia, com síndrome de reconstituiçao imune4,11.
A reativaçao clínica apresentada pelo paciente, após a melhora inicial com o tratamento, sugere que a diminuiçao precoce da dose do corticosteroide possa ter sido a causa, entretanto, nao se pode afastar a possibilidade de reativaçao do HHV6, HHV7 ou EBV, características na 3ª a 5ª semanas de evoluçao do quadro. As sorologias, mesmo quando negativas, nao afastam a possibilidade de participaçao da reativaçao viral, que pode ocorrer nos órgaos de forma independente da detecçao viral em amostras do sangue periférico. Da mesma forma, sao possíveis reativaçoes sorológicas assintomáticas, como a observada para o CMV na 10ª semana após o início do quadro do paciente10. A participaçao das reativaçoes virais pode ser comprovada pela detecçao do vírus (PCR) ou pela sorologia, com anticorpos específicos da classe IgM, ou aumento de 4 vezes de IgG em titulaçao pareada.
Durante a fase aguda da reaçao, ocorre intensa resposta de células T regulatórias para conter as lesoes em órgaos alvo, com subsequente longo período de exaustao funcional destas células. Complicaçoes autoimunes tardias, com produçao de autoanticorpos e possibilidade de desenvolvimento de doenças autoimunes como diabetes, tireoidites, lúpus eritematoso sistêmico, entre outras, podem ocorrer após períodos variáveis de meses a anos após a resoluçao da fase aguda5.
A confirmaçao da droga suspeita em pacientes com reaçoes cutâneas graves está limitada pela falta de padronizaçao e indisponibilidade dos testes in vitro, além do risco inerente aos testes in vivo12. Os testes de contato sao considerados seguros e têm sido uma ferramenta valiosa para confirmaçao da imputabilidade da droga em casos de DRESS por anticonvulsivantes. Segundo Barbaud e cols.6,os resultados dos testes de contato sao variáveis de acordo com o tipo de reaçao cutânea investigada, sendo mais frequentemente positivos em SHD/ DRESS, com positividade de 64%. Entre os anticonvulsivantes, a positividade é maior para carbamazepina, pelas suas características como lipofilia, reatividade intrínseca e metabolismo cutâneo pelas enzimas xenobióticas12.
Avanços recentes na farmacogenética associam a variante alélica do HLA-A*31;01 ao risco de reaçoes de hipersensibilidade à carbamazepina. A identificaçao deste alelo tem valor para rastreamento de pacientes susceptíveis ao desenvolvimento da DRESS por carbamazepina, bem como para reforço da relaçao causal com reaçoes cutâneas adversas causadas pelo fármaco. A prevalência deste alelo superior a 3% em diversos grupos étnicos a torna variante alélica de risco mundial13. Em pacientes japoneses, a prevalência é de 9%, reforçando a importância do teste genético neste grupo14. Segundo dados publicados na Rede Brasileira de Imunogenética, o perfil genômico dos doadores cadastrados no REDOME, a frequência do grupo alélico A*31 entre os diferentes grupos classificados por cor e raça (preta, amarela, indígena, branca e parda), residentes no Rio de Janeiro, variou de 3,6 a 3,8%15. Entretanto, em populaçao tipicamente miscigenada, variantes alélicas relacionadas a drogas e fenótipos já descritos podem estar relacionadas à proporçao de herança ancestral individual, ou a combinaçoes alélicas ainda desconhecidas.
CONCLUSAO
A DRESS é uma grave reaçao a droga com intensa ativaçao imunológica, reativaçoes virais, envolvimento multissistêmico e desregulaçao imune. A possibilidade de sequelas tardias requer acompanhamento ambulatorial por pelo menos 5 anos após a resoluçao da fase aguda. A confirmaçao da droga envolvida pelo teste de contato positivo e teste farmacogenético com variante alélica relacionada foi fundamental para a orientaçao de restriçoes medicamentosas futuras, e orientaçao farmacogenética do pacientes e de familiares diretos.
REFERENCIAS
1. Husain Z, Reddy BY, Schwartz RA. DRESS syndrome: Part I. Clinical perspectives. J Am Acad Dermatol. 2013; 68(5): 693.e1-e14.
2. Błaszczyk B, Lasoń W, Czuczwar SJ. Antiepileptic drugs and adverse skin reactions: An update. Pharmacol Rep. 2015;67(3):426-34.
3. Criado PR, Avancini J, Santi CG, Medrado AT, Rodrigues CE, Carvalho JF. Drug reaction with eosinophilia and systemic symptoms (DRESS): A complex interaction of drugs, viruses and the immune system. Isr Med Assoc J. 2012;14(9):577-82.
4. Tan SC, Chan GY. Relapsing drug-induced hypersensitivity syndrome. Curr Opin Allergy Clin Immunol. 2016;16(4):333-8.
5. Kano Y, Ishida T, Hirahara K, Shiohara T. Visceral Involvements and long-term sequelae in drug-induced hypersensitivity syndrome. Med Clin North Am. 2010;94(4):743-59.
6. Barbaud A, Collet E, Milpied B, Assier H, Staumont D, Avenel-Audran M, et al. A multicentre study to determine the value and safety of drug patch tests for the three main classes of severe cutaneous adverse drug reactions. Br J Dermatol. 2013;168(3):555-62.
7. Barbaud A, Gonçalo M, Bruynzeel D, Bircher A. Guidelines for performing skin tests with drugs in the investigation of cutaneous adverse drug reactions. Contact Dermatitis. 2001;45(6):321-8.
8. Thong BY, Tan TC. Epidemiology and risk factors for drug allergy. Br J Clin Pharmacol. 2011;71(5):684-700.
9. Kardaun SH, Sidoroff A, Valeyrie-Allanore L, Halevy S, Davidovici BB, Mockenhaupt M, et al. Variability in the clinical pattern of cutaneous side-effects of drugs with systemic symptoms: does a DRESS syndrome really exist? Br J Dermatol. 2007;156(3):609-11.
10. Kano Y, Hiraharas K, Sakuma K, Shiohara T. Several herpesviruses can reactivate in a severe drug-induced multiorgan reaction in the same sequential order as in graft-versus-host disease. Br J Dermatol. 2006;155(2):301-6.
11. Shiohara T, Kurata M, Mizukawa Y, Kano Y. Recognition of immune reconstitution syndrome necessary for better management of patients with severe drug eruptions and those under immunosuppressive therapy. Allergol Int. 2010;59(4):333-43.
12. Elzagallaai AA, Knowles SR, Rieder MJ, Bend JR, Shear NH, Koren G. Patch testing for the diagnosis of anticonvulsant hypersensitivity syndrome: a systematic review. Drug Saf. 2009;32(5):391-408.
13. Amstutz U, Shear NH, Rieder MJ, Hwang S, Fung V, Nakamura H, et al. Recommendations for HLA-B*15: 02 and HLA-A*31: 01 genetic testing to reduce the risk of carbamazepine-induced hypersensitivity reactions. Epilepsia. 2014;55(4):496-506.
14. McCormack M1, Alfirevic A, Bourgeois S, Farrell JJ, Kasperavičiūtė D, Carrington M, et al. HLA-A*31: 01 and carbamazepineinduced hypersensitivity reactions in Europeans. N Engl J. 2011;364(12):1134-43.
15. Rede Brasil de imunogenética [homepage na internet]. Perfil genômico do REDOME/REREME. Frequência do grupo alélico HLA-A*31 em doadores cadastrados no REDOME no Rio de Janeiro [acesso em 24 jan 2017]. Disponível em: www.imunogenética.org.