Número Atual: Outubro-Dezembro 2017 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Esofagite eosinofílica: um conceito em evolução?
Eosinophilic esophagitis: an evolving concept?
Fernanda Marcelino da Silva Veiga; Ana Paula Beltran Moschione Castro; Cristiane de Jesus Nunes dos Santos; Mayra de Barros Dorna; Antonio Carlos Pastorino
DOI: 10.5935/2526-5393.20170054
Instituto da Criança - Hospital das Clínicas da Faculdade de Medicina da Universidade de Sao Paulo (FMUSP), Unidade de Alergia e Imunologia - Sao Paulo, SP, Brasil
Endereço para correspondência:
Fernanda Marcelino da Silva Veiga
E-mail: fefams23@yahoo.com.br
Submetido em: 29/08/2017
Aceito em: 02/10/2017
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
O objetivo deste artigo é revisar a literatura dos últimos 10 anos sobre esofagite eosinofílica (EoE) e descrever os conceitos atuais da doença em seus aspectos de definiçao, fisiopatologia, fatores de risco, quadro clínico, diagnóstico e tratamento. Foram pesquisados artigos na base de dados do PubMed, do Bireme/ LILACS e do SciELO, nos últimos 10 anos. Os critérios para a inclusao dos artigos foram: (a) publicaçao nos últimos 10 anos, (b) artigos originais, (c) apenas humanos, (d) artigos de revisao, (e) diretrizes. Os critérios de exclusao foram: (a) artigos que nao continham como tema principal a EoE, (b) artigos repetidos, (c) descriçao de casos, (d) artigos com abordagem muito específicas para tratamento e diagnóstico. Foi realizada leitura dos resumos por dois pesquisadores, e posterior seleçao dos artigos completos para a leitura. Foram acrescentados estudos que aprofundavam aspectos cruciais da revisao, sendo incluídos, ao todo, 3 consensos, 35 estudos e 3 artigos de revisao, que constituíram o total de artigos analisados. A conclusao é de que a EoE é uma doença crônica, cujos aspectos clínicos sao fundamentais para a suspeita diagnóstica, mas requer a associaçao de achados endoscópicos e histológicos para sua confirmaçao. Na última década, houve modificaçoes significativas nos critérios diagnósticos e algumas novas recomendaçoes no tratamento, mas que necessitam uma observaçao em longo prazo.
Descritores: Esofagite eosinofílica, diagnóstico, patologia, tratamento farmacológico.
INTRODUÇAO
A esofagite eosinofílica (EoE) foi descrita pela primeira vez em 1978 por Landres e cols.1, e , desde 1993, é reconhecida como uma doença, porém somente nos últimos 10 anos houve aumento de publicaçoes sobre o tema2.
Sua prevalência vem aumentando principalmente em países ocidentalizados e áreas geográficas com maior desenvolvimento socioeconômico, e pode afetar indivíduos de todas as idades e raças, sendo mais frequente em caucasianos, do sexo masculino, e está fortemente associada a outras doenças atópicas3-8.
Trata-se de uma condiçao inflamatória crônica do esôfago, caracterizada por infiltraçao significativa e isolada de eosinófilos na mucosa esofágica associada a sintomatologia clínica de disfunçao desse órgao. A EoE é uma importante causa de disfagia e impactaçao alimentar em adultos, sendo considerada a segunda causa mais comum de esofagite crônica, após o refluxo gastroesofágico9.
O diagnóstico de EoE baseia-se principalmente nos sintomas clínicos, na avaliaçao endoscópica, incluindo a histologia e na exclusao de outras doenças que possam acarretar eosinofilia esofágica10. O tratamento envolve o controle da inflamaçao eosinofílica e, neste contexto, a corticoterapia deglutida e restriçoes dietéticas sao as principais alternativas disponíveis11.
Embora o conhecimento sobre EoE tenha aumentado rapidamente, as dificuldades em relaçao ao seu diagnóstico, tratamento e evoluçao vem gerando inúmeras diretrizes.
O objetivo deste trabalho é revisar a literatura dos últimos 10 anos sobre EoE, e descrever os conceitos atuais da doença em seus aspectos de definiçao, fisiopatologia, fatores de risco, quadro clínico, diagnóstico e tratamento.
METODOLOGIA
Trata-se de uma revisao nao sistemática sobre EoE, onde inicialmente foram pesquisados artigos na base de dados do PubMed, do Bireme/LILACS e do SciELO, nos últimos 10 anos (2007-2017). A busca foi realizada por dois autores (FM e ACP) em momentos diferentes, em inglês e português. Foram utilizados os seguintes descritores, palavras e combinaçoes para a busca de dados: Eosinophilic Esophagitis; guidelines. Foram acrescentados estudos que aprofundavam aspectos cruciais da revisao, sendo incluídos ao todo 3 consensos, 35 estudos e 3 artigos de revisao, que complementaram a descriçao.
Os critérios para a inclusao dos artigos foram (a) publicaçao nos últimos 10 anos; (b) artigos originais; (c) apenas humanos; (d) artigos de revisao; (e) diretrizes. Os critérios de exclusao foram (a) artigos que nao continham como tema principal a esofagite eosinofílica; (b) artigos repetidos; (c) descriçao de casos; (d) artigos com abordagem muito específicas para tratamento e diagnóstico. Durante as fases da busca, procedeu-se a análise dos títulos com consequente retirada das duplicatas e a leitura dos resumos, sendo, assim, realizada a seleçao dos artigos completos para leitura, e, por fim, a seleçao dos artigos para serem incluídos na revisao.
As diretrizes para a doença foram também incluídas, e originalmente escritas em 2007 e atualizadas em 2011 e em 201710,12,13.
A seguir serao apresentados e discutidos os seguintes tópicos em relaçao à EoE: definiçao, fisiopatologia, quadro clínico, diagnóstico, tratamento e conclusao.
DEFINIÇAO
A EoE é atualmente definida como uma "doença crônica, esofágica, imunológica e/ou antígeno-mediada, caracterizada clinicamente por sintomas relacionados à disfunçao esofágica e histologicamente por inflamaçao predominante de eosinófilos". É também uma doença onde as informaçoes clínicas e patológicas devem ser consideradas em conjunto, sem nenhum destes parâmetros interpretados isoladamente. É importante destacar que a EoE é classicamente definida como uma doença exclusivamente esofágica, e o achado de eosinófilos em grande quantidade em outros sítios do trato gastrintestinal nos remete a outras doenças11.
Por esta definiçao, fica claro que nao se trata apenas de um infiltrado eosinofílico no esôfago, pois o aumento da infiltraçao epitelial do esôfago por eosinófilos pode estar presente em diversas doenças. Portanto, este aumento requer interpretaçao no contexto clínico em que foi obtido, e isoladamente nao define EoE14. Uma série de outras doenças com características clínicas e histológicas distintas também têm sido associadas à eosinofilia esofágica (Tabela 1).

Em resumo: a EoE é uma doença crônica, recidivante, imunológica e/ou antígeno mediada que acomete somente o esôfago. A doença deve levar em conta as alteraçoes clínicas e patológicas em conjunto.
FISIOPATOLOGIA
Embora nao se tenha exatamente definidas as causas da gênese da EoE, sabe-se que ocorre uma interaçao entre as características genéticas e os fatores ambientais de cada paciente. O nascimento por cesariana, parto prematuro, exposiçao aos antibióticos durante a infância, alergia alimentar, falta de aleitamento materno, permanência em uma área de menor densidade populacional e a falta de exposiçao precoce aos micróbios têm sido associados à esofagite eosinofílica, conferindo a essa doença uma "assinatura" epigenética15,16.
Entre as alteraçoes genéticas possíveis, destacase o polimorfismo de um único nucleotídeo no gene CCL2617. O gene que codifica a eotaxina-3, também conhecido como CCL26, é altamente expresso em pacientes com EoE comparado com indivíduos saudáveis. A eosinofilia e mastocitose tecidual estao fortemente associadas aos níveis de RNAm, e de proteína de eotaxina-3 esofágicos. Além disso, o polimorfismo de um único nucleotídeo no gene da eotaxina-3 em humanos foi associado com susceptibilidade à doença. Em contrapartida, murinos deficientes no receptor de eotaxina (também conhecido como CCR3) foram protegidos da EoE experimental. Estes resultados implicam que a eotaxina-3 é uma molécula efetora para EoE e se relaciona à patogênese da doença17, sendo altamente expressa em células epiteliais esofágicas de pacientes afetados e desempenha um papel importante na quimiotaxia de eosinófilos18,19.
Na análise histopatológica existe, em geral, um infiltrado inflamatório crônico que inclui eosinófilos, mastócitos, basófilos e células T, que produzem citocinas do perfil Th2 (IL-4 e IL-13) e promovem inflamaçao e disfunçao adicional3,7,8.
Muitas citocinas estao implicadas na cascata inflamatória da EoE, em especial a linfopoetina estromal tímica (TSLP) que representa um regulador fundamental da inflamaçao alérgica do tipo Th-2. É secretada por células de linhagem nao hematopoiética, tais como células epiteliais, fibroblastos e células de músculo liso em resposta a citocinas atópicas (IL-4, IL13, TNFa) e alérgenos ambientais. A TSLP encontrase aumentada nas biópsias esofágicas de indivíduos com EoE, em comparaçao com indivíduos nao EoE, e é mais expressa em barreiras epiteliais, incluindo a epiderme na dermatite atópica3,7,8. Os polimorfismos descritos em TSLP estao mais relacionados à EoE, e a deleçao de TSLP num modelo murino de EoE eliminou completamente a eosinofilia esofágica20.
O comprometimento do epitélio da mucosa esofágica pode estar relacionado a disfunçoes na IL-13, desmogleina 1 (DSG1) e filagrinas. A IL-13 ativa a inflamaçao local nas doenças relacionadas com o Th-2, além de regular negativamente a DSG1 e as filagrinas, que atuam na adesao intercelular e estao acentuadamente diminuídas nas biópsias esofágicas de doentes com EoE. Essa permeabilidade epitelial alterada pode levar a um ambiente que facilita a apresentaçao do antígeno, o que, por sua vez, leva ao recrutamento de eosinófilos21.
Sintomas clínicos, como impactaçao alimentar e a disfagia, sao descritos em pacientes com EoE e sao consequência direta do remodelamento da mucosa esofágica e fibrose. Os eosinófilos sintetizam e liberam muitas proteínas e mediadores, em particular a proteína básica principal (MBP), a proteína catiônica eosinofílica, a peroxidase eosinofílica, a neurotoxina derivada de eosinófilo, o TGF-β, a IL-13, e o fator de ativaçao de plaquetas (PAF). Embora todos estes mediadores desempenhem um papel fundamental no dano dos tecidos e remodelaçao, os dados mais consistentes relacionam-se à MBP e ao TGF-β22. A MBP é capaz de danificar diretamente as células epiteliais, mas também induzir a desgranulaçao dos mastócitos, aumentando a liberaçao de enzimas proteolíticas, triptase e quimase, que participam ainda mais da desconstruçao da matriz extracelular23. Do mesmo modo, o TGF-β ativa a produçao de colágeno pelas células epiteliais, contribuindo para a fibrose e sintomas de dismotilidade.
Em resumo: a EoE é uma doença multifatorial que abrange alteraçoes genéticas, ambientais, locais e sistêmicas. Além das alteraçoes presentes no indivíduo, o contato com alérgenos predispoe à doença. A eotaxina-3 é a molécula que mais se relaciona à fisiopatologia da EoE, mas citocinas liberadas de várias células imunológicas e do próprio epitélio da mucosa, fibroblastos e células de músculo liso participam do processo inflamatório que se instala durante a evoluçao da EoE.
QUADRO CLINICO
Apesar de vários estudos descreverem características clínicas da EoE, nao há nenhum sintoma e/ ou sinal ao exame físico patognomônicos de EoE. A clínica é muito variável, inclusive nas diferentes faixas etárias dos pacientes. Muitas vezes os sintomas podem ser confundidos com DRGE (doença do refluxo gastroesofágico)24.
Em lactentes, os sintomas sao pouco específicos, e incluem recusa alimentar ou intolerância, irritabilidade, vômitos, baixo ganho pondero-estatural, ou regurgitaçao. Em crianças, os sintomas mais comuns sao dor abdominal, vômitos, sintomas clássicos de DRGE, disfagia, aversao à comida, dieta muito limitada, ou baixo ganho pondero-estatural. Em adolescentes é comum a disfagia, impactaçao alimentar, náuseas, sintomas de DRGE, ou dieta seletiva. Nos adultos, disfagia e impactaçao alimentar sao marcas de EoE24.
Os sintomas podem ser subestimados como resultado de uma acomodaçao do paciente aos sintomas, como comer devagar, mastigar cuidadosamente, cortar os alimentos em pedaços pequenos, lubrificar alimentos com molhos, beber líquidos para diluir alimentos e evitar pílulas e alimentos consistentes que possam causar desconforto ao deglutir, tais como carnes e paes. Os pacientes podem ter receio em comer em lugares públicos, antecipando dificuldades na alimentaçao. Em casos raros, a esofagite eosinofílica pode manifestar-se com a ruptura espontânea do esôfago devido a vômitos fortes (síndrome de Boerhaave) após uma impactaçao alimentar25.
A impactaçao alimentar é um achado frequente de EoE, e cerca de 50% dos casos onde foi necessária a retirada do alimento em sala de emergência estao relacionados à doença24.
Em resumo: apesar de nao haver nenhum sintoma ou sinal específicos da EoE, alguns sintomas nos remetem à doença, sendo necessários exames que confirmem a hipótese diagnóstica. Os sintomas variam de acordo com a faixa etária, porém a impactaçao alimentar é um sinal clássico, nao patognomônico, da doença.
DIAGNOSTICO
Segundo os últimos consensos, para o diagnóstico e EoE é necessário o paciente apresentar sintomas de disfunçao esofágica, associado a biópsias de mucosas evidenciando pelo menos 15 eosinófilos por campo de grande aumento10,12,13. Primeiramente, há que se excluir as causas secundárias de eosinofilia esofágica, como apresentado na Tabela 1.
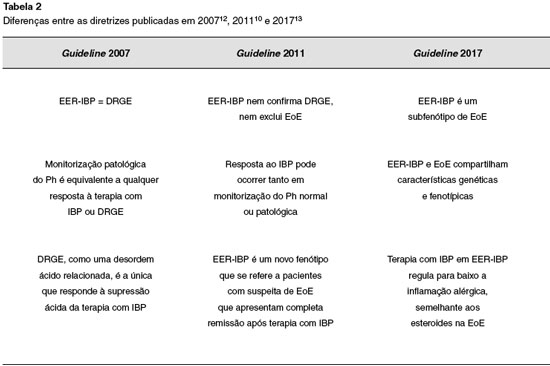
As primeiras diretrizes sobre EoE de 2007 se concentraram na exclusao de todas as outras causas de eosinofilia local e da mucosa do trato digestório, e incluíam recomendaçoes para a terapia com inibidores de bomba de prótons (IBP) para excluir DRGE12. Em 2011, uma nova diretriz chamava atençao para uma doença distinta da EoE que respondia muito bem à terapia com IBP, a chamada "eosinofilia esofágica responsiva a IBP (EoE-rIBP)"10. Em 2015, Wen et al. publicaram estudo de transcriptoma na EoE, e que mostrava a expressao de RNA de 94 genes com presença no esôfago. A análise revelou sobreposiçao de expressao gênica em grande parte nos pacientes com EoE-rIBP daqueles com EoE, incluindo os genes da eotaxina 3, CCL26, relacionados a atividade de mastócitos, moléculas de barreira e remodelaçao tecidual26. Uma nova diretriz publicada em 2017 sobre EoE em adultos evidenciou que os pacientes que respondiam e os que nao respondiam à terapia com IBP apresentavam características fenotípicas, genéticas e mecânicas sobrepostas. A partir disso, ficou definido que a EoE e EoE responsiva a IBP fazem parte da mesma doença, com espectros diferentes. Para a populaçao pediátrica, sao necessários mais estudos para essa diferenciaçao13.
Quando se suspeita de EoE apenas com base nos sintomas, a esofagogastroduodenoscopia (EDA) se faz necessária para avaliar o aspecto morfológico do esôfago, avaliar outras causas potenciais de eosinofilia esofágica e obter biópsias esofágicas.Também nao há achados endoscópicos patognomônicos de EoE, porém algumas alteraçoes sao altamente sugestivas, com destaque a: anéis esofágicos, que podem ser fixos (traquealizaçao esofágica ou ondulaçao) ou transitórios; sulcos lineares ou longitudinais, que sao sulcos mucosos que correm paralelos ao eixo longo do esôfago; e placas brancas ou exsudatos, que podem revestir o esôfago e mimetizar candidíase esofágica. Em alguns casos, a mucosa se apresenta pálida ou tem vascularizaçao diminuída. Em um esôfago de calibre estreito, a mucosa frágil, conhecida como "mucosa em papel crepom" pode romper com a passagem do endoscópio24.
As biópsias esofágicas sao mandatórias para diagnosticar EoE, pois estudos apontam que 10 a 20% dos doentes com EoE podem ter um esôfago endoscopicamente normal. Neste contexto, recomenda-se a realizaçao de biópsias esofágicas em todos os doentes suspeitos de EoE, incluindo todos aqueles submetidos a EDA para disfagia sem causa aparente, independentemente dos achados endoscópicos10.
Vale lembrar que é necessário realizar biópsia do esôfago, estômago, e duodeno, especialmente na primeira endoscopia, para descartar outras doenças gastrintestinais que também cursam com infiltrados eosinofílicos.
É reconhecido que uma biópsia isolada esofágica tem baixa sensibilidade (55%) para o diagnóstico de EoE. Realizar o mínimo de seis biópsias aumenta a sensibilidade para 99%. As biópsias em esôfago médio e distal ajudam a distinguir EoE da eosinofilia associada à esofagite de refluxo, pois há nesta última menor concentraçao de eosinófilos no esôfago proximal. Focalizar biópsias em sulcos e exsudatos também pode melhorar a sensibilidade11. Com base em diretrizes, o diagnóstico requer 15 eosinófilos ou mais por campo de grande aumento em pelo menos um sítio esofágico11,13.
O exame radiográfico é de valor limitado no diagnóstico de EoE, embora em certas circunstâncias o esofagograma de bário possa ajudar a detectar estenoses sutis ou o estreitamento luminal difuso27. Dois estudos recentes relataram que 71% dos adultos, e 55% das crianças com esofagite eosinofílica nao tinham estreitamento esofágico reconhecido no momento da EDA, mas tinham evidências de estreitamento no momento da esofagografia28,29.
Em resumo: o diagnóstico de EoE envolve anamnese e investigaçao laboratorial que inclui a EDA e a avaliaçao histopatológica. A Tabela 2 resume as principais diferenças entre as Diretrizes de EoE.
TRATAMENTO
O tratamento da EoE ainda é um desafio. Pacientes com EoE podem ter uma incompatibilidade entre sintomas e características histopatológicas, o que cria a necessidade de múltiplas avaliaçoes da atividade da doença. Os objetivos do tratamento incluem o alívio dos sintomas, o controle da inflamaçao, e a restauraçao da funçao esofágica25.
A abordagem utilizada para atingir esses objetivos se resumem em "3-Ds": dieta, drogas e dilataçao. Quando possível, a terapia deve incluir equipe multidisciplinar com gastroenterologista, alergista e nutricionista25.
Atualmente, existem três estratégicas terapêuticas dietéticas:
1. Dieta de eliminaçao de todos os alérgenos alimentares, utilizando fórmula baseada em aminoácidos;
2. Dieta de restriçao alimentar orientada por testes de alergia (pesquisa de IgE específica por testes cutâneos de punctura ou séricos e patch test );
3. Dieta empírica de eliminaçao de seis alimentos, que exclui da dieta do doente os seis grupos de alimentos mais comumente conhecidos como desencadeantes de EoE: soja, ovo, leite, trigo, nozes e frutos do mar14.
Spergel et al. realizaram, em 2002, o primeiro estudo prospectivo com dieta de restriçao dirigidas por testes de alergia em crianças. Neste estudo, 26 crianças realizaram teste de puntura e patch test,e após foram submetidas a dietas de restriçao direcionadas pelo resultado dos testes por pelo menos 6 semanas30. Das 24 crianças que foram seguidas, 75% tiveram melhora dos sintomas, e todas tiveram melhora significativa na biópsia esofágica, com diminuiçao de 50% nos eosinófilos/campo de grande aumento (eos/cga). Publicaçoes subsequentes deste mesmo grupo evidenciaram taxa de sucesso de apenas 53% para dietas dirigidas com testes alérgicos31,32.
Os estudos que avaliaram a dieta de restriçao de acordo com resultados de testes alérgicos (teste de puntura e patch test) em adultos sao mais limitados. Em 2006, Simon et al. descreveram seis adultos com EoE sensibilizados à gramínea, centeio e trigo. Esses indivíduos evitaram centeio e trigo por 6 semanas, e apenas 1 paciente apresentou melhora em seus sintomas clínicos33.
Em 2012, Molina-Infante et al. realizaram um estudo prospectivo em que 22 adultos com EoE foram submetidos a teste de puntura, patch test e prick to prick para 26 alimentos diferentes34. Dezessete destes pacientes seguiram entao uma dieta orientada pelo teste de alergia durante 6 semanas, e apenas 5 (29%) obtiveram remissao histológica (≤ 15 eos/ cga). Em 2014, Wolf et al. realizaram uma revisao retrospectiva de sua populaçao de adultos com EoE e, aproximadamente, 32% dos pacientes que seguiram a dieta de restriçao baseada no teste alérgico obtiveram remissao histológica (≤ 15 eos/cga)35. Esses dois últimos estudos foram incluídos em uma revisao sistemática, que demonstrou uma taxa de remissao de apenas 32,2% (95% IC; 17,8-48,7%) para esta terapia em adultos36. Estes estudos relataram consistentemente a baixa eficácia de dietas dirigidas por testes de alergia.
A dieta elementar demonstra uma alta taxa de resposta (quase 90% em crianças, 70% em adultos), com um rápido alívio dos sintomas associados à remissao histológica. Esta dieta contempla o uso de fórmulas baseadas em aminoácidos por 4-6 semanas, seguida pela avaliaçao histológica da resposta. Se a remissao é alcançada, os alimentos sao reintroduzidos lentamente, seguindo um esquema rigoroso que contempla quatro grupos de alimentos diferentes, com base no seu potencial alergênico9. Um único alimento de cada grupo deve ser reintroduzido a cada 5-7 dias. Na ausência de recorrência dos sintomas, a avaliaçao endoscópica e histológica deve ser realizada antes de iniciar a reintroduçao de alimentos de outro grupo. Se um alimento determina sintomas esofágicos, este deve ser excluído, e o próximo alimento do mesmo grupo testado. Apesar da alta taxa de resposta, esta dieta raramente é aceita pelos pacientes. Questoes como palatabilidade, grande restriçao alimentar e ausência de alimentos sólidos na dieta podem contribuir para a baixa taxa de adesao e comprometimento da qualidade da vida do paciente. Casos mais graves demandam colocaçao de sonda de alimentaçao para a administraçao da fórmula. Outros aspectos a serem avaliados incluem custo elevado e comprometimento nutricional9.
As dietas empíricas baseiam-se na exclusao dos alimentos mais alergênicos, como leite de vaca, soja, trigo, ovo, amendoim/nozes e peixe/frutos do mar, independentemente de testes alérgicos. Esta terapia dietética mostrou uma taxa de resposta de quase 70% em crianças e adultos. No entanto, se a remissao é alcançada, uma avaliaçao endoscópica e histológica deve ser realizada após a reintroduçao de cada alimento9.
A terapia medicamentosa envolve basicamente o uso de IBP e/ou esteroides deglutidos, bastante eficazes no controle da EoE.
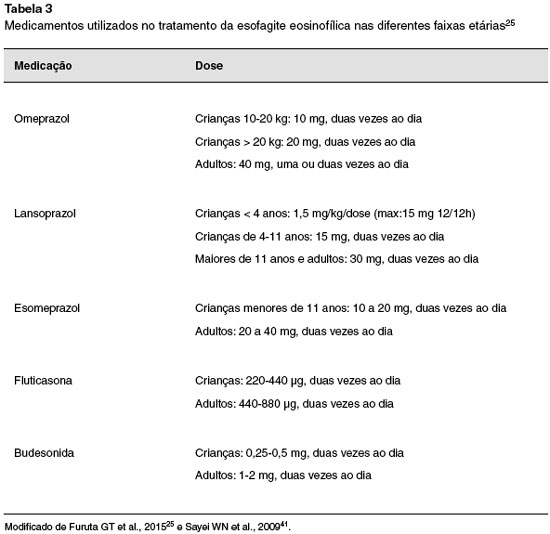
O uso de IBP pode melhorar os sintomas em pacientes que apresentam DRGE e/ou simultaneamente ser eficaz no tratamento de EoE em adultos. Há duas teorias que explicam a eficácia dos IBPs na EoE: uma delas é que os IBPs restauram a barreira epitelial comprometida pela secreçao ácida, onde o ácido aumenta a permeabilidade da mucosa, permitindo o influxo de alérgenos e ativando a resposta inflamatória mediada por Th2. A segunda teoria destaca o papel anti-inflamatório da terapia com IBP, reduzindo os níveis de mediadores inflamatórios (como eotaxina-3, IL-4, IL-5 e IL-13) independentemente dos seus efeitos na secreçao ácida37. A dose recomendada de IBP é de 1-2 mg/kg/dia, máximo de 40-80 mg/dia.
Os esteroides, disponíveis como inaladores multidose ou soluçoes aquosas para nebulizaçao de uso em asma, sao deglutidos, ao invés de inalados, a fim de revestir a parede do esôfago, atuando de maneira tópica. Em caso do uso de sprays dosimetrados, como por exemplo fluticasona, o paciente é orientado a colocar o spray na boca de maneira invertida, apertar o dispositivo e deglutir o medicamento liberado. Um pequeno enxague da boca é recomendado, sem a deglutiçao de nenhum líquido ou qualquer alimento por 30 a 60 minutos14.
Outra alternativa que se mostrou eficaz em ensaios randomizados é a budesonida em sua apresentaçao aquosa. Para que se torne viscosa, pode-se misturar à sucralose (2 mL de budesonida + 5 mg de sucralose) que altera sua consistência, facilitando a adesao à mucosa esofágica38,39. Estudos mostram que a forma viscosa oral de budesonida foi mais eficaz do que a utilizaçao de spray dosimetrado deglutido. As doses das medicaçoes estao descritas na Tabela 3.
Estudos avaliando eventos adversos com esteroides tópicos sao escassos, mas sabe-se que a candidíase esofágica é a complicaçao mais comum (5-26%) especialmente em pacientes que utilizam doses elevadas11.
A dilataçao para aliviar o estreitamento esofágico tem sido utilizada mais em adolescentes e adultos.
Estudos anteriores sugeriam uma alta taxa de complicaçoes relacionadas à dilataçao, porém relatos mais recentes mostram uma taxa de perfuraçao de menos de 1% (3 casos de 992 dilataçoes)40. Deve ser realizada gradualmente, ao longo de várias sessoes e 75% dos pacientes podem apresentar dor torácica após o procedimento. A dilataçao resolve temporariamente o estreitamento luminal, porém nao trata o processo inflamatório subjacente, podendo apresentar recorrências do quadro.
Um terço dos pacientes com EoE nao respondem ao tratamento convencional com esteroides tópicos ou dietas, o que tem levado os pesquisadores a uma busca constante por uma terapia antieosinofílica11.
A azatioprina e 6-mercaptopurina podem ter um papel importante na remissao e manutençao em longo prazo em alguns pacientes com EoE, porém mais estudos sao necessários. Os anti-leucotrienos, anti-histamínicos e cromoglicato dissódico e o anti-IgE nao apresentaram eficácia no tratamento de EoE. Os imunobiológicos anti-IL5, mepolizumab e reslizumab, e o anti-IL-13 (QAX576) reduziram a eosinofilia esofágica, porém sem qualquer efeito sobre os sintomas11,13.
A eficácia de qualquer terapia farmacológica/ dietética deve ser verificada por meio de uma endoscopia de seguimento após um curso inicial de 6 a 12 semanas, porém o seguimento desse paciente deve ser individualizado, sendo necessário realizar EDA a cada 3 meses ou se piora dos sintomas13. É controversa a terapia de manutençao a longo prazo em pacientes com menos que 15 eos/cga na EDA e/ ou ausência de sintomas25.
Evidências até o momento indicam que a esofagite eosinofílica nao representa uma doença pré-maligna e nao diminui o tempo de vida. Podem ocorrer períodos de remissao dos sintomas espontaneamente ou induzida por dilataçao, sem necessidade de restriçao dietética ou abordagem terapêutica. No entanto, na maioria dos pacientes, a EoE é uma doença crônica, e se o tratamento é interrompido, a inflamaçao e os sintomas podem recorrer, promovendo uma reduçao na qualidade de vida desses pacientes25.
Por se tratar de uma doença recentemente conhecida, a sua história natural ainda nao está bem definida, sendo necessários mais estudos para o melhor entendimento da doença e sua abordagem terapêutica a longo prazo visando a qualidade de vida do doente, reduzindo possíveis complicaçoes futuras.
Em resumo: o tratamento da EoE é individualizado. O médico pode optar pela dieta, medicamentos e, em alguns casos, pela dilataçao esofágica. É necessário avaliar cada paciente e posteriormente decidir em conjunto com o paciente e seus familiares pela melhor abordagem e a eficácia de cada terapia revista por EDA após 6 a 12 semanas. Em alguns casos poderá ser indicado mais de uma intervençao (medicamentosa e dietética, por exemplo) podendo ser intercambiável. Contudo, sabemos que é um tratamento complexo e que dificilmente o paciente receberá alta das especialidades, uma vez que se trata de uma doença crônica e recidivante.
CONCLUSAO
A EoE tem estado cada vez mais presente nos consultórios de clínicos, pediatras, alergologistas e gastroenterologistas, devendo fazer parte dos diagnósticos diferenciais. O olhar cuidadoso sobre os sintomas clínicos, muitas vezes inespecíficos, poderá guiar os profissionais que lidam com esses pacientes para a suspeiçao e início da investigaçao. Será necessário estabelecer o perfil de atopia do paciente e da família e proceder a realizaçao de exames mais invasivos, quando necessários. A estratégia terapêutica poderá demandar um prévio tratamento com inibidores de bomba de prótons, e posteriormente a decisao de tratamento irá incluir abordagem dietética e/ou uso de terapêutica antiinflamatória.
A EoE é uma doença crônica, que requer observaçao e tratamento em longo prazo, sendo necessária a individualizaçao do paciente em seu seguimento clínico e a adequaçao nutricional, terapêutica e indicaçao de novos exames.
REFERENCIAS
1. Landres RT, Kuster GGR, Strum WB. Eosinophilic esophagitis in a patient with vigorous achalasia. Gastroenterology. 1978;74:1298-301.
2. Attwood SEA, Smyrk TC, DeMeester TR, et al. Esophageal eosinophilia with dysphagia: a distinct clinicopathological syndrome. Dig Dis Sciences. 1993;38:109-16.
3. Spergel JM, Brown-Whitehorn TF, Beausoleil JL, et al. 14 years of eosinophilic esophagitis: clinical features and prognosis. J Pediatr Gastroenterol Nutr. 2009;48:30-6.
4. Moawad FJ, Veerappan GR, Lake JM, et al. Correlation between eosinophilic esophagitis and aeroallergens. Aliment Pharmacol Ther. 2010;31:509-15.
5. Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen MM, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol. 2011;128:1349-50.
6. Sperry SL,Woosley JT,Shaheen NJ, et al. Influence of race and gender on the presentation of eosinophilic esophagitis. Am J Gastroenterol. 2012;107:215-21.
7. Moawad FJ, Veerappan GR, Dias JA, et al. Race may play a role in the clinical presentation of eosinophilic esophagitis. Am J Gastroenterol. 2012;107:1263.
8. Dellon ES. Epidemiology of eosinophilic esophagitis. Gastroenterol Clin North Am. 2014;43:201-18.
9. D'Alessandro A, Esposito D, Pesce M, Cuomo R, Palma GD, Sarnelli G. Eosinophilic esophagitis: from pathophysiology to treatment. World J Gastrointest Pathophysiol. 2015;6(4):150-8.
10. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, et al. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011;128:3-20.
11. Singla MB, Moawad FJ. An overview of the diagnosis and management of eosinophilic esophagitis. Clin Transl Gastroenterol. 2016;7:e155.
12. Furuta GT, Liacouras CA, Collins MH, et al. Eosinophilic esophagitis in children and adults: a systematic review and consensus recommendations for diagnosis and treatment. Gastroenterology. 2007;133:1342-63.
13. Lucendo AJ, Molina-Infante J, Arias A, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adult. United European Gastroenterol J. 2017;5(3):335-58.
14. Dellon ES, Gonsalves N, Hirano I, Furuta GT, Liacouras CA, Katzka DA. Clinical guideline: evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). Am J Gastroenterol. 2013;108:679-92.
15. Jensen E, Hoffman K, Shaheen NJ, Genta RM, Dellon ES. Esophageal eosinophilia is increased in rural areas with low population density: results from a national pathology database. Am J Gastroenterol. 2014;109:668-75.
16. Jensen ET, Kappelman MD, Kim HP, Ringel-Kulka T, Dellon ES. Early life exposures as risk factors for pediatric eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2013;57:67-71.
17. Blanchard C, Wang N, Stringer KF, Mishra A, Fulkerson PC, Abonia JP, et al. Eotaxin-3 and a uniquely conserved gene expression profile in eosinophilic esophagitis. J Clin Invest. 2006;116:536-47.
18. Fujiwara H, Morita A, Kobayashi H, Hamano K, Fujiwara Y, Hirai K, et al. Infiltrating eosinophils and eotaxin: their association with idiopathic eosinophilic esophagitis. Ann Allergy Asthma Immunol. 2002;89:429-32.
19. Blanchard C, Stucke EM, Burwinkel K, Caldwell JM, Collins MH, Ahrens A, et al. Coordinate interaction between IL-13 and epithelial differentiation cluster genes in eosinophilic esophagitis. J Immunol. 2010;184:4033-41.
20. Spergel JM. An Allergist's perspective to the evaluation of eosinophilic esophagitis. Best Pract Res Clin Gastroenterol. 2015;29(5):771-81.
21. Sherrill JD, Kc K, Wu D, et al. Desmoglein-1 regulates esophageal epithelial barrier function and immune responses in eosinophilic esophagitis. Mucosal Immunol. 2014;7:718-29.
22. Travers J, Rothenberg ME. Eosinophils in mucosal immune responses. Mucosal Immunol. 2015;8:464-75.
23. Gleich GJ, Frigas E, Loegering DA, Wassom DL, Steinmuller D. Cytotoxic properties of the eosinophil major basic protein. J Immunol. 1979;123:2925-27.
24. Dellon ES. Eosinophilic esophagitis: Diagnostic tests and criteria. Curr Opin Gastroenterol. 2012;28(4):382-8.
25. Furuta GT, Katzka DA. Eosinophilic esophagitis. N Engl J Med. 2015;373:1640-8.
26. Wen T, Dellon ES, Moawasa FJ, Furuta GT, et al. Transcriptome analysis of PPI-REE reveals PPI-reversible allergic inflammation. J Allergy Clin Immunol. 2015;135:187-97.
27. Allen BC, Baker ME, Falk GW. Role of barium esophagography in evaluating dysphagia. Cleve Clin J Med. 2009;76:105-11.
28. Gentile N, Katzka D, Ravi K, et al. Oesophageal narrowing is common and frequently under-appreciated at endoscopy in patients with oesophageal eosinophilia. Aliment Pharmacol Ther. 2014;40:1333-40.
29. Menard-Katcher C, Swerdlow MP, Mehta P, Furuta GT, Fenton LZ. Contribution of esophagram to the evaluation of complicated pediatric eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2015;61(5):541-6.
30. Spergel JM, Beausoleil JL, Mascarenhas M, et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002;109(2):363-8.
31. Spergel JM, Andrews T, Brown-Whitehorn TF, et al. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests. Ann Allergy Asthma Immunol. 2005;95(4):336-43.
32. Spergel JM, Brown-Whitehorn TF, Cianferoni A, et al. Identification of causative foods in children with eosinophilic esophagitis treated with an elimination diet. J Allergy Clin Immunol. 2012;130(2):461-7.
33. Simon D, Straumann A, Wenk A, et al. Eosinophilic esophagitis in adults - no clinical relevance of wheat and rye sensitizations. Allergy. 2006;61(12):1480-3.
34. Molina-Infante J, Martin-Noguerol E, Alvarado-Arenas M, Porcel-Carreño SL, Jimenez-Timon S, Hernandez-Arbeiza FJ. Selective elimination diet based on skin testing has suboptimal efficacy for adult eosinophilic esophagitis. J Allergy Clin Immunol. 2012;130(5):1200-2.
35. Wolf WA, Jerath MR, Sperry SL, Shaheen NJ, Dellon ES. Dietary elimination therapy is an effective option for adults with eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2014;12(8):1272-9.
36. Arias A, Gonzalez-Cervera J, Tenias JM, Lucendo AJ. Efficacy of dietary interventions for inducing histologic remission in patients with eosinophilic esophagitis: a systematic review and meta-analysis. Gastroenterology. 2014;146(7):1639-48.
37. Molina-Infante J, Gisbert JP. Letter: PPI-responsive oesophageal eosinophilia - from initial scepticism to consistent prospective data. Aliment Pharmacol Ther. 2014;39:229-30.
38. Aceves SS, Bastian JF, Newbury RO, Dohil R. Oral viscous budesonide: a potential new therapy for eosinophilic esophagitis in children. Am J Gastroenterol. 2007;102:2271-9.
39. Aceves SS, Dohil R, Newbury RO, Bastian JF. Topical viscous budesonide suspension for treatment of eosinophilic esophagitis. J Allergy Clin Immunol. 2005;116:705-6.
40. Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther. 2013;38:713-20.
41. Sayei WN, Patel R, Backer RD, Tron E, Backer SS. Treatment with high-dose proton pump inhibitors helps distinguish eosinophilic esophagitis from noneosinophilic esophagitis. Journal of Pediatric Gastroenterology and Nutrition. 2009;49:393-9.