Número Atual: Julho-Setembro 2017 - Volume 1 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Avaliação do teste do soro autólogo e do teste do plasma autólogo na urticária crônica espontânea
Evaluation of autologous serum skin test and autologous plasma skin test in chronic spontaneous urticaria
Cristiane Fernandes Moreira Boralli1; Sérgio Duarte Dortas Júnior2; Bruno Emanuel Carvalho Oliveira3; Alfeu Tavares França4; Solange Oliveira Rodrigues Valle5
DOI: 10.5935/2526-5393.20170039
1. Alergista e Imunologista
2. Doutorando de Alergia e Imunologia, HUCFF-UFRJ
3. Titulado em Alergia e Imunologia pela ASBAI
4. Professor Livre-docente da Disciplina de Alergia e Imunologia do HUCFF-UFRJ
5. Chefe do Serviço de Alergia e Imunologia do HUCFF-UFRJ
Endereço para correspondência:
Solange Oliveira Rodrigues Valle
E-mail: solangervalle@gmail.com
RESUMO
OBJETIVO: Comparar o teste do soro autólogo (TSA) e o teste do plasma autólogo (TPA) para o diagnóstico de autorreatividade em pacientes com urticária crônica espontânea (UCE) e avaliar sua relaçao com autoanticorpos antitireoidianos.
MÉTODOS: Cinquenta pacientes com UCE foram pareados por sexo e faixa etária a 50 indivíduos saudáveis (controle) e comparados em relaçao aos resultados do TSA e TPA e autoimunidade tireoidiana.
RESULTADOS: Vinte e três (46%) pacientes e 5 (10%) controles apresentaram TSA positivo; 16 (32%) pacientes e 7 (14%) controle apresentaram TPA positivo. Houve associaçao entre funçao tireoidiana e TSA em pacientes com UCE. Pacientes eutireóideos com UCE tiveram taxa maior de TSA positivo.
CONCLUSAO: O TSA é simples e barato e contribui consideravelmente para a elucidaçao da patogênese da UCE e pode demonstrar a presença de autoanticorpos funcionais. Alguns autores sugerem que o TPA é mais sensível que o TSA. Todos os estudos relevantes sobre o assunto até o momento reportaram que ambos podem ser utilizados como métodos diagnósticos em pacientes com UCE. Concluindo, TSA e TPA podem ser utilizados para a avaliaçao de autorreatividade na etiologia da UCE, e autoanticorpos antitireoidianos devem ser investigados mesmo quando testes de funçao tireoidiana revelam-se normais.
Descritores: Urticária, testes cutâneos, autoimunidade.
INTRODUÇAO
Urticária crônica (UC) é uma doença frequente da pele, caracterizada por pápulas recorrentes, transitórias, com lesoes individuais durando cerca de 4 a 24 horas, acompanhada ou nao de angioedema, por um período superior a 6 semanas. Sua frequência é maior nos adultos, especialmente mulheres de meia-idade. A duraçao do quadro é variável. Em 50% dos casos, permanece em torno de 12 meses, podendo persistir por mais de 20 anos em 20% dos pacientes. Ocorre aproximadamente em 0,1% da populaçao, podendo ser grave e de difícil controle. Em 40% dos casos, está associada a angioedema, que frequentemente acomete face, lábios e extremidades. A UC representa um desafio para o médico e para o paciente. No médico, causa frustraçao e distúrbio do seu bem-estar intelectual pela dificuldade na identificaçao etiológica e tratamento da doença. No paciente, estas mesmas dificuldades podem repercutir, ocasionando uma instabilidade emocional e também deterioraçao da qualidade de vida inerente ao quadro clínico da doença1,2.
Segundo Augey et al., as causas de urticária crônica podem incluir infecçoes crônicas, intolerância alimentar, doenças inflamatórias crônicas nao infecciosas (como gastrite, esofagite, etc.) e atopia3. Entretanto, uma causa nao é identificada em aproximadamente 70% dos pacientes4,5. Este grupo de pacientes sao designados como portadores de urticária crônica espontânea (UCE), que é subdividida em "urticária crônica autoimune (UCAI)" e "urticária crônica idiopática (UCI)". A UCAI é responsável por 25% dos pacientes com UCE5.
Há evidências indicando a presença de autoanticorpos funcionais IgG contra a subunidade alfa (Fc_RI_) dos receptores de alta afinidade de IgE de basófilos e mastócitos e contra a própria IgE em pacientes com UCAI. Esses autoanticorpos no soro de pacientes com UC sao capazes de ativar mastócitos e basófilos, promovendo a liberaçao de mediadores pré e neoformados, sugerindo o mecanismo autoimune da doença. A presença desses autoanticorpos foi demonstrada através do teste do soro autólogo (TSA), tendo sido observado por alguns autores, como Grattan et al. e Hide et al., uma positividade de 30% em pacientes com UC6,7.
O TSA é utilizado no diagnóstico de UCAI desde 1940, e uma reaçao positiva é detectada geralmente durante as fases ativas da doença. Recentemente, Asero et al. reportaram que o teste do plasma autólogo (TPA) é mais sensível que o TSA, mas nao pode ser considerado um teste isolado de triagem para detecçao de autoanticorpos funcionais. Entretanto, há poucos estudos sobre o assunto na literatura8,9.
Na década de 1980, foi feita a primeira descriçao da relaçao da UC e angioedema com autorreatividade, através da observaçao da incidência aumentada de anticorpos antitireoidianos nestes pacientes com relaçao à populaçao em geral10. A incidência de autoanticorpos antitireoidianos na UC e angioedema varia de 15 a 24%. Na UCAI é de 27%; na UCI, de 11%; e na populaçao em geral, de 7 a 8%11,12.
Há muitos estudos que apoiam a relaçao entre autorreatividade contra a tireoide e urticária10,13. A presença e a gravidade da UC em pacientes com tireoidite autoimune têm sido descritas como significativamente maiores do que em pacientes com autoanticorpos contra a tireoide negativos e indivíduos saudáveis2,14,15. O objetivo deste estudo é comparar o TSA e o TPA para o diagnóstico de autorreatividade em pacientes com UCE em termos de eficácia e viabilidade, e avaliar sua relaçao com autoanticorpos contra a tireoide, permitindo, assim, a seleçao do tratamento mais apropriado para cada paciente.
MATERIAIS E MÉTODOS
Cinquenta pacientes com UCE e 50 controles, pareados em relaçao a sexo e faixa etária, foram incluídos nesse estudo prospectivo. O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário Clementino Fraga Filho, em sua Reuniao Extraordinária realizada em 28 de maio de 2007, de acordo com o Protocolo de Pesquisa: 001/05 - CEP. Termo de Consentimento Livre e Esclarecido (TCLE) foi obtido de todos os pacientes e voluntários antes do início do estudo. História médica detalhada foi obtida de cada paciente e exames físicos seriados e exames laboratoriais de rotina (hemograma, IgE, entre outros) foram realizados em todos. Outras causas de UCE foram excluídas. Pacientes com urticária física também foram excluídos. A maioria dos pacientes inscritos neste estudo receberam pelo menos um anti-histamínico e/ou estabilizador de mastócito previamente, e nao obtiveram benefício com o tratamento a longo prazo apenas com essas medicaçoes. Corticosteroides sistêmicos foram utilizados por curto prazo, apenas nos ataques agudos.
Ambos os grupos foram submetidos ao TSA e ao TPA e realizadas dosagens de TSH, T4L, anti-tireoperoxidase (TPO) e anti-tireoglobulina (TG). Foram suspensos anti-histamínicos por 72 horas e estabilizadores de mastócitos por 8 dias antes da realizaçao do TSA e do TPA. Em relaçao aos testes, adrenalina, hidrocortisona e anti-histamínicos foram deixados preparados para a possibilidade de uma reaçao anafilática. Para o TSA, amostras de 5 mL de sangue venoso foram obtidas de todos os pacientes e grupo controle em tubos estéreis e sem anticoagulante. Para o TPA, as amostras foram colocadas em tubos estéreis contendo citrato de sódio. Os tubos foram deixados em repouso durante 30 minutos em temperatura ambiente para retraçao do coágulo. Foram centrifugadas a 2500 rpm durante 5 minutos.
Após assepsia, 0,05 mL do soro e 0,05 mL do plasma foram injetados por via intradérmica em área nao comprometida, na superfície volar do antebraço direito, a 5 cm de distância. 0,05 mL de soluçao salina estéril foi utilizado como controle negativo. Na superfície volar do antebraço esquerdo, aplicouse na forma de puntura 0,01 mL de histamina na concentraçao de 0,1 mg%, como controle positivo. Após 30 minutos das injeçoes, foram medidos os diâmetros horizontal e vertical das pápulas. O teste foi considerado positivo quando as pápulas do soro e do plasma autólogos foram, no mínimo, 1,5 mm maior que a pápula da soluçao salina. A dosagem de autoanticorpos antitireoidianos foi realizada utilizando o sistema Immulite 2000.
Foram feitas análises separadas para cada informaçao relativa à doença (presença de autoanticorpos tireoidianos, intervalo entre ataques e duraçao das pápulas) e para cada teste (TSA e TPA). Foi desenvolvida ainda uma análise conjunta, que buscou verificar se a consideraçao conjunta dos testes é estatisticamente significativa na previsao de ocorrência da presença de autoanticorpos tireoidianos, intervalo entre ataques e duraçao das pápulas. Na análise separada para cada teste, foram considerados os testes de Qui-quadrado para a presença de autoanticorpos tireoidianos e o teste t de Student para o intervalo entre ataques e duraçao das pápulas. No caso da análise conjunta, considerou-se o modelo logístico para a presença de autoanticorpos tireoidianos, e a ANOVA para o intervalo entre ataques e duraçao das pápulas. Objetivando-se analisar a associaçao entre os níveis de hormônios tireoidianos e a presença de autoanticorpos tireoidianos, tanto do grupo dos pacientes quanto do grupo controle, foi feito o teste Qui-quadrado entre TSH e T4L e anti-TPO e anti-TG e o teste Qui-quadrado entre a variável de grupo (doença versus controle) e as variáveis TSA e TPA. Todos os testes de hipóteses desenvolvidos nesse trabalho consideraram uma significância de 5%, ou seja, a hipótese nula foi rejeitada quando p-valor foi menor ou igual a 0,05.
RESULTADOS
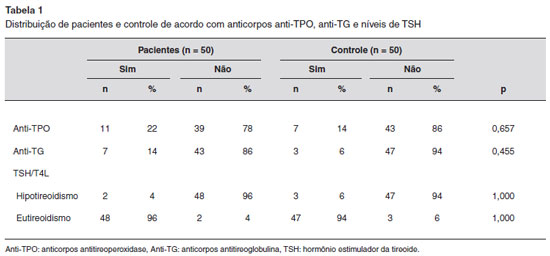
Um total de 7 (14%) pacientes masculinos e 43 (86%) femininos com idade média de 49,2 anos e 7 (14%) masculinos e 43 (86%) femininos saudáveis com idade média de 47,72 anos foram incluídos neste estudo. Os pacientes e o grupo controle foram estatisticamente similares nas distribuiçoes por faixa etária e sexo (idade média, p = 0,472; sexo, p = 0,982). Nao houve diferenças estatisticamente significativas na autoimunidade tireoidiana e funçao tireoidiana entre os pacientes e o grupo controle (Tabela 1).
Um total de 23 (46%) pacientes teve TSA positivo, e 27 (54%) pacientes tiveram TSA negativo, enquanto 16 (32%) dos pacientes tiveram TPA positivo e 34 (68%) dos pacientes tiveram TPA negativo. Nove pacientes tiveram TSA e TPA positivos, e 20 pacientes tiveram TSA e TPA negativos. Quatorze pacientes com TSA positivo tiveram TPA negativo, enquanto sete pacientes com TPA positivo tiveram TSA negativo.
No grupo controle, 5 (10%) tiveram TSA positivo, e 45 (90%) tiveram TSA negativo. O TPA foi positivo em 7 indivíduos (14%) do grupo controle, e negativo em 43 (86%). A positividade do TSA e TPA foi estatisticamente diferente entre pacientes e grupo controle. A positividade do TSA e TPA foi significativamente maior no grupo dos pacientes comparado ao grupo controle (TSA, p < 0,001;TPA, p = 0,0319).Nenhuma diferença estatisticamente significativa foi notada entre os resultados de TSA e TPA no grupo de doentes e grupo controle (Tabelas 2 e 3).
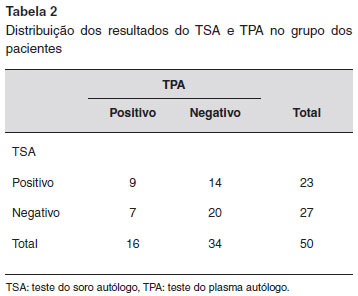
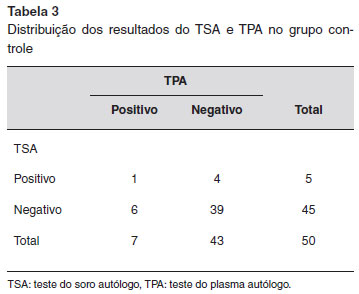
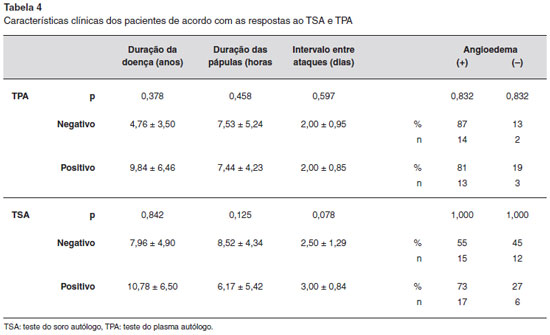
Nenhuma diferença estatisticamente significativa foi notada na duraçao da doença, duraçao das pápulas, intervalo entre os ataques e associaçao de angioedema entre os pacientes com e sem TSA e TPA positivos (Tabela 4).
O tamanho das pápulas medidas variou entre 4 e 16 mm (média de 9 mm) de diâmetro para TSA, e 5 a 14 mm (média de 7 mm) para TPA no grupo dos doentes. Já entre o grupo controle, o diâmetro da pápula foi medido entre 3 e 9 mm (média de 5 mm) para TSA, e 5 e 9 mm (média de 7 mm) para TPA.
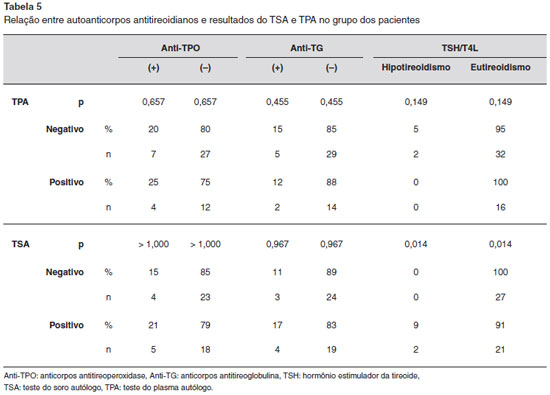
Quatro pacientes com TSA positivo foram positivos para anti-TPO e anti-TG e estes pacientes eram funcionalmente eutireóideos. Nenhuma diferença estatisticamente significativa foi observada na autoimunidade tireoidiana entre pacientes com TSA positivo e aqueles com TSA negativo (p > 1,0 para anti-TPO; p = 0,967 para anti-TG). Houve diferença estatística entre funçao tireoidea (TSH e T4L) e positividade e negatividade ao TSA em pacientes com urticária crônica (p = 0,014). Pacientes eutireóideos com urticária crônica tiveram taxa maior de TSA positivo. Dois pacientes com TPA positivo foram positivos para anti-TPO e anti-TG, e estes pacientes eram funcionalmente eutireóideos. Nenhuma diferença estatisticamente significativa foi observada na autoimunidade tireoidiana e TSH/T4L entre os pacientes com TPA positivo ou negativo. (p = 0,657 para anti-TPO e p = 0,455 para anti-TG; p = 0,149 para funçao tireoidiana). A Tabela 5 apresenta a relaçao entre autoanticorpos antitireoidianos e respostas ao TSA e TPA em pacientes com urticária crônica.
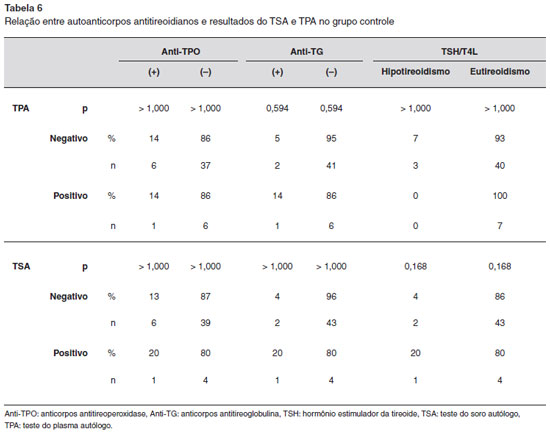
Nao houve diferença estatística entre autorreatividade e TSH nos indivíduos saudáveis com TSA e TPA positivo ou negativo (Tabela 6).
DISCUSSAO
O teste de liberaçao de histamina de mastócitos e basófilos (TLHMB) in vitro permanece o método padrao ouro para a detecçao de autoanticorpos funcionais em pacientes com UCE. Neste teste, basófilos humanos de dois doadores saudáveis sao estimulados com o soro do paciente. A liberaçao de histamina subsequente é medida, e a presença de autoanticorpos funcionais circulantes é detectada16. Entretanto, este teste nao é amplamente utilizado, pois requer basófilos frescos de doadores saudáveis, é demorado e pode nao detectar autoanticorpos nao funcionais4. A medida da expressao de CD63 e CD203c em basófilos doados após incubaçao no soro do paciente tem sido descrito como um novo método confiável17. A análise in vitro da expressao das moléculas CD63 na superfície de basófilos está sendo considerado um método confiável para o diagnóstico de UCE18. ELISA e Western Blot também podem ser utilizados para detectar a presença de autoanticorpos; entretanto, eles nao diferenciam entre anticorpos funcionais e nao funcionais e levam tempo para serem realizados16.
O desenvolvimento de eritema e edema após a injeçao intradérmica do soro autólogo nos pacientes com UCE é o primeiro indicador da presença de anticorpos circulantes em alguns pacientes. Esta observaçao fornece o motivo pelo qual o TSA permanece sendo utilizado para o diagnóstico da UCE16. A demonstraçao de autoanticorpos in vitro contra IgE e Fc_RI por métodos imunológicos em alguns pacientes com TSA e TPA positivos (25-50%) confirmam que fatores outros, além dos autoanticorpos, desempenham um papel na etiologia da doença19. Por essa razao, TSA positivo é sugestivo de autorreatividade; entretanto, a presença de anticorpos deve ser confirmada por testes in vitro 20. A prevalência de positividade ao TSA alcança 50 a 60% em pacientes com UCE21. Portanto, TSA é considerado um teste simples e barato in vivo que contribui consideravelmente para a elucidaçao da patogênese da UCE e pode demonstrar a presença de autoanticorpos funcionais em paralelo à liberaçao de histamina de basófilos in vitro 21. Entretanto, tem sido sugerido que uma quantidade elevada de bradicinina gerada pela cascata de coagulaçao leva à liberaçao de enzimas que destroem o C5a, causando resultados falso-negativos, e que a formaçao de mediadores vasoativos enquanto o soro é preparado leva a resultados falso-positivos22. Por causa dos resultados falso-negativos e falso-positivos, Asero et al. descreveram o TPA. Eles sugeriram que este teste in vivo é mais sensível que o TSA em pacientes com UCE9, o que, entretanto, ainda nao foi confirmado por outros autores23,24.
O TPA é considerado positivo de acordo com diferentes critérios em diferentes estudos. Em alguns deles, o resultado do teste foi tido como positivo caso a placa e o edema induzidos pelo plasma tivessem diâmetro de 3 mm maior que o controle9,23. Em um estudo de Godse, uma reaçao de placa e edema evidente de pelo menos 1,5 mm maior que o controle foi tida como resultado do teste positivo25. Em estudos anteriores, heparina, EDTA e citrato de sódio foram utilizados como anticoagulantes no preparo do plasma para o TPA. Entretanto, tem sido reportado que a heparina inibe os mastócitos e a degranulaçao de basófilos, levando, portanto, a resultados falso-negativos. EDTA também tem sido demonstrado como causador de resultados falso-positivos por levar a eritema e edema localizado no sítio de injeçao em pacientes e controle. Todos estes achados apontaram o citrato de sódio como o anticoagulante mais efetivo no TPA para a detecçao de autoanticorpos em pacientes com UCE9. Por esta razao, utilizamos citrato de sódio como anticoagulante neste estudo.
Dos 50 pacientes com UCE incluídos neste estudo, 23 (46%) tiveram TSA positivo, e 16 (32%) tiveram TPA positivo. Em alguns estudos, a prevalência de TSA positivo alcança 42 a 68%, enquanto a prevalência de TPA positivo varia de 14 a 97%20,23,25. Nenhuma diferença estatisticamente significativa foi encontrada entre TSA positivo e TPA positivo nos grupos (TSA, p > 1,000; TPA, p > 1,000). A compatibilidade destes dois testes in vivo, utilizados no diagnóstico de UCE, foi avaliada, e a relaçao entre os dois foi considerada significativa. Em nosso estudo, os testes foram 32% compatíveis um com o outro. Portanto, ambos os testes podem ser utilizados no diagnóstico de UCAI.
Alguns autores atribuíram a alta taxa de positividade no TPA a diferenças na realizaçao nos testes em cada indivíduo, à ausência de um método padrao para a avaliaçao dos resultados, e a diferenças na seleçao dos pacientes24,26. Por outro lado, alguns autores sugeriram que TPA é mais sensível que o TSA em pacientes com UCE9,20. Todos os estudos relevantes sobre o assunto até o momento reportaram que TSA e TPA podem ser utilizados com propósitos de diagnóstico em pacientes com UCE9,20,23,25.
Estudos prévios enfatizaram que anticorpos antitireoidianos (anti-TPO em particular) e testes de funçao tireoidiana anormais sao mais comuns em pacientes com UCE27,28. No presente estudo, 11 (22%) pacientes com UCE tinham anti-TPO positivo e 7 (14%) tinham anti-TG positivo. Sete (14%) dos indivíduos do grupo controle tinham anti-TPO positivo, e nenhuma diferença estatisticamente significativa foi vista em relaçao à autoimunidade tireoidiana entre os grupos. Adicionalmente, foi investigada a relaçao entre positividade dos anticorpos antireoidianos e resultados do TSA e do TPA. Também nao houve associaçao nos pacientes com UCE. Alpay et al. encontraram estatísticas similiares em relaçao a características clínicas da doença, resultados do TSA e do TPA e presença de autoanticorpos antitireoidianos em pacientes com UCE e indivíduos saudáveis29.
CONCLUSAO
Consideramos que TSA e TPA podem ser utilizados como testes in vivo para a avaliaçao de autorreatividade na etiologia da urticária crônica espontânea, e autoanticorpos antitireoidianos devem ser investigados mesmo quando testes de funçao tireoidiana revelam-se normais.
REFERENCIAS
1. França AT, Valle SOR. Urticária e Angioedema - Diagnóstico e Tratamento. 3a ed. Rio de Janeiro: Revinter; 2014.
2. Greaves MW. Chronic urticaria. N Engl J Med. 1995;332(26):1767-72.
3. Augey F, Goujon-Henry C, Berard, Nicolas JF, Gunera-Saad N. Is there a link between Chronic urticaria and atopy? Eur J Dermatol. 2008;18(3):348-9.
4. Grattan CE, Sabroe RA, Greaves MW. Chronic urticaria. J Am Acad Dermatol. 2002;46(5):645-57.
5. Kaplan AP. Chronic urticaria: pathogenesis and treatment. J Allergy Clin Immunol. 2004;114(3):465-74.
6. Grattan CE, Hamon CG, Cowan MA, Leeming RJ. Preliminary identification of a low molecular weight serological mediator in chronic idiopathic urticaria. Br J Dermatol. 1988;119(2):179-83.
7. Hide M, Francis DM, Grattan CE, Hakimi J, Kochan JP, Greaves MW. Autoantibodies against the high affinity IgE receptor as a cause of histamine release in chronic urticaria. N Engl J Med. 1993;328(22):1599-604.
8. Niimi N, Francis DM, Kermani F, O'Donnell BF, Hide M, Kobza-Black A, et al. Dermal mast cell activation by autoantibodies against the high affinity IgE receptor in chronic urticaria. J Invest Dermatol. 1996;106(5):1001-6.
9. Asero R, Tedeschi A, Riboldi P, Cugno M. Plasma of patients with chronic urticaria shows signs of thrombin generation, and its intradermal injection causes wheal-and-flare reactions much more frequently than autologous serum. J Allergy Clin Immunol. 2006;117(5):1113-7.
10. Leznoff A, Josse RG, Denberg J, Dolovich J. Association of chronic urticaria and angioedema with thyroid autoimmunity. Arch Dermatol. 1983;119(8):636-40.
11. Kaplan AP, Finn A. Autoimmunity and the etiology of chronic urticaria. Can J Allergy Clin Immunol. 1999;4:286-92.
12. Kikuchi Y, Fann T, Kaplan AP. Antithyroid antibodies in chronic urticaria and angioedema. J Allergy Clin Immunol. 2003;112(1):218.
13. Heymann WR. Chronic urticaria and angioedema associated with thyroid autoimmunity: review and therapeutic implications. J Am Acad Dermatol. 1999;40(2 Pt 1):229-32.
14. Leznoff A, Sussman GL. Syndrome of idiopathic chronic urticaria and angioedema with thyroid autoimmunity: a study of 90 patients. J Allergy Clin Immunol. 1989;84(1):66-71.
15. Turktas I, Gokcora N, Demirsoy S, Cakir N, Onal E. The association of chronic urticaria and angioedema with autoimune thyroiditis. Int J Dermatol. 1997;36(3):187-90.
16. Sabroe RA, Grattan CE, Francis DM, Barr RM, Kobza Black A, Greaves MW. The autologous serum skin test: a screenig test for autoantibodies in chronic idiopathic urticaria. Br J Dermatol. 1999;140(3):446-52.
17. Yasnowsky KM, Dreskin SC, Efaw B, Schoen D, Vedanthan PK, Alam R, et al. Chronic urticaria sera increase basophil CD203c expression. J Allergy Clin Immunol. 2006;117(6):1430-4.
18. Szegedi A, Irinyi B, Gál M, Hunyadi J, Dankó K, Kiss E, et al. Significant correlation between the CD63 assay and the histamine release assay in chronic urticaria. Br J Dermatol. 2006;155(1):67-75.
19. Platzer MH, Grattan CE, Poulsen LK, Skov PS. Validation of basophil histamine release against the autologous serum skin test and the outcome of serum-induced basophil histamine release studies in a large population of chronic urticaria patients. Allergy. 2005;60(9):1152-6.
20. Asero R, Tedeschi A, Coppola R, Griffini S, Paparella P, Riboldi P, et al. Activation of the tissue fator pathway of blood coagulation in patients with chronic urticaria. J Allergy Clin Immunol. 2007;119(3):705-10.
21. Grattan CE, Wallington TB, Warin RP, Kennedy CT, Bradfield JW. A serological mediator in chronic idiopathic urticaria - a clinical, immunological and histological evaluation. Br J Dermatol. 1986;114(5):583-90.
22. Fusari A, Colangelo C, Bonifazi F, Antonicelli L. The autologous serum skin test in the follow-up of patients with chronic urticarial. Allergy. 2005;60(2):256-8.
23. Altrich ML, Halsey JF, Altman LC. Comparison of the in vivo autologous skin test with vitrodiagnostic tests for the diagnosis of chronic autoimune urticaria. Allergy Asthma Proc. 2009;30(1):28-34.
24. Asero R, Tedeschi A, Cugno M. Is the autologous plasma skin test in patients with chronic urticaria really useless? J Allergy Clin Immunol. 2009;12(6):1417-8.
25. Godse KV. Autologous serum skin test v/s autologous plasma skin test. Indian J Dermatol Venereol Leprol. 2008;74(5):496-7.
26. Sajedi V, Movahedi M, Aghamohammadi A, Gharagozlou M, Shafiei A, Soheili H, et al. Comparison between sensitivity of autologous skin serum test and autologous plasma skin test in patients with chronic idiopathic urticaria for detection of antibody against IgE or IgE receptor. Iran J Allergy Asthma Immunol. 2011;10(2):111-7.
27. Sabroe RA, Greaves MW. Chronic idiopathic urticaria with funcional autoantibodies: 12 years on. Br J Dermatol. 2006;154(5):813-9.
28. O'Donnel BF, Swana GT, Kobza Black A. Organ and nonorgan specific autoimmunity in chronic urticaria. Br J Dermatol. 1995;133(1):42.
29. Alpay A, Solak Tekin N, Tekin IÖ, Altinyazar HC, Koca R, Cınar S. Autologous serum skin test versus autologous plasma skin test in patients with chronic spontaneous urticaria. Dermatol Res Pract. 2013;2013:267278.