Número Atual: Julho-Setembro 2017 - Volume 1 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Mecanismos da imunoterapia alérgeno-específica
Mechanisms of allergen-specific immunotherapy
Veridiana Aun Rufino Pereira1; Wilson C. Tartuci Aun2; Joao Ferreira de Mello3
DOI: 10.5935/2526-5393.20170036
1. Médica assistente do Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual de Sao Paulo
2. Chefe da Seçao de Imunologia do Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual de Sao Paulo
3. Diretor do Serviço de Alergia e Imunologia do Hospital do Servidor Público Estadual de Sao Paulo
Endereço para correspondência:
Veridiana Aun Rufino Pereira
E-mail: veridiana.aun@uol.com.br
Submetido em: 20/06/2017
Aceito em: 07/07/2017.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A imunoterapia alérgeno-específica tem sido usada há mais de 100 anos como um tratamento de dessensibilizaçao para doenças alérgicas, representando um método potencialmente curativo e específico. O presente estudo tem como objetivo revisar os mecanismos da imunoterapia alérgeno-específica, através de revisao bibliográfica com base em artigos publicados entre 1998 e 2016, disponíveis no banco de dados PubMed. Os mecanismos de açao da imunoterapia incluem modulaçao de linfócitos T e B, produçao de IgG4 alérgeno-específica e reduçao de IgE alérgenoespecífica, migraçao de eosinófilos, basófilos e mastócitos nos tecidos, bem como a liberaçao de seus mediadores. As células T reguladoras (Treg) suprimem as células dendríticas responsáveis pela geraçao de células T efetoras, inibindo TH1, TH2 e TH17. As células Treg foram identificadas como peças-chave no processo de induçao de tolerância periférica aos alérgenos.
Descritores: Imunoterapia, linfócitos T reguladores, linfócitos B reguladores.
INTRODUÇAO
A imunoterapia alérgeno-específica tem sido usada há mais de 100 anos como um tratamento de dessensibilizaçao para doenças alérgicas, representando o único método capaz de alterar o curso dessas patologias e ainda induzir tolerância aos alérgenos por um longo tempo. Segundo Jean Bousquet, a imunoterapia alergênica pode ser definida como a prática de administrar gradualmente quantidades crescentes de extrato de alérgeno em um indivíduo alérgico, para melhorar os sintomas associados com a exposiçao seguinte ao alérgeno causador1,2.
Durante muitos anos acreditou-se que a imunoterapia induziria um desvio da imunidade de TH2 para TH1, através da reduçao dos níveis de IL-4, IL-5 e IL-13 e consequente aumento de IFN-γ (Figura 1). Entretanto, esta teoria era incapaz de explicar porque os indivíduos submetidos à imunoterapia nao apresentavam maior incidência de doenças relacionadas à populaçao de linfócitos TH13.
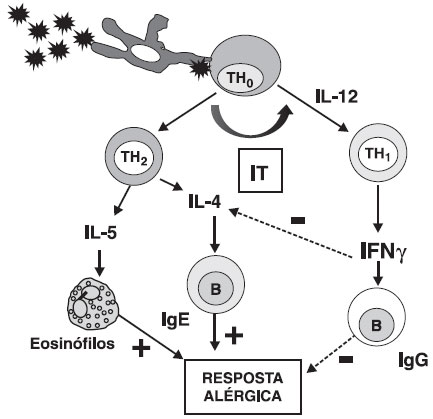
Figura 1 Teoria do desvio de TH2 para TH1
Dependendo da natureza do antígeno e das citocinas envolvidas, o linfócito TH0 se diferencia em TH1 ou TH2. A subpopulaçao TH2 predomina nos indivíduos alérgicos e caracterizase por produzir IL-4 e IL-5, responsáveis por produçao de IgE e ativaçao de eosinófilos respectivamente. Estas citocinas inibem a subpopulaçao TH1 e consequentemente a produçao de IFN-γ. Durante a imunoterapia ocorreria um desvio da populaçao TH2 para TH1, inibindo a resposta alérgica
A partir de 2004 surgiram os primeiros trabalhos demonstrando a participaçao de células T regulatórias no mecanismo da imunoterapia alérgeno-específica. Desde entao, a induçao de tolerância imunológica tornou-se o alvo principal na prevençao e tratamento de doenças relacionadas à disfunçao do sistema imune, como as alergias.
As principais alteraçoes imunológicas observadas durante a imunoterapia sao: induçao de células T e B reguladoras, regulaçao de IgE e IgG4 alérgeno-específicas e tolerância imune. Os principais alvos deste tratamento sao as células imunes tipo 2, incluindo células TH2 e células linfoides inatas tipo 2 (ILC2), que produzem IL-4, IL-5 e IL-134.
Essas alteraçoes imunológicas da imunoterapia podem ser didaticamente divididas em precoces, intermediárias e tardias.
Alteraçoes precoces
Relacionadas à dessensibilizaçao de mastócitos e basófilos
Após as primeiras injeçoes de imunoterapia, observa-se um declínio na degranulaçao dos mastócitos e basófilos, apesar dos níveis aumentados de IgE específica. Os mecanismos moleculares que explicam este comportamento celular ainda precisam ser elucidados. Uma das explicaçoes possíveis seria o rápido aumento de receptores de histamina do tipo 2, já nas primeiras 6 horas da fase de induçao da imunoterapia4,5.
Os receptores de histamina H1 possuem propriedades pró-inflamatórias, ativando as células da inflamaçao como TH1. Os receptores H2 estao envolvidos na resposta imune tolerogênica (Figura 2). Ao se ligar aos receptores H2 nas células dendríticas imaturas, a histamina reduz a capacidade de apresentaçao de antígeno e aumenta IL-10, aumentando assim a capacidade supressora das células T regulatórias (Treg)6,7.Os receptores H2 sao encontrados preferencialmente nos linfócitos TH2, enquanto os receptores H1 predominam na populaçao TH1.
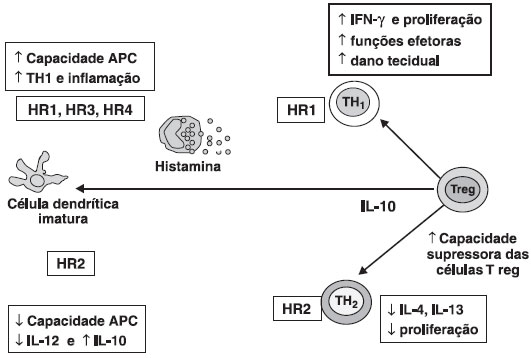
Figura 2 Receptores de histamina nas células imunes
As células dendríticas possuem os 4 receptores de histamina: HR1, HR2, HR3 e HR4. A ligaçao da histamina aos receptores HR1, HR3 e HR4 aumentam a capacidade de apresentaçao de antígeno e a subpopulaçao TH1. Nos linfócitos TH1 predominam os receptores H1 e sua ativaçao promove aumento de IFN-γ. Estímulo nos receptores HR2 na célula dendrítica reduzem a capacidade de apresentaçao de antígeno, IL-12, aumentam IL-10 e a capacidade supressora das células Treg.
Assim, o aumento de receptores H2 contribuiria para a reduçao da liberaçao de mediadores de mastócitos e basófilos, além de regular as atividades de células T, células dendríticas e basófilos4.
Relacionadas às células apresentadoras de antígeno
A imunoterapia também é responsável pela induçao de células dendríticas reguladoras, responsáveis pela ativaçao de células Treg produtoras de IL10 e TGFβ. Consequentemente, observa-se inibiçao das células dendríticas tipo 1 e 2, responsáveis pela diferenciaçao de TH1 e TH2 respectivamente (Figura 3)5.
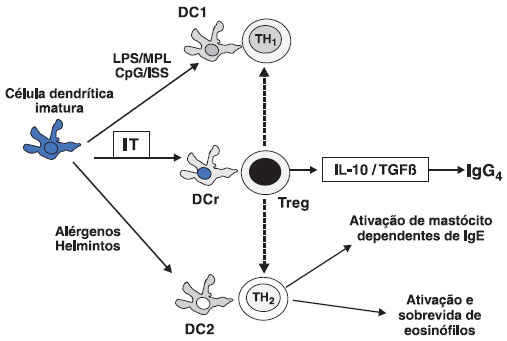
Figura 3 Diferenciaçao das células dendríticas imaturas
As células dendríticas imaturas diferenciam-se em tipo1 (DC1), tipo 2 (DC2) e tipo regulador (DCr) dependendo do estímulo. Na presença de alérgenos e helmintos predomina a populaçao DC2, responsável por ativar TH2. Peptídeos bacterianos como LPS ativam a populaçao DC1, e, consequentemente, TH1. A imunoterapia aumenta as células dendríticas reguladoras e Treg.
Alteraçoes intermediárias
Alteraçoes nas células T
A imunoterapia alérgeno-específica promove alteraçao nos subtipos de linfócitos T (Figura 4). A proporçao de células TH2 secretoras de IL-4 diminuem durante o tratamento, enquanto as células T reguladoras (T reg) induzíveis produtoras de IL-10 aumentam consideravelmente, atingindo níveis encontrados em indivíduos saudáveis4,5,8-10.
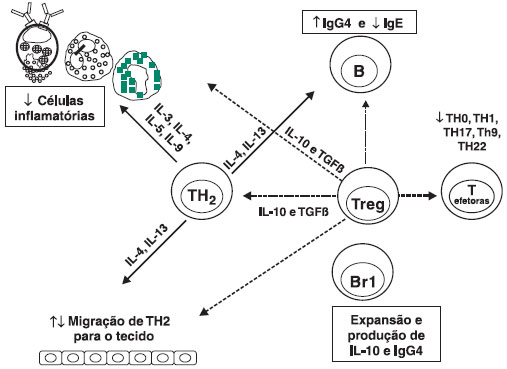
Figura 4 Principais funçoes das células T e B reguladoras induzidas pela imunoterapia
A imunoterapia induz linfócitos T reg que diminui a atividade das células T efetoras e ativa células B reg produtoras de IL-10 e IgG4.
Existem dois tipos de células T reg induzíveis: FOXP3+ adaptativa e FOXP3-, também chamada Tr1. Esses dois tipos celulares produzem grandes quantidades de IL-10 e TGFβ. As principais açoes dessas citocinas estao resumidas na Tabela 15.
A secreçao de IL-10 e TGFβ, assim como a expressao de CTLA-4 e PD-1 na superfície das células T sao fundamentais para as atividades supressoras das células Treg induzíveis. A induçao de FOXP3 e geraçao de células Treg induzíveis dependem da açao de TGFβ e IL-2, associados ao aumento da coestimulaçao por CTLA-4 e reduçao de CD284,5,10.
Sabe-se que durante a imunoterapia ocorre um aumento da relaçao TH1/TH2, uma vez que as citocinas TH2 sao rapidamente inibidas. Isto estimula a populaçao TH1 e IFN-γ como se acreditava anteriormente. Entretanto, as células Treg e suas citocinas IL-10 e TGFβ inibem todos os subtipos de linfócitos T efetores, impedindo o aumento de doenças relacionadas a TH1. Assim, observa-se também, uma reduçao nos subtipos TH9, TH17 e TH22 e consequentemente suas citocinas4,5,10.
Reduçao do número de eosinófilos e mediadores
Durante a imunoterapia ocorre reduçao dos níveis séricos de eosinófilos e da proteína catiônica eosinofílica, assim como reduçao de fatores quimiotáticos para eosinófilos e neutrófilos. A IL-10 diminui a funçao e atividade dos eosinófilos, além de suprimir a produçao de IL-5 pelas células TH24,5,9,10.
Regulaçao das células linfoides inatas (ILC)
As células linfoides inatas do tipo 2 diferem dos linfócitos TH2 por nao apresentarem receptor de célula T específico. Sao capazes de produzir grandes quantidades de IL-5 e IL-13, porém pequenas quantidades de IL-4. Assim como os linfócitos TH2, sua diferenciaçao depende de IL-25, IL-31, IL-33 e linfopoietina do estroma tímico (TSLP)4.
A imunoterapia regula as ILCs, diminuindo o número de ILC24.
ALTERAÇOES TARDIAS
Alteraçoes nos linfócitos B e produçao de anticorpos
Recentemente foram descritas células B reguladoras (Br1) induzidas numa fase tardia da imunoterapia, caracterizadas como CD73-CD25+CD71+, com funçao supressora das células TCD4+ e capacidade de produzir IL-10 e IgG4 específica. A IL-10 derivada das células Treg estimula o linfócito Br1 a produzir IgG na presença de IL-4, enquanto que a IL-4 sozinha induziria IgE4,5,10.
A IgG4 específica, também conhecida como anticorpo bloqueador, compete com a IgE específica pelo sítios de ligaçao com o antígeno, evitando assim a degranulaçao de mediadores de mastócitos e basófilos4,5,8,10.
Meses ou anos após o tratamento com imunoterapia, observa-se uma queda gradual nos níveis de IgE sérica, apesar do aumento transitório que ocorre no início da terapia4,5,8,10.
Supressao da resposta de fase tardia
A imunoterapia por longo tempo está associada à reduçao da resposta imediata e tardia durante a provocaçao com alérgeno na mucosa nasal, brônquica ou na pele. O mecanismo das reaçoes de fase tardia é diferente das reaçoes imediatas desencadeadas por mastócitos. A fase tardia envolve o recrutamento, ativaçao e persistência de eosinófilos, além de ativaçao de células T nos locais de exposiçao alergênica. Como a reaçao de fase tardia está associada ao aumento da hiper-reatividade brônquica e nasal, além de imitar a patologia da inflamaçao alérgica crônica, postulou-se que a eficácia clínica da imunoterapia depende de seus efeitos sobre esta fase tardia5.
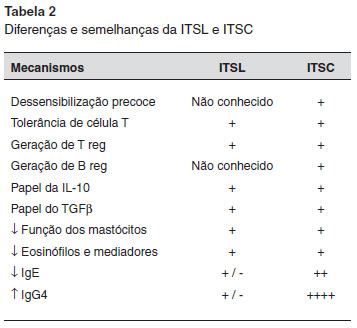
TOLERANCIA IMUNE INDUZIDA NA IMUNOTERAPIA SUBLINGUAL
Os mecanismos imunológicos da imunoterapia sublingual (ITSL) nao sao tao bem estabelecidos como na imunoterapia subcutânea (ITSC). A Tabela 2 resume as principais diferenças e semelhanças no mecanismo das ITSC e ITSL.
CONCLUSAO
A compreensao dos mecanismos imunológicos da imunoterapia alérgeno-específica é fundamental para se conduzir corretamente o tratamento das doenças alérgicas. Diferente do que se imaginava anteriormente, o desvio da imunidade de TH2 para TH1 nao é o ponto chave para o sucesso do tratamento.
Os recentes avanços no conhecimento das células Treg e Breg e dos mecanismos de tolerância periférica foram essenciais para explicar as alteraçoes imunológicas decorrentes da imunoterapia.
Assim, atualmente, considera-se como principal evento imunológico deste tratamento, a induçao das células T reg, responsáveis por mudanças no equilíbrio das células T CD4 efetoras suprimindo TH1, TH2, TH9, TH17 e TH22.
REFERENCIAS
1. Bousquet J. Immunotherapy: state of art. In: New therapeutic approaches for allergic diseases of the respiratory tract, p1-36, Apr 1998. Programme and Abstracts. Apresentado a Euro Conferences Institut Pasteur,1998.
2. Ozdemir C, Kucuksezer UC, Akdis M, Akdis CA. Mechanisms of Allergen Immunotherapy. Immunol Allergy Clin N Am. 2016;36:71-86.
3. Durham SR, Till SJ. Immunologic changes associated with allergen immunotherapy. J Allergy Clin Immunol. 1998;102:157-64.
4. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International consensus on Allergen Immunotherapy II: Mechanisms, standardization, and pharmacoeconomics. J Allergy Clin Immunol. 2016;137:358-68.
5. Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy: Multiple suppressor factors at work in immune tolerance to allergens. J Allergy Clin Immunol. 2014;133:621-31.
6. Jutel M, Akdis M, Akdis CA. Histamine, histamine receptors and their role in immune pathology. Clin Exp Allergy. 2009;39:1786-800.
7. Jutel M, Blaser K, Akdis CA. Histamine in chronic allergic responses. J Investig Allergol Clin Immunol. 2005;15(1):1-8.
8. Durham SR. Mechanisms of Immunotherapy. J Allergy CIin Immunol. 2004;113:1025-34.
9. Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol. 2011;127:18-27.
10. Cavkaytar O, Akdis CA, Akdis M. Modulation of immune responses by immunotherapy in allergic diseases. Cur Opin Pharmacol. 2014;17:30-7.




