Número Atual: Julho-Setembro 2017 - Volume 1 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
ARTIGO ESPECIAL
Vacina contra a febre amarela: reações adversas e populações de risco
Yellow fever vaccine: adverse reactions and at-risk populations
Ana Karolina Barreto Berselli Marinho1,11; Aluce Loureiro Ouricuri2,11; Cláudia França Cavalcante Valente3,11; Fátima Rodrigues Fernandes4,11; Gilberto Saciloto5,11; Lorena de Castro Diniz6,11; Mônica de Araújo Alvares da Silva7,11; Antonio Condino Neto8; Norma de Paula M. Rubini9; Dirceu Solé10
DOI: 10.5935/2526-5393.20170035
1. Serviço de Imunologia Clínica e Alergia do Hospital de Clínicas, Faculdade de Medicina, Universidade de Sao Paulo, SP
2. Ex-Chefe do Setor de Alergia e Imunologia do Serviço de Pediatria do Hospital Federal dos Servidores do Estado RJ. Coordenadora da Comissao de Imunodeficiências da ASBAI-RJ
3. Setor de Alergia e Imunologia do Serviço de Pediatria do Hospital Federal dos Servidores do Estado do Rio de Janeiro, RJ
4. Serviço de Alergia e Imunologia Clínica, Hospital do Servidor Público do Estado de Sao Paulo, SP
5. Clínica Bambina, Guarapuava, PR
6. Clínica Privada, Goiânia, GO
7. Serviço de Alergia e Imunologia do Hospital da Criança de Brasília José Alencar, DF
8. Departamento de Imunologia, Instituto de Ciências Biomédicas, Universidade de Sao Paulo. Coordenador do Departamento Científico de Imunodeficiências da Associaçao Brasileira de Alergia e Imunologia (ASBAI)
9. Disciplina de Alergia e Imunologia, Escola de Medicina e Cirurgia, UNIRIO, RJ. Presidente da ASBAI
10. Disciplina de Alergia, Imunologia Clínica e Reumatologia, Departamento de Pediatria, Universidade Federal de Sao Paulo, Escola Paulista de Medicina, Diretor Científico da ASBAI
11. Membros do Departamento Científico de Imunizaçoes da ASBAI
Endereço para correspondência:
Ana Karolina B. B. Marinho
E-mail: ana.marinho@hc.fm.usp.br
Submetido em: 11/06/2017
Aceito em: 28/06/2017.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A febre amarela é uma doença infecciosa grave causada por um arbovírus e transmitida pelos mosquitos Haemagogus (ciclo silvestre) e Aedes aegypti (ciclo urbano). Os sintomas mais comuns sao febre, calafrios, cefaleia, mialgia e náuseas. Uma parcela dos pacientes desenvolve as formas graves, que podem cursar com insuficiência hepática e renal. A partir de 2014 a febre amarela passou a ser endêmica em áreas extra-amazônicas, tornando-se um grave problema de saúde pública. Por isso, a vacinaçao contra a febre amarela é essencial para o controle da doença no Brasil, tornando-se a medida mais eficaz, com imunogenicidade superior a 95%. Em relaçao à segurança, a maioria dos eventos adversos após a vacinaçao sao locais, e os eventos adversos graves, como a encefalite pós-vacinal, sao relatados principalmente em idosos e imunossuprimidos. Por se tratar de vacina de vírus vivo atenuado, é recomendada cautela na sua indicaçao nesses indivíduos. Outra preocupaçao em relaçao à segurança se deve ao fato de que, por ser cultivada em ovos embrionados de galinha (maior quantidade de proteínas do ovo), a vacina febre amarela é contraindicada em indivíduos que apresentam história prévia de reaçao anafilática ao ovo. No entanto, diante do cenário epidemiológico atual, indivíduos com história de hipersensibilidade leve ou moderada ao ovo podem recebê-la seguindo as recomendaçoes de segurança revisadas e sugeridas neste texto. O objetivo deste documento foi revisar as indicaçoes e contraindicaçoes da vacina febre amarela e apresentar uma abordagem prática em situaçoes especiais, com a finalidade de garantir a imunizaçao à populaçao de risco.
Descritores: Vacina, febre amarela, eventos adversos, alergia, imunossuprimidos.
INTRODUÇAO
A febre amarela é uma doença febril aguda, de curta duraçao (no máximo 12 dias) e de gravidade variável, cujo agente etiológico é um arbovírus. Tem início súbito, com sintomas gerais como febre, calafrios, dor de cabeça, dor lombar, dores musculares generalizadas, prostraçao, náuseas e vômitos. A forma grave caracteriza-se por apresentar insuficiência hepática e renal. Em muitos casos, evolui para óbito em aproximadamente uma semana (Brasil, 2002)1.
A febre amarela continua sendo um importante problema de saúde pública, em particular nas áreas endêmicas. A maior parte do território brasileiro é considerada regiao endêmica (principalmente a Regiao Amazônica) ou área de transiçao. O vírus ocorre em locais de clima tropical, mais comum na América do Sul e Africa1. A partir de julho de 2014, a doença voltou a ser endêmica em áreas extra-amazônicas, nos seguintes estados: Goiás, Pará e Mato Grosso do Sul. No mesmo período, foram registradas 49 epizootias (morte em primatas nao humanos) nos estados de Sao Paulo, Goiás, Tocantins, Pará e no Distrito Federal2. O surto atual no estado de Minas Gerais ocorreu em áreas de divisa com o Espírito Santo, e há relatos de morte em humanos e de epizootia em alguns municípios. A ocorrência de epizootia em macacos pode ser sinal de circulaçao viral e sentinela para a ocorrência de casos de febre amarela em humanos3.
O período sazonal de transmissao de febre amarela silvestre (FAS) no Brasil ocorre entre os meses de dezembro a maio. A presença de macacos mortos e/ou doentes é um indicativo de que o vírus da febre amarela pode estar presente no local onde foram encontrados aqueles animais. A identificaçao de uma epizootia e/ou o isolamento de vírus da febre amarela em mosquitos sao eventos com impacto epidemiológico similar ao da detecçao de um caso humano. As informaçoes epidemiológicas sobre a situaçao da febre amarela no Brasil sao muito dinâmicas, e podem ser acessadas no portal do Ministério da Saúde4.
A vacinaçao é a medida de proteçao mais eficaz contra este agravo. A vacina confere imunidade individual, sendo necessária cobertura vacinal (CV) de 100% nas áreas com recomendaçao de vacinaçao (ACRV), para que a populaçao esteja efetivamente protegida1.
Os pacientes com alergia alimentar ao ovo, os pacientes com imunodeficiências primárias ou secundárias e os idosos constituem populaçoes especiais que devem ser analisadas de maneira individual no momento de indicar ou contraindicar a vacina contra febre amarela.
É de extrema importância o esclarecimento, para que toda a populaçao esteja devidamente protegida, pois a febre amarela é uma doença de alta letalidade e a decisao de nao vacinar um paciente, principalmente em áreas endêmicas e epidêmicas, pode trazer prejuízos enormes à sua saúde1. Assim, tendo-se a necessidade de aprofundar os conhecimentos e a discussao sobre esse tema, foi elaborada essa revisao cujo objetivo principal é auxiliar o clínico na prática diária.
VACINA CONTRA FEBRE AMARELA
A vacinaçao é importante na eliminaçao da febre amarela urbana do país, pois é a forma de proteçao mais eficaz contra a doença. Recomenda-se também a proteçao de cada indivíduo pelo uso de repelentes e telas antimosquitos, entre outros (Tabela 1). As medidas de combate aos vetores sao importantes, porém, de difícil execuçao5.
A vacinaçao constitui a principal estratégia de prevençao, e até 2012 todos os países das Américas com áreas enzoóticas haviam incluído a vacina nos programas nacionais de imunizaçao, com a Argentina, Brasil e Panamá recomendando-a somente em áreas de risco potencial6.
No Brasil há dois tipos de vacinas disponíveis, a produzida pela Biomanguinhos-Fiocruz, utilizada pela rede pública, e a produzida pela Sanofi Pasteur, utilizada na rede privada. Ambas compostas de vírus vivo atenuado, cepa 17D-204, que apresenta imunogenicidade superior a 95%. As vacinas sao cultivadas em ovo de galinha, e podem conter em sua formulaçao sacarose, glutamato, sorbitol, gelatina bovina, eritromicina, canamicina, cloridrato de L-histidina, L-alanina, cloreto de sódio e água para injeçao. A dose recomendada é 0,5 mL, via subcutânea, a partir de 9 meses de idade3.
A vacina é recomendada nas seguintes situaçoes3,5:
- rotineiramente, para todos os residentes das áreas com recomendaçao para vacinaçao com idades entre 9 meses e 59 anos;
- para indivíduos nao vacinados, que se deslocam para essas áreas;
- em viagens para países que exigem a vacinaçao, segundo o Regulamento Sanitário Internacional.
A Organizaçao Mundial de Saúde (OMS) passou a recomendar que viajantes internacionais que queiram ir aos estados do Rio de Janeiro e Sao Paulo tomem a vacina contra a febre amarela, exceto se forem a áreas urbanas das cidades do Rio de Janeiro (RJ), Niterói (RJ), Sao Paulo (SP) e Campinas (SP). A OMS já havia recomendado a vacinaçao para todos os habitantes do estado do Espírito Santo e a 69 municípios do sul e sudoeste da Bahia, assim como para todo o território de Minas Gerais (antes do surto deste ano). Segundo o Ministério da Saúde, a rápida expansao da febre amarela no país estaria relacionada à baixa cobertura vacinal em 20166.
CONSIDERAÇOES
1. Crianças menores de 2 anos de idade nao devem receber a vacina tríplice viral ou a tetravalente (sarampo-rubéola-caxumba-varicela) simultaneamente, devendo aguardar o intervalo mínimo de 30 dias entre essas vacinas e a vacina contra a febre amarela.
2. Em situaçoes de surto em que a vacina é antecipada para os 6 meses de idade, nao é considerado vacinaçao de rotina, devendo ser realizada uma segunda dose aos 9 meses de idade7.
3. Em maio de 2014, o Regulamento Sanitário Internacional foi alterado, estendendo a validade do certificado internacional de vacinaçao contra a febre amarela dos atuais 10 anos para toda a vida do vacinado. Isso estaria relacionado à forte memória imunológica conferida pela vacina contra a febre amarela cepa 17D. No entanto, sao necessários melhores estudos, sobretudo na populaçao pediátrica. Para efeito do Certificado Internacional de Vacinaçao, a partir de 2017 o Brasil seguirá a modificaçao já aprovada pelo Regulamento Sanitário Internacional, considerando a vacina febre amarela como de imunidade permanente, sem necessidade de revacinaçao6,8.
4. Em 05/04/2017, o Ministério da Saúde divulgou novas recomendaçoes de vacinaçao, em consonância com as recomendaçoes da Organizaçao Mundial da Saúde: a partir de abril de 2017, dose única da vacina febre amarela será adotada em todo o país para todas as faixas etárias. Portanto, pessoas que já receberam uma dose da vacina, mesmo que há muitos anos, nao serao revacinadas, mesmo em situaçao de risco. Esta medida pode ser modificada posteriormente dependendo da situaçao epidemiológica da febre amarela3 (Tabela 2).
EVENTOS ADVERSOS POS-VACINAIS
A vacina febre amarela (atenuada) é uma das vacinas mais eficazes e seguras; entretanto, raramente eventos adversos graves (EAG) e até fatais têm sido notificados, e estao associados à disseminaçao do vírus vacinal9.
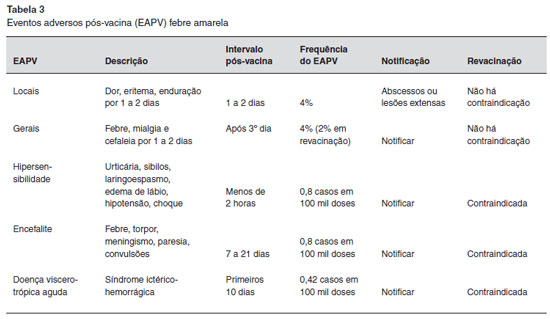
A maioria dos eventos adversos pós-vacinais (EAPV) sao locais. A manifestaçao mais frequentemente referida é a dor no local de aplicaçao (4% em adultos, e um pouco menos em crianças pequenas), de curta duraçao (primeiro e segundo dias depois da aplicaçao), autolimitada e de intensidade leve ou moderada. Manifestaçoes sistêmicas podem se apresentar como febre, cefaleia e mialgia. Eventos adversos graves sao raros, e incluem as reaçoes de hipersensibilidade (anafilaxia e manifestaçoes alérgicas), doença neurológica aguda (encefalite, meningite, doenças autoimunes com envolvimento do sistema nervoso central e periférico) e doença viscerotrópica aguda (infecçao multissistêmica generalizada, semelhante às formas graves da doença). No Brasil, no período entre 2007 e 2012, a incidência de EAG associados à vacina febre amarela foi de 0,42 casos por 100.000 doses administradas2.
Ressalta-se a importância da avaliaçao pelo serviço de saúde da vacinaçao nas pessoas com critérios de precauçao ou contraindicaçao, pois a frequência de notificaçao de eventos adversos associados à vacina febre amarela tem sido maior nas campanhas do que na rotina, particularmente em áreas onde a vacina nao era realizada anteriormente.
Destaca-se a importância de ser observado o protocolo de investigaçao, diante de uma suspeita de um evento adverso grave. Portanto, os eventos adversos graves observados após a vacinaçao devem ser informados e notificados imediatamente (em até 24 horas).
Os eventos adversos após a vacinaçao contra a febre amarela estao descritos na Tabela 3.
CONSIDERAÇOES
1. A aplicaçao da vacina é subcutânea (0,5 mL) e nao necessita de cuidados especiais no local da aplicaçao. A administraçao é realizada, de preferência, na regiao do deltoide, na face externa superior do braço. Se o paciente estiver febril, recomenda-se adiar a aplicaçao.
2. Alguns estudos publicados registraram aumento limitado e reversível de enzimas hepáticas nas duas primeiras semanas de vacinaçao, sem manifestaçoes clínicas.
3. Outros eventos neurotrópicos relatados sao síndrome de Guillain-Barré, paralisia de Bell, mononeurite e doença autoimune com envolvimento de sistema nervoso central ou periférico.
4. A doença viscerotrópica aguda é caracterizada por quadro clínico semelhante à febre amarela selvagem, com febre, astenia, mialgias, icterícia, oligúria, instabilidade cardiovascular, insuficiência renal, insuficiência respiratória, hemorragias e necrose hepática. Todos os casos descritos ocorreram após a primeira dose da vacina2,11,12.
CONTRAINDICAÇOES ABSOLUTAS E RELATIVAS: SITUAÇOES ESPECIAIS
Pacientes com comprometimento do sistema imunológico, tanto por imunodeficiências primárias como secundárias, incluindo a infecçao por HIV ou uso de drogas imunossupressoras, apresentam risco aumentado de infecçoes, e estas, quando ocorrem, sao potencialmente mais graves. A imunizaçao se faz necessária para protegê-los das infecçoes imunopreveníveis ou, pelo menos, diminuir o risco de complicaçoes mais graves e o óbito10,11.
No entanto, dependendo do risco do paciente adoecer devido à infecçao natural, e levando também em consideraçao o grau de imunossupressao, a vacinaçao poderá ser recomendada após análise criteriosa e individualizada.
A indicaçao de vacinas com componentes vivos atenuados em pacientes imunodeprimidos continua sendo um tema controverso. De modo geral, as vacinas atenuadas, como é a vacina contra febre amarela, sao contraindicadas em pacientes com imunodeficiências primárias ou secundárias.
De acordo com a nota informativa do Ministério da Saúde de fevereiro de 2017, sao consideradas contraindicaçoes para a administraçao da vacina contra a febre amarela, as seguintes situaçoes:
- crianças menores de 6 meses de idade;
- pacientes com imunossupressao de qualquer natureza;
- pacientes com neoplasia;
- pacientes infectados pelo HIV com imunossupressao grave, com a contagem de células CD4+ < 200 células/mm3 ou menor de 15% do total de linfócitos para crianças menores de 6 anos;
- pacientes em tratamento com drogas imunossupressoras (corticosteroides, quimioterapia, radioterapia, imunobiológicos);
- pacientes submetidos a transplante de órgaos;
- pacientes com história pregressa de doença do timo (timoma, miastenia grave).
Apesar das contraindicaçoes gerais, em algumas situaçoes devemos reconsiderar a administraçao da vacina contra a febre amarela:
- indivíduos infectados pelo HIV, assintomáticos e com imunossupressao moderada, de acordo com a contagem de células CD4+. Deve-se avaliar o risco/benefício em casos de exposiçao inevitável ao vírus amarílico em pacientes HIV+ adultos assintomáticos e que tenham contagem de células CD4+ ≥ 200 células/mm3. Em crianças infectadas pelo HIV e assintomáticas, maiores de 9 meses e com até 5 anos, deve-se considerar a contagem de células T CD4+ ≥ 15% para análise de risco/ benefício da vacinaçao.
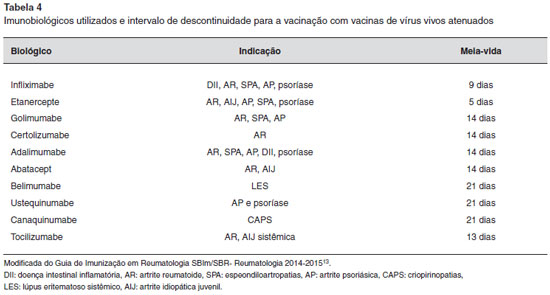
- indivíduos com lúpus eritematoso sistêmico (LES) ou com outras doenças de etiologia potencialmente autoimune devem ser avaliados caso a caso tendo em vista a possibilidade de maior risco de eventos adversos. Na Tabela 4 estao descritas as orientaçoes em relaçao ao uso de imunobiológicos e vacinas vivas atenuadas como a febre amarela. Deve-se suspender por cinco meias-vidas antes de administrar vacinas vivas atenuadas. Em relaçao ao Rituximabe, só devemos vacinar após seis meses13 (Tabela 4).
- pacientes que tenham desencadeado doença neurológica de natureza desmielinizante (Síndrome de Guillain-Barré e esclerose múltipla) no período de seis semanas após a aplicaçao de dose anterior da vacina febre amarela, devem ser avaliados caso a caso;
- pacientes transplantados com células tronco hematopoiéticas (medula óssea) devem ser avaliados caso a caso, considerando o risco epidemiológico. Caso se decida pela vacinaçao, deve ser respeitado o prazo mínimo de 24 meses após o transplante;
- imunodeficiências primárias: as contraindicaçoes de vacinas em pacientes com imunodeficiências primárias vao depender do compartimento do sistema imunológico envolvido. Pacientes com defeitos no complemento a princípio podem receber a vacina contra febre amarela. Paciente com imunodeficiências humorais, celulares, combinadas e síndrome bem definidas que cursam com reduçao de linfócitos T e/ou B nao devem receber a vacina contra febre amarela. Os membros saudáveis da família de pacientes com imunodeficiência grave de células T e B devem ser vacinados. Em relaçao à deficiência de IgA, sao necessários estudos que avaliem a segurança em relaçao à vacina contra a febre amarela14,17 (Tabela 5).
Deve-se levar em consideraçao:
1. o uso de doses elevadas de corticosteroide sistêmico (acima de 20 mg/dia) contraindicam a vacinaçao; porém, o de corticosteroide inalatório nao a contraindica;
2. pacientes em uso de corticoides sao considerados com potencial de imunossupressao quando recebem altas doses de prednisona (dose ≥ 20 mg/ dia ou ≥ 2 mg/kg/dia ou equivalente) por período maior que 14 dias. Nesse caso, deve-se evitar a administraçao de vacinas vivas atenuadas por até um mês após a interrupçao do tratamento;
3. em idosos, embora raro, a doença viscerotrópica associada à vacina febre amarela pode ocorrer especialmente quando vacinados pela primeira vez. No entanto, durante surtos epidêmicos, o benefício da imunizaçao pode ser superior aos riscos de reaçoes. Cabe ao médico definir o que é melhor para o paciente. Em estudo prospectivo realizado por um Centro de Imunizaçoes em Sao Paulo, entre 2009 e 2010, foram avaliados os eventos adversos pós vacinaçao contra febre amarela em indivíduos maiores que 60 anos de idade. Poucos eventos foram relatados, mostrando que a vacinaçao pode ser segura em idosos desde que uma avaliaçao clínica criteriosa seja feita em relaçao a condiçoes de imunossupressao17,18.
VACINA FEBRE AMARELA E ALERGIA AO OVO
A vacina febre amarela está disponível para uso clínico desde 1930, e já foram aplicadas mais de 540 milhoes de doses no mundo. A maioria dos EAPV relatados sao dor local, mal-estar, cefaleia, dores musculares e febre baixa em 2 a 5 % dos vacinados, e ocorrem entre o 5° e o 10° dia após a vacinaçao2.
Nos EUA, foram relatados pelo VAERS (Vaccine Adverse Event Reporting System) 938 eventos adversos à aplicaçao da vacina febre amarela entre 2007 e 2013. Cabe ressaltar que naquele país a vacina nao faz parte do calendário vacinal sistemático, e é indicada somente para viajantes que se dirigem a áreas endêmicas de febre amarela. Mais de 90% dos eventos adversos relatados nos EUA foram nao graves, sendo a vacina considerada segura. A taxa de ocorrência de anafilaxia foi de 1,3/100.000 doses, sendo maior entre os menores de 18 anos, e foi 2,7/100.000 doses6.
Há relatos de que a taxa de EAG à vacina febre amarela seja de 4,7/100.000 doses. No Brasil, no período de 2007 a 2012, a ocorrência de EAG associados à vacina febre amarela foi 0,42/100.000 doses administradas2.
Os principais EAG associados à vacina febre amarela sao: anafilaxia, doença neurológica associada à vacina febre amarela e a doença viscerotrópica associada à vacina febre amarela. É importante lembrar que qualquer EAG deve ser informado e notificado em até 24 horas após a sua ocorrência2,12.
A anafilaxia é a forma mais grave de reaçao de hipersensibilidade IgE mediada, envolve mais de um órgao ou sistema e é potencialmente fatal. Os critérios clínicos para o diagnóstico de anafilaxia incluem uma das definiçoes abaixo19.
1. Doença de início agudo (minutos a horas) com envolvimento da pele e/ou mucosas (urticária, prurido ou rubor facial, angioedema) e comprometimento respiratório (dispneia, broncoespasmo, estridor, reduçao do pico de fluxo expiratório, hipoxemia) ou reduçao da pressao arterial/sintomas de disfunçao de órgao terminal (síncope, convulsao, incontinência).
2. Duas ou mais das seguintes manifestaçoes que ocorrem em minutos a horas após a exposiçao a um provável alérgeno: envolvimento de pele/ mucosas, comprometimento respiratório; reduçao da pressao sanguínea ou sintomas associados; sintomas gastrointestinais persistentes (cólicas, vômitos).
3. Reduçao da pressao sanguínea após exposiçao (minutos a horas) a um alérgeno conhecido para determinado paciente.
Em relaçao a vacinas disponíveis no Brasil que contêm ovo, sabemos que a tríplice viral SCR (sarampo, caxumba e rubéola) é cultivada em fibroblastos de galinha, sendo a quantidade de proteína do ovo nela encontrada desprezível (picogramas) e insuficiente para causar uma reaçao em pacientes alérgicos a ovo2.
A alergia a ovo pode ser causa de hipersensibilidade à vacina influenza e febre amarela. A vacina influenza é cultivada em fluido alantoide de ovos embrionados de galinha, podendo conter alguma quantidade de proteína do ovo. No geral, as vacinas influenza comercializadas hoje contêm menos do que 1,2 µg/mL20.
A alergia a ovo já foi considerada uma contraindicaçao à vacina influenza, mas estudos que incluíram 4.300 indivíduos com história de alergia a ovo, dos quais 650 referiram reaçao anafilática, mostraram ter boa tolerância à vacina. Hoje a recomendaçao é que pacientes com anafilaxia a ovo recebam a vacina infuenza e permaneçam em observaçao por 30 a 60 minutos21-22.
A vacina febre amarela é cultivada em ovos embrionados de galinha. Os embrioes sao homogeneizados e centrifugados. A vacina nao é aquecida em nenhum momento de sua produçao, assim quantidades residuais de proteína do ovo podem estar presentes. Níveis variáveis de ovalbumina, entre 0,067 µg/0,5 mL e 2,21 µg/0,5 mL, foram documentados em diferentes lotes de vacinas produzidas pelo mesmo fabricante entre as comercializadas nos EUA e Reino Unido23.
Além da ovalbumina, podem ser considerados como possíveis causadores de reaçao de hipersensibilidade à vacina febre amarela: o próprio agente vacinal (vírus vivo atenuado da febre amarela), gelatina bovina, eritromicina, canamicina, látex (sendo estes quatro últimos presentes apenas em algumas apresentaçoes da vacina), e proteína da galinha. A ocorrência de anafilaxia é muito baixa, variando de 0,8 a 1,8 casos /100.000 doses aplicadas2,23.
O questionamento sobre alergia a ovo é considerado adequado para todas as pessoas que irao receber a vacina febre amarela. Devemos lembrar que em crianças sem qualquer história clínica compatível com alergia a ovo e que estejam em introduçao da alimentaçao complementar, nao há nenhuma evidência sobre a necessidade de ingestao prévia do ovo à vacinaçao de febre amarela21-23.
Se o indivíduo tem diagnóstico ou suspeita clínica de alergia a ovo, deve ser encaminhado ao alergologista para a realizaçao de investigaçao de possível sensibilizaçao a ovo pelos testes cutâneos de hipersensibilidade imediata ou a quantificaçao de IgE específica sérica (Figura 1). Se o teste for negativo, a vacina será administrada e o indivíduo mantido sob supervisao por algum tempo. Caso o resultado seja positivo, confirmada a sensibilizaçao a ovo, o paciente será dessensibilizado empregando-se a vacina em doses fracionadas conforme algoritmo sugerido (Figura 2). Tanto o teste quanto a dessensibilizaçao devem ser realizadas sem o uso prévio de medicaçoes (corticosteroides, anti-histamínicos, por exemplo)22,24,25.
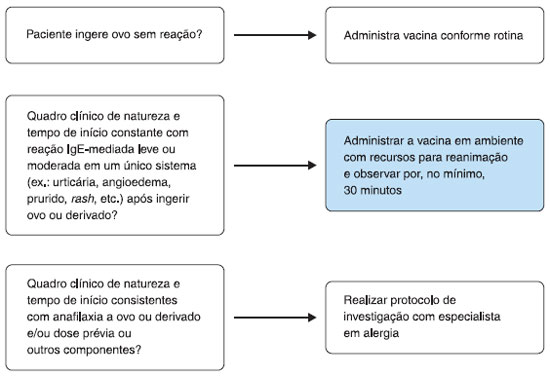
Figura 1 Algoritmo para conduçao de casos suspeitos de alergia a ovo e aplicaçao da vacina febre amarela. Adaptado de Kelso et al., 201020
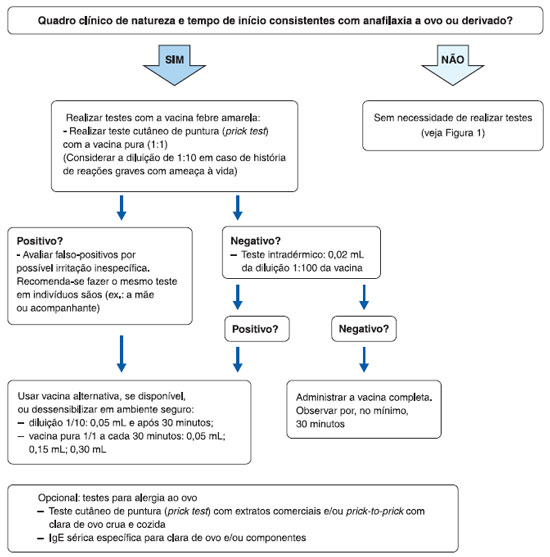
Figura 2 Protocolo de investigaçao e conduta em pacientes com história de anafilaxia a ovo e/ou derivado que necessitam receber a vacina febre amarela. Adaptado de Muñoz-Cano et al.25
Um aspecto importante a ser considerado é se o paciente refere tolerar o ovo cozido ou frito, mas nao sabe se tolera o ovo cru. Como a vacina febre amarela nao é aquecida em nenhum momento de seu processo de fabricaçao, mesmo o paciente que tolera o ovo cozido/frito pode apresentar reaçao à vacina25.
CONDUTA DIANTE DE SUSPEITA DE REAÇOES ALÉRGICAS A VACINA FEBRE AMARELA OU ALGUM DE SEUS COMPONENTES
1. Reaçoes locais leves e sintomas constitucionais, como febre, sao comuns após vacinaçao e nao caracterizam alergia. Nao contraindicam doses futuras.
2. Reaçao de hipersensibilidade tardia causada por constituintes das vacinas e caracterizada por um nódulo no local da aplicaçao, é rara e também nao contraindica doses futuras.
3. Colher história clínica minuciosa e definir a natureza e o tempo de início de ocorrência dos sintomas após ingestao de ovo e/ou seus derivados. Sintomas inespecíficos como flatulência, cefaleia e mal-estar isolados nao caracterizam alergia.
RECOMENDAÇOES PARA A ADMINISTRAÇAO EM CASOS DE ANAFILAXIA - ALGORITMO E DOSES
A Figura 1 apresenta algoritmo a ser seguido em pacientes com suspeita de história prévia de reaçao alérgica ao ovo.
Na Figura 2 é proposto um protocolo de investigaçao e conduta para pacientes com suspeita de alergia ao ovo ou a componentes da vacina febre amarela e que necessitam ser vacinados segundo Muñoz-Cano e colaboradores25.
Dentre as vacinas hoje comercializadas no Brasil, somente a produzida por BioManguinhos contém gelatina bovina, eritromicina ou canamicina, por ser embalada em frascos de multidoses. Desta forma, pacientes com história de alergia a algum destes componentes podem receber a vacina produzida pelo laboratório Sanofi Pasteurr que nao contém tais componentes2.
CONSIDERAÇOES FINAIS
A experiência clínica com o uso da vacina febre amarela é vasta no Brasil. Entretanto, publicaçoes sao necessárias para avaliar o risco real entre a associaçao de alergia a ovo e a vacina febre amarela. Talvez, no futuro, possamos chegar às mesmas conclusoes já alcançadas sobre o uso da vacina influenza nos pacientes alérgicos a ovo.
Em relaçao aos indivíduos em outras condiçoes especiais, é importante a avaliaçao individualizada e criteriosa para nao perdermos a oportunidade de vacinaçao.
No Brasil, a maior parte do território é considerada área endêmica ou área de risco para febre amarela. Segundo a Secretaria de Vigilância em Saúde do Ministério da Saúde, de dezembro de 2016 a março de 2017 foram notificados 1.558 casos suspeitos de febre amarela, sendo 424 confirmados. Do total de casos, 259 evoluíram para óbito, sendo a taxa de letalidade da febre amarela nos casos confirmados de 32,2%. Frente a este cenário epidemiológico, temos que ser cautelosos ao contraindicar a vacinaçao contra a febre amarela, uma doença com alta letalidade e para a qual nao há tratamento específico. A vacinaçao continua sendo a forma eficaz de proteçao contra a doença.
REFERENCIAS
1. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Coordenaçao-Geral do Programa Nacional de Imunizaçoes. Coordenaçao Geral de Doenças Transmissíveis. Nota Informativa nº 143 /GPNI/DEVIT/SVS/MS. Recomendaçoes da vacinaçao contra febre amarela, após declaraçao da Organizaçao Mundial da Saúde. Brasília, 2014.
2. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de vigilância epidemiológica de eventos adversos pós-vacinaçao / Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância das Doenças Transmissíveis, 3ª ed, Brasília: Ministério da Saúde, 2014. 250 p.: il.
3. SBIm - Sociedade Brasileira de Imunizaçoes. Nota Técnica 23/01/2017 - Revisada em 17/04/2017 - Febre Amarela. Disponível em www.sbim.org.br. Acessado em 01/06/2017.
4. Brasil. Ministério da Saúde. Disponível em: http://portalsaude.saude.gov.br/index.php/o-ministerio/principal/leia-mais-o-ministerio/619- secretaria-svs/l1-svs/27300-febre-amarela-informacao-eorientacao). Acessado em 02/06/2017.
5. SBI - Sociedade Brasileira de Infectologia. Febre Amarela - Informativo para Profissionais de Saúde (atualizado em 13/02/2017) - disponível em www.infectologia.com.br. Acessado em 01/03/2017.
6. Centers for Disease Control and Prevention. MMWR. Yellow Fever Vaccine-Recommendations of the Advisory Committee on Immunization Practices (ACIP). 2010; 59(RR-7). Disponível em: https://www.cdc.gov/mmwr/pdf/rr/rr5907.pdf. Acessado em 20 de março de 2017.
7. Sociedade Brasileira de Pediatria. Documento Científico. Departamento Científico de Imunizaçoes. Febre amarela: Nota informativa. Nº 3, fevereiro de 2017.
8. Ministério da Saúde. Nota Informativa nº 94 de 2017, CGPNI/SVS/MSTDEVI. Orientaçoes e Indicaçoes de dose única da vacina febre amarela. https://central3.to.gov.br/arquivo/344399/. Acessado em 24/06/2017.
9. Lindsey NP, Rabe IB, Miller ER, Fischer M, Staples JE. Adverse event reports following yellow fever vaccination, 2007-2013. J Travel Med. 2016;23(5):1-6.
10. Kelso JM, Greenhawt MJ, Li JT, Nicklas RA, Bernstein DI, Blessing- Moore J, et al. Adverse reactions to vaccines practice parameter 2012 update. J Allergy Clin Immunol. 2012;130(1):25-43.
11. Kelso JM, Greenhawt MJ. Adverse Reactions to Vaccines for Infections Diseases. In: Adkinson NF et al. (ed). Middleton's Allergy Principles and Practice. 8ª ed. Philadelphia: Elsevier; 2014.
12. Rafferty E, Duclos P, Yactayo S, Schuster M. Risk of yellow fever vaccine-associated viscerotropic disease among the elderly: a systematic review. Vaccine. 2013;31:5798-805.
13. Guia de Imunizaçoes SBIm/SBR - Reumatologia - 2015-2016 - disponível em: https://sbim.org.br/images/files/guia-reumato-sbimsbr- 141014-141205a-web.pdf.
14. Shearer WT, Fleisher TA, Buckley RH, Ballas Z, Ballow M, Blaese RM, et al. Recommendations for live viral and bacterial vaccines in immunodeficient patients and their close contacts. J Allergy Clin Immunol. 2014;133(4):961-6.
15. Martins RM, Maia MLS, Farias RHG, Camacho LAB, Freire MS, Galler R, et al. 17DD yellow fever vaccine. A double blind, randomized clinical trial of immunogenicity and safety on a dose- response study. Hum Vaccines Immunother. 2013;9:4,1-10.
16. Martins RM, Maia MLS, Farias RHG, Camacho LAB, Freire MS, Galler R, et al. 17DD yellow fever vaccine. A double blind, randomized clinical trial of immunogenicity and safety on a dose-response study. Hum Vaccines Immunother. 2013;9:4,1-10.
17. Guia de Imunizaçao SBIm/ASBAI - Asma, Alergia e Imunodeficiências 2015-2016 - disponível em: http://sbim.org.br/images/files/guiasbim- asbai-151110-bx.pdf
18. Miyaji KT, Luiz AM, Lara AN, do Socorro Souza Chaves T, Piorelli Rde O, Lopes MH, et al. Active assessment of adverse events following yellow fever vaccination of persons aged 60 years and more. Hum Vaccin Immunother. 2013;9:277-82.
19. Bernd LAG, Sá AB, Watanabe AS, Castro APM, Solé D, Castro FM, et al. Guia Prático para o manejo da anafilaxia - 2012. Rev Bras Alerg Imunopatol. 2012;35:53-70.
20. Kelso JM. Administering influenza vaccine to egg allergic persons. Exp Ver Vaccines. 2014;13(8):1049-57.
21. Echeverría-Zudaire LA, Ortigosa-del Castillo L, Alonso-Lebrero E, Alvarez-García FJ, Cortés-Alvarez N, García-Sánchez N, et al. Consensus document on the approach to children with allergic reactions after vaccination or allergy to vaccine components. Allergol Immunopathol (Madr). 2015;43(3):304-25.
22. Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016;9(1):32.
23. Smith D, Wong P, Gomez R, White K. Ovalbumin content in the yellow fever vaccine. J Allergy Clin Immunol Pract. 2015;3(5):794-5.
24. Rutkowski K, Ewan PW, Nasser SM. Administration of yellow fever vaccine in patients with egg allergy. Int Arch Allergy Immunol. 2013;161(3):274-8.
25. Muñoz-Cano R, Sanchez-Lopez J, Bartra J, Valero A. Yellow fever vaccine and egg allergy: really a problem? Allergy. 2010;65(4):533-4.