Número Atual: Novembro-Dezembro 2015 - Volume 3 - Número 6
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
RELATO DE CASO
O alérgeno imunodominante da tilápia geneticamente melhorada para aquacultura (Oreochromis niloticus) em quatro brasileiros alérgicos é uma proteína de 100 kDa susceptível à digestao péptica
The immunodominant allergen of genetically improved farmed tilapia (Oreochromis niloticus) is a 100-kDa protein susceptible to pepsin digestion in four fish-allergic Brazilian patients
Celso Eduardo Olivier1; Regiane Patussi dos Santos Lima2; Daiana Guedes Pinto Argentao2; Mariana Dias da Silva3; Raquel Acácia Pereira Gonçalves dos Santos4; Jaison Castro Oliveira5; Priscila Cristina Vaz Bortolozzo6
DOI: 10.5935/2318-5015.20150031
1. MD, PhD. Instituto Alergoimuno de Americana, Americana, SP
2. BSc. Instituto Alergoimuno de Americana, Americana, SP
3. PHARM. Instituto Alergoimuno de Americana, Americana, SP
4. RN. Instituto Alergoimuno de Americana, Americana, SP
5. BSc. Faculdade Anhanguera de Santa Bárbara, Santa Bárbara D'Oeste, SP
6. BSc, MSc. Faculdade Anhanguera de Santa Bárbara, Santa Bárbara D'Oeste, SP
Endereço para correspondência:
Celso Eduardo Olivier
E-mail: celso@docsystems.med.br
Submetido em: 29/12/2013
Aceito: em 29/11/2016
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A caracterizaçao dos alérgenos de peixes brasileiros ainda é deficiente. Este estudo foi conduzido com quatro indivíduos brasileiros que apresentaram reaçoes imediatas após a ingestao de tilápia. A natureza mediada por IgE da hipersensibilidade foi demonstrada por testes cutâneos e por immunoblotting. Uma proteína ainda nao caracterizada de 100 kDa foi identificada pelo immunoblotting IgE como o alérgeno do extrato natural nao digerido da tilápia do Nilo (Oreochromis niloticus) geneticamente melhorada para aquacultura. Esta proteína foi susceptível à atividade péptica como demonstrado por SDS-PAGE, que mostrou uma banda única entre 12 e 19 kDa após a digestao péptica. Os testes cutâneos com o extrato digerido de tilápia nao demonstraram nenhuma reaçao, assim como o immunoblotting IgE nao demarcou nenhuma banda na corrida eletroforética do extrato digerido.
Descritores: Hipersensibilidade alimentar, imunoglobulina E, tilápia, immunoblotting, pepsina A, criança.
Reaçoes de hipersensibilidade a alimentos, e em particular, a proteínas de peixes, sao um problema médico universal1. Reaçoes alérgicas a peixes podem ser produzidas após a ingestao, contato ou inalaçao de vapores por indivíduos sensibilizados que podem desenvolver urticária, angioedema, asma, dispepsia, perda de consciência e/ou choque anafilático. A parvalbumina, uma pequena proteína ligante de cálcio, abundante na musculatura branca de vertebrados de sangue frio, representa o principal alérgeno de peixes marinhos devido a sua reatividade cruzada entre espécies e resistência ao aquecimento e digestao2. Além da parvalbumina, que age como um pan-alérgeno, diversas outras proteínas de peixes podem desencadear reaçoes mediadas por IgE e reaçoes nao IgE-mediadas. A maioria dos estudos publicados sobre alergia a peixes focaliza sua atençao sobre espécies marinhas, mas nos últimos anos, a alergia a peixes de água doce tem sido relatada mais frequentemente3. A medida que a demanda por carne de peixes tem aumentado mundialmente, as fontes naturais vêm sendo depletadas pela superexploraçao. Isto tem sido um incentivo para a aquacultura, que vem nos últimos anos aumentando progressivamente a sua contribuiçao para o suprimento de carne de peixe para a alimentaçao humana4. Neste propósito, a tilápia do Nilo (Oreochromis niloticus) foi introduzida no Nordeste brasileiro em 1971, trazida da Costa do Marfim5. A tilápia do Nilo adaptou-se bem às condiçoes climáticas brasileiras e sua reproduçao prolífica e alta resistência contribuíram para sua disseminaçao para outras regioes. Em 1988 o WorldFish Center das Filipinas e o da Noruega desenvolveram uma cepa geneticamente melhorada da tilápia do Nilo para aquacultura (GIFT)4. Manipulaçao genética, reversao sexual e técnicas de seleçao foram usadas para modificar as cepas nativas de maneira a torná-las mais produtivas6,7. Em 2005 a cepa GIFT foi finalmente introduzida no Brasil e adotada por muitos piscicultores8. Mais recentemente, alergia à tilápia do Nilo nao causada por parvalbumina foi descrita, diversamente das espécies marinhas9. A caracterizaçao dos alérgenos da tilápia de Moçambique também demonstrou que a parvalbumina nao é um alérgeno relevante para a tilápia10. Até o momento, o alérgeno da tilápia mais bem estudado é a tropomiosina de 33 kDa da tilápia de Moçambique (Ore m 4)11.
O presente trabalho descreve um grupo de quatro indivíduos brasileiros que desenvolveram alergia oral e/ou urticária após a ingestao de tilápia, assim como o estudo de sua imunorreatividade contra as proteínas da tilápia através de testes cutâneos, e SDS-PAGE e immunoblotting IgE.
Este estudo foi aprovado pela Comissao de Ética da Universidade Anhanguera e registrado na Plataforma Brasil, CAAE 12361213.1.0000.5372 e conduzido conforme os princípios da declaraçao de Helsinque após obtençao de consentimento informado. Os dados dos pacientes foram mantidos em confidencialidade. Nao foram utilizadas drogas experimentais. Nao houve nenhum conflito de interesses potencial ou declarado.
RELATO DE CASOS
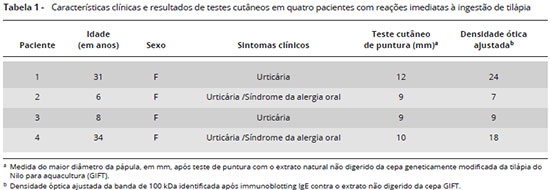
Paciente n° 1: sexo feminino, 31 anos. Apresentou nos dois meses anteriores ao exame dois episódios de urticária 30 minutos após a ingestao de tilápia. Referiu estar habituada a comer tilápia e outros peixes, sem apresentar sintomas previamente.
Paciente n° 2: sexo feminino, 6 anos. Apresentou edema labial e urticária 10 minutos após a ingestao de tilápia. Seus pais nao se lembravam de que a criança houvesse comido tilápia anteriormente, mas havia comido outras espécies de peixes sem desenvolver sintomas.
Paciente n° 3: sexo feminino, 8 anos. Apresentou edema de lábios 20 minutos após a ingestao de tilápia. Seus pais referiram que ela havia ingerido tilápia uma ou duas vezes, assim como outras espécies de peixes, sem apresentar sintomas previamente.
Paciente n° 4: sexo feminino, 31 anos. Apresentou prurido e edema de lábios imediatamente após contato com tilápia na boca, interrompendo a ingestao. Referiu que nao ingeria tilápia habitualmente, mas fazia uso de outros peixes sem apresentar sintomas.
MÉTODOS
Preparaçao dos extratos e digestao péptica
Os extratos foram preparados a partir de exemplares da cepa GIFT doadas por um piscicultor da regiao. Os extratos foram preparados por extraçao em soluçao de Coca sob agitaçao contínua por 24 horas a 4 °C. Após a centrifugaçao, a concentraçao de proteína do sobrenadante foi determinada pelo método de Hartree, ajustada para 1 mg/mL e armazenada a -20 °C. Para a digestao péptica, as preparaçoes de proteínas foram incubadas a 37 °C com 0,87 g/L de pepsina (Sigma, St Louis, Mo, USA) em pH 2 sob agitaçao contínua. A reaçao enzimática foi finalizada por neutralizaçao do pH e resfriamento em gelo após 1 minuto de incubaçao. A digestao da proteína foi avaliada através de eletroforese em gel de gradiente de poliacrilamida pelo método de Lammeli (SDS-PAGE 5%T/20%C) e coloraçao com azul de Coomassie, como descrito previamente12.
Testes cutâneos de hipersensibilidade imediata
Nao estando em uso de nenhuma medicaçao por duas semanas, os pacientes foram submetidos a testes cutâneos de puntura (skin prick test) com os extratos de tilápia nao digerido, digerido e controles de histamina (1 mg/mL) e diluente.
Immunoblotting
As amostras de soro foram analisadas após eletroforese em gel de gradiente (5%T/20%C) de poliacrilamida (SDS-PAGE) em condiçoes redutoras em aparelho Mini Protean Tetra Cell (Bio-Rad, CA, USA). Alíquotas de 5 µL dos extratos nao digeridos e digeridos preparados em tampao contendo SDS (2%) e mercaptoethanol (5%) foram aquecidos por 10 minutos a 96 °C e aplicados em cada poço. Um padrao de comparaçao de pesos moleculares pré-corado de 10-170 kDa (PageRulerH, Fermentas, Hanover, MD, USA) foi empregado para identificar os pesos moleculares aproximados. Após a corrida eletroforética vertical, as proteínas foram transferidas por eletroforese horizontal para membranas de nitrocelulose com poros de 0,45 mm (Bio-Rad, CA, USA) com auxílio do Mini Trans-Blot Cell (Bio-Rad, CA, USA). As membranas foram incubadas por 10 horas a 4 °C e agitaçao pendular suave em 3 mL de soluçao de fosfato tamponada (PBS), pH 7,0 contendo 3 µL do soro de cada paciente individualmente, seguido por 3 lavagens em PBST (PBS adicionado de 0,05% Tween-20). A seguir, as membranas foram incubadas em agitaçao pendular suave por 2 horas com IgG de cabra policlonal anti-IgE humano (15 µg em 3 mL PBS), lavadas 3 vezes com PBST e incubadas com IgG de coelhos anti-IgG de cabra conjugado com peroxidase do rábano por 2 horas. Após 3 lavagens em PBST, a atividade da peroxidase foi estimulada incubando as membranas em 10 mL de PBS contendo 0,05% de diaminobenzidina, seguida por adiçao de 50 µL de soluçao reagente (CoCl2.6H2O e NiSO4) e 20 µL de peróxido de hidrogênio 30% vol. (H2O2). Quando a impregnaçao e desenvolvimento da coloraçao se completaram, as membranas foram lavadas em água destilada e secadas. Imagens do gel e das membranas de nitrocelulose foram escaneadas em escala de cinza e a densitometria relativa das bandas foi analisada usando o programa ImageJ (Windows version 1.44 NIH ImageJ, http://rsb.info.nih.gov/ij/index.html) pela mensuraçao da densidade óptica média (OD) das bandas após inversao do brilho da imagem. A densidade óptica ajustada (AOD) foi calculada após a correçao do background por subtraçao da OD da banda demarcada da OD de área similar lida na proximidade da banda que nao demonstrou nenhum sinal de coloraçao.
RESULTADOS
Testes cutâneos de hipersensibilidade imediata
Todos os indivíduos demonstraram testes cutâneos de hipersensibilidade imediata positivos para o controle de histamina e para o extrato de tilápia GIFT nao digerido (Tabela 1). Nao houve reaçoes para o extrato digerido ou para o diluente (resultados nao mostrados).
Eletroforese em SDS-PAGE
A análise do gel de gradiente corado com azul de Coumassie demonstrou a distribuiçao das proteínas do extrato natural nao digerido entre 10 faixas de pesos moleculares: 100 kDa, 64 kDa, 52 kDa, 44 kDa, 40 kDa, 34 kDa, 30 kDa, 19 kDa, 15 kDa e 12 kDa. Este padrao desapareceu após a digestao com pepsina que mostrou no gel corado com azul de Coomassie uma única banda em torno de 12 a 19 kDa (Figura 1).
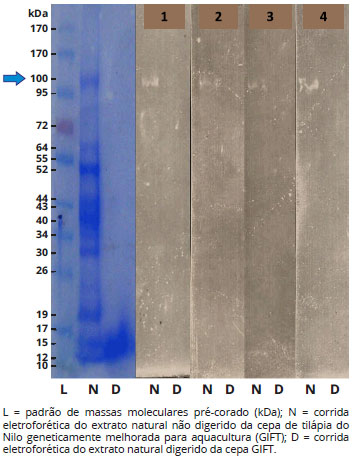
Figura 1 - Gel de gradiente de poliacrilamida (SDS-PAGE) corado em azul de Coomassie (à esquerda) e as 4 membranas de nitrocelulose reveladas após immunoblotting IgE com soro dos quatro pacientes (à direita)
Immunoblotting
Os soros dos quatro pacientes marcaram uma única banda de 100 kDa na corrida eletroforética do extrato natural nao digerido de tilápia. Nao houve nenhuma marcaçao na corrida eletroforética do extrato digerido. As densidades ópticas ajustadas da banda de 100 kDa variaram de 7 a 24 (Tabela 1). Como nao houve nenhuma marcaçao na corrida eletroforética do extrato digerido, todas as leituras ópticas ajustadas foram iguais a zero. A Figura 1 mostra lado a lado, da esquerda para a direita, o padrao de peso molecular (L), a distribuiçao eletroforética no gel de gradiente corado com azul de Coomassie das proteínas do extrato natural nao digerido (N), do extrato digerido (D) e as membranas de nitrocelulose dos quatro pacientes após o immunoblotting revelado com anti-IgE e peroxidase.
DISCUSSAO
A caracterizaçao dos antígenos alimentares é uma etapa essencial na conduçao do tratamento de pacientes com alergia alimentar e para o planejamento de estratégias de induçao de tolerância. Os alérgenos alimentares podem ser classificados de acordo com a sua natureza em duas classes. Os alérgenos de classe 1 sao resistentes à digestao gástrica e podem sensibilizar após a absorçao intestinal, como é o exemplo da beta-lactoglobulina bovina (Bos d 5). Os alérgenos de classe 2 sao suscetíveis à digestao gástrica e sensibilizam por contato direto com a mucosa oral/nasal e/ou por reatividade cruzada, como por exemplo, as proteínas dos polens e das frutas13. Os alérgenos de classe 1 estao geralmente associados com manifestaçoes sistêmicas como urticária, asma ou anafilaxia. Os alérgenos de classe 2 estao geralmente associados com manifestaçoes locais como a síndrome da alergia oral ou a rinite, mas podem produzir ocasionalmente manifestaçoes sistêmicas quando a digestao gástrica está por alguma razao comprometida (uso de antiácidos, por exemplo). Os quatro pacientes apresentados aqui sao um exemplo típico de sensibilizaçao por um alérgeno de classe 2. O aparecimento "ocasional" de reaçoes adversas sugere que a digestao gástrica das proteínas da tilápia protege contra o aparecimento de reaçoes alérgicas. A pepsina digere até 20% das ligaçoes amídicas pela clivagem preferencial entre os resíduos aromáticos dos aminoácidos. A digestao péptica de um alérgeno geralmente destruirá seus epítopos conformacionais (dependentes da estrutura secundária, terciária e quartenária), diminuindo sua alergenicidade. Uma vez que a digestao péptica é incompleta, os peptídeos resultantes podem preservar os epítopos lineares responsáveis pelo reconhecimento nos receptores de células T (ou mesmo em alguns receptores de linfócitos B). A preservaçao dos epítopos conformacionais de um extrato de alérgenos é altamente desejável quando este extrato é usado com propósitos diagnósticos. Entretanto, a preservaçao dos epítopos conformacionais de um extrato de alérgenos nao é tao desejável quando este extrato é utilizado com propósitos terapêuticos. De fato, para a induçao de um repertório de células T regulatórias, a célula apresentadora de antígenos apresenta para a célula T virgem somente os epítopos lineares resultantes da digestao intracelular do alérgeno. Estes epítopos lineares nao correspondem necessariamente ao mesmo epítopo conformacional imunorreativo, mas podem ter sido retirados de outra parte da proteína. Atualmente, estratégias de induçao de tolerância incluem a imunoterapia alérgeno-específica e também a imunoterapia "epítopo de célula T específico" (peptídica)14. Neste sentido, a estratégia de induçao de tolerância para o tratamento da alergia a peixes também procura por proteínas modificadas de forma a serem menos alergênicas que suas contrapartes originais, mas que preservem a imunorreatividade para as células T (epítopos lineares)2. O uso de tecnologia recombinante abre novas perspectivas para o tratamento de alérgenos resistentes à digestao como a parvalbumina, mas pode nao ser tao necessária para as proteínas digeríveis, que podem ser convertidas em peptídeos tolerogênicos pela simples digestao com pepsina.
A carne de peixe é um dos alérgenos mais comuns. Entretanto, enquanto diversos pesquisadores estudam os alérgenos de peixes marinhos consumidos globalmente, a caracterizaçao dos alérgenos dos peixes brasileiros de água-doce ainda está inexplorada. A cepa GIFT de tilápia está se disseminando rapidamente por nosso país e tornando-se uma fonte importante de carne de peixe. O aparecimento de indivíduos alérgicos às suas proteínas específicas é de certa forma esperado. Pesquisadores estao trabalhando no desenvolvimento de estratégias de induçao de tolerância para a alergia a peixes marinhos; entretanto, possíveis diferenças com os alérgenos de peixes brasileiros podem levar à falta de eficácia com o uso de imunoterapia desenvolvida em outros países nos pacientes brasileiros. A caracterizaçao dos alérgenos de peixes brasileiros é o primeiro passo na pesquisa de estratégias de induçao de tolerância adaptadas ao nosso país.
REFERENCIAS
1. Sharp MF, Lopata AL. Fish Allergy: in Review. Clin Rev Allergy Immunol. 2014;46:258-71.
2. Swoboda I, Bugajska-Schretter A, Linhart B, Verdino P, Keller W, Schulmeister U, et al. A recombinant hypoallergenic parvalbumin mutant for immunotherapy of IgE-mediated fish allergy. J Immunol. 2007;178:6290-6.
3. Liu R, Krishnan HB, Xue W, Liu C. Characterization of allergens isolated from the freshwater fish blunt snout bream (Megalobrama amblycephala). J Agric Food Chem. 2011;59:458-63.
4. Gupta MV, Acosta BO. From drawing board to dining table: the success story of the GIFT project. NAGA - Worldfish Center Quarterly. 2004;27:4-14.
5. Oliveira SN, Ribeiro RP, Lopera NM, Candioto FB, Resende EKd, Legat AP. Genetic characterization of three Nile tilapia (GIFT strain) generations using the RAPD marker. Acta Scientiarum - Animal Sciences. 2011;33:207-12.
6. Li S-F, He X-J, Hu G-C, Cai W-Q, Deng X-W, Zhou P-Y. Improving growth performance and caudal fin stripe pattern in selected F6-F8 generations of GIFT Nile tilapia (Oreochromis niloticus L.) using mass selection. Aquaculture Research. 2006;37:1165-71.
7. Phelps RP, Pompma TJ. Sex reversal of tilapia In: Tilapia Aquaculture in the Americas. Vol 2. Baton Rouge, Louisiana, United States: The World Aquaculture Society; 2000 p. 34-59.
8. Lupchinski-Junior E, Vargas L, Povh JA, Ribeiro RP, Mangolin CA, Barrero NML. Variability evaluation of G0 and F1 generations of GIFT Nile tilapia strain (Oreochromis niloticus) by RAPD. Acta Scientiarum - Animal Sciences. 2008;30:233-40.
9. Ebo DG, Kuehn A, Bridts CH, Hilger C, Hentges F, Stevens WJ. Monosensitivity to pangasius and tilapia caused by allergens other than parvalbumin. J Investig Allergol Clin Immunol. 2010;20:84-8.
10. Liu R, Yang E, Liu C, Xue W. Tilapia (Oreochromis mossambicus) allergens characterized by ELISA, SDS-PAGE, 2D gels, Western blotting and MALDI-TOF mass spectrometry. Int J Food Sci Nutr. 2012;63:259-66.
11. Liu R, Holck AL, Yang E, Liu C, Xue W. Tropomyosin from tilapia (Oreochromis mossambicus) as an allergen. Clin Exp Allergy. 2012;43:365-77.
12. Olivier CE, Lorena SLS, Pavan CR, Santos RAPG, Lima RPS, Pinto DG, et al. Is it just lactose intolerance? Allergy Asthma Proc. 2012;33:432-6.
13. Olivier CE. Food Allergy. J Allergy Ther. 2013;S3:004. doi: 10.4172/2155-6121.S3-004.
14. Pickl WF. The value of identifying major T cell epitopes of clinically important allergens. Int Arch Allergy Immunol. 2013;160:4-6.