Número Atual: Maio-Junho 2015 - Volume 3 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Pneumonias em imunodeficiência comum variável após mudança de ambiente físico
Pneumonia in common variable immunodeficiency after change in physical environment
Ana Paula Kazue Beppu, MD1; Julia Warchavchik Melardi, MD2; Verônica Reche Rodrigues Gaudino, MD2; Marina Colella dos Santos, MD2; Maria da Conceiçao Santos de Menezes, MD, MSc1; Wilma Carvalho Neves Forte, MD, PhD2
DOI: 10.5935/2318-5015.20150019
1. Irmandade da Santa Casa de Misericórdia de Sao Paulo
2. Faculdade de Ciências Médicas, Santa Casa de Sao Paulo
Endereço para correspondência:
Wilma Carvalho Neves Forte
E-mail: wilmanevesforte@yahoo.com.br
Submetido em: 20/05/2015
Aceito em: 15/07/2016
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVO: Estudar a possível relaçao entre mudança para ambiente físico com maior número de pessoas e aparecimento de pneumonias de repetiçao em pacientes com imunodeficiência comum variável (ICV).
MÉTODOS: Realizou-se estudo prospectivo-transversal em amostra de conveniência de pacientes com ICV e história de pneumonias de repetiçao, acompanhados em serviço especializado de hospital terciário.
RESULTADOS: Entre os 23 pacientes selecionados com ICV e história de pneumonias, cinco apresentaram pneumonias após mudança para ambientes com maior número de pessoas.
CONCLUSAO: Um subgrupo de pacientes com ICV apresentou pneumonias após mudança para ambiente físico com maior número de pessoas. O diagnóstico de ICV deve ser feito o mais precocemente possível, na tentativa de evitar sequelas pulmonares irreversíveis. Sendo assim, é importante a pesquisa desta doença em indivíduos que apresentem pneumonias após mudanças de ambiente físico, incluindo mudanças para locais onde o espaço é compartilhado com número aumentado de pessoas.
Descritores: Imunodeficiência comum variável, imunodeficiências primárias, pneumonias.
INTRODUÇAO
Imunodeficiência comum variável (ICV) constitui um grupo heterogêneo de alteraçoes genéticas caracterizado por baixos valores séricos de IgG e IgA e/ou IgM, baixa produçao de anticorpos (isohemaglutininas, deficiência de anticorpos específicos), diagnosticada após exclusao de outras causas de hipogamaglobulinemia e depois dos quatro anos de idade1-7. Sua prevalência é estimada entre 1:10.000 e 1:75:0007,8, sendo mais frequente em caucasianos (1:25.000 europeus) e rara em asiáticos (1:2.000.000) e afro-americanos9-12, afetando os dois gêneros de forma semelhante7.
Mais de 90% dos pacientes com ICV sao suscetíveis a infecçoes bacterianas respiratórias e gastrointestinais, apresentando otites, amigdalites, diarreias e pneumonias de repetiçao6,7,10,14. O quadro clínico pode iniciar com infecçoes de mucosas, seguindo-se por pneumonias de repetiçao, mostrando uma evoluçao das manifestaçoes clínicas de deficiência de IgA para ICV14-17. Foram observadas deficiências de IgA e ICV em membros da mesma família, sugerindo-se uma predisposiçao genética comum às duas IDPs10-17.
O quadro clínico da ICV, em especial as pneumonias de repetiçao, pode se manifestar em qualquer faixa etária. A idade mais frequente de aparecimento das manifestaçoes clínicas desta IDP é entre 20 a 40 anos; em apenas 20% dos casos as manifestaçoes aparecem antes dos 20 anos, principalmente entre seis a dez anos1,18,19.
Sao descritos vários fatores de risco para a aquisiçao de pneumonias na populaçao: colonizaçao da orofaringe, micro e macroaspiraçao, insuficiência cardíaca, envelhecimento, fatores ambientais como alcoolismo/cirrose hepática, tabagismo/DPOC, desnutriçao, além de imunodeficiência primária ou secundária20. Os fatores de risco para pneumonias em ICV sao pouco estudados, além da causa imunológica.
Os patógenos mais frequentes das pneumonias em ICV sao Streptococcus pneumoniae, Haemophilus influenzae, seguindo-se Staphylococcus aureus e Moraxella catharralis7,10. As frequentes pneumonias na ICV ocasionam complicaçoes irreversíveis, em especial bronquiectasias18.
O tratamento da ICV é feito com reposiçao de imunoglobulina humana endovenosa ou subcutânea ao longo da vida, uso de antibióticos durante as infecçoes e tratamento das complicaçoes. A reposiçao com imunoglobulina previne novas pneumonias, diminuindo significativamente a frequência e a gravidade dessas infecçoes, as complicaçoes pulmonares e o número de hospitalizaçoes3,6,10,21.
O acompanhamento por vários anos de portadores de ICV em setor especializado sugeriu que as manifestaçoes pulmonares pudessem estar relacionadas às mudanças de ambiente físico apresentadas pelos pacientes. Nao encontramos na literatura até o momento trabalhos sobre esta possível relaçao. Por tais motivos nos propusemos a realizar o presente trabalho, que teve como objetivo estudar a possível relaçao entre mudança para ambiente físico com maior número de pessoas e aparecimento de pneumonias de repetiçao em pacientes com imunodeficiência comum variável (ICV).
MÉTODOS
O estudo foi realizado após a aprovaçao pelo Comitê de Ética da Instituiçao, conforme número 16622913.5.0000.5479, com assinatura de todos os pacientes e/ou responsáveis do termo de consentimento livre e esclarecido.
Foi feito um estudo transversal-prospectivo, clínico-laboratorial, em amostra de conveniência de pacientes com ICV e história positiva para pneumonias de repetiçao, acompanhados em Setor de Imunodeficiências Primárias de hospital terciário. Foram selecionados 23 portadores de ICV durante o período de um ano, incluindo-se: pacientes com diagnóstico prévio de ICV conforme os critérios da Sociedade Europeia de Imunodeficiências1; deficiência de IgA e de anticorpos antipolissacarídeos; história positiva de pneumonias de repetiçao caracterizada como duas ou mais pneumonias no período de um ano, diagnosticadas por profissional médico, com melhora clínica do número de infecçoes pulmonares após reposiçao de imunoglobulina humana a cada 21 ou 28 dias. Foram excluídos os portadores de ICV com história negativa de pneumonias de repetiçao. Após o consentimento livre e esclarecido, os pacientes foram submetidos a questionário padronizado e dirigido às manifestaçoes iniciais da ICV (Figura 1).

Figura 1 - Questionário sobre as manifestaçoes clínicas, aplicado aos pacientes com Imunodeficiência Comum Variável apresentando pneumonias de repetiçao
Foi considerada mudança de ambiente físico quando os pacientes apresentavam história prévia de convivência diária com número restrito de pessoas e passaram a ter hábitos cotidianos que obrigavam a contato com grande número de indivíduos. Nao houve mudança de ambiente físico quando o paciente continuou a morar na mesma residência e a frequentar os mesmos locais antes e após o aparecimento das manifestaçoes pulmonares.
RESULTADOS
Entre os 23 pacientes com ICV selecionados, 13 (57%) eram do gênero masculino, e 10 (43%) do feminino. A média de idade dos pacientes na ocasiao da coleta dos dados foi de 23 anos (variando de 6 a 64 anos), sendo 7 (39%) pacientes com idade inferior a 18 anos, e 11 (61%) com idade igual ou superior a 18 anos. No grupo de crianças, 4 eram meninos e 3 meninas, enquanto no grupo de adultos havia 7 homens e 4 mulheres. A idade de início das infecçoes de repetiçao nao pulmonares foi de 5,5 anos (variando de 3 meses a 32 anos) e a idade de pneumonias de repetiçao foi de 6,5 anos (variando de 3 meses a 32 anos). A média de idade do diagnóstico de ICV foi de 11 anos (variando de 5 a 59 anos).
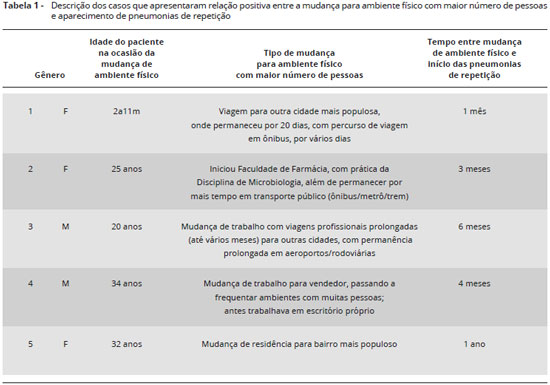
O aparecimento de pneumonias de repetiçao após a mudança para ambiente físico com maior número de pessoas foi observado entre cinco dos 23 pacientes estudados.
As mudanças de ambiente físico ocorreram em diferentes situaçoes: após viagens prolongadas com maior número de pessoas, início do uso de transporte público diário, contato direto com patógenos, permanência prolongada em locais de aglomeraçoes, início de trabalho ou mudança de moradia para regioes populosas. A Tabela 1 mostra os resultados observados com maiores detalhes. No caso 1, a paciente viajou acompanhada de sua mae, a qual se manteve hígida. Os pacientes 2, 3 e 4 relataram mudanças de hábitos de vida que passaram a exigir utilizaçao de transporte público (antes nao utilizado); além disso, o paciente 2 passou a apresentar pneumonias após o contato direto com patógenos, ao cursar a disciplina prática de Microbiologia em Faculdade de Farmácia, fato que nao ocorreu com os demais alunos. O paciente 5 e a esposa mudaram de residência para bairro muito populoso, com casas próximas e contato direto com grande número de pessoas.
DISCUSSAO
No presente estudo a prevalência de pacientes com ICV que evoluíram com pneumonias de repetiçao após mudança de ambiente físico foi de 22% (5/23). Como mudanças para ambiente físico com maior número de pessoas foram consideradas as situaçoes que pudessem levar ao contato com maior número de patógenos
Desde os meados do século XIX há descriçoes sobre a maior incidência de infecçoes e maior gravidade destas, em cidades com maiores concentraçoes populacionais. O maior número de contatos interpessoais resulta em mudanças da microbiota, com aumento do número de patógenos e maior chance de infecçao22-24. Há maior incidência de infecçoes diante da maior proximidade entre as pessoas, por maior transmissao de microrganismos patogênicos através de perdigotos (gotículas de saliva, espirros, tosse ou respiraçao), ocorrendo de forma mais fácil em lugares com aglomeraçoes25. É o que ocorre nas chamadas "doenças de inverno", onde crianças e adultos saudáveis, após aglomeraçoes, passam a apresentar processos infecciosos.
Estudo sobre a flora nasofaríngea de crianças saudáveis com menos de cinco anos em Angola, Brasil e Holanda, excluindo crianças desnutridas ou que estavam recebendo antibióticos, revelou que as crianças brasileiras e angolanas residiam com maior número de pessoas vivendo na mesma casa em comparaçao às crianças holandesas, e apresentavam maior colonizaçao bacteriana26. Portadores de ICV apresentando deficiência de IgA, como os do presente estudo, estao predispostos a menor eliminaçao de patógenos na mucosa da orofaringe. A IgA sérica monomérica e a cadeia polipeptídica J sao sintetizadas por plasmócitos. Ao atravessarem as células epiteliais de mucosas, recebem o componente secretor produzido por estas células, tornando-se IgA secretora dimérica6. A IgA secretora é resistente às enzimas digestivas, sendo responsável pela defesa adaptativa das mucosas. A mucosa da orofaringe em indivíduos saudáveis nao é receptiva à adesao de bactérias, resultando em rápida eliminaçao das mesmas27.
Na deficiência de IgA, a mucosa apresenta menor defesa e menor clareamento de patógenos. De forma semelhante, idosos apresentam menor defesa inespecífica de mucosas, tornando-se mais suscetíveis à colonizaçao da orofaringe28. Na maioria dos casos, o início das infecçoes respiratórias inferiores ocorre após colonizaçao do trato respiratório superior, por aspiraçao das secreçoes de orofaringe29. Provavelmente os pacientes estudados com ICV apresentavam maior colonizaçao da orofaringe e maior chance de infecçao em vias respiratórias inferiores, fato que deve ter ocorrido especialmente quando em contato com maior número de pessoas.
A deficiência de anticorpos antipolissacarídeos apresentada pelos pacientes do presente estudo propicia a infecçoes por bactérias encapsuladas, que necessitam ser opsonizadas para que haja a defesa imunológica contra tais bactérias6. Entre as bactérias encapsuladas encontram-se Streptococcus pneumoniae e Haemophilus influenzae, principais agentes etiológicos das pneumonias.
Apesar de nao ser possível a comparaçao direta dos pacientes estudados com grupos controles, uma vez que sao mudanças de hábitos pessoais, pode-se comparar o aparecimento de pneumonias de repetiçao com indivíduos imunocompetentes que acompanharam os pacientes estudados. Assim, nao foram observadas pneumonias de repetiçao nos familiares ou colegas de trabalho que acompanharam os pacientes nessas mudanças de ambiente físico nos casos 1 (mae manteve-se hígida) e 2 (sem outros casos de pneumonias no novo curso). Nos casos 3 e 4 essa comparaçao nao pôde ser feita, pois somente os envolvidos apresentaram mudanças de ambiente físico. Entretanto, nao é habitual que adultos imunocompetentes passem a ter pneumonias, em especial de repetiçao, após mudanças para trabalhos comuns. No quinto caso, tanto a paciente quanto seu esposo mudaram-se para bairro mais populoso e só a paciente com ICV é que passou a ter pneumonias de repetiçao. Assim, observamos que a mudança para ambiente com maior número de pessoas foi um fator predisponente ao aparecimento de pneumonias de repetiçao entre os pacientes estudados com ICV.
Além do fato observado de mudanças de ambiente nos cinco pacientes descritos, com maior impacto em suas vidas, outros pacientes também referiam o aparecimento de manifestaçoes pulmonares após menores alteraçoes de ambiente. Entre estes, podem ser citadas mudanças para escola com maior número de crianças por sala de aula e mudança dos cuidados maternos para residência de cuidadora. Tais mudanças, por serem mais subjetivas, nao foram consideradas no presente trabalho como positivas à mudança de ambiente. Mas, se tais alteraçoes físicas fossem consideradas, os resultados seriam ainda mais expressivos.
Notou-se um tempo de atraso no diagnóstico e idade de início das infecçoes de repetiçao de 5 anos e 6 meses a 7 anos entre a primeira pneumonia e o diagnóstico de ICV. O diagnóstico dessa imunodeficiência é feito, em especial, após o aparecimento de pneumonias de repetiçao. A ICV é a IDP com maior número de sintomas graves (57%), segundo a Sociedade Europeia de Imunodeficiências1,29,30, causando danos pulmonares irreversíveis. Apesar disso, a literatura descreve um atraso no diagnóstico de ICV estimado entre quatro a nove anos após o início dos sintomas3,10,19.
A conhecida distribuiçao bimodal do aparecimento das manifestaçoes clínicas da ICV de seis a dez anos e entre 20 e 40 anos coincide com habituais mudanças de vida do ser humano. O primeiro pico coincide com o ingresso de crianças em escolas maiores, em classes com maior número de alunos e, com certeza, maior número de patógenos. O segundo pico, em adultos jovens, coincide com a exploraçao de novos ambientes e experiências, como ingresso em cursos técnicos ou superiores, início de trabalho, maior permanência em transportes públicos, assim como frequentes mudanças de residência, fatos que trazem um contato com maior número de pessoas e, consequentemente, mais patógenos. É possível que a distribuiçao bimodal resulte de mudanças de ambientes físicos com maior número de patógenos, sendo necessário para tanto a observaçao em cada paciente, pesquisando-se mudanças de ambiente físico.
O diagnóstico de ICV deve ser feito o mais precoce possível, na tentativa de evitar sequelas pulmonares irreversíveis, sendo por isso importante a pesquisa de fatores de risco que possam determinar as manifestaçoes clínicas desta IDP.
Concluímos que a mudança para ambiente físico com maior número de pessoas mostrou-se como fator de risco predisponente para o aparecimento de pneumonias de repetiçao em portadores de ICV. Acreditamos ser apropriada a hipótese diagnóstica dessa IDP em pacientes apresentando pneumonias de repetiçao após mudanças para ambientes físicos com maior número de pessoas.
REFERENCIAS
1. The European Society for Immunodeficiencies registry. [citado 2015 maio 15]. Disponível: http://esid.org/Working-Parties/Registry/New-ESID-Registry.
2. Brazilian Group for immunodeficiency. [citado 2015 maio 15]. Disponível: http://imunopediatria.org.br/_download/artigos/ESIDRegistry_ClinicalCriteria.pdf.
3. Cunningham-Rundles C, Maglione PJ. Common Variable Immunodeficiency. J Allergy Clin Immunol. 2012;129:1425-6.
4. Conley ME, Notarangelo LD, Etzioni A. Diagnostic criteria for primary immunodeficiencies. Representing PAGID (Pan-American Group for Immunodeficiency) and ESID (European Society for Immunodeficiencies). Clin Immunol. 1999;93:190-7.
5. Buckley HR, Orange JS. Primary Immunodeficiency Diseases. In: Adkinson Jr. NF, Boschner BS, Burks AW, Busse WW, Holgate ST, Lemanske Jr RF, et al., editors. Middleton's allergy: principles and practice. 8th ed. Philadelphia: Elsevier; 2014. p. 1148-9.
6. Forte WCN. Imunologia do básico ao aplicado. Sao Paulo: Editora Atheneu; 2015. 339p.
7. Errante PR, Condino-Neto A. Imunodeficiência comum variável: revisao da literatura. Rev bras alerg imunopatol. 2008;31:10-8.
8. Chapel H, Cunningham-Rundles C. Update in understanding common variable immunodeficiency disorders (CVIDs) and the management of patients with these conditions. Br J Haematol. 2009;145:709-27.
9. Kokron CM, Errante PR, Barros MT, Baracho GV, Camargo MM, Kalil J, et al. Clinical and laboratory aspects of Common Variable Immunodeficiency. An Acad Bras Cienc. 2004;76:707-26.
10. Salzer U, Warnatz K, Peter HH. Common Variable Immunodeficiency - an update. Arthritis Res Ther. 2012;14:223.
11. Cunningham-Rundles C, Bodian C. Common variable immunodeficiency: clinical and immunological features of 248 patients. Clin Immunol. 1999;92:34-48.
12. Oksenhendler E, Gérard L, Fieschi C, Malphettes M, Mouillot G, Jaussand R, et al.; DEFI Grupo de Estudos. Infections in 252 patients with Common Variable Immunodeficiency. Clin Infect Dis. 2008,46:1547-54.
13. Cunningham-Rundles C. The many faces of common variable immunodeficiency. Hematology Am Soc Hematol Educ Program. 2012;2012:301-5.
14. Almeida Barry LR, Forte WCN. Common Variable Immunodeficiency. Allerg Immunopathol. 2004;32:89-91.
15. Espanol T, Catala M, Hernandez M, Caragol I, Bertran JM. Development of a Common Variable Immunodeficiency in IgA-deficient patients. Clin Immunol Immunopathol. 1996;80:333-5.
16. Forte WCN, Carvalho Jr FF, Damasceno N, Perez FV, Lopes CG, Mastrotti RA. Evolution of IgA deficiency to IgG subclass deficiency and common variable immunodeficiency. Allerg Immunopathol. 2000;28:18-20.
17. Rivas JJ, Brocardo GA, Kokron C, Rizzo LV, Kalil J, Barros MT. Caracterizaçao imunofenotípica de linfócitos B de memória na deficiência de IgA e imunodeficiência comum variável. Rev bras alerg imunopatol. 2010;33:23-31.
18. Deane S, Selmi C, Naguwa SM, Teuber SS, Gerschwin ME. Common Variable Immunodeficiency: etiological and treatment issues. Int Arch Immunol. 2009;150:311-24.
19. Yong PF, Tarzi M, Chua I, Grimbacher B, Chee R. Common variable immunodeficiency: an update on etiology and management. Immunol Allergy Clin North Am. 2008;28:367-86.
20. Gomes L. Fatores de risco e medidas profiláticas nas pneumonias adquiridas na comunidade. J Pneumol. 2001;27:97-114.
21. Ballow M, Notarangelo L, Grimbacher B, Cunningham-Rundles C, Stein M, Helbert M, et al. Immunodeficiencies. Clin Exp Immunol. 2009;158:14-22.
22. Cardoso MRA, Cousens SN, Siqueira LFG, Alves FM, D'Angelo L. Crowding: risk fator or protective factor for lower respiratory disease in young children? BMC Public Health. 2004;4:19.
23. Mulholland E, Smith L, Carneiro I, Becher H, Lehmann D. Equity and child-survival strategies. Bull World Health Organ. 2008;86:399-407.
24. Pedraza DF, Queiroz D, Sales MC. Infectious diseases among Brazilian preschool children attending daycare centers. Ciênc saúde coletiva. 2014:19:511-28.
25. World Health Organization: Guidelines for Healthy Housing. Health Series 31. WHO: Regional Office for Europe; 1988.
26. Wolf B, Gama A, Rey L, et al. Striking differences in the nasopharyngeal flora of healthy Angolan, Brazilian and Dutch children less than 5 years old. Ann Trop Paediatr. 1999;19:287-92.
27. Mobbs KJ, Van Saene HKF, Sunderland D, Davies PDO. Oropharyngeal Gram-negative bacillary carriage. A survey of 120 healthy individuals. Chest. 1999;115:1570-5.
28. Beachey EH. Bacterial adherence: adhesin-receptor interactions mediating the attachment of bacteria to mucosal surfaces. J Infect Dis. 1981;143:325-45.
28. Gomes L. Fatores de risco e medidas profiláticas nas pneumonias adquiridas na comunidade. J Pneumol. 2001;27:97-114.
29. Quirós AB, Sánchez SP, Adrados JAG, Sanz EA. Common Variable Immunodeficiency. Old questions are getting clearer. Allergol Immunopathol. 2006;34:263-75.
30. Jolles S. The variable in common variable immunodeficiency: a disease of complex phenotypes. J Allergy Clin Immunol Pract. 2013;1:545-56.