Número Atual: Maio-Junho 2015 - Volume 3 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
MicroRNAs: papel no diagnóstico e tratamento da asma
MicroRNAs: role in the diagnosis and treatment of asthma
Ataualpa P. Reis, MD, PhD; Karla Fernandes, PhD; Fernanda Sarquis Jehee, BSc, PhD
DOI: 10.5935/2318-5015.20150018
Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, MG
Endereço para correspondência:
Ataualpa P. Reis
E-mail: ataualpapreis@gmail.com
Submetido em: 20/05/2015
Aceito em: 15/07/2016
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A asma é reconhecida como uma doença inflamatória crônica das vias aéreas e que tem como características a hiper-reatividade das vias aéreas, a hipersecreçao de muco e a obstruçao ao fluxo aéreo, resultando em sintomas de gravidade variável. Na maior parte dos casos, a asma está associada a processo inflamatório crônico mediado por padrao tipo 2 da resposta imune, que pode ser induzido ou aumentado por alérgenos ambientais, irritantes primários, exercício, infecçoes do trato respiratório e comorbidades. Alteraçoes epigenéticas sao reconhecidas como participantes do início e/ou da manutençao da resposta tipo 2. MicroRNAs (miRNAs) sao reguladores da expressao gênica e têm papel importante na patogênese da asma. Sua caracterizaçao na circulaçao sanguínea pode prover uma ferramenta de alta especificidade e sensibilidade no diagnóstico da asma. Seu papel em regular a expressao de genes por mecanismos pós-transcricionais através de interaçao com RNAs mensageiros (mRNA) pode oferecer o potencial de constituir uma nova modalidade terapêutica desta doença. A presente revisao incluiu artigos originais, revisoes e consensos indexados nos bancos de dados PubMed, MEDLINE, LILACS, SciELO e publicaçoes on line nos últimos 10 anos, e pretende apresentar o conhecimento atual da importância dos microRNAs no diagnóstico e tratamento da asma.
Descritores: Asma, microRNA, diagnóstico e tratamento da asma.
INTRODUÇAO
Asma é reconhecida como uma doença inflamatória crônica das vias aéreas, caracterizada por hiper-reatividade brônquica, hipersecreçao de muco e obstruçao ao fluxo aéreo, resultando em sintomas com gravidade variável1. Pode ser exacerbada por alérgenos ambientais, irritantes primários, exercício, infecçoes do trato respiratório ou comorbidades1. No mundo existem atualmente cerca de 300 milhoes de pacientes com asma e para 2025 a previsao é de 400 milhoes2. No Brasil, os estudos utilizando o International Study of Asthma and Allergies in Childhood (ISAAC) evidenciaram que a asma é muito prevalente, além de ser subdiagnosticada, e colocaram o Brasil no oitavo lugar entre os países com os maiores índices. Em nosso país foi demonstrada notável variaçao entre as regioes, e os resultados referentes à participaçao de várias cidades no estudo ISAAC, fase III, têm confirmado as altas prevalências de asma entre crianças e adolescentes brasileiros3-5. A despeito da melhora no diagnóstico e dos avanços no tratamento da asma, o controle desta doença ainda permanece ineficiente. Dados obtidos de European National Health and Wellness Surveys, conduzidas na França, Alemanha, Itália, Espanha e Reino Unido, durante os anos de 2006, 2008 e 2010, mostraram que em 2010 a proporçao de asma nao controlada foi de 53,5%, a julgar pelo Asthma Control Test (ACT), e que nao houve diminuiçao significante em relaçao aos últimos 5 anos6. Estes dados sugerem que, com nossos recursos farmacológicos atuais, o controle da asma continua pobre apesar da universalidade e da gravidade da doença. Diferentes fenótipos e endótipos de asma têm sido propostos, associados a diferentes mecanismos ou características, que podem levar a resposta terapêutica variável, indicando que o tratamento da asma deve ser personalizado7,8. Vários fatores contribuem para pobre controle da asma, incluindo comorbidades (tais com rinossinusite crônica e refluxo gastroesofágico), obesidade, exposiçoes ambientais, poluiçao atmosférica, fumaça do cigarro, presença de doença pulmonar obstrutiva crônica (DPOC) associada, distúrbios psicológicos e falta de adesao ao tratamento9.
Na última década muito tem sido descrito a respeito de genes codificadores de proteínas, que sao transcritos em RNA mensageiros (mRNAs) e traduzidos em proteínas no citoplasma, compreendendo 2% do genoma humano. Além disso, foco tem sido dirigido a RNAs nao codificadores de proteínas (nc-RNAs), particularmente os microRNAs (miRNAs), envolvidos em várias funçoes vitais no nosso corpo, incluindo a regulaçao da expressao gênica, que pode ter um papel preponderante na patogênese da asma10. Esta revisao pretende demonstrar que a caracterizaçao de miRNAs na circulaçao sanguínea pode ser um meio específico e bastante sensível para se diagnosticar asma e sugerir que a correçao de defeitos da sua regulaçao pode levar a novas modalidades terapêuticas desta doença.
MicroRNAs
A denominaçao microRNA (miRNA) foi cunhada quando pequenos RNAs conservados filogeneticamente, com potencial de regular a expressao gênica, foram descobertos em C. elegans 200111. No ano seguinte, foi estabelecida a sua presença em plantas12, e em seguida foi demonstrado que os miRNA-15 e miRNA-16 estavam subexpressos ou deletados em leucemias linfocíticas, sugerindo que miRNAs estariam envolvido em câncer humano13. Os miRNAs sao constituídos por uma cadeia curta (aproximadamente 20 nucleotídeos) de RNA de fita simples, nao codificadores de proteínas (nc-RNAs), e regulam a expressao de genes controlando a traduçao do RNA mensageiro (mRNA) que contém a instruçao genética para produzir proteínas, através de interaçao direta entre sua regiao 5' e a regiao nao traduzida do mRNA alvo14,15. A ligaçao direta do miRNA a um mRNA alvo pode resultar na degradaçao do RNA ou inibiçao da traduçao em proteína (Figura 1). miRNAs podem também indiretamente alterar a expressao gênica através de efeitos globais na metilaçao e sua açao em fatores de transcriçao responsáveis pela expressao gênica. Análise computacional sugere que miRNAs podem regular até um terço de todos os genes codificadores de proteínas no genoma humano. miRNAs podem se ligar e regular centenas de genes simultaneamente, e uma das características únicas dos miRNAs é que eles podem ser secretados no plasma, compartimento broncoalveolar e líquidos orgânicos. De forma importante, miRNAs sao resistentes a degradaçao por nucleases porque eles sao em geral englobados em nanovesículas chamadas exossomos, e associados a argonauta-2, uma proteína chave no complexo silenciador de RNA (RISC), que os protege. Em conjunto, estes aspectos colocam os miRNAs como potenciais marcadores sensíveis e nao-invasivos de diversas doenças, incluindo asma10.
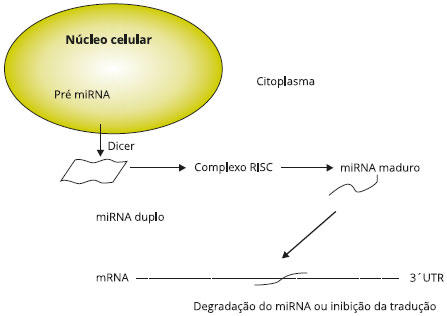
Figura 1 - Biogênese do miRNA. A biogênese do miRNA envolve vários passos, iniciando-se no núcleo da célula, onde um pré-miRNA é ativamente transportado ao citoplasma e processado em um miRNA de dupla fita por uma enzima denominada Dicer. Uma das fitas deste miRNA é incorporada ao complexo silenciador RISC, enquanto a outra é degradada. Esta parte incorporada tem uma sequência complementar na regiao 3'UTR do mRNA alvo e a traduçao nao acontece por bloqueio do ribosoma ou degradaçao do mRNA
Segundo a base de dados de miRNAs publicados, a miRBASE (http://www.mirbase.org/), existem atualmente cerca de 13.464 miRNAs maduros identificados em mamíferos, cerca de 2.588 hsa-miRNAs ou miRNAs humanos e por volta de 1.915 mmu-miRNAs ou miRs de camundongos. A biogênese dos miRNAs envolve uma fase nuclear de transcriçao por uma RNA polimerase do tipo II (transcritos primários ou pri-miRs), catalisada pela endonuclease do tipo III, a Drosha, que forma o pré-miR e uma fase de transporte deste último do núcleo para o citoplasma pela exportina-5, localizada na membrana nuclear. A fase citoplasmática envolve uma endonuclease do tipo III altamente conservada, a Dicer, que catalisa o pre-miR a duplex de 22 nucleotídeos ou miRNAs maduros16,17. O complexo no citosol é denominado complexo silenciador (RISC) e forma o miRISC. Este, por sua vez, é guiado ao mRNA apropriado via ligaçao complementar entre uma sequência de 6 a 8 nucleotídeos, única para cada miRNA, e um elemento de reconhecimento (MRE) existente na regiao 3' do mRNA alvo13,14.
Sabemos hoje que a maioria dos miRNAs sao codificados no genoma humano em "genes de miRNA". Assim, princípios genéticos também se aplicam aos miRNAs, isto é, variantes genéticas com SNPs (polimorfismos genéticos de troca de base única) ou mutaçoes pontuais em suas sequências podem regular sua expressao e funcionalidade em seus alvos. Exemplos incluem alteraçoes nas regioes promotoras dos genes, em sítios de "splicing" no caso de miRNAs intrônicos, ou mesmo alteraçoes na afinidade de ligaçao entre o miRNA maduro e sua sequência alvo no RNA mensageiro ou com enzimas acessórias envolvidas em sua biogênese. Alguns miRNAs também sao produtos secundários do mRNA de genes codificadores de proteínas. Um exemplo disso sao miRNAs que originam-se de íntrons removidos durante o processo de maturaçao do transcrito primário.
REGULAÇAO DOS MicroRNAs NA ASMA
Os miRNAs sao moléculas reguladoras de RNA e sao componentes integrais da programaçao genética na maioria das células humanas, sendo que esta funçao ocorre devido a modificaçoes pós-transcricionais18-20. Diversas linhas de evidências sugerem que o silenciamento epigenético dos genes codificadores de miRNA seja um dos mecanismos responsáveis pela reduçao global dos miRNAs em câncer21. Na asma, que é uma inflamaçao de padrao de resposta tipo 2, um dos mecanismos propostos para desencadeamento ou aumento desta inflamaçao é o vírus respiratório sincicial (VRS), patógeno responsável por infecçoes graves do trato respiratório22. O genoma do VRS codifica diversos miRNAs humanos que regulam a expressao de citocinas e quimiocinas, sugerindo assim que o VRS utiliza miRNAs das células hospedeiras para ativar o sistema imune23. O sistema de reconhecimento molecular através de toll-like receptors (TLR), capaz de reconhecer patógenos invasores e ativar o sistema imune inato ou adaptativo, está intimamente ligado aos miRNAs.
Em modelo murino, a exposiçao de vias aéreas a ácaros induziu a produçao de mmu-miR-126. No entanto, esta resposta nao foi observada em camundongos knockout para o gene TLR4, o que sugere que alguns miRNAs estao ligados à resposta inata do hospedeiro. Quando a expressao de mmu-miR-126 foi inibida nas vias aéreas dos camundongos expostos a ácaros, ocorreu a supressao completa da resposta inflamatória nos animais, atenuando a hipersecreçao de muco e inibindo o acúmulo de eosinófilos nas vias aéreas e tecido pulmonar24. Alguns mRNAs sao reguladores dos sinalizadores de TLR. O mmu-miR-21 regulou negativamente o TLR4 após estimulaçao por lipopolissacarídeos (LPS), diminuindo a expressao de IL-1225. Além disto, o mmu-miR-21 tem funçao regulatória por alterar os mRNAs dos genes que codificam estas proteínas e originar uma proteína pró-inflamatória denominada PDCD4, que diminui a produçao da interleucina IL-1025. Esta dupla funçao do mmu-miR-21 demonstra a complexidade da regulaçao dos miRNAs. Desta maneira, os TLR e os miRNAs podem se juntar e atuar como sinais básicos regulatórios de ligaçao do sistema inato com a inflamaçao na asma24,26,27.
Em estudos em humanos, uma família de miRNAs denominada hsa-Let-7 foi descrita, com propriedades regulatórias e capacidade de inibir a expressao de IL-1328, sendo considerada um dos maiores reguladores na modulaçao de IL-13 e, consequentemente, da inflamaçao tipo 2.
O miRNA murino mmu-miR-145 funciona como regulador negativo da maquinária pró-inflamatória, embora o alvo deste miRNA nao tenha ainda sido descrito. Sabe-se que ele é altamente expresso nas vias aéreas de animais experimentais com exposiçao às proteínas dos ácaros ambientais29.
O hsa-miR-146 é um regulador negativo dos TLR após estimulaçao por LPS e também inibe a apoptose das células epiteliais brônquicas induzida por citocinas10.
O mmu-miR-155 também é um regulador pró-inflamatório positivo que atua após estimulaçao dos TLR por LPS e pode regular a inflamaçao de tipo 2 através do fator de transcriçao PU.1. Por outro lado, pode ser um dos responsáveis pela açao anti-inflamatória dos glicocorticosteroides, neste caso por regulaçao negativa do miRNA-15530,31.
Finalmente, foi demonstrado que mmu-miR-106a inibe IL-10 de maneira pós-transcricional. Em modelo experimental de inflamaçao alérgica em vias aéreas, knockdown de mmu-miR-106a causou diminuiçao de vários aspectos da asma já estabelecida, tais como: hiper-reatividade brônquica, inflamaçao de vias aéreas, metaplasia de goblet cells, e fibrose subepitelial, em paralelo a aumento dos níveis de IL-10 nos pulmoes32. Este modelo representa uma prova in vivo da regulaçao de IL-10 mediada por miRNA, com potencial de reverter uma condiçao asmática estabelecida.
Além disto, os miRNA têm papel importante na programaçao fenotípica da resposta de células da imunidade tipo 2, tais como mastócitos, eosinófilos, linfócitos T, macrófagos, neutrófilos e células epiteliais brônquicas, no sentido de aumentar a produçao de citocinas e outros mediadores que promovem a inflamaçao característica da asma33,34. A interleucina IL-13 tem papel chave na patogênese da asma e funciona como uma citocina efetora na induçao da resposta inflamatória. Tem sido proposto que ela modula o fenótipo do músculo liso brônquico e regula os níveis de mmu-miR-133, resultando no aumento da expressao da proteína RhoA, que por sua vez aumenta a contraçao do músculo liso brônquico35-38. A Figura 2 descreve as evidências de participaçao dos miRNAs na resposta alérgica da asma.

Figura 2 - Diagrama do papel dos miRNAs em processos envolvidos na patogênese da asma associados à citocina IL-13, com miRNAs direta ou indiretamente regulando a sua produçao. A IL-13 é produzida em resposta a sinalizaçao por TLR, que por sua vez é também regulada pelos miRNAs. Alguns miRNAs servem como efetores da ativaçao do TLR, enquanto outros funcionam como reguladores negativos
IgE = imunoglobulina E; IL = interleucina; SOCS = Suppressors of cytokine signaling; TRAF6 = TNF Receptor Associated Factor 6; IRAK1 = Interleukin 1 Receptor Associated Kinase 1
MicroRNAs NO DIAGNOSTICO DE ASMA
MicroRNAs têm sido detectados em diferentes fluídos corporais, tais como plasma, urina e saliva39-41. No plasma, a quantidade de miRNAs pode ser usada para distinguir pacientes com câncer de indivíduos saudáveis e, portanto, podem ser utilizados para diagnóstico, prognóstico e como biomarcadores de vários tipos de câncer39,42,43. Estudos recentes relatam que miRNAs podem ser usados como biomarcadores em diferentes condiçoes alérgicas e patologias respiratórias. Em pacientes com doença pulmonar obstrutiva crônica (DPOC), quatro miRNAs foram detectados no plasma e agem como reguladores negativos: hsa-miR-20a, hsa-miR-28-3p, hsa-miR-34c-5p e hsa-miR-10044. Em pacientes com esogafite eosinofílica (EEo), foram detectados no plasma e em tecido de biópsia esofagiana os hsa-miR-146a, hsa-miR-146b e hsa-miR-223 que funcionam como biomarcadores de EEo45. Alguns trabalhos correlacionam o padrao de expressao de miRNAs e asma em humanos, e podem indicar o seu papel como biomarcadores. Em um dos trabalhos, após exposiçao alergênica e sequenciamento de nova geraçao (next generation sequencing, NGS), foi observada induçao de miRNAs no tecido pulmonar, sugerindo seu importante papel na doença46. Dentre os miRNAs induzidos, estao: hsa-miR-106b, 205, 145 a, 133a, e Asth-miR-1 e Asth-miR-2. Na asma experimental, diversos miRNAs foram encontrados diferentemente expressos nos tecidos pulmonares, e foi encontrado que o mmu-miR-21 estava regulado positivamente quando os animais foram desafiados com ovoalbumina (OVA) ou quando receberam IL-13 inalada, resultando em expressao aumentada de resposta do tipo 247. Têm sido observadas diferenças significativas no conteúdo de miRNAs em exosomos de lavado broncoalveolar de pacientes com asma nao-sintomática leve. Após exposiçao alergênica, análise de microarranjos apontou a expressao alterada de cerca de 24 hsa-miRNAs nos asmáticos quando comparados aos indivíduos saudáveis. A análise de vias biológicas afetadas por esses miRNAs apontaram para citocinas relacionadas à asma, como IL-13, IL-10, IL-6, e IL-848. Em modelo experimental com asma aguda e asma crônica, os miRNAS 106a, 146b, 223, 29b, 483, 574p, 672, e 690 foram identificados e implicados na patogênese da asma32,49.
MicroRNAs NA TERAPEUTICA DA ASMA
Asma alérgica pode ser controlada com corticosteroides inalados50-53, embora as formas mais graves tenham difícil controle54 e o único tratamento que leva realmente à induçao prolongada de tolerância imunológica é a imunoterapia, que está indicada nas formas leves e moderadas, mas deve ser usada com muita cautela nas formas mais graves55-57. Portanto, uma terapia biológica que possa modificar a resposta imune de maneira mais individualizada ainda está faltando no arsenal terapêutico54,58. A terapia com miRNAs poderia ser uma resposta como novo grupo de tratamento imunobiológico, com capacidade de modular a resposta imune inibindo-a ou estimulando-a positivamente59. microRNAs poderiam ser moduladores da regulaçao gênica, com papel central em sua expressao60. Além desta possibilidade de adiçao de uma pequena molécula que modula a expressao de genes, a introduçao no organismo de uma menor molécula que possa se acoplar a uma estrutura de miRNA, ao processamento do miRNA ou ao Complexo RISC61, um dos responsáveis pelo miRNA maduro, pode representar um novo desenvolvimento de tratamento farmacológico. Tratamento com miRNA-122 foi capaz de silenciar a replicaçao viral do vírus da hepatite C em primatas62, e o uso de miRNA-34 foi capaz de inibir o metabolismo de célula tumoral em modelos animais, tendo sido usado em ensaios clínicos63. O fato de o miRNA ser estável no plasma humano, e a sua capacidade de corrigir defeitos na resposta genética, o torna um potencial tratamento para controlar ou mesmo eliminar a resposta inflamatória na asma.
CONCLUSOES
Embora o conhecimento dos miRNAs esteja no seu início, o uso destes miRNAs pode ser uma oportunidade de regular ou suprimir a inflamaçao nas doenças alérgicas. A presença de miRNAs como moléculas circulantes estáveis as tornam potenciais biomarcadores clínicos importantes para diagnóstico, tratamento e prognóstico da asma. Tendo papel de reguladores e moduladores da resposta imune na inflamaçao alérgica, também se tornam importantes para tratamento destas doenças no futuro próximo. A possibilidade de serem usados como partículas em aerossol nas vias aéreas humanas aponta a probabilidade de seu uso como tratamento da asma como medicamento por via inalatória.
REFERENCIAS
1. GINA. The global initiative for asthma. 2016 GINA report, global strategy for asthma management and prevention. Available from: www.ginasthma.org .
2. Pawankar R. Allergic diseases and asthma: a global public health concern and a call to action. World Allergy Organ J. 2014;7(1):12.
3. Solé D, Camelo-Nunes IC, Wandalsen GF, Mallozi MC. Asthma in children and adolescents in Brazil: contribution of the International Study of Asthma and Allergies in Childhood (ISAAC). Rev Paul Pediatr. 2014;32(1):114-25.
4. Mallol J, Crane J, von Mutius E, Odhiambo J, Keil U, Stewart A, et al. The International Study of Asthma and Allergies in Childhood (ISAAC) Phase Three: a global synthesis. Allergol Immunopathol (Madr). 2013;41(2):73-85.
5. Solé D, Cassol VE, Silva AR, Teche SP, Rizzato TM, Bandim LC, et al. Prevalence of symptoms of asthma, rhinitis, and atopic eczema among adolescents living in urban and rural areas in different regions of Brazil. Allergol Immunopathol (Madr). 2007;35(6):248-53.
6. Demoly P, Annunziata K, Gubba E, Adamek L. Repeated cross-sectional survey of patient-reported asthma control in Europe in the past 5 years. Eur Respir Rev. 2012;21:66-74.
7. Wenzel SE. Complex phenotypes in asthma: current definitions. Pulm Pharmacol Ther. 2013;26:710-15.
8. Corren J. Asthma phenotypes and endotypes: an evolving paradigm for classification. Discov Med. 2015;21:55-67.
9. Usmani OS. Small-airway disease in asthma: pharmacological considerations. Curr Opin Pulm Med. 2015;21:55-67.
10. Greene MC, Gaughan KP. MicroRNAs in asthma: potential therapeutic targets. Curr Opin Pulm Med. 2013;19:66-72.
11. Lau NC, Lim LP, Weinstein EG, Bartel DP: An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science. 2001;294(5543):858-62.
12. Reinhart BJ, Weinstein EG, Rhoades MW, Bartel B, Bartel DP: MicroRNAs in plants. Genes Dev. 2002;16(13):1616-26.
13. Calin GA, Dumitru CD, Shimizu M, Bichi R, Zupo S, Noch E, et al. Frequent deletions and down-regulation of micro- RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia. Proc Natl Acad Sci USA. 2002;99(24):15524-9.
14. Fabbri M, Garzon R, Cimmino A, Liu Z, Zanesi N, Callegari E, et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA ethyltransferases 3A and 3B. Proc Natl Acad Sci USA. 2007;104:15805-10.
15. Mertens-Talcott SU, Chintharlapalli S, Li X, Safe S. The oncogenic microRNA-27a targets genes that regulate specificity protein transcription factors and the G2-M checkpoint in MDA-MB-231 breast cancer cells. Cancer Res. 2007;67:11001-11.
16. John B, Enright AJ, Aravin A, Tuschl T,Sander C, Marks DS. Human microRNA targets. PLoS Biol. 2004;2(11):e 363.
17. Takacs CM, Giraldez AJ. MicroRNAs as genetic sculptors: fishing for clues. Semin Cell Dev Biol. 2010;21:760-7.
18. He L, Hannon GJ. MicroRNAs: small RNAs with a big role in gene regulation. Nat Rev Genet. 2004;5:522-31.
19. Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of posttranscriptional regulation by microRNAs: are the answers in sight? Nat Rev Genet. 2008;9:102-14.
20. Garbacki N, Di Valentin E, Huynh-Thu VA, Geurts P, Irrthum A, Crahay C. MicroRNAs profiling in murine models of acute and chronic asthma: a relationship with mRNAs targets. PLoS One. 2011;6:e16509.
21. Davalos V, Esteller M. MicroRNAs and cancer epigenetics: a macrorevolution. Curr Opin Oncol. 2009;4(1):35-45.
22. Mohapatra SS, Boyapalle S. Epidemiologic, experimental, and clinical links between respiratory syncytial virus infection and asthma. Clin Microbiol Rev. 2008;4(3):495-504.
23. Artem RAT, Mark TS, Jones LP. In: Gene Profiles in Drug Design. Lidbury BA MS, editor. Vol: CRC Press; 2009. Virally Encoded MicroRNA (miRNA) Candidates for Gene Silencing; pp. 11-28.
24. Mattes J, Plank M, Phipps S, Foster PS. Antagonism of microRNA-126 suppresses the effector function of TH2 cells and the development of allergic airways disease. Proc Natl Acad Sci USA. 2009;4(44):18704-09.
25. Sheedy FJ, McDermott E, Hennessy EJ, Martin C, O'Leary JJ, Ruan Q, Johnson DS. Negative regulation of TLR4 via targeting of the proinflammatory tumor suppressor PDCD4 by the microRNA miR-21. Nat Immunol. 2009;4(2):141-7.
26. O'Connell RM, Taganov KD, Boldin MP, Cheng G, Baltimore D. MicroRNA-155 is induced during the macrophage inflammatory response. Proc Natl Acad Sci USA. 2007;4(5):1604-09.
27. Lindsay MA. microRNAs and the immune response. Trends Immunol. 2008;4(7):343-51.
28. Kumar M, Ahmad T, Sharma A, MabalirajanU, Kulshreshtha A, Agrawal A, Ghosh B. Let-7 microRNA-mediated regulation of IL-13 and allergic airway inflammation. J Allergy Clin Immunol. 2011;128(5):1077-85.
29. Collison A, Mattes J, Plank M, Foster PS. Inhibition of house dust mite-induced allergic airways disease by antagonism of microRNA-145 is comparable to glucocorticoid treatment. J Allergy Clin Immunol. 2011;128(1):160-7.
30. Zheng Y, ,Xiong S, Jiang P, Liu X, Qian J, Zheng X, Chu Y . Glucocorticoids inhibit lipopolysaccharide mediated inflammatory response by downregulating microRNA-155: a novel antiinflammation mechanism. Free Radic Biol Med. 2012;52:1307-17.
31. Malmhall C, Alawieh S, Lu Y, Sjostrand M, Bossios A, Eldh M, Radinger M. MicroRNA-155 is essential for TH2-mediated allergen-induced eosinophilic inflammation in the lung. J Allergy Clin Immunol. 2014;133:1429-38.
32. Sharma A, Kumar M, Ahmad T, Mabalirajan U, Aich J, Agrawal A, et al. Antagonism of mmu-mir-106a attenuates asthma features in allergic murine model. J Appl Physiol. 2012;113:459-64.
33. Mattes J, Yang M, Foster PS. Regulation of microRNA by antagomirs: a new class of pharmacological antagonists for the specific regulation of gene function? Am J Respir Cell Mol Biol. 2007;4(1):8-12.
34. Mattes J, Collison A, Foster PS. Emerging role of microRNAs in disease pathogenesis and strategies for therapeutic modulation. Curr Opin Mol Ther. 2008;4(2):150-7.
35. Chiba Y, Nakazawa S, Todoroki M, Shinozaki K, Sakai H, Misawa M. Interleukin-13 augments bronchial smooth muscle contractility with an upregulation of RhoA protein. Am J Respir Cell Mol Biol. 2009;40:159-67.
36. Chiba Y, Todoroki M, Nishida Y, Tanabe M, Misawa M. A novel STAT6 inhibitor AS1517499 ameliorates antigen-induced bronchial hypercontractility in mice. Am J Respir Cell Mol Biol. 2009;41:516-24.
37. Chiba Y, Sakai H, Misawa M. Augmented acetylcholine-induced translocation of RhoA in bronchial smooth muscle from antigen induced airway hyperresponsive rats. Br J Pharmacol. 2001;133:886-90.
38. Chiba Y, Misawa M. The role of RhoA-mediated Ca2+ sensitization of bronchial smooth muscle contraction in airway hyperresponsiveness. J Smooth Muscle Res. 2004;40(4-5):155-67.
39. Mitchell P, Parkin R, Kroh E, Fritz B, Wyman S, Pogosova-Agadjanyan E, et al. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA. 2008;105:10513-8.
40. Hanke M, Hoefig K, Merz H, Feller AC, Kausch I, Jocham D, et al. A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer. Urol Oncol. 2010;28:655-61.
41. Park NJ, Zhou H, Elashoff D, Henson BS, Kastratovic DA, Abemayor E, et al. Salivary microRNA: discovery, characterization, and clinical utility for oral cancer detection. Clin Cancer Res. 2009;15:5473-7.
42. Cortez MA, Bueso-Ramos C, Ferdin J, Lopez-Berestein G, Sood AK, Calin GA. MicroRNAs in body fluids - the mix of hormones and biomarkers. Nat Rev Clin Oncol. 2011;8:467-77.
43. Weiland M, Gao XH, Zhou L, Mi QS. Small RNAs have a large impact: circulating microRNAs as biomarkers for human diseases. RNA Biol. 2012; 9:850-9.
44. Akbas F, Coskunpinar E, Aynaci E, Oltulu YM, Yildiz P. Analysis of serum micro-RNAs as potential biomarker in chronic obstructive pulmonary disease. Exp Lung Res. 202;38:286-94.
45. Lu TX, Sherrill JD, Wen T, Plassard AJ, Besse JA, Abonia JP, et al. MicroRNA signature in patients with eosinophilic esophagitis, reversibility with glucocorticoids, and assessment as disease biomarkers. J Allergy Clin Immunol. 2012;129:1064-75.
46. Munitz A, Karo-Atar D, Foster PS. Asthma diagnosis: MicroRNAs to the rescue. J Allergy Clin Immunol. 2016;137(5):1447-8.
47. Lu TX,Munitz A, Rothenberg ME. MicroRNA-21 is up-regulated in allergic airway inflammation and regulates IL-12p35 expression. J Immunol. 2009;4:4994-5002.
48. Levanen B, Bhakta NR, Torregrosa Paredes P, Barbeau R, Hiltbrunner S, Pollack JL, et al. Altered microRNA profiles in bronchoalveolar lavage fluid exosomes in asthmatic patients. J Allergy Clin Immunol. 2013;131:894-903.
49. Garbacki N, Di Valentin E, Huynh-Thu VA, Geurts P, Irrthum A, Crahay C. MicroRNAs profiling in murine models of acute and chronic asthma: a relationship with mRNAs targets. PLoS One. 2011;4:e16509.
50. Bjermer L, Diamant Z. Complementary therapy in asthma: inhaled corticosteroids and what? Curr Opin Pulm Med. 2009;4(1):46-51.
51. Ivanova JI, Birnbaum HG, Hsieh M, Yu AP, Seal B, van der Molen T, et al. Adherence to inhaled corticosteroid use and local adverse events in persistent asthma. Am J Manag Care. 2008;4(12):801-9.
52. Chapman KR. Safer inhaled corticosteroid therapy for asthma. Pediatrics. 2008;4(1):179-80.
53. Lee SY, Kim JS, Lee JM, Kwon SS, Kim KH, Moon HS, et al. Inhaled corticosteroid prevents the thickening of airway smooth muscle in murine model of chronic asthma. Pulm Pharmacol Ther. 2008;4(1):14-9.
54. Akdis CA. Therapies for allergic inflammation: refining strategies to induce tolerance. Nat Med. 2012;18:736-49.
55. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International consensus on allergy immunotherapy. J Allergy Clin Immunol. 2015;136(3):556-68.
56. Ozdemir C, Kucuksezer UC, Akdis M, Akdis CA. Mechanisms of aeroallergen immunotherapy: subcutaneous immunotherapy and sublingual immunotherapy. Immunol Allergy Clin North Am. 2016;36(1):71-86.
57. Niederberger V. Allergen-specific immunotherapy. Immunol Lett. 2009;4:131-3.
58. Akdis M, Akdis CA. Therapeutic manipulate on of immune tolerance in allergic disease. Nat Rev Drug Discov. 2009;8:645-60.
59. Rebane A, Akdis CA. MicroRNAs: Essential players in the regulation of inflammation. J Allergy Clin Immunol. 2013;132:15-26.
60. Wang Jia-wang, Li Kunyu, Hellermann G, Lockey RF, Mohapatra S, Mohapatra S. Regulating the regulators: microRNA and asthma. World Allergy Organ J. 2011;4(6):94-103.
61. Tan GS, Chiu CH, Garchow BG, Metzler D, Diamond SL, Kiriakidou M. Small molecule inhibition of RISC loading. ACS Chem Biol. 2012;7:403-10.
62. Lanford RE, Hildebrandt-Eriksen ES, Petri A, Persson R, Lindow M, Munk ME, et al. Therapeutic silencing of microRNA-122 in primates with chronic hepatitis C virus infection. Science. 2010;327:198-201.
63. Bader AG. miR-34 - a microRNA replacement therapy is headed to the clinic. Front Genet. 2012;3:120.



