Número Atual: Maio-Junho 2015 - Volume 3 - Número 3
Editorial
Terapia anti IL-4/IL-13: revolução no tratamento da asma, dermatite atópica e rinossinusite crônica com polipose nasossinusal?
Anti IL4/IL-13 therapy: a revolution in the treatment of asthma, atopic dermatitis and chronic rhinossinusitis with nasal polyps?
L. Karla Arruda, MD, PhD; Lucas Brom, MD; Thais Nociti Mendonça, MD; Janaina Michelle Lima Melo, MD, PhD
DOI: 10.5935/2318-5015.20150016
Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo, Ribeirao Preto, SP
Endereço para correspondência:
L. Karla Arruda
karla@fmrp.usp.br
A imunidade de um hospedeiro inclui o sistema nao-específico de imunidade inata, e o sistema específico de imunidade adaptativa. Células linfoides inatas (innate lymphoid cells, ILCs) sao células do sistema imune inato caracterizadas por sua morfologia linfoide e ausência de marcadores de superfície para linhagens de linfócitos, nao possuindo receptores de células T ou B. Estas células sao capazes de fazer respostas efetoras robustas com produçao de citocinas nas fases iniciais de uma infecçao, e frequentemente contribuem para a resoluçao desta infecçao. Linfócitos T CD4+ respondem de maneira antígeno-específica a agentes infecciosos, e podem liberar o mesmo grupo de citocinas que sao produzidas pelas ILCs1.
Doenças alérgicas sao caracterizadas por eosinofilia tecidual, hipersecreçao de muco, produçao de IgE, ativaçao de mastócitos e de células Th2. A produçao de citocinas incluindo IL-4, IL-5, IL-13, e IL-9 tem sido atribuída principalmente a células Th2 CD4+. Entretanto, a descoberta recente das células linfoides inatas do grupo 2 (ICL2s) em humanos, e achados de modelos experimentais têm desafiado os conceitos convencionais associados à contribuiçao de células específicas para inflamaçao do tipo 2 em doenças alérgicas. Os membros do grupo das ILCs sao divididos em três subpopulaçoes: ILC1s, ILC2s, e ILC3s. ILC2s produzem citocinas do tipo 2, IL-4, IL-5, e IL-13, após estimulaçao por citocinas derivadas de células epiteliais (IL-33 e IL-25), mediadores lipídicos (cisteinil leucotrienos e prostaglandina D2), e por membro da família TNF, TL1A, e promovem respostas estruturais e imunológicas nas vias aéreas após exposiçao a antígeno. Além disso, a funçao dos ILC2 é influenciada por interaçoes com o inducible T cell costimulator (ICOS)/ICOS-ligante(ICOS-L), via contato direto entre células imunes2. ILC2s já foram detectadas em sangue de cordao umbilical; amigdalas e pólipos nasais de pacientes com rinossinusite crônica; tecido pulmonar humano; sangue periférico; trato gastrointestinal; pele e lavado broncoalveolar de adultos e crianças com asma3, sugerindo que ILC2s poderiam contribuir para asma, dermatite atópica, rinossinusite crônica e doenças alérgicas gastrointestinais. Além disso, a depleçao destas células em modelos animais sugere um papel das mesmas em asma e dermatite atópica4.
Alérgenos e vírus sao frequentemente associados à induçao de doenças alérgicas com subjacente inflamaçao do tipo 2. Na asma alérgica, exposiçao a aeroalérgenos em indivíduos sensibilizados mobiliza respostas robustas da imunidade inata e adaptativa nas vias aéreas, estimulando inflamaçao eosinofílica e ativaçao e infiltraçao de células T CD4+ alérgeno-específicas nas vias aéreas. Células T CD4+ alérgeno-específicas sao consideradas como tendo papel central na resposta asmática, pelo fato delas reconhecerem especificamente o alérgeno e iniciarem e orquestrarem a resposta inflamatória na asma4.
Os requisitos para induçao de citocinas em células Th CD4+, para que produzam sua assinatura de citocinas sao: estimulaçao com um membro da família da interleucina 1 (IL-1) e um ativador de proteina Signal Transducer and Activator of Transcription (STAT). Para células Th1, o membro da família de IL-1 é a IL-18 e a citocina ativadora de STAT é a IL-12, que ativa STAT4. Para células Th2, o par é IL-33 e IL-2, IL-7 ou Thymic Stromal Lymphopoietin (TSLP), todos ativadores de STAT5. E para células Th17, IL-1β e IL-23, uma ativadora de STAT3. Para as células ILC2, ILCs que expressam GATA-3 e produzem as citocinas do tipo 2 IL-13 e IL-5, a IL-33 é a principal estimuladora, e TSLP pode aumentar a resposta1.
Classificaçao da asma e outras doenças alérgicas em fenótipos e endótipos pode melhorar o entendimento e o tratamento destas doenças. A identificaçao e utilizaçao de biomarcadores, particularmente aqueles ligados a inflamaçao do tipo 2, pode ser útil para agrupar os pacientes em fenótipos, predizer quais os pacientes que se beneficiarao com uma terapia específica, e avaliar a resposta ao tratamento5. Biomarcadores estao presentes no escarro, ar exalado e sangue de pacientes com doenças alérgicas. Eles incluem eosinófilos e neutrófilos no escarro, fraçao exalada do óxido nítrico (FeNO), eosinofilia sanguínea, IgE e periostina. Muitos desses biomarcadores estao associados com inflamaçao eosinofílica, propagada principalmente por citocinas do tipo 2, como IL-4, IL-5 e IL-13, que sao produzidas tanto por células Th2 como por células linfoides inatas do tipo 2 (ILC2s). Biomarcadores têm sido utilizados em ensaios clínicos recentes de novos agentes biológicos com alvo na inflamaçao do tipo 2, e podem contribuir para melhor definir a populaçao que irá responder a essas terapias, levando a uma abordagem terapêutica mais personalizada e melhores resultados clínicos5,6. Embora o papel dos biomarcadores ainda nao esteja completamente estabelecido, alguns parâmetros tem sido utilizados de forma consistente como marcadores de resposta do tipo 2:
- Eosinofilia sanguínea > 300/mm3 ou µL (associada com exacerbaçoes graves de asma) ou > 400/ mm3 ou µL;
- Eosinofilia no escarro > 2%;
- Periostina (estimulada por IL-13) > 50 ng/mL;
- FeNO > 30 partes por bilhao ppb;
- Dipeptidil peptidase IV (DPP4) (estimulada por IL-13) - níveis de cut-off ainda nao estabelecidos7,8.
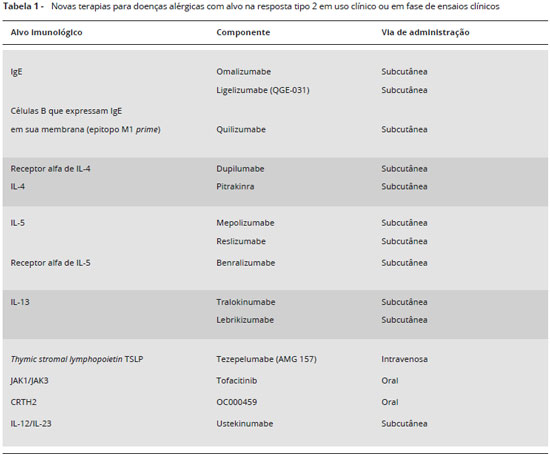
Novas terapias com alvo na resposta tipo 2 têm sido entao utilizadas (Tabela 1). Algumas delas, como o Omalizumabe, anticorpo monoclonal humanizado anti-IgE (Xolair®), tem sua eficácia e segurança bem estabelecidas no tratamento da asma moderada a grave9 e urticária crônica espontânea10, sendo licenciado para essas indicaçoes internacionalmente e no Brasil. Mais recentemente, dois anticorpos monoclonais anti-IL-5 Mepolizumabe (Nucala®) e Reslizumabe (Cinqair®) também foram licenciados para uso em pacientes com asma grave e fenótipo eosinofílico pelo FDA nos Estados Unidos. Outros agentes terapêuticos estao em fases variáveis de investigaçao em estudos de fase 2a-2b, e será interessante verificar se os benefícios observados nos estudos iniciais serao replicados em estudos de fase 311.
Considerando a relevância da resposta tipo 2 em doenças alérgicas, faz sentido prever que o bloqueio simultâneo da açao das citocinas IL-4 e IL-13 possa resultar em sucesso terapêutico nessas doenças. Tanto a IL-4 como a IL-13 se ligam à combinaçao heterodimérica da cadeia alfa-1 do receptor de IL-13 (IL-13Rα1) e a cadeia alfa do receptor de IL-4 (IL-4Rα), o que leva à sinalizaçao de ambas as interleucinas IL-4 e IL-13 (Figura 1A). Estas interaçoes levam à fosforilaçao de STAT6, com subsequente transcriçao dos genes de resposta a IL-4 e IL-13. Bloqueio do IL-4Rα com um anticorpo direcionado a este receptor bloquearia os efeitos das duas interleucinas, IL-4 e IL-13 (Figura 1B). A interleucina 4 tem um importante papel na diferenciaçao em Th2 a partir de células T naive. Juntamente com a IL-13, a IL-4 causa a mudança de isotipo em células B para síntese de IgE, e está envolvida no recrutamento de mastócitos. IL-4 também faz regulaçao positiva da expressao de receptores de alta afinidade para IgE em mastócitos, e de receptores de baixa afinidade para IgE em células B e células mononucleares. IL-4 e IL-13 fazem regulaçao positiva de moléculas de adesao vasculares em células endoteliais, facilitando a transmigraçao de eosinófilos, linfócitos T, monócitos e basófilos. IL-13 apresenta 30% de homologia com IL-4 e é secretada por células Th2, ILC2s, mastócitos, basófilos e eosinófilos. Na asma, os efeitos da IL-13 incluem aumento da diferenciaçao de células produtoras de muco goblet-cells, ativaçao de fibroblastos e remodelamento de vias aéreas, aumento da hiporresponsividade brônquica, e mudança para produçao de IgE em células B11.
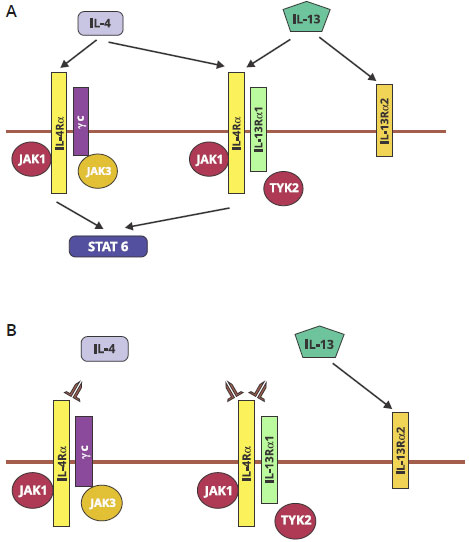
Figura 1 - A. IL-4 e IL-13 sinalizam por via comum através do receptor IL-4Rα. Esta interaçao leva à fosforilaçao de STAT6, com subsequente transcriçao dos genes de resposta a IL-4 e IL-13. B. Bloqueio da sinalizaçao de IL-4 e IL-13 pelo anticorpo monoclonal anti IL-4Rα dupilumabe. Modificado de Chung KF11
Em pacientes com asma moderada e eosinofilia no escarro ou sangue, um anticorpo monoclonal totalmente humano que se liga ao IL-4Rα, dupilumabe (Sanofi-Genzyme e Regeneron Pharmaceuticals, EUA), reduziu exacerbaçoes de asma, aumentou o controle da asma e melhorou a funçao pulmonar comparado ao placebo, quando beta-2 agonistas de açao prolongada foram descontinuados e as doses de corticosteroide inalatório foram reduzidas e suspensas12,13. Ocorreu também uma reduçao associada do FeNO, com concentraçao reduzida de marcadores inflamatórios associados à resposta Th2 como CCL17 (TARC), CCL26 (eotaxina-3), e IgE12. Estudo subsequente duplo-cego, controlado com placebo, de grupos paralelos, multicêntrico, de fase 2b envolvendo 769 pacientes adultos com asma nao controlada apesar do uso de doses média a altas de corticosteroides inalatórios e beta-2 agonistas de açao prolongada, revelou que dupilumabe melhorou o VEF1 na 12ª semana de tratamento, em pacientes com eosinofilia sanguínea (> 300 eosinófilos/µL), nas doses de 200 mg ou 300 mg a cada 2 semanas14,15. De forma interessante, a análise do grupo total de pacientes, e do subgrupo de pacientes com menos de 300 eosinófilos/µL mostrou resultados semelhantes, com aumento significante do VEF1. Da mesma forma, aplicaçao de dupilumabe via subcutânea a cada 2 semanas durante o período de 24 semanas de tratamento resultou em diminuiçao significante das taxas anualizadas de exacerbaçoes de asma tanto no grupo total de pacientes quanto no subgrupo com pelo menos 300 eosinófilos/µL, e naqueles com menos de 300 eosinófilos/µL14, portanto efeitos independentes da contagem de eosinófilos no sangue. Ao final das 24 semanas de tratamento, houve também melhor controle da asma e melhora da qualidade de vida em pacientes que receberam dupilumabe versus placebo. Os regimes de doses a cada 2 semanas foram mais consistentemente eficazes, e foram entao selecionados para investigaçao de eficácia e segurança em estudo de fase 3, que está em andamento14.
A eficácia e segurança da terapia anti IL-4/IL-13 com regimes variados de doses de dupilumabe foram também investigadas em pacientes adultos com dermatite atópica moderada a grave, em estudo de 16 semanas de duraçao e 16 semanas de follow-up. Neste estudo randomizado, controlado com placebo, duplo-cego, multicêntrico, envolvendo 379 pacientes de pelo menos 18 anos de idade, que tinham um Eczema Area and Severity Index (EASI) escore de 12 ou mais alto, inadequadamente controlados com tratamentos tópicos, dupilumabe melhorou a resposta clínica de maneira dose-dependente, sem efeitos adversos significantes. A melhora dos escores EASI favoreceu todos os regimes de doses de dupilumabe versus placebo, sendo os benefícios mais consistentes observados com doses de 300 mg uma vez por semana e 300 mg a cada 2 semanas16,17. De forma importante, em paralelo à melhora das medidas objetivas de eficácia clínica, o tratamento com dupilumabe resultou em melhora marcante do prurido, avaliado pelo escore NRS de prurido, com reduçao significante já na primeira semana de tratamento, além de melhora significante da qualidade de vida, avaliada pelo questionário DLQI16,18.
A administraçao subcutânea de dupilumabe uma vez por semana (600 mg dose de ataque, seguida de 300 mg por semana), por periodo de 16 semanas, com 16 semanas de follow-up, trouxe também benefício a um grupo pacientes adultos com rinossinusite crônica e polipose nasossinusal, refratários ao tratamento com corticosteroide intranasal (furoato de mometasona). Em estudo duplo-cego, controlado com placebo, de grupos paralelos, randomizado, multicêntrico, com 51 pacientes que completaram o estudo, a administraçao de dupilumabe foi associada com melhora significante do escore endoscópico de pólipos nasais, dos achados de tomografia computadorizada (escore de Lund-Mackay), e da qualidade de vida dos pacientes, quando comparado ao placebo19. Além disso, mudanças em medidas como o Sino-Nasal Outcome Test de 22 itens (SNOT-22) e a Visual Analog Scale (VAS) demonstraram melhora significante no grupo tratado com dupilumabe comparado com placebo, bem como melhora da sensaçao de cheiro, avaliada pelo University of Pennsylvania Smell Identification Test UPSIT. Houve ainda diferenças significantes em alguns marcadores inflamatórios séricos como níveis de IgE e eotaxina-319. Em resumo, em pacientes adultos com rinossinusite crônica e polipose nasossinusal refratários ao tratamento com spray nasal de furoato de mometasona, a adiçao de dupilumabe subcutâneo reduziu o impacto clínico dos pólipos nasais após 16 semanas19.
O bloqueio do receptor alfa de IL-4 com dupilumabe, de forma aditiva à terapia padrao, pode melhorar a vida de pacientes com asma nao controlada com corticosteroide inalatório e beta-2 agonista de açao prolongada, independente da contagem basal de eosinófilos; dermatite atópica inadequadamente controlada com tratamentos tópicos; e rinossinusite crônica com polipose naossinusal refratária a corticosteroide intranasal. Desta forma, dupilumabe é único entre os biológicos, pelo fato de poder melhorar condiçoes que frequentemente coexistem, como asma, dermatite atópica e pólipos nasais11. Até o momento, dupilumabe já foi estudado em pelo menos 3.000 pacientes com asma, dermatite atópica e pólipos nasais, e tem mostrado um perfil de segurança muito aceitável em estudos controlados com placebo nas várias indicaçoes. A incidência de efeitos adversos foi geralmente semelhante nos diferentes grupos de tratamento, e estes efeitos incluíram reaçoes transitórias no local da injeçao, cefaleia e nasofaringite. Nenhum efeito adverso clinicamente importante foi observado15. De uma forma geral, a contagem de eosinófilos no sangue tem permanecido estável ao longo do tratamento. Entretanto, em estudos com pacientes asmáticos com contagem basal de eosinófilos igual ou maior que 300 eosinófilos/µL, um aumento transitório nos níveis de eosinófilos sanguíneos foi observado após o início do tratamento, que rapidamente normalizou após a retirada do tratamento14,15. Este efeito do dupilumabe em aumentar a contagem de eosinófilos sanguíneos será investigado em mais detalhes no estudo de fase 3 que está em andamento (NCT02414854).
A terapia anti IL-4/IL-13 com o anticorpo monoclonal totalmente humano dupilumabe tem se mostrado muito promissora, e mesmo revolucionária, em várias doenças alérgicas, particularmente em condiçoes clínicas como asma, dermatite atópica e polipose nasal de difícil controle, fortemente associadas a resposta imune do tipo 220,21. Entretanto, estudos de fase 3 que estao em andamento com dupilumabe serao decisivos para consolidar a eficácia e segurança desta modalidade inovadora de tratamento, e espera-se que possam replicar os resultados obtidos até o momento com os estudos iniciais.
REFERENCIAS
1. Guo L, Huang Y, Chen X, Hu-Li J, Urban JF Jr, Paul WE. Innate immunological function of TH2 cells in vivo. Nat Immunol. 2015;16(10):1051-9.
2. Doherty TA, Broide DH. Group 2 Innate Lymphoid Cells: new players in human allergic diseases. J Investig Allergol Clin Immunol. 2015;25(1):1-11.
3. Nagakumar P, Denney L, Fleming L, Bush A, Lloyd CM, Saglani S. Type 2 innate lymphoid cells in induced sputum from children with severe asthma, J Allergy Clin Immunol. 2016;137(2):624-6.
4. Karta MR, Broide DH, Doherty TA. Insights into Group 2 Innate Lymphoid Cells in Human Airway Disease. Curr Allergy Asthma Rep. 2016;16(1):8.
5. Parulekar AD, Diamant Z, Hanania NA. Role of T2 inflammation biomarkers in severe asthma. Curr Opin Pulm Med. 2016;22(1):59-68.
6. Boguniewicz M, Leung DY. Targeted therapy for allergic diseases: at the intersection of cutting-edge science and clinical practice. J Allergy Clin Immunol. 2015;135(2):354-6.
7. Shiobara T, Chibana K, Watanabe T, Arai R, Horigane Y, Nakamura Y, et al. Dipeptidyl peptidase-4 is highly expressed in bronchial epithelial cells of untreated asthma and it increases cell proliferation along with fibronectin production in airway constitutive cells. Respir Res. 2016;17:28.
8. Brightling CE, Chanez P, Leigh R, O'Byrne PM, Korn S, She D, et al. Efficacy and safety of tralokinumab in patients with severe uncontrolled asthma: a randomised, double-blind, placebo-controlled, phase 2b trial. Lancet Respir Med. 2015;3(9):692-701.
9. Humbert M, Busse W, Hanania NA, Lowe PJ, Canvin J, Erpenbeck VJ, et al. Omalizumab in asthma: an update on recente developments. J Allergy Clin Immunol Pract. 2014;2:525-36.
10. Zhao ZT, Ji CM, Yu WJ, Meng L, Hawro T, Wei JF, et al. Omalizumab for the treatment of chronic spontaneous urticaria: a meta-analysis of randomized clinical trials. J Allergy Clin Immunol. 2016;137(6):1742-50.
11. Chung KF. Targeting the interleukin pathway in the treatment of asthma. Lancet. 2015;386:1086-96.
12. Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013;368(26):2455-66.
13. Wechsler ME. Inhibiting interleukin-4 and interleukin-13 in difficult-to-control asthma. N Engl J Med. 2013;368(26):2511-3.
14. Wenzel S, Castro M, Corren J, Maspero J, Wang L, Zhang B, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting β2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial. Lancet. 2016 Apr 26. doi: 10.1016/S0140-6736(16)30307-5.
15. Chung KF. Dupilumab: a potential new treatment for severe asthma. Lancet. 2016 Apr 26. doi: 10.1016/S0140-6736(16)30311-7.
16. Thaçi D, Simpson EL, Beck LA, Bieber T, Blauvelt A, Papp K, et al. Efficacy and safety of dupilumab in adults with moderate-to-severe atopic dermatitis inadequately controlled by topical treatments: a randomised, placebo-controlled, dose-ranging phase 2b trial. Lancet. 2016;387(10013):40-52.
17. Tsianakas A, Ständer S. Dupilumab: a milestone in the treatment of atopic dermatitis. Lancet. 2016;387(10013):4-5.
18. Simpson EL, Bieber T, Eckert L, Wu R, Ardeleanu M, Graham NM, et al. Patient burden of moderate to severe atopic dermatitis (AD): Insights from a phase 2b clinical trial of dupilumab in adults. J Am Acad Dermatol. 2016;74(3):491-8.
19. Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of subcutaneous Dupilumab on nasal polyp burden in patients with Chronic Sinusitis and Nasal Polyposis: a randomized clinical trial. JAMA. 2016;315(5):469-79.
20. Beck LA, Thaçi D, Hamilton JD, Graham NM, Bieber T, Rocklin R, et al. Dupilumab treatment in adults with moderate-to-severe atopic dermatitis. N Engl J Med. 2014;371(2):130-9.
21. Bachert C, Zhang L, Gevaert P. Current and future treatment options for adult chronic rhinosinusitis: Focus on nasal polyposis. J Allergy Clin Immunol. 2015;136(6):1431-40.