Número Atual: Março-Abril 2014 - Volume 2 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Citologia do escarro induzido em asmáticos infectados pelo Schistosoma mansoni
Induced sputum cytology in asthmatics infected with Schistosoma mansoni
Givaneide S. Lima1; Maria Ilma Araújo2,3; Maria Cecília F. Almeida4; Alvaro A. Cruz2; Luciana S. Cardoso5
1. MSc. Universidade Federal da Bahia (UFBA), Salvador, Bahia
2. MD, PhD. Universidade Federal da Bahia (UFBA), Salvador, Bahia
3. MD, PhD. Escola Bahiana de Medicina e Saúde Pública (EBMSP), Salvador, Bahia
4. MD. Universidade Federal da Bahia (UFBA), Salvador, Bahia
5. PhD. Universidade Federal da Bahia (UFBA), Salvador, Bahia
Endereço para correspondência:
Givaneide dos Santos Lima
E-mail gillima.cear@gmail.com
Submetido em 20/05/2014.
Aceito em 09/05/2015.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
Fontes financiadoras: Bolsa de Estudos do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Serviço de Imunologia do Hospital Universitário Professor Edgard Santos (HUPES) da Universidade Federal da Bahia.
RESUMO
INTRODUÇAO: A infecçao pelo Schistosoma mansoni inibe manifestaçao da asma. A avaliaçao do escarro induzido em pacientes infectados pelo parasita pode trazer informaçoes importantes sobre a relaçao entre doenças alérgicas e parasitoses.
OBJETIVO: Avaliar a celularidade do escarro em asmáticos em uma área endêmica em esquistossomose na Bahia.
MÉTODOS: Estudo randomizado, duplo cego, controlado com placebo, incluindo asmáticos infectados pelo S. mansoni e um grupo de asmáticos nao infectados. Foi utilizada a celularidade do escarro induzido, em contagens sequenciais pré (D0) e pós-tratamento (D7, D60 e D90), para avaliar os efeitos do tratamento da parasitose com praziquantel sobre a asma.
RESULTADOS: Avaliados 22 indivíduos asmáticos infectados pelo S. mansoni e grupo controle adicional composto por oito asmáticos nao infectados. O grupo que usou praziquantel nao diferiu do grupo placebo quando comparada a celularidade do escarro. Houve aumento no número de eosinófilos nos D7, D60 e D90 no grupo placebo, quando comparados ao basal, e no D60 no grupo praziquantel. O número total de células aumentou em relaçao ao basal no D7 e no D90 para o grupo placebo, e no D90 para o grupo praziquantel. O grupo que usou praziquantel apresentou uma reduçao do volume expiratório forçado no 1º segundo (VEF1) no D7, D60 e D90. Nao houve associaçao entre a eosinofilia e a gravidade da asma.
CONCLUSAO: No presente estudo nao foi encontrada correlaçao entre os tipos celulares encontrados e a gravidade da asma, nem houve variaçao significativa do percentual de eosinófilos em resposta ao tratamento da esquistossomose.
Descritores: Escarro, asma, eosinófilos, eosinofilia, esquistossomose.
INTRODUÇÃO
Nos últimos anos, tem-se buscado marcadores da atividade inflamatória em asmáticos empregando-se técnicas pouco invasivas, como a medida do óxido nítrico no ar exalado e a celularidade do escarro1. O escarro induzido (EI) foi inicialmente utilizado para o diagnóstico de câncer de pulmão e, posteriormente, para doenças infecciosas. Foi posteriormente reestudado e aceito como um instrumento de investigação da patogenia da asma2, e também usado para acompanhar a evolução da inflamação das vias aéreas pelo processo de análise das células e proteínas3,4.
Desde a última década, a identificação do padrão inflamatório da mucosa brônquica por meio do escarro induzido tem ajudado no diagnóstico e no melhor entendimento da asma. Além de ser um método não invasivo, tem boa acurácia, é de baixo custo e seguro, inclusive em crianças1,5. O escarro pode ser obtido espontaneamente ou por indução com inalação de solução salina hipertônica (SSH) a 4,5%6.
A asma é histologicamente caracterizada por um infiltrado celular inflamatório das vias áreas, representado pela presença de células inflamatórias como eosinófilos, neutrófilos, linfócitos e mastócitos. Pesquisas realizadas no Serviço de Imunologia da Universidade Federal da Bahia (SIM) têm mostrado que há uma relação inversa entre a infecção por Schistosoma mansoni e a gravidade da asma7. O presente estudo é pioneiro em avaliar a celularidade do escarro induzido em pacientes asmáticos infectados pelo S. mansoni em área rural.
MÉTODOS
Este estudo foi desenvolvido em Água Preta, distrito pertencente ao município de Gandu, Bahia, localizado no Litoral Sul, a 280 km de Salvador. O povoado de Água Preta compreende uma comunidade com cerca de 500 habitantes.
As condições sanitárias da região são precárias, não existindo saneamento básico. A água utilizada para consumo é proveniente de uma estação de água da própria região, sem tratamento adequado para consumo humano. A população usa o rio para lavagem de roupas, utensílios domésticos e também para o banho, sendo assim um local propício para a transmissão da esquistossomose. Não há sistema de esgotamento sanitário e o destino dos dejetos é feito a céu aberto ou em fossas artesanais.
A principal fonte de renda da população é a agricultura cacaueira. O acesso da população aos serviços de saúde é difícil e existem apenas relatos de tratamentos prévios esporádicos das parasitoses.
Este trabalho foi parte do projeto "Efeito do tratamento da esquistossomose sobre as manifestações clínicas e resposta imune da asma" que foi realizado por pesquisadores do Serviço de Imunologia da Universidade Federal da Bahia SIM-UFBA em Água Preta. Neste estudo randomizado, duplo cego, controlado com placebo, com dois grupos de asmáticos infectados pelo S. mansoni pareados por faixa etária, foram avaliados os efeitos do tratamento anti-helmíntico na gravidade da asma, avaliada segundo critérios clínicos, prova de função pulmonar e celularidade do escarro induzido. Todos os indivíduos incluídos foram diagnosticados como portadores de asma. Adicionalmente, foi comparada a celularidade do escarro dos pacientes residentes na área endêmica em esquistossomose com pacientes asmáticos não infectados pelo S. mansoni atendidos no ambulatório de alergia do Hospital Universitário Professor Edgard Santos HUPES-UFBA.
Um questionário padronizado (ISAAC)8 com questões básicas, abrangendo nível socioeconômico, existência de história pessoal de asma brônquica nos últimos 12 meses, presença de rinite alérgica, história familiar de atopia, patologias concomitantes e condições de habitação foi aplicado em amostra populacional do distrito de Água Preta. Todos os indivíduos foram admitidos no estudo por ordem de atendimento ao recrutamento. Eles foram randomicamente divididos em dois grupos utilizando-se um programa de computador Statistical Package for the Social Sciences (SPSS) versão 9.0. Um grupo foi tratado inicialmente com os anti-helmínticos Albendazol e Praziquantel (GRUPO II) e outro grupo foi tratado com placebo (GRUPO I). Após 90 dias, o Grupo I, que recebeu placebo, foi tratado com Albendazol e Praziquantel.
No momento da inclusão no estudo, os pacientes responderam a um questionário e foram submetidos a exame físico como parte da determinação do escore de gravidade da doença7, além de raio-X de tórax, espirometria e testes cutâneos para aeroalérgenos. Os pacientes do Grupo I tratados com placebo e os pacientes do Grupo II tratados com anti-helmínticos, foram reavaliados clinicamente durante todas as visitas do estudo, antes do tratamento (D0) e após 7, 60 e 90 dias de tratamento (D7, D60 e D90). O raio-X de tórax foi feito em D0 e em D7, e a espirometria foi realizada em todas as visitas onde foi realizada coleta do escarro induzido (D0, D7, D60 e D90). Após 90 dias do primeiro tratamento o grupo foi tratado novamente com anti-helmínticos. Os indivíduos dos dois grupos foram reavaliados quanto à gravidade da asma (escore de gravidade e espirometria) nos dias: D7, D60 e D90 após o tratamento.
Critérios de inclusão: (a) indivíduos com asma leve a moderada; (b) idade entre 5 a 50 anos; (c) residir na área endêmica em esquistossomose de Água Preta, BA, para compor o grupo de estudo; (d) indivíduos com diagnóstico de asma leve/ moderada, atendidos no ambulatório de alergia do HUPES-UFBA para compor o grupo controle.
Critérios de exclusão: (a) indivíduos em uso de anti-histamínicos nas últimas 72h, bem como corticosteroides e antileucotrienos nos últimos 30 dias; (b) mulheres gestantes; (c) alguma condição que não permitisse colaboração na realização dos exames; (d) indivíduos com asma grave; (e) indivíduos com a forma hepatoesplênica da esquistossomose; (f) indivíduos nos quais não se conseguiu amostras adequadas do escarro induzido.
Cálculo do tamanho amostral: este estudo foi desenhado para incluir 40 indivíduos, tomando-se por base um estudo piloto prévio que demonstrou piora da gravidade da asma em 45% dos indivíduos após o tratamento imediato das helmintíases9. Para uma diferença de 45% na frequência de escore de gravidade da asma > 1 entre pré e pós-tratamento com anti-helmínticos, o número mínimo de pacientes por grupo deveria ser 18, considerando o IC de 95% e um poder de 80%.
Avaliação da gravidade da asma: foi realizada utilizando-se o questionário para avaliação de gravidade de asma e dados do exame físico7. O escore de gravidade de asma varia de 0 a 2 conforme descrito na Tabela 1.
Testes cutâneos de hipersensibilidade imediata: foram realizados pela técnica de punctura, utilizando-se os antígenos Dermatophagoides pteronyssinus, D. farinae, Blomia troplicalis, Periplaneta americana e Blattella germanica (IPI-ASAC, Madri, Espanha)10.
Provas de função pulmonar: foi utilizado um espirômetro computadorizado, da marca Koko®, cujo software incluiu valores basais preditos da população brasileira11.
Radiografia do tórax: foram realizados em todos os pacientes na área endêmica.
Exame parasitológico de fezes: foram avaliadas 3 amostras de fezes através das técnicas da sedimentação espontânea e de Kato-Katz12, para a determinação da carga parasitária dos helmintos.
Escarro induzido: todos os indivíduos foram submetidos a uma espirometria para avaliação do VEF1. Pacientes com VEF1 > 60%, foram submetidos a indução do escarro, enquanto naqueles com VEF1 < 60% foi solicitada uma amostra espontânea. Os pacientes usaram, após a realização da espirometria basal (pré-BD), duas inalações de broncodilatador e foram imediatamente submetidos a nebulização com solução salina (4,5%) por 15 minutos, com inalação por via oral. A nebulização foi feita com nebulizador Inalar compact®, com taxa de nebulização de 0,15-0,25 mL/min. Os indivíduos foram incentivados a tossir e escarrar em um coletor. As amostras foram armazenadas em isopor com gelo para o processamento (até 4 horas) após a coleta6,13.
A coleta do escarro induzido e a confecção das lâminas para contagem diferencial foram baseadas na técnica de Pizzichini14, modificada para o nebulizador utilizado. As amostras foram centrifugadas por dez minutos a 3.000 rpm; desprezou-se o sobrenadante e acrescentou-se a mesma quantidade de cisteína (1/1) ao precipitado. Homogeneizou-se a amostra até a quebra total do muco e centrifugou-se por mais 10 min. Após a segunda centrifugação desprezou-se o sobrenadante, homogeneizando o precipitado e pipetando 10 µL para a contagem global em câmera de Neubauer. O precipitado também foi utilizado para a confecção do esfregaço, onde colocaram-se 20 µL do precipitado em uma lâmina com a identificação do paciente e data da coleta. O material foi espalhado na lâmina e esta foi reservada até sua secagem total, e após 24 h, corada pelo método de Wright para posterior contagem diferencial das células. A contagem diferencial foi feita de acordo com as características específicas de cada célula, sendo feita uma contagem de 200 a 400 células inflamatórias (macrófagos, eosinófilos, neutrófilos e células mononucleares). O ponto de corte utilizado para eosinófilos foi 2,5%1 devido a população em estudo ser formada em sua maioria por crianças e adolescentes. Para os neutrófilos, 65%14.
Análise estatística: foi utilizado o teste estatístico Qui-quadrado de associação entre as variáveis para comparar os grupos em caracterizações dicotômicas. Realizou-se também teste não paramétrico para comparação entre as contagens percentuais encontradas no escarro dos pacientes.
Os dados foram digitalizados no software Excel e analisados através do software estatístico SPSS® versão 11.0. Os gráficos e tabelas foram construídos através do software Excel. Os dados referentes à amostra estão apresentados através de medianas, desvios-interquartílicos para variáveis quantitativas, e através de porcentagens para variáveis qualitativas. Em todos os testes foram avaliadas as diferenças entre os desfechos, sendo considerados estatisticamente significantes valores de "p" inferiores ao nível de significância pré-estabelecido em 5%.
Considerações éticas: o estudo foi aprovado pelo Comitê de Ética em Pesquisa da Maternidade Climério de Oliveira, Universidade Federal da Bahia (Parecer/Resolução Nº 042/2009).
RESULTADOS
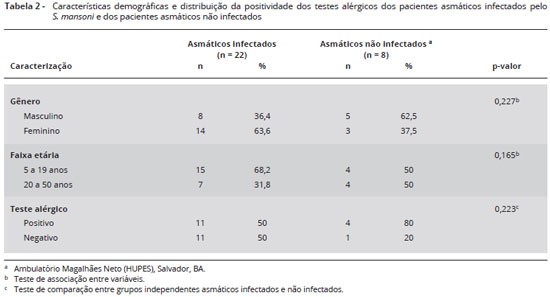
Não houve diferença significante quando comparados os gêneros e faixa etária entre os asmáticos residentes na área endêmica em esquistossomose (p = 0,227 e p = 0,165, respectivamente) e os asmáticos não infectados, atendidos no ambulatório de alergia do HUPES-UFBA (p = 0,165) indicando a homogeneidade dos grupos (Tabela 2).
As características demográficas dos asmáticos, tratados ou não com praziquantel, demonstraram o gênero feminino predominante, ocorrendo em 14 pacientes (63,6%), e o masculino em 36,4% dos indivíduos. Avaliando o grupo por faixa etária, 15 pacientes eram crianças ou adolescentes (68,2%), havendo apenas 7 adultos (31,8%). Feito o teste de associação entre as variáveis para o gênero (p = 0,234) e faixa etária (p = 0,167) entre os grupos placebo (n = 12; 54,5%) e o grupo praziquantel (n = 10; 44,5%) não foi encontrada diferença, o que indica que os grupos foram homogêneos e bem distribuídos na população estudada.
A carga parasitária teve uma mediana de 84 ovos/grama de fezes (ogf) para o grupo com os 22 indivíduos estudados. Quando avaliados separadamente, o grupo que usou placebo apresentou mediana de 56±108,5 ogf e o grupo praziquantel apresentou mediana de 96±48 ogf. O grupo que usou o praziquantel apresentou carga parasitária mais elevada.
Os escores de gravidade de asma estão representados na Figura 1, onde se percebe que os indivíduos apresentam 83,3% e 80% de escore 0 basal (pré-tratamento) e 16,7% e 20% de escore dois (2) nos grupos placebo e praziquantel, respectivamente. Sete dias após o tratamento com o praziquantel (D7), houve uma mudança nestes perfis, onde o escore 1 foi mais representativo com 22,2% no grupo placebo e 25% no grupo praziquantel, indicando uma redução dos sintomas nos dois grupos. Sessenta dias após o tratamento, houve uma queda nos escores 1 e nos escores 2 no grupo placebo, enquanto que o grupo praziquantel apresentou um acréscimo dos mesmos, indicando uma piora dos sintomas. No D90 os dois grupos apresentaram um aumento do escore 2; 37,5% e 33,3%, sendo semelhante o padrão entre eles.
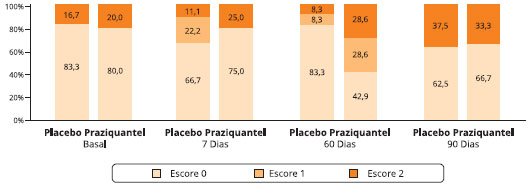
Figura 1 - Perfil dos escores da gravidade da asma* nos dois grupos de pacientes asmáticos infectados pelo S. mansoni, Gandu-BA
* Escore com base no questionário desenvolvido por Medeiros, 2003.
Quando avaliado o número de eosinófilos em relação à gravidade da asma, observou-se que o percentual de eosinófilos em D0 dos indivíduos do grupo placebo com escore zero não diferiu significantemente dos que apresentaram escore 2. O mesmo ocorreu para o grupo que usou praziquantel. Esta comparação foi também realizada em D90, não havendo diferença no percentual mediano de eosinófilos nos grupos placebo e praziquantel, quando comparados o escore zero e dois (Figura 2).
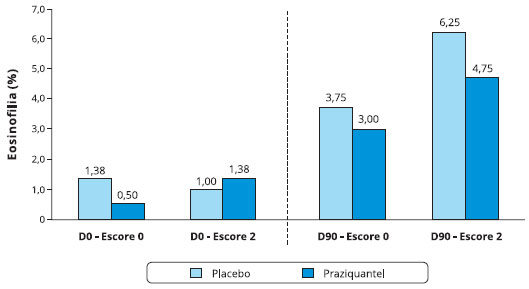
Figura 2 - Comparação dos perfis dos escores de gravidade da asma no período basal e com 90 dias em relação a eosinofilia no escarro induzido nos infectados pelo S. mansoni
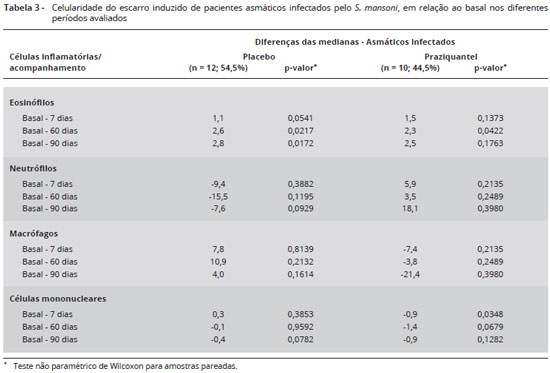
A análise da celularidade do escarro induzido nos grupos placebo e praziquantel mostrou aumento significante de eosinófilos no grupo placebo em D7, D60 e D90, quando comparados ao basal. O grupo praziquantel só apresentou diferença significante em D60, como representado na Tabela 3. Para as outras células não houve diferença significante, à exceção de células mononucleares entre basal e D7 no grupo praziquantel (p = 0,03).
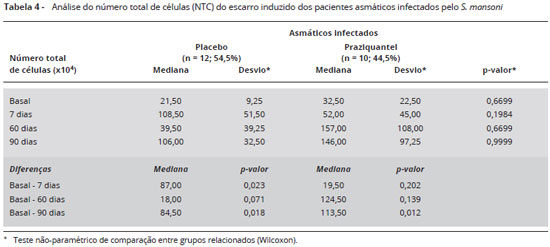
O número total de células foi também avaliado entre os asmáticos infectados (placebo e praziquantel), e está representado na Tabela 4.
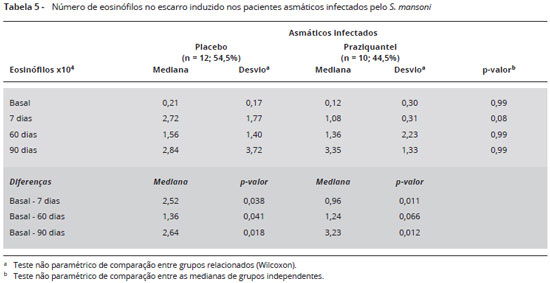
A eosinofilia no escarro foi comparada entre o período basal e após o tratamento, como mostrado na Tabela 5. Quando feita a comparação entre as medianas dos grupos placebo e praziquantel não houve diferença significante. Na comparação dentro do mesmo grupo houve aumento significante para o grupo placebo em D7, D60 e D90 e no grupo praziquantel em D7 e no D90.
Em relação à espirometria, os indivíduos do grupo placebo apresentaram VEF1 (volume expiratório forçado no 1º segundo) normal (> 80%) em todos (100%) os indivíduos no período basal, tendo uma redução para 81,8% e 91,7% desta proporção nos D7 e D60 respectivamente, voltando a ficar acima de 80% em 100% dos indivíduos em D90. O grupo praziquantel apresentou VEF1 normal em 90% dos indivíduos no período basal, reduzindo para 80% em D7 e 66,7% em D60 e 85,7% em D90. Pode-se observar através da espirometria que os indivíduos que fizerem uso do praziquantel tiveram uma redução maior no valor do VEF1 nas avaliações subsequentes.
O exame radiológico do tórax (radiografia de tórax) dos pacientes infectados pelo S. mansoni não apresentou alterações nas avaliações realizadas em D0 e em D7 após o tratamento com praziquantel.
DISCUSSÃO
Estudos vêm demonstrando que o escarro induzido é uma ferramenta útil para a avaliação da inflamação brônquica1,4,6,15. A eosinofilia no escarro caracteriza um subgrupo homogêneo de pacientes asmáticos, geralmente atópicos, e a neutrofilia ocorre em subgrupo heterogêneo de asmáticos habitualmente não atópicos16. Estudos realizados por diversos autores avaliam também a eosinofilia como um marcador de exacerbação de asma. Chakir e colaboradores17, por exemplo, utilizaram o estudo da celularidade do escarro para monitorar a inflamação da mucosa brônquica e o seu remodelameto, avaliando, além da celularidade, a deposição de colágeno após dois anos de tratamento. Este foi um estudo piloto, onde foram estudados 20 pacientes com asma moderada e randomizados para o estudo do escarro ou avalição clínica. O escarro mostrou redução de eosinófilos na asma moderada após o tratamento.
No presente estudo, foi avaliado se havia mudança na eosinofilia no escarro em três ocasiões (avaliações) após o tratamento com anti-helmínticos. Observando as frequências medianas pode-se afirmar que o escarro dos grupos estudados (placebo e praziquantel) não apresentou-se eosinofílico no período basal nem aos sete dias após o tratamento. Houve, entretanto, um aumento dos eosinófilos em D60 e D90 após o tratamento em ambos os grupos, tomando-se como ponto de corte 2,5% de eosinófilos1. Este ponto de corte foi utilizado devido ao fato de que a população de estudo ser formada por 68% de crianças e adolescentes, estando de acordo com o estudo de Palomino e colaboradores1. Não ficou claro, porém, se o aumento destas células está relacionado com a piora da asma depois do tratamento, pois os dois grupos, placebo e praziquantel, se comportaram de maneira semelhante. Quando se analisou a evolução dos pacientes, o número de eosinófilos aumentou em relação ao período basal nos dois grupos de estudo. Este aumento do número de eosinófilos após o tratamento nos dois grupos não é inteiramente concordante com a gravidade da asma, avaliada através do escore de gravidade e da espirometria. Enquanto o número de eosinófilos aumentou em D7, D60 e D90 após o tratamento nos dois grupos, o aumento do escore de gravidade ocorreu em D7 e D90 do grupo placebo e em D60 e D90 do grupo praziquantel. Em relação à espirometria, VEF1 < 80% ocorreu em D60 do grupo que usou praziquantel, estando acima de 80% nos pacientes nos outros períodos avaliados e também em todas as avaliações do grupo placebo. Considerando estes resultados, o número de eosinófilos não refletiu a gravidade da asma no presente trabalho. Uma possível explicação é que o número de indivíduos asmáticos incluídos neste estudo foi pequeno, não atingindo o poder planejado para mostrar diferenças significativas. Uma outra possível explicação seria o fato de que a maioria dos indivíduos envolvidos no estudo possuía a forma leve da asma, não sendo possível mostrar grandes diferenças na celularidade. O fato de que não houve diferença no número de eosinófilos e de outras células, entre os asmáticos infectados e não infectados pelo S. mansoni, ambos com asma leve, reforça esta hipótese. Será necessário portanto, avaliar com mais cuidado a celularidade do escarro em pacientes com asma moderada a grave.
Há entretanto, relatos na literatura sugestivos de que a celularidade e outros marcadores de inflamação presentes no escarro, estejam relacionados à gravidade da asma18. Por outro lado, resultados de estudos bem conduzidos diferem dos anteriores, e permanece controverso o real papel da celularidade do escarro em discriminar a gravidade da asma19. De fato, o próprio grupo de trabalho internacional sobre escarro induzido discute que há uma fraca relação entre a gravidade da asma definida por função pulmonar ou sintomas, e a contagem de eosinófilos no escarro, e que outros estudos são necessários para definir a relação entre a celularidade do escarro e a inflamação das vias aéreas20. Em outro trabalho, Bartoli et al.21 descreveram a celularidade do escarro em um grupo de 223 pacientes asmáticos de gravidade variável e 14 indivíduos controle, e observaram que pacientes com asma persistente leve e moderada não diferem quanto à contagem de eosinófilos no escarro, independentemente do tratamento regular com corticosteroides inalatórios. Ficou evidente, entretanto, que o percentual de eosinófilos no escarro diferenciou adequadamente os pacientes asmáticos dos controles.
Na análise do presente estudo houve evolução de aumento de eosinófilos após o tratamento de parasitose intestinal, como esperado, o que indicaria uma piora da asma. Houve, entretanto, aumento da eosinofilia também no grupo placebo. Foi também observado que a frequência de VEF1 abaixo de 80% ocorreu no grupo que fez uso do praziquantel, havendo uma redução principalmente em D60, enquanto que o número de eosinófilos neste período foi 2,8%.
O número de neutrófilos encontrado neste estudo foi abaixo do descrito na literatura para classificar o escarro como neutrofílico na asma14, o que sugere que os neutrófilos não são componentes importantes da inflamação brônquica nos pacientes incluídos.
Sobre o importante aumento da celularidade total em relação à exacerbação da asma, há consenso22,23. Isso deve-se provavelmente a maior descamação do epitélio e ao maior influxo de células inflamatórias. O aumento do número total de células foi também avaliado neste estudo, sendo maior em D7 e no D90 em relação ao basal do grupo placebo, e em D90 do grupo que usou o praziquantel, provavelmente devido ao aumento do número de eosinófilos.
A indução do escarro em pacientes asmáticos é segura para obtenção de amostras clínicas em crianças e adolescentes. A obtenção do escarro induzido foi bem aceita pelo grupo deste estudo, apesar dos seus desconfortos. Nenhum paciente apresentou broncoespasmo durante a nebulização com a solução hipertônica. O tratamento com praziquantel não alterou significativamente a celularidade do escarro, embora tenha alterado a gravidade da asma24. Não foi encontrada correlação entre a celularidade do escarro e a gravidade da asma.
AGRADECIMENTOS
Os autores agradecem aos pacientes de Água Preta e do Ambulatório de Alergia que aceitaram participar deste estudo, à agente comunitária de saúde Irene Jesus pela contribuição, e ao Dr. Edgar M. Carvalho pelo apoio. Maria Ilma Araújo e Alvaro Cruz são pesquisadores do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
REFERÊNCIAS
1. Palomino AL, Bussamra MH, Saraiva-Romanholo BM, Martins MA, Nunes MP, Rodrigues JC. Induced sputum in children and adolescents with asthma: safety, clinical applicability and inflammatory cells aspects in stable patients and during exacerbation. J Pediatria (Rio J). 2005;81:216-24.
2. Rufino R, Costa CH, Souza HS, Madi K, Silva JR. Induced sputum and peripheral blood cell profile in chronic obstructive pulmonary disease. J Bras Pneumol. 2007;33:510-8.
3. Bullens DM, Decraene A, Dilissen E, Meyts I, De Boeck K, Dupont LJ, et al. Type III IFN-lambda mRNA expression in sputum of adult and school-aged asthmatics. Clin Exp Allergy. 2008;38:1459-67.
4. Baines KJ, Simpson JL, Wood LG, Scott RJ, Fibbens NL, Powell H, et al. Sputum gene expression signature of 6 biomarkers discriminates asthma inflammatory phenotypes. J Allergy Clin Immunol. 2014;133:997-1007.
5. Bretscher P, Cohn M. A theory of self-nonself discrimination. Science. 1970;169(950):1042-9.
6. Drews AC, Escouto DC, Stein RT. The use of induced sputum to evaluate inflammation of the airways in patients with asthma. Scientia Medica. 2006;16:126-32.
7. Medeiros MJ, Figueiredo JP, Almeida MC, Matos MA, Araujo MI, Cruz AA, et al. Schistosoma mansoni infection is associated with a reduced course of asthma. J Allergy Clin Immunol. 2003;111:947-51.
8. Asher MI, Weiland SK. The International Study of Asthma and Allergies in Childhood (ISAAC). ISAAC Steering Committee. Clin Exp Allergy. 1998;28[Suppl 5]:52-66.
9. Araujo MI, Hoppe B, Medeiros M Jr, Alcantara L, Almeida MC, Schriefer A, et al. Impaired T Helper 2 response to aeroallergen in helminth-infected patients with asthma. J Infect Dis. 2004;190:1797-803.
10. Medeiros MJ, Almeida MC, Figueiredo JP, Atta AM, Mendes CM, Araujo MI, et al. Low frequency of positive skin tests in asthmatic patients infected with Schistosoma mansoni exposed to high levels of mite allergens. Pediatr Allergy Immunol. 2004;15:142-7.
11. Pereira CA, I Consenso Brasileiro sobre Espirometria. J Pneumol. 1996;22:107-64.
12. Katz N, Coelho PM, Pellegrino J. Evaluation of Kato's quantitative method through the recovery of Schistosoma mansoni eggs added to human feces. J Parasitol. 1970;56:1032-3.
13. Cai Y, Carty K, Henry RL, Gibson PG. Persistence of sputum eosinophilia in children with controlled asthma when compared with healthy children. Eur Respir J. 1998;11:848-53.
14. Efthimiadis A, Pizzichini E, Pizzichini MMM, Hargreave FE. Sputum examination for indices of airway inflammation: laboratory procedures. Lund: Astra Draco; 1997. p.31.
15. Pizzichini E, Pizzichini MM, Efthimiadis A, Hargreave FE, Dolovich J. Measurement of inflammatory indices in induced sputum: effects of selection of sputum to minimize salivary contamination. Eur Respir J. 1996;9:174-80.
16. Simpson JL, Scott R, Boyle MJ, Gibson PG. Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology. 2006;11:54-61.
17. Chakir J, Loubaki L, Laviolette M, Milot J, Biardel S, Jayaram L, et al. Monitoring sputum eosinophils in mucosal inflammation and remodelling: a pilot study. Eur Respir J. 2010;35:48-53.
18. Gibson PG. Use of induced sputum to examine airway inflammation in childhood asthma. J Allergy Clin Immunol. 1998;102:S100-1.
19. Fuhlbrigge AL. Asthma severity and asthma control: symptoms, pulmonary function, and inflammatory markers. Curr Opin Pulm Med. 2004;10:1-6.
20. Pavord ID, Sterk PJ, Hargreave FE, Kips JC, Inman MD, Louis R, et al. Clinical applications of assessment of airway inflammation using induced sputum. Eur Respir J. 2002;37:40s-43s.
21. Bartoli ML, Bacci E, Carnevali S, Cianchetti S, Dente FL, Di Franco A, et al. Clinical assessment of asthma severity partially corresponds to sputum eosinophilic airway inflammation. Respir Med. 2004;98:184-93.
22. Twaddell SH, Gibson PG, Carty K, Woolley KL, Henry RL. Assessment of airway inflammation in children with acute asthma using induced sputum. Eur Respir J. 1996;9:2104-8.
23. Gibson PG, Simpson JL, Hankin R, Powell H, Henry RL. Relationship between induced sputum eosinophils and the clinical pattern of childhood asthma. Thorax. 2003;58:116-21.
24. Almeida MC, Lima GS, Cardoso LS, Souza RP, Campos RA, Cruz AA, et al. The effect of anthelminthic treatment on subjects with asthma from an endemic area of Schistosomiasis: A randomized, double-blinded, and placebo-controlled trial. J Parasitol Res. 2012:296856.