Número Atual: Novembro-Dezembro 2013 - Volume 1 - Número 6
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Reações adversas à imunoglobulina humana endovenosa no tratamento de pacientes com imunodeficiência primária
Adverse reactions to intravenous human immunoglubulin for the treatment of patients with primary immunodeficiency
Danielli C. Bichuetti-Silva1; Fernanda P. Furlan2; Fernanda A. Nobre1; Camila T. M. Pereira2; Tessa R. T. Gonçalves2; Mariana Gouveia-Pereira2; Rafael Rota2; Juliana T. L. Mazzucchelli1; Beatriz T. Costa-Carvalho3
DOI: 10.5935/2318-5015.20130048
1. MD, MSc. Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP
2. MD. Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP
3. MD, PhD. Escola Paulista de Medicina, Universidade Federal de Sao Paulo (EPM-UNIFESP), Sao Paulo, SP
Endereço para correspondência:
Daniélli Christinni Bichuetti Silva
E-mail: daniellibichuete@gmail.com
Submetido em 28/01/2014.
Aceito em 02/11/2014.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVOS: Avaliar a incidência e gravidade das reaçoes adversas à infusao de imunoglobulina endovenosa (IgEV) em pacientes com imunodeficiência primária (IDP) e identificar fatores de risco associados.
MÉTODOS: Estudo prospectivo das infusoes ocorridas no período de agosto/2011 a junho/2012 em centro de referência para atendimento de pacientes com IDP. Foi realizada análise descritiva e nao paramétrica (teste do qui-quadrado) através do software Minitab 16r. O valor de p < 0,05 foi considerado significante.
RESULTADOS: Um total de 741 infusoes de IgEV foram realizadas em 93 pacientes, sendo 34% mulheres e 66% homens. A faixa etária variou de 6 meses a 77 anos, e os pacientes foram divididos em 3 grupos: < 10 anos (33,3%); 10-18 anos (21,5%); >18 anos (12,9%). A maioria foi representada por pacientes com deficiências humorais (70,9%). As marcas de IgEV utilizadas foram: Octagamr (31,6%), Flebogamar (28%), Tegeliner (27,2%), Imunoglobulinr (8,6%), Vigamr (2,6%), e Kiovigr (0,9%). A incidência de reaçoes foi 2,8%, ocorrendo em 21 infusoes, (IC95% 1,6-4,0%), sendo 86% de intensidade leve/moderada. O grupo com maior incidência de reaçoes adversas foi o de pacientes < 10 anos. Nao houve diferença significante (p = 0,743) entre os que receberam IgEV com ou sem processo infeccioso agudo. Quanto às reaçoes adversas, 81,2% (13) ocorreram em infusoes com velocidade < 4 mg/kg/min, e 18,8% no grupo com velocidade acima desta; nao houve diferença significante entre os grupos (p=0.21). O uso de Tegeliner quando comparado ao uso de outras preparaçoes de IgEV representou fator de risco significante para reaçao (p=0,002).
CONCLUSAO: IgEV mostrou ser uma droga segura, com baixa incidência de reaçoes adversas, sendo a maioria nao graves.
Descritores: Imunodeficiência, imunoglobulina endovenosa, efeitos adversos.
INTRODUÇAO
A imunoglobulina humana endovenosa (IgEV) vem sendo usada no tratamento de imunodeficiências primárias e secundárias há mais de 20 anos, e consiste, no momento, na principal terapia disponível para as imunodeficiências primárias (IDP) com defeitos na produçao de anticorpos1-3, proporcionando melhora na qualidade de vida e reduzindo significativamente a morbidade e mortalidade dos pacientes com IDP4-7. Estudos mais recentes sugerem que a IgEV tem um papel modulador no sistema imune, nao funcionando somente como uma terapia de reposiçao de anticorpos1.
Visto que a IgEV é um hemoderivado extraído de um pool de milhares de doadores humanos, sua utilizaçao vem sendo associada à ocorrência de reaçoes adversas8,9. Estudos apontam uma incidência de reaçoes bastante variável, entre 0,6 a 30%. A maioria dos trabalhos sugere a presença de fatores de risco para essas reaçoes, incluindo infecçoes agudas no momento da infusao, alta velocidade de infusao, primeira infusao ou intervalo grande desde a última infusao, mudança de preparaçao comercial, e presença de anticorpos anti-IgA no soro dos pacientes6,9-11.
Os efeitos adversos durante a infusao podem mimetizar quadros infecciosos, incluindo sintomas como tremores, artralgias/mialgias, febre e cefaleia. Reaçoes do tipo opressao no peito, falta de ar e taquicardia também podem ocorrer. Efeitos adversos graves como lesao renal, hemólise ou trombose sao raros12. A insuficiência renal é raramente relatada e parece estar associada ao uso de produtos com sucrose13.
O presente estudo objetivou avaliar a frequência e gravidade das reaçoes adversas à infusao regular de IgEV e identificar os fatores associados a maior risco para sua ocorrência em pacientes com imunodeficiência primária em um centro de referência no tratamento dessas condiçoes.
MÉTODOS
O estudo foi realizado no serviço de Imunologia Clínica da Universidade Federal de Sao Paulo, onde sao atendidas crianças e adultos. Pacientes com diagnóstico de defeitos na produçao de IgG recebem infusoes regulares de IgEV sob a supervisao de médicos especialistas e enfermeiras treinados. Todos os diagnósticos foram baseados nos critérios da Sociedade Europeia de Imunodeficiências (ESID) e do Grupo Pan-americano de Imunodeficiências (PAGID)14.
Uma planilha de preenchimento dos detalhes de cada infusao foi preparada durante o mês de julho/2011 e teve sua aplicaçao na rotina iniciada no mês seguinte. A cada infusao, foram anotadas dose administrada, marca e lote da preparaçao, condiçoes clínicas do paciente incluindo sinais vitais, medicaçoes em uso, medicaçoes utilizadas imediatamente antes da infusao e velocidade de infusao, pelos médicos que assistiam os pacientes durante as infusoes. Todas as reaçoes adversas observadas foram anotadas na planilha e no prontuário, e notificadas ao Serviço de Farmacovigilância.
Os pacientes realizaram infusoes a cada 3 ou 4 semanas, com doses que variaram de 300 a 900 mg/kg. Foram incluídos no estudo todos os pacientes que fizeram no mínimo uma infusao de IgEV supervisionada no serviço. A velocidade de infusao do medicamento é regulada de forma manual pelo gotejamento, uma vez que o serviço nao dispoe de bomba de infusao. A velocidade de infusao pode ser estimada dividindo-se o intervalo de tempo gasto para a infusao da dose total de IgEV pelo peso corporal do paciente. Como rotina do serviço, todos os pacientes recebem soluçao salina a 0,9% na quantidade de 100 a 250 mL para crianças e adultos, respectivamente, antes da infusao de IgEV.
As seis preparaçoes de IgEV utilizadas foram Vigamr (Bio Products Laboratory Hertfordshire, UK), Kiovigr (Baxter AG, Austria), Octagamr (Octapharma, Alemanha), Flebogamar (Grifols, Espanha), Imunonoglobulinr (GCC, Coreia) e Tegeliner (LFB-Biomedicaments, França) todas disponibilizadas pela rede pública.
Os dados obtidos no período de agosto/2011 a junho/2012 foram analisados através no software de estatística Minitab 16r. A frequência de reaçoes adversas foi categorizada de acordo com a classificaçao de gravidade baseada nos dados da literatura6. As reaçoes adversas foram comparadas nos diferentes grupos (faixa etária, diagnóstico, velocidade de infusao, vigência ou ausência de infecçao aguda, preparaçao da IgEV) através do teste do qui-quadrado. Um valor de p menor que 0,05 foi considerado significante. O estudo foi aprovado pelo Comitê de Ética da instituiçao.
RESULTADOS
A populaçao estudada foi composta de 93 pacientes sendo 32 mulheres (34%) e 61 homens (66%), com idade que variou de 6 meses a 77 anos. A estratificaçao por faixa etária resultou nos seguintes grupos: < 10 anos, 33,3%; 10-18 anos, 21,5%; > 18 anos, 12,9%. Quatro pacientes tinham mais que 60 anos. Os diagnósticos incluíram: 38 pacientes com imunodeficiência comum variável (ICV) (40,8%); 12 com defeitos de reparo de DNA (12,9%); 11 pacientes com hipogamaglobulinemia (11,8%); 9 pacientes com defeitos específicos de anticorpos (9,6%); 8 com agamaglobulinemia ligada ao X (8,6%); 5 com defeito de troca de isotipo de IgG (5,3%); 2 com Síndrome de DiGeorge (2,2%); 2 com imunodeficiência combinada (2,2%); 2 com imunodeficiência combinada grave (2,2%); 2 com Síndrome de Wiskott-Aldrich (2,2%); 1 com deficiência parcial de adenosina deaminase (ADA) (1,1%); e 1 paciente com Síndrome de Hiper-IgE (1,1%). Nenhum dos pacientes do estudo apresentava diabetes, insuficiência renal ou cardíaca.
Durante o período estudado, ocorreram 741 infusoes supervisionadas e documentadas de IgEV, sendo 244 em < 10 anos (32,9%), 170 entre 10 e 18 anos (22,9%), e 327 infusoes em > 18 anos (44,1%). As marcas de IgEV administradas, em ordem decrescente de frequência, foram: Octagamr (31,6%), Flebogamar (28%), Tegeliner (27,2%), Imunoglobulinr (8,6%), Vigamr (2,6%) e Kiovigr (0,9%). Dois pacientes receberam duas marcas diferentes (Flebogamar e Octagamr; Flebogamar e Imunoglobulinr) numa mesma infusao. Em cinco infusoes nao foram documentadas as marcas utilizadas.
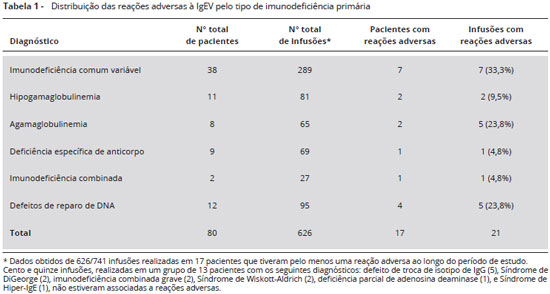
Dentre as 741 infusoes realizadas, 21 infusoes foram associadas a reaçoes adversas, que ocorreram em 17 pacientes durante o recebimento de 626 doses (Tabela 1). Por outro lado, 115 infusoes, realizadas em 13 pacientes com os seguintes diagnósticos: defeito de troca de isotipo de IgG (5), Síndrome de DiGeorge (2), imunodeficiência combinada grave (2), Síndrome de Wiskott-Aldrich (2), deficiência parcial de adenosina deaminase (1), e Síndrome de Hiper-IgE (1), nao estiveram associadas reaçoes adversa. A incidência de reaçoes adversas foi, portanto, de 2,8%. Por faixa etária, as reaçoes foram distribuídas da seguinte forma: 10 (4%) em 244 infusoes em pacientes < 10 anos; 6 (3,5%) em 170 infusoes entre 10 e 18 anos; 5 (1,5%) em 327 infusoes em pacientes > 18 anos. Nao houve associaçao significante entre o índice de reaçoes e a idade. Os pacientes apresentavam ICV em 33,3% das reaçoes; agamaglobulinemia em 23,8% das reaçoes; defeitos de reparo de DNA em 23,8% das reaçoes; hipogamaglobulinemia em 9,5% das reaçoes; defeito específico de anticorpo em 4,8% das reaçoes; e imunodeficiência combinada em 4,8% das reaçoes (Tabela 1).
A vigência de infecçoes no momento da infusao da IgEV fez-se presente em 7 (33,3%) reaçoes, incluindo infecçoes de vias respiratórias superiores em 6 casos, infecçoes de vias respiratórias inferiores (1 caso), e do trato gastrintestinal (1 caso). Nao houve diferença significante (p = 0,743) entre os grupos que receberam IgEV na vigência ou na ausência de algum processo infeccioso. Portanto, a presença de distúrbio infeccioso nao configurou fator de risco significante para as reaçoes.
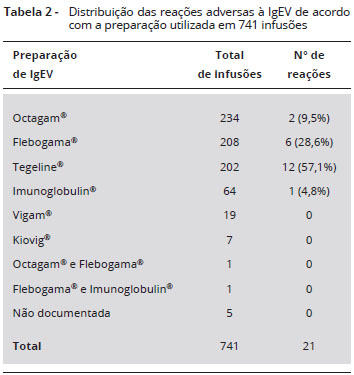
Todos os eventos adversos ocorreram em infusoes em que foi utilizada uma única marca da IgEV: 12 (57,1%) reaçoes com Tegeliner, 6 (28,6%) com Flebogamar, 2 (9,5%) com Octagamr e 1 (4,8%) com Imunoglobulinr. (Tabela 2) A utilizaçao da marca Tegeliner representou fator de risco significante para reaçoes adversas quando comparada a todas as outras marcas (p = 0,002).
Das 21 infusoes associadas a reaçoes, 16 (76,2%) foram realizadas com o mesmo lote do produto durante toda infusao; 4 (19%) foram realizadas com 2 lotes diferentes, e 1 (4,7%) infusao foi realizada com 3 lotes diferentes.
As reaçoes ocorreram com diferentes velocidades de infusao: 2 (7,1%) reaçoes em 28 infusoes com velocidade < 2 mg/Kg/min; 11 (3,2%) em 339 infusoes com velocidade > 2 e < 4 mg/Kg/min; e 3 (2,1%) reaçoes em 142 infusoes > 4 e < 6 mg/Kg/min. Nas 31 e 12 infusoes com taxas de infusao > 6 e < 8 mg/Kg/min, e > 8 mg/Kg/min, respectivamente, nao houve reaçoes adversas. Em cinco reaçoes a velocidade de infusao nao pode ser calculada. Portanto, a maior parte das reaçoes, 81,2% (13 reaçoes), ocorreu em infusoes com velocidade < 4 mg/Kg/min. O grupo com velocidade maior apresentou 18,8% das reaçoes, entretanto nao houve diferença significante entre os grupos quanto à velocidade de infusao (p = 0,216).
Das 21 reaçoes observadas, 9 (42,8%) foram de intensidade leve; 9 (42,8%) de intensidade moderada; e 3 (14,2%) foram reaçoes graves. As reaçoes do tipo leve incluíram episódios de cefaleia (5 casos), rubor (4 casos), febre (3 casos), mal-estar ou tontura (5 casos), tremores ou calafrios (7 casos), sudorese (1 caso), taquicardia (2 casos) e urticária ou angioedema localizados (3 casos). As reaçoes de intensidade moderada foram náuseas ou vômitos (4 casos), dor abdominal (3 casos) e dispneia ou aperto no peito (5 casos). Os eventos considerados graves foram sensaçao de aperto na garganta (1 caso), hipotensao (1 caso) e convulsao (1 caso). Os três casos de reaçoes graves ocorreram com 3 diferentes marcas do produto. O tempo médio para início dos sintomas foi de 92,3 minutos após o início da infusao da preparaçao, variando de 20 minutos a 4 horas. (Figura 1). Todas as reaçoes foram revertidas com interrupçao temporária (85,7%) ou completa (14,2%) da infusao da medicaçao, expansao com soro fisiológico a 0,9%, e medicaçoes sintomáticas, dentre elas: antitérmicos/AINES (17,8%), antiemético (8,9%), anti-histamínico (6,6%), corticosteroides (15,5%), broncodilatador inalatório (4,5%), oxigenioterapia através de máscara (4,5%) e diazepam (2,1%).
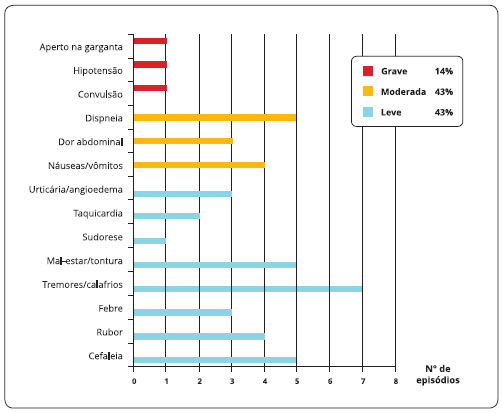
Figura 1 - Sintomas observados nas reaçoes adversas à IgEV
DISCUSSAO
O número de pacientes com necessidade de terapia com IgEV tem aumentado em todo o mundo e em vários locais esta administraçao é feita em domicílio com supervisao de um profissional de saúde5. No Brasil, a grande maioria das infusoes é realizada em serviços de saúde6, porém é necessário determinar a frequência e as causas de reaçoes adversas a fim de procurar evitá-las e tratá-las adequadamente. A avaliaçao de reaçoes adversas entre os pacientes com IDP do centro do estudo, apesar do curto período de registro das reaçoes, pode ser obtida para um número considerável de infusoes, dado o grande volume de pacientes atendidos no serviço. A casuística forneceu uma prevalência reduzida de reaçoes, 2,8%, com um intervalo de confiança de 95% variando 1,6 a 4,0%, inferior quando comparada a dados da literatura, que mostram frequência de até 30%14-17.
Nosso estudo nao mostrou diferença significante da frequência de reaçoes entre crianças e adultos, da mesma forma que estudos prévios que observaram uma variaçao de 0,8% de reaçoes em adultos e 0,7% em crianças abaixo dos 10 anos11. Em nosso serviço, apenas 3 reaçoes (14,2%) foram consideradas graves, sendo o restante leves (42,8%) e moderadas (42,8%). Um dos pacientes que apresentou reaçao grave evoluiu com crise convulsiva tônico-clônica generalizada, porém tinha história pregressa de crise convulsiva e sequela neurológica devido a quadro de encefalite herpética.
A frequência de eventos adversos à infusao endovenosa de imunoglobulina pode ser maior na presença de infecçoes, na primeira infusao, em pacientes com ICV e com alguns produtos específicos. Nos pacientes infectados, essa maior proporçao de eventos adversos é em parte associada à formaçao de complexos antígeno-anticorpo, e os eventos adversos podem ser reduzidos se o paciente estiver afebril ou recebendo tratamento anti-infeccioso18. Identificar infecçao durante a administraçao de IgEV pode entao ajudar a prevenir reaçoes adversas. Nestes casos, a carga antigênica deve ser diminuída por tratamento adequado com antibiótico durante 2 a 7 dias antes da infusao da IgEV. Reaçoes graves podem ocorrer em pacientes com infecçoes crônicas por ativaçao do complemento com a produçao de C3a e C5a19. Diferente do observado na literatura, em nosso estudo a maioria das infusoes que cursaram com eventos adversos ocorreram em pacientes sem infecçao aguda vigente. Esse achado pode refletir a complexidade dos fatores implicados em uma reaçao adversa durante a infusao de IgEV. Apesar de infectados, todos os pacientes estavam afebris durante a administraçao do produto, nenhum deles apresentava uma infecçao grave, e 53% estavam sob uso contínuo de antibioticoterapia profilática.
Outro fator associado à maior prevalência de reaçoes é a presença de agregados de imunoglobulina nos produtos liofilizados diluídos antes do uso. A diluiçao requer alguns cuidados como temperatura adequada e observaçao atenta do produto durante a diluiçao antes de se iniciar a infusao18. Doze pacientes da nossa casuística apresentaram reaçao com a imunoglobulina Tegeliner; esta é a única preparaçao liofilizada e contém alta quantidade de sacarose em sua composiçao, podendo este ser um dos fatores causadores do aumento da frequência de reaçoes com esta preparaçao.
Segundo a literatura, a maioria dos eventos está associada à velocidade de infusao18. Para minimizar esses eventos, a infusao deve ser iniciada lentamente na dose de 0,01 mL/Kg/min (equivalente a 0,5 mg/Kg/min da soluçao a 5%, ou a 1 mg/Kg/min da soluçao a 10%), utilizando-se, sempre que possível, bomba de infusao11. Os sinais vitais devem ser monitorizados e se o paciente sentir-se bem, a velocidade pode ser aumentada em intervalos de 15 a 30 min, até o máximo tolerado, geralmente 0,08 mL/Kg/min (equivalente a 4 mg/Kg/min da soluçao a 5% e 8 mg/Kg/min da soluçao a 10%)20. Entretanto, a velocidade de infusao varia de acordo com o produto, devendo ser seguidas as recomendaçoes do fabricante. No presente estudo, observamos que 9,2% dos pacientes que apresentaram reaçoes adversas receberam IgEV numa velocidade de infusao igual ou inferior a 2 mg/Kg/min; 52,4% receberam em velocidade maior que 2 mg/Kg/min até 4 mg/Kg/min; e apenas 14,3% com velocidade superior a 4 mg/Kg/min, portanto todos dentro das velocidades consideradas "seguras". Como nosso serviço nao dispoe de bombas de infusao, a velocidade de infusao da medicaçao foi controlada manualmente, calculando-se o tempo de infusao a cada frasco. Essa pode ser considerada uma importante limitaçao do nosso estudo e talvez possa explicar o inesperado achado de que as altas velocidades de infusao nao estiveram associadas às maiores taxas de reaçoes adversas. Por outro lado, nosso estudo demonstra que a ausência de bombas de infusao nao proporcionou uma maior frequência de eventos adversos.
As reaçoes adversas sao particularmente comuns em pacientes que nao receberam IgEV anteriormente. Um estudo feito pela Immune Deficiency Foundation mostrou que cerca de 30% das reaçoes ocorreram durante a primeira infusao de IgEV21. Portanto, a primeira infusao em um paciente deve ser administrada lentamente, com soluçao a 3% ou 5%, a partir de 0,5-1,0 mg/Kg/min5. Entre os pacientes do nosso estudo, apenas 1 paciente recebeu IgEV pela primeira vez no período estudado, e nao apresentou reaçao adversa durante essa infusao.
Todos os pacientes atendidos em nosso serviço recebem a imunoglobulina fornecida pela Secretaria de Saúde do Estado, de forma que é comum nao termos um único lote durante uma mesma infusao, bem como ocorrer a troca da marca comercial em diferentes infusoes. Pacientes iniciados em uma preparaçao podem ser mudados para outras por razoes de custo ou de disponibilidade22. Um estudo recente aconselhou cautela quando uma preparaçao de IgEV é substituída por outra, podendo haver um risco aumentado de reaçoes adversas ao se mudar de lote do medicamento23. Em nosso estudo, 16 pacientes (76,2%) dentre os que apresentaram alguma reaçao durante a infusao de IgEV receberam o mesmo lote do produto durante toda infusao; 4 (19%) receberam 2 lotes diferentes na mesma infusao e apenas 1 paciente havia recebido 3 lotes diferentes.
Nossos dados indicam que as reaçoes adversas à infusao de IgEV sao pouco frequentes, na maioria das vezes de leve intensidade. Eventos adversos potencialmente fatais associados à IgEV sao raros e podem ser prevenidos pela supervisao médica cuidadosa, com intervençao precoce da infusao e administraçao de terapêutica específica.
REFERENCIAS
1. Kaveri SV, Maddur MS, Hedge P, Lacroix-Desmazes S, Bayry J. Intravenous immunoglobulin in immunodeficiences: more than mere replacement therapy. Clin Exp Immunol. 2011;164(Suppl.2):2-5.
2. Chapel H, Geha R, Rosen F. Primary immunodeficiency diseases: an update. Clin Exp Immunol. 2003;132:9-15.
3. Buckley RH, Schiff RI. The use of intravenous immune globulin in immunodeficiency diseases. N Engl J Med. 1991;325:110-7.
4. Bayrakci B, Ersoy F, Sanal O, Kilic S, Metin A, Tezcan I. The efficacy of immunoglobulin replacement therapy in the long- term follow-up of the B-cell deficiencies (XLA, HIM, CVID). Turk J Pediatr. 2005;47:239-46.
5. Orange JS, Hossny EM, Weiler CR, Ballow M, Berger M, Bonilla FA, Buckley R, et al. Use of intravenous immunoglobulin in human disease: a review of evidence by members of the Primary Immunodeficiency Committee of the American Academy of Allergy, Asthma and Immunology. J Allergy Clin Immunol. 2006;117(Suppl 4):S525-53.
6. Costa-Carvalho BT, Solé D, Condino-Neta A, Rosário Filho N. I Consenso Brasileiro sobre o uso de Imunoglobulina Humana em pacientes com Imunodeficiência Primárias. Sociedade Brasileira de Alergia e Imunopatologia. Rev Bras Alerg Imunol. 2010;33(3):104-16.
7. Shehata N, Palda V, Bowen T, Haddad E, Issekutz TB, Mazer B, et al. The use of immunoglobulin therapy for patients with primary immune deficiency: an evidence-based practice guideline. Transfus Med Rev. 2010;24(Suppl 1):S28-S50.
8. Ballow M. Intravenous immunoglobulins: clinical experience and viral safety. J Am Pharm Assoc (Wash). 2002;42:449-58;quiz 58-9.
9. Fasano MB. Risks and benefits of intravenous immunoglobulin treatment in children. Curr Opin Pediatr. 1995;7:688-94.
10. Siegel J. The product: All intravenous immunoglobulins are not equivalent. Pharmacotherapy. 2005;25(11 Pt 2):78S-84S.
11. Brennan VM, Salomé-Bentl, Chapel HM. Immunology Nurses Study. Prospective audit of adverse reactions occurring in 459 primary antibody-deficient patients receiving intravenous immunoglobulin. Clin Exp Immunol. 2003;133:247-51.
12. Pierce LR, Jain N. Risks associated with the use of intravenous immunoglobulin. Transfusion Med Rev. 2003;17:241-54.
13. http://www.fda.gov/cber/ltr/ igiv101603.htm. Acessado em abril/2010.
14. Primary immunodeficiency diseases. Report of a WHO scientific group. Clin Exp Immunol. 1997;109(Suppl 1):1-28.
15. Skull S, Kemp A. Treatment of hypogammaglobulinaemia with intravenous immunoglobulin, 1973-93. Arch Dis Child. 1996;74:527-30.
16. Brennan VM, Cochrane S, Fletcher C, Hendy D, Powell P. Surveillance of adverse reactions in patients self-infusing intravenous immunoglobulin at home. J Clin Immunol. 1995;15:116-9.
17. Roifman CM, Levison H, Gelfand EW. High-dose versus low-dose intravenous immunoglobulin in hypogammablobulinaemia and chronic lung disease. Lancet. 1987;1:1075-7.
18. Berger M, Pinciaro PJ, Flebogamma 5% Investigators. Safety, efficacy and pharmacokinetics of Flebogamma 5% for replacement therapy in primary immunodeficiency diseases. J Clin Immunol. 2004;24:389-96.
19. Pautard B, Hachulla E, Bagot d'Arc M, Chantreuil L. [Intravenous immunoglobulin (Endobulin) clinical tolerance: prospective therapeutic follow-up of 142 adults and children]. Rev Med Interne. 2003;24:505-13.
20. Berger M. Principles of and Advances in Immunoglobulin Replacement Therapy for Primary Immunodeficiency. Immunol Allergy Clin North Am. 2008;28:413-37.
21. IDF. Immune Deficiency Foundation patient survey. Disponível em: http://www.primaryimmune.org; 2002
22. Gelfand EW, Winkelstein J. Are all IGEVs the same? J Allergy Clin Immunol. 2002;110:938.
23. Ameratunga R, Sinclair J, Kolbe J. Increased risk of adverse events when changing intravenous immunoglobulin preparations. Clin Exp Immunol. 2004;136:111-3.
Este trabalho foi agraciado com o Prêmio Antônio Oliveira Lima 2012.