Número Atual: Novembro-Dezembro 2013 - Volume 1 - Número 6
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Diagnóstico das reações imediatas aos meios de contraste iodados: revisão da literatura
Diagnosis of immediate reactions to iodinated contrast media: a review
Mara M. R. Felix1; Maria Fernanda Malaman2; Luis Felipe C. Ensina3,4
DOI: 10.5935/2318-5015.20130045
1. MD, MSc. Hospital Federal dos Servidores do Estado, Rio de Janeiro, RJ
2. MD, PhD. Faculdade de Medicina da Universidade Tiradentes, Aracaju, SE
3. MD, MSc. Escola Paulista de Medicina, Universidade Federal de Sao Paulo, Sao Paulo, SP
4. MD, MSc. Faculdade de Medicina da Universidade de Santo Amaro (UNISA), Sao Paulo, SP
Endereço para correspondência:
Mara M. R. Felix
E-mail: maramorelo@gmail.com
Submetido em 11/10/2013.
Aceito em 27/09/2014.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
As reaçoes adversas aos meios de contraste sao comuns e incluem as reaçoes de hipersensibilidade alérgicas e nao-alérgicas. As reaçoes de hipersensibilidade sao denominadas imediatas quando ocorrem em até 1h após a administraçao do contraste, e têm se tornado menos frequentes com o uso de compostos nao-iônicos. Além do tipo de contraste, a história de reaçao prévia é um fator de risco importante para recorrência destas reaçoes. As principais manifestaçoes clínicas sao cutâneas, como urticária e/ou angioedema, porém quadros graves de anafilaxia também podem ocorrer. O diagnóstico correto, através da história e testes cutâneos, pode auxiliar na prevençao de novas reaçoes. Além disso, a identificaçao do paciente sob risco, e a minimizaçao deste risco através da utilizaçao de outros métodos radiológicos ou do uso de contrastes alternativos, pode ser útil na reduçao da incidência destas reaçoes. Outra medida profilática que pode ter impacto positivo é a utilizaçao das pré-medicaçoes. O objetivo deste artigo foi fornecer uma revisao atualizada da abordagem às reaçoes de hipersensibilidade imediatas aos meios de contraste iodados, através da busca de artigos originais, revisoes e consensos indexados nas bases bibliográficas LILACS e MEDLINE.
Descritores: Hipersensibilidade imediata, meios de contraste, testes cutâneos.
INTRODUÇÃO
Os meios de contraste são compostos utilizados para dar melhor definição de imagem nos distintos métodos de diagnóstico radiológicos e incluem o sulfato de bário, a fluoresceína, o gadolíneo e os meios de contraste iodados (MCI)1. Os MCI foram introduzidos na prática clínica em 1950 e desde então têm sido amplamente empregados, principalmente depois do advento da tomografia computadorizada. Estima-se que aproximadamente 75 milhões de doses de MCI são aplicadas por ano no mundo inteiro2.
Existem quatro tipos de MCI comercialmente disponíveis. Os compostos podem ter um anel de benzeno tri-iodado (monômeros) ou dois anéis de benzeno ligados por um grupo funcional orgânico (dímeros). Além disso, a tendência iônica é determinada pela presença ou não de um grupo funcional carboxilato (-COO-), diferenciando-os em iônicos e não-iônicos, respectivamente. As propriedades e exemplos de cada uma destas quatro classes estão descritas na Figura 13.
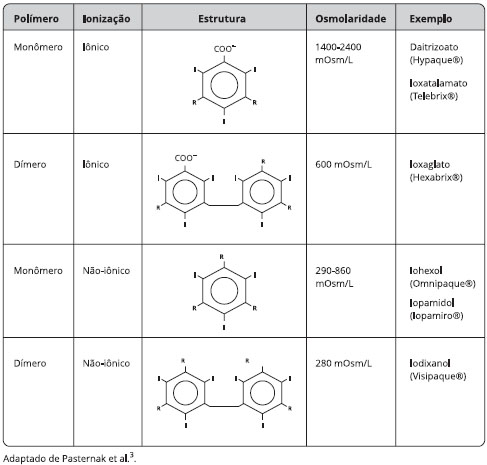
Figura 1 - Propriedades e exemplos das 4 classes de meios de contraste iodados
Os grupos de MCI têm diferentes perfis de toxicidade que variam de acordo com suas características. Os compostos iônicos tendem a alterar o potencial elétrico das membranas celulares, o que aumenta sua toxicidade. Além disso, os monômeros iônicos têm menor habilidade de atenuar os raios X, portanto são administrados em altas concentrações que são hiperosmolares (aproximadamente 1500-2000 mOsm/L) em relação ao sangue (280-290 mOsm/L). Os agentes de baixa osmolaridade incluem os dímeros iônicos e os monômeros não-iônicos com osmolaridades entre 290 e 860 mOsm/L. Os dímeros não-iônicos são isosmolares em comparação ao sangue (290 mOsm/L)3.
As reações adversas aos MCI são comuns e podem ser divididas em três diferentes tipos, descritos na Figura 2: (1) reações tóxicas; (2) eventos não relacionados; e (3) reações de hipersensibilidade alérgicas e não-alérgicas. As reações de hipersensibilidade podem ser subdivididas em: imediatas, quando ocorrem em até 1h após a administração do MCI; e não-imediatas, que aparecem após 1h4.
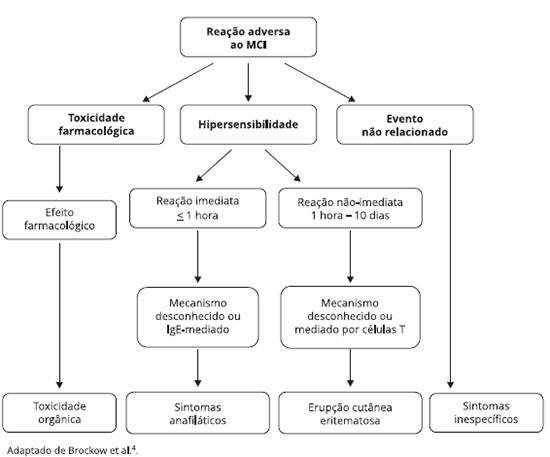
Figura 2 - Classificaçao das reaçoes adversas aos meios de contraste iodados
As reações de hipersensibilidade imediatas tornaram-se menos frequentes com o uso de compostos não-iônicos. Entretanto, o número de procedimentos que utilizam contrastes iodados é cada vez maior. Considerando a importância deste tema para o radiologista, o alergista e o clínico geral, descrevemos uma revisão atualizada da abordagem às reações de hipersensibilidade imediatas aos MCI.
EPIDEMIOLOGIA
A frequência das reações imediatas varia de acordo com o tipo de MCI usado. Alguns estudos mostraram que as reações imediatas leves ocorrem em 3,8 a 12,7% dos pacientes que recebem injeções intravenosas de MCI monoméricos iônicos, e em 0,7 a 3,1% dos pacientes que recebem compostos não-iônicos5,6. A prevalência das reações imediatas graves também é maior com o uso de MCI iônicos (0,1 a 0,4%) comparada com a dos não-iônicos (0,02 a 0,04%)5-7. Entretanto, a taxa de mortalidade não é diferente quando se analisam os dois tipos de produtos, sendo estimada em 1 em 100.000 procedimentos7.
O principal fator de risco para uma reação imediata ao MCI é a história de uma reação prévia1,4,8. Os pacientes que reagiram anteriormente têm risco de 21 a 60% de repetirem a reação quando reexpostos ao mesmo MCI ou similar5,9. Há uma redução de 10 vezes no risco de reações graves se os reatores prévios a um MCI iônico receberem um MCI não-iônico9.
Outros potenciais fatores de risco para reações imediatas mais graves incluem: doenças alérgicas (especialmente asma mal controlada), mastocitose, cardiopatias e/ou doenças metabólicas, tratamento com beta-bloqueador, doenças autoimunes, e infecções virais1,4. Em relação ao contraste, a dose, a via de administração (injeção intravenosa versus intra-arterial) e a velocidade da infusão também parecem influenciar o risco10.
Um estudo observacional realizado na Austrália com 29.962 pacientes submetidos a tomografia computadorizada com MCI não-iônico mostrou uma incidência de reações imediatas de 0,16%. Os fatores associados com maior risco de reações ao MCI foram: (1) sexo feminino; (2) idade < 55 anos; (3) pacientes externos; (4) certas estações do ano (primavera e outono)11.
Tem sido aventado que pacientes alérgicos a crustáceos e iodo teriam maior risco de reação ao MCI. Crustáceos contêm iodo; entretanto, o principal alérgeno destes alimentos é a tropomiosina, e não o iodo. Além disso, as reações ao MCI são desencadeadas pela molécula do contraste, e não pelo iodo. Entretanto, pacientes alérgicos a crustáceos podem apresentar doenças atópicas, e devem ser questionados a respeito de outras alergias, o que poderia predispor a uma reação de hipersensibilidade ao MCI12.
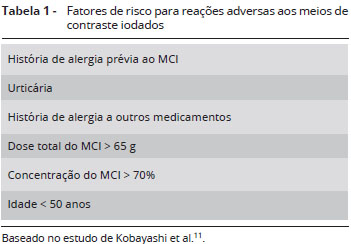
A Tabela 1 mostra um conjunto de fatores de risco que foram propostos após análise retrospectiva de pacientes que receberam MCI durante exames de tomografia computadorizada13.
FISIOPATOLOGIA
Existem vários mecanismos propostos de hipersensibilidade imediata aos MCI. Entre eles, destacam-se: (1) efeito direto na membrana relacionado à osmolaridade ou estrutura química da molécula do MCI; (2) ativação do sistema complemento; (3) formação direta de bradicinina; e (4) mecanismo IgE-mediado1.
Há aumento progressivo do número de evidências que sugerem que as reações de hipersensibilidade imediatas podem ser causadas por um mecanismo IgE-mediado em contraposição ao dogma de que todas as reações imediatas aos MCI são "pseudoalérgicas"1.
Recentemente, um estudo multicêntrico europeu avaliou 220 pacientes com reações imediatas e não-imediatas aos contrastes, objetivando determinar a especificidade e sensibilidade dos testes cutâneos com MCI. Foi observado que pelo menos 50% dos pacientes apresentaram testes positivos quando examinados em 2 a 6 meses após a reação, indicando que um mecanismo imunológico poderia estar envolvido nestes casos14.
Um argumento contra o mecanismo alérgico é o fato de que as reações aos MCI podem ocorrer numa primeira exposição, e a reação não ocorre em todas as exposições ao MCI1. De qualquer modo, isto poderia ser explicado por reatividade cruzada a outros antígenos15.
Os membros da Academia Americana de Alergia, Asma e Imunologia (AAAAI) que publicaram o Consenso Americano de Alergia a Medicamentos (US Practice Parameters) consideram que as reações imediatas aos MCI são de natureza não alérgica, e não incluem testes cutâneos no manejo destes pacientes16. Por outro lado, esta posição é diferente daquela defendida por pesquisadores europeus representados pelo ENDA (European Network for Drug Allergy). Alguns destes investigadores já relataram a presença de testes cutâneos positivos, além de IgE-específica para MCI e teste de ativação de basófilos positivo em pacientes que tiveram reações imediatas. Portanto, eles acreditam que o mecanismo IgE-mediado deve existir pelo menos em uma parcela dos pacientes1,17.
MANIFESTAÇÕES CLÍNICAS
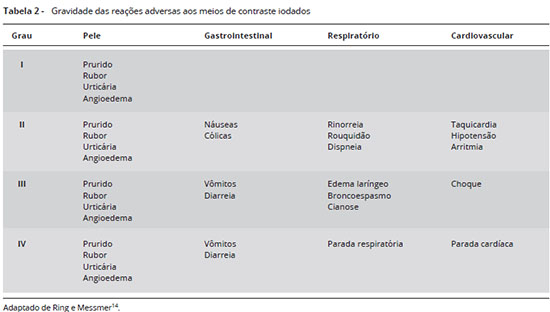
As reações de hipersensibilidade imediatas se apresentam principalmente com manifestações cutâneas. Ocorre prurido, e urticária com ou sem angioedema em 65 a 85% dos pacientes1,14. Outras manifestações incluem: sensação de calor, vômitos, diarreia, rinorreia, espirros, rouquidão e tosse. Pode haver reações mais graves como dispneia, broncoespasmo, hipotensão, taquicardia, arritmias, e até evolução para um quadro de choque anafilático, com parada cardiorrespiratória1,4. A maioria das reações fatais ao MCI são do tipo imediato anafilático4.
O início das reações imediatas é rápido, ocorrendo em até 5 minutos após a injeção do MCI em cerca de 70% dos casos14. As reações graves e fatais surgem dentro de 20 minutos após a infusão em 96% dos pacientes18.
Em relação aos sistemas de graduação de gravidade, um dos mais utilizados é o de Ring e Messmer, descrito na Tabela 219.
DIAGNÓSTICO
O diagnóstico das reações imediatas aos contrastes deve-se basear principalmente na história clínica. Nesta investigação, o questionário elaborado pelo ENDA auxilia na obtenção dos dados relativos às manifestações clínicas apresentadas pelo paciente20. Uma informação de muita importância é o intervalo entre a administração do MCI e o início dos sintomas. A partir daí, pode-se classificar a reação em imediata (< 1h) ou não-imediata (> 1h)4. Outros dados relevantes são: o MCI usado, dose e velocidade de infusão (se disponível); tipo de manifestação (urticária, angioedema, broncoespasmo, entre outras), gravidade (classificação de Ring e Messmer), relato de reação prévia aos MCI, história pessoal ou familiar de atopia, presença de comorbidades, uso de outros medicamentos, e o tratamento ao qual o paciente foi submetido devido à reação adversa.
Após a recuperação do paciente, o alergista pode realizar uma investigação mais específica através de exames complementares. Existem testes in vivo, que são os testes cutâneos de puntura e intradérmico de leitura imediata e o teste de provocação; e testes in vitro, que são a dosagem de IgE específica para MCI e o teste de ativação de basófilos1,4.
Como dito anteriormente, a AAAAI não recomenda a realização de testes cutâneos para esclarecimento diagnóstico de pacientes que tiveram reações de hipersensibilidade imediata aos MCI16. Entretanto, o ENDA encoraja a realização dos testes cutâneos e a realização de novos estudos para verificar se os resultados encontrados pelo grupo são replicados em outros países e populações17.
As concentrações recomendadas para os testes cutâneos estão descritas na Tabela 31,21. Estas concentrações não são irritantes e os testes possuem especificidade alta (> 95%)21. Os estudos realizados na Europa mostraram valores de sensibilidade que variam de 4,2 a 50% (quando realizados entre 2 e 6 meses após a reação) e especificidade entre 96 a 100%14,22-24. Dewatcher e colaboradores relataram um valor de sensibilidade mais alto (73%)25. Entretanto, neste trabalho, os testes intradérmicos foram realizados com MCI não diluído, o que pode ter desencadeado reações irritativas não específicas25.

O ideal é testar um painel de diferentes MCI, pois existe uma grande reatividade cruzada entre eles1,14,21. Inicialmente, o paciente deve ser submetido ao teste de puntura, com leitura após 15-20 minutos. Se o tamanho da pápula for > 3 mm, o teste é considerado positivo. Caso o teste de puntura seja negativo, o paciente é submetido ao teste intradérmico, com leitura após 15-20 minutos. Se houver aumento do tamanho da pápula inicial > 3 mm, ele é considerado positivo. O teste intradérmico é mais sensível que o teste de puntura, porém tem maior risco e por isso, deve ser realizado após o teste de puntura1,14,21.
Em relação aos exames in vitro, a dosagem de IgE-específica para MCI ainda não está comercialmente disponível, e os testes de ativação de basófilos (BAT) são realizados somente em pesquisas científicas1. O BAT consiste na quantificação de marcadores de ativação (CD63 ou CD203c) na superfície do basófilo através da citometria de fluxo26. Alguns estudos pesquisaram a utilidade do BAT no diagnóstico da reação de hipersensibilidade imediata ao MCI, e encontraram valores de sensibilidade de 46,2 até 62,5%, e especificidade de 76,7 a 100%27-29. Estes resultados sugerem que o BAT poderá ser útil como exame complementar, combinado aos resultados dos testes cutâneos, com o objetivo de definir uma alternativa segura para o teste de provocação26.
O teste de provocação (TP) é a última etapa da investigação diagnóstica. A principal indicação deste teste ainda controverso seria encontrar um MCI seguro em pacientes com testes cutâneos positivos29-31. Há alguns protocolos com administração dos MCI por via intravenosa. O protocolo usado por Prieto-García e colaboradores foi realizado com aumentos progressivos de doses em intervalos de 30 minutos: 1º dia (1, 5, 30 e 60 mL) e 2º dia (120 mL), considerando que o volume total de MCI para uma tomografia computadorizada em adultos seria de 120 mL31. Outro protocolo descrito é o de Salas e colaboradores, que utilizaram 4 doses (5, 15, 30 e 50 mL) em intervalos de 45 minutos (dose cumulativa de 100 mL)29. Neste estudo, os pacientes com história de reação imediata a MCI foram submetidos a testes cutâneos, BAT e TP com MCI. No grupo de pacientes com testes cutâneos positivos, 40% apresentaram TP positivos com MCI alternativos, mostrando o papel do TP no diagnóstico destas reações29. É importante ressaltar que o TP é um procedimento de risco e pode desencadear reações graves mesmo com aplicações intravenosas de volumes pequenos de MCI (0,5 a 1 mL)1. Por isso, deve ser realizado somente em locais com pessoal treinado e material de suporte adequado para reversão de uma eventual reação anafilática30,31.
TRATAMENTO
O tratamento da reação adversa depende do tipo de manifestação clínica. As reações graves são mais raras, entretanto a monitorização do paciente e o reconhecimento precoce das reações é fundamental para o sucesso do tratamento. Deve-se sempre valorizar a queixa do paciente e examiná-lo para ser capaz de tomar a conduta mais adequada32.
Existem erros comuns no manejo dos pacientes com reações imediatas. Entre eles, podem ser destacados: (1) retardo no início do tratamento; (2) atraso na administração da adrenalina em casos de anafilaxia; (3) confiança exagerada por parte dos profissionais que administram pré-medicação; entre outros33.
Caso o paciente apresente apenas sinais e sintomas cutâneos, como prurido, urticária e angioedema, os anti-histamínicos anti-H1 associados ou não aos corticoides podem ser úteis no controle do quadro34.
Por outro lado, se o paciente tiver anafilaxia, devese considerar que esta é uma reação alérgica grave e que pode levar à morte34. Iniciam-se medidas para manutenção da via aérea, respiração e circulação (ABC) e aplica-se adrenalina, que é a medicação de primeira escolha para tratamento da anafilaxia. Esta deve ser feita por via intramuscular na concentração de 1:1000, na dose de 0,01 mL/kg, até o máximo de 0,3 mL em crianças e 0,3 a 0,5 mL em adultos35.
Outros medicamentos podem auxiliar no manejo da anafilaxia. Os anti-histamínicos anti-H1 são importantes quando estão presentes urticária, angioedema, obstrução de vias aéreas superiores e hipersecreção brônquica. Os corticosteroides agem dentro de 4 a 6 horas, e atuam na fase tardia da anafilaxia, inibindo a progressão da urticária e angioedema. Em situação de dificuldade respiratória, oferecer oxigenoterapia e, se houver sibilância, fazer nebulização com beta-agonista. Caso o paciente apresente hipotensão, deve-se colocá-lo em posição deitada com as pernas elevadas e administrar fluidos intravenosos35.
A instituição de um tratamento rápido e adequado é o mais importante diante de um quadro de anafilaxia. Portanto, toda sala de radiologia onde são realizados procedimentos com MCI deve estar preparada com material e pessoal treinado para reversão de uma eventual reação anafilática10.
PREVENÇÃO
A prevenção das reações de hipersensibilidade imediata aos MCI requer, inicialmente, a identificação dos pacientes sob risco10,12. De qualquer forma, é importante lembrar que uma reação pode ocorrer mesmo numa primeira exposição ao contraste12.
O principal fator de risco é a história prévia de uma reação do tipo imediata1. O método mais eficaz de prevenção nestes casos é não reexpor o paciente a um MCI e considerar a possibilidade da realização de outros exames, como a ultrassonografia ou a ressonância nuclear magnética. Caso não seja possível mudar o tipo de método radiológico a ser utilizado, procura-se um MCI diferente do implicado na reação prévia e com menor toxicidade, por exemplo, um contraste não-iônico10,12. Neste contexto, a investigação com testes cutâneos pode auxiliar na escolha de um contraste alternativo14.
Outra medida amplamente difundida em pacientes de risco é o uso das pré-medicações. Os dois regimes de pré-medicação mais utilizados nos EUA são: (1) prednisona 50 mg via oral (VO) 13h, 7h e 1h antes da injeção do MCI e difenidramina 50 mg intravenoso (IV), intramuscular (IM) ou VO 1h antes; ou (2) metilprednisolona 32 mg VO 12h e 2h antes da injeção do MCI (um antihistamínico pode ser adicionado a este esquema)12,36. Se o paciente não puder ingerir medicação VO, a hidrocortisona (200 mg) IV pode substituir a prednisona36. No Brasil, o esquema mais difundido é: prednisona 50 mg VO 13h, 7h e 1h antes da injeção do CI e a prometazina ou difenidramina 50 mg via parenteral 1h antes37.
Caso o paciente não tenha tido tempo hábil para realizar o preparo, o esquema preconizado é metilprednisolona 40 mg ou hidrocortisona 200 mg IV a cada 4h até que o estudo seja realizado, e difenidramina ou prometazina 50 mg IV 1h antes36,37.
Como há bastante controvérsia sobre o uso e a eficácia da pré-medicação na prevenção das reações graves aos MCI, foram realizadas duas revisões sistemáticas com alguns ensaios clínicos que avaliaram este tema38,39. Ambas apontaram limitações como: (1) heterogeneidade no que diz respeito à população, tipos de contrastes, esquemas de pré-medicação e sintomas clínicos analisados; (2) utilização de contrastes hiperosmolares que estão em desuso hoje em dia; e (3) exclusão de pacientes com história prévia de reação, que seriam os de maior risco. Tendo em vista estes aspectos, as revisões mostraram efeito protetor dos corticosteroides e da associação de anti-histamínicos anti-H1 e anti-H2 na prevenção das reações graves. O efeito do corticoide foi observado quando administrado em duas doses, pelo menos 6h e 2h antes da injeção do contraste. As conclusões foram: (1) existem poucos estudos que justificam o uso de anti-H1 e corticoide para prevenção de reações anafiláticas; e (2) há necessidade de novas pesquisas sobre a população mais adequada para receber esta profilaxia e qual seria a combinação ótima de medicações38,39.
A avaliação da necessidade da pré-medicação é feita para cada paciente em particular. Existem argumentos contra e a favor da pré-medicação, exemplificados na Tabela 410. Entretanto, a melhor estratégia para a prevenção é individualizar a abordagem, de modo que os pacientes de maior risco tenham possibilidade de realizar o procedimento radiológico de forma mais segura. Por outro lado, aqueles que não têm indicação de pré-medicação, não devem recebê-la apenas para reduzir a ansiedade do médico assistente.
CONCLUSÕES
As reações adversas aos MCI são comuns. Entretanto, as reações de hipersensibilidade imediatas aos MCI são cada vez menos frequentes, principalmente após a disseminação do uso dos compostos não-iônicos.
Em relação ao diagnóstico das reações de hipersensibilidade imediata, são necessários estudos multicêntricos com utilização de protocolos sistemáticos objetivando: (1) padronização dos testes cutâneos; (2) avaliação da sensibilidade, especificidade e valores preditivos; e (3) reprodução dos resultados em diferentes centros. Apesar destas limitações, em centros especializados, o ENDA recomenda a utilização de testes cutâneos em concentrações não irritantes para investigação de indivíduos com história clínica sugestiva de reações aos MCI.
A melhor forma de tratar uma reação adversa é prevenir sua ocorrência. A identificação do paciente sob risco e a minimização deste risco através da utilização de outros métodos radiológicos ou do uso de contrastes alternativos pode ser útil na redução da incidência das reações de hipersensibilidade. Outra medida preventiva que pode ter impacto positivo é a utilização das pré-medicações, sempre se analisando o custo versus benefício individualmente. De todo modo, o melhor conhecimento dos mecanismos patogênicos envolvidos e o estudo dos pacientes com história de reações irá auxiliar na prevenção destas reações no futuro. Por último, é importante ressaltar que o reconhecimento precoce das manifestações clínicas de hipersensibilidade e o manejo rápido e adequado das reações adversas são medidas que modificam o prognóstico do paciente e podem salvar vidas quando se trata de reações anafiláticas.
REFERENCIAS
1. Brockow K. Immediate and delayed reactions to radiocontrast media: Is there an allergic mechanism? Immunol Allergy Clin N Am. 2009;29:453-68.
2. Christiansen C. X-ray contrast media: an overview. Toxicology. 2005;209(2):185-7.
3. Pasternak JJ, Williamson EE. Clinical pharmacology, uses, and adverse reactions of iodinated contrast agents: a primer for the non-radiologist. Mayo Clin Proc. 2012;87(4):390-402.
4. Brockow K, Christiansen C, Kanny G, et al. Management of hypersensitivity reactions to iodinated contrast media. Allergy. 2005;60:150-8.
5. Katayama H, Yamaguchi K, Kozuka T, et al. Adverse reactions to ionic and nonionic contrast media. A report from the Japanese Committee on the Safety of Contrast Media. Radiology. 1990;175:621-8.
6. Wolf GL, Arenson RL, Cross AP. A prospective trial of ionic vs nonionic contrast agents in routine clinical practice: Comparison of adverse effects. Am J Roentgenol. 1989;152:939-44.
7. Caro JJ, Trindade E, McGregor M. The risks of death and of severe nonfatal reactions with high- VS low-osmolality contrast media: a meta-analysis. Am J Roentgenol. 1991;156:825-32.
8. Greenberger PA. Drug Allergy: Part B. Allergic reactions to individual drugs: low molecular weight. In: Patterson's Allergic Diseases. 7th Ed. Lippincott Williams & Wilkins; 2009. p. 276-303.
9. Wolf GL, Mishkin MM, Roux SG, et al. Comparison of the rates of adverse drug reactions. Ionic contrast agents, ionic agents combined with steroids, and nonionic agents. Invest Radiol. 1991;26:404-10.
10. Liccardi G, Lobefalo G, Di Florio E, et al. Strategies for the prevention of asthmatic, anaphylatic and anaphylactoid reactions during the administration of anesthetics and/or contrast media. J Investig Allergol Clin Immunol. 2008;18(1):1-11.
11. Ho J, Kingston RJ, Young N, et al. Immediate hypersensitivity reactions to IV non-ionic iodinated contrast in computed tomography. Asia Pac Allergy. 2012;2:242-7.
12. Schopp JG, Iyer RS, Wang CL, et al. Allergic reactions to iodinated contrast media: premedication considerations for patients at risk. Emerg Radiol. 2013;20:299-306.
13. Kobayashi D, Takahashi O, Ueda T, et al. Risk factors for adverse reactions from contrast agents for computed tomography. BMC Medical Informatics and Decision Making. 2013;13:18.
14. Brockow K, Romano A, Aberer W, et al. Skin testing in patients with hypersensitivity reactions to iodinated contrast media: a European multicenter study. Allergy. 2009;64:234-41.
15. Schnyder B, Pichler WJ. Mechanisms of drug-induced allergy. Mayo Clin Proc. 2009;84(3):268-72.
16. Joint Task Force on Practice Parameters; American Academy of Allergy, Asthma and Immunology; Joint Council of Allergy, Asthma and Immunology. Drug allergy: an updated practice parameter. Ann Allergy Asthma Immunol. 2010;105:259-73.
17. Demoly P, Adkinson NF, Brockow K, et al. International Consensus on drug allergy. Allergy. 2014;69:420-37.
18. Idee JM, Pines E, Prigent P, et al. Allergy-like reactions to iodinated contrast agents: a critical analysis. Fundam Clin Pharmacol. 2005;19:263-81.
19. Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet. 1977;1:466-9.
20. Demoly P, Kropf R, Bircher A, Pichler WJ. Drug hypersensitivity: questionnaire. Allergy. 1999;54:999-1003.
21. Brockow K, Garvey LH, Aberer W, et al. Skin test concentrations for systemically administered drugs - an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013;68:702-12.
22. Brockow K, Ring J. Anaphylaxis to radiographic contrast media. Curr Opin Allergy Clin Immunol. 2011;11:326-31.
23. Trcka J, Schmidt C, Seitz CS, et al. Anaphylaxis to iodinated contrast material: nonallergic hypersensitivity or IgE-mediated allergy? AJR Am J Roentgenol. 2008;190(3):666-70.
24. Goksel O, Aydin O, Atasoy C, et al. Hypersensitivity reactions to contrast media: prevalence, risk factors and the role of skin tests in diagnosis - a cross-sectional survey. Int Arch Allergy Immunol. 2011;155(3):297-305.
25. Dewachter P, Laroche D, Mouton-Faivre C, et al. Immediate reactions following iodinated contrast media injection: a study of 38 cases. Eur J Radiol. 2011;77(3):495-501.
26. Hausmann OV, Gentinetta T, Bridts CH, Ebo DG. The basophil activation test in immediate-type drug allergy. Immunol Allergy Clin N Am. 2009;29:555-66.
27. Song WJ, Chang YS. Recent applications of basophil activation tests in the diagnosis of drug hypersensitivity. Asia Pac Allergy. 2013;3(4):266-80.
28. Pinnobphun P, Buranapraditkun S, Kampitak T, et al. The diagnostic value of basophil activation test in patients with an immediate hypersensitivity reaction to radiocontrast media. Ann Allergy Asthma Immunol. 2011;106:387-93.
29. Salas M, Gomez F, Fernandez TD, et al. Diagnosis of immediate hypersensitivity reactions to radiocontrast media. Allergy. 2013;68:1203-6.
30. Chiriac AM, Demoly P. Drug provocation tests: up-dated and novel approaches. Allergy Asthma Clin Immunol. 2013;9(1):12.
31. Pietro-García A, Tomás M, Pineda R, et al. Skin test-positive immediate hypersensitivity reaction to iodinated contrast media: the role of controlled challenge testing. J Investig Allergol Clin Immunol. 2013;23(3):183-9.
32. Iyer RS, Schopp JG, SwansonJO, et al. Safety essentials: acute reactions to iodinated contrast media. Can Assoc Radiol J. 2013;64:193-9.
33. Segal AJ, Bush WH Jr. Avoidable errors in dealing with anaphylactoid reactions to iodinated contrast media. Invest Radiol. 2011;46(3):147-51.
34. Sampson HA, Muñoz-Furlong A, Campbell RL, et al. Second symposium on the definition and management of anaphylaxis: summary report- Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol. 2006;117:391-7.
35. Simmons FER. Anaphylaxis: Recent advances in assessment and treatment. J Allergy Clin Immunol. 2009;124:625-36.
36. ACR Committee on Drugs and Contrast Media. ACR Manual on Contrast Media. Disponível em: www.acr.org. Acessado: 06/08/2013.
37. Ensina LF, Fernandes FR, Di Gesu G, Malaman MF, et al. Reações de hipersensibilidade a medicamentos - parte II. Rev Bras Alerg Imunopatol. 2009;32(3):74-83.
38. Tramèr MR, von Elm E, Loubeyere P, et al. Pharmacological prevention of serious anaphylactic reactions due to iodinated contrast media: systematic review. BMJ. 2006;1-6.
39. Delaney A, Carter A, Fisher M. The prevention of anaphylactoid reactions to iodinated radiological contrast media: a systematic review. BMC Medical Imaging. 2006,6:2.