Número Atual: Setembro-Outubro 2013 - Volume 1 - Número 5
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Vitamina D e dermatite atópica: o que há de novo?
Vitamin D and atopic dermatitis: what is new?
Renata Robl1; Vânia O. Carvalho2; Marjorie Uber1; Kerstin T. Abagge1; Rosana M. Pereira3
DOI: 10.5935/2318-5015.20130036
1. MD. Departamento de Pediatria - Unidade de Dermatologia Pediátrica, Hospital das Clínicas da Universidade Federal do Paraná (HC-UFPR)
2. MD, PhD. Departamento de Pediatria - Unidade de Dermatologia Pediátrica, Hospital das Clínicas da Universidade Federal do Paraná (HC-UFPR)
3. MD, PhD. Departamento de Pediatria - Unidade de Endocrinologia Pediátrica, HC-UFPR
Endereço para correspondência:
Renata Robl
E-mail: natarobl@hotmail.com
Submetido em 26/10/2013.
Aceito em 9/06/2014.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
Nao há consenso sobre quais sao os valores ideais da vitamina D em crianças saudáveis. Porém, níveis séricos altos ou baixos parecem ter influência na fisiopatologia das doenças alérgicas. Há dados na literatura atual que demonstram os potenciais efeitos da vitamina D em aumentar a atividade dos peptídeos antimicrobianos e suprimir a resposta inflamatória, apontando uma relaçao inversa entre os níveis de vitamina D e a gravidade da dermatite atópica. O objetivo do presente trabalho foi revisar artigos publicados sobre a relaçao entre níveis séricos de vitamina D e dermatite atópica, uma vez que a vitamina D tem sido implicada em várias açoes imunomoduladoras e alguns estudos têm descrito sua influência na gravidade da dermatite atópica, porém com resultados conflitantes. Este estudo baseou-se em revisao de artigos originais, artigos de revisao e consensos publicados nos últimos 10 anos, obtidos a partir da pesquisa dos termos "vitamin D" e "atopic dermatitis", nos bancos de dados online. Concluímos que a suplementaçao da vitamina D pode trazer benefícios no tratamento da dermatite atópica. No entanto, mais pesquisas sao necessárias para determinar se existe alguma relaçao entre os níveis de vitamina D e a gravidade da dermatite atópica.
Descritores: Dermatite atópica, atopia, vitamina D.
INTRODUÇAO
Muitos estudos têm avaliado os níveis de vitamina D (VD) com o objetivo de determinar sua influência nos mecanismos imunológicos, incluindo os mecanismos envolvidos em doenças alérgicas1. Dados de estudos clínicos e epidemiológicos demonstram uma relaçao entre alergia e VD, entretanto alguns resultados sao conflitantes2-4. Pesquisas sobre a suplementaçao de VD em pacientes com doenças alérgicas sao necessárias e podem ajudar a compreender essas doenças. O presente estudo se propoe a revisar artigos originais, artigos de revisao e consensos obtidos a partir da pesquisa com os termos vitamin D e atopic dermatitis, nos bancos de dados online publicados nos últimos 10 anos, em inglês ou português. Especificamente, esta revisao tem por objetivo avaliar os estudos que determinaram a relaçao entre níveis séricos de VD e dermatite atópica (DA).
FONTES DE DADOS
Foram utilizados os bancos de pesquisa de dados MEDLINEr, SciELOr, COCHRANEr e PUBMEDr, tendo sido encontrados 103 artigos publicados, em acesso realizado em 28/05/2013.
Foram incluídos os estudos em que foi realizada a dosagem de vitamina D em pacientes com DA e que continham amostra maior do que 10 casos, aqueles que avaliaram gravidade da doença e reposiçao de vitamina D, assim como as revisoes sobre o tema e consensos, sendo excluídos os relatos de casos. Foram selecionados 17 artigos de revisao, 20 estudos originais e 2 metanálises.
A VITAMINA D E SUAS DIFERENTES AÇOES NO ORGANISMO
A VD é uma vitamina lipossolúvel, que atua como um hormônio esteroide, cujos receptores (VDR) estao distribuídos por diversos tecidos do organismo. Assim, a VD controla o metabolismo do cálcio e fósforo, está envolvida na funçao neuromuscular, na inflamaçao, e também influencia a açao de muitos genes que regulam a proliferaçao, diferenciaçao e apoptose celular5.
O organismo humano produz os precursores de VD. Na pele, a exposiçao aos raios UVB (290-315 nm) determina a conversao da 7-dehidrocolesterol (pró-vitamina D3), presente na membrana plasmática das células epiteliais, em pré-colecalciferol (pré-vitamina D3). Esta, devido à sua natureza instável, isomeriza espontaneamente a colecalciferol (vitamina D3).
Este processo é responsável por 90% dos níveis séri-cos de VD. Os 10% restantes sao provenientes da dieta, através de alimentos naturais, alimentos fortificados por suplementaçao ou compostos vitamínicos com vitamina D3 (colecalciferol) e vitamina D2 (ergocalciferol). Uma vez sintetizada ou ingerida, a vitamina D3 sofrerá duas hidroxilaçoes sucessivas, a primeira no fígado, pela 25-hidroxilase, originando a 25-OH vitamina D3 (ou calcidiol), e posteriormente nos rins, por açao da 1α-hidroxilase, originando por fim a forma ativa da vitamina D: 1,25 OH vitamina D3, ou calcitriol. A Figura 1 ilustra a produçao de vitamina D. Sua açao efetiva ocorre pela interaçao com seu receptor intranuclear (VDR), formando um heterodímero que, ao ligar-se ao elemento responsivo à Vitamina D (VDRE), promove a transcriçao de elementos que serao responsáveis pelos efeitos celulares, como transporte de cálcio, controle do metabolismo ósseo, regulaçao da proliferaçao e diferenciaçao celular.
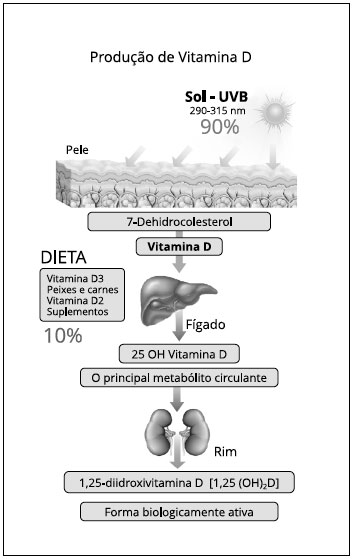
Figura 1 - Produçao de vitamina D
A exposiçao solar necessária para manter a suficiên-cia de VD é pequena; mesmo assim, níveis séricos baixos sao encontrados em grandes proporçoes da populaçao. A deficiência de vitamina D é comum em crianças e adul-tos e é estimado que um bilhao de pessoas no mundo tenha deficiência ou insuficiência de VD6.
Quando se avaliam os níveis séricos de VD, os consensos têm considerado níveis inferiores a 20 ng/mL como deficiência, níveis entre 21 e 29 ng/mL como insuficiência, e níveis superiores a 150 ng/ml como a intoxicaçao6. Estes parâmetros foram em sua maioria delineados para a prevençao da doença óssea6. A American Academy of Pediatrics e a Endocrine Society consideram como ponto de corte para a deficiência concentraçoes de VD de 20 ng/mL, e insuficiência entre 21 a 29 ng/ml7. Recomenda-se que os níveis séricos sejam mantidos no intervalo de suficiência, pois valores acima ou abaixo dos considerados normais podem determinar consequências clínicas1.
Considera-se adequada a exposiçao solar de braços e pernas, duas vezes por semana, no período entre as 10 e 15 horas para produzir níveis ótimos da vitamina. O tempo da exposiçao depende do fototipo, mas geralmente a duraçao ideal é de 5 a 30 minutos. Tal exposiçao pode produzir VD suficiente para armazenamento na gordura para uso no período de inverno6.
Alguns fatores podem influenciar a capacidade de síntese de vitamina D determinada pela exposiçao solar, como período do ano (menor síntese no inverno), latitude geográfica, horário do dia, cobertura corpórea, fumaça/poluiçao, conteúdo de melanina e uso de proteçao solar6.
O uso de protetor solar tem impacto sobre a síntese cutânea da VD, diminuindo intensamente a sua produçao cutânea. Com fator de proteçao solar (FPS) 8, esta reduçao é de 92,5%, enquanto com FPS 15 pode chegar a 99%6. O uso do protetor solar diário é amplamente recomendado por diversas especialidades médicas (dermatologistas, oncologistas, pediatras), pois é a única forma de prevençao primária do câncer de pele e do fotoenvelhecimento8-10.
Entretanto, há grande controvérsia no quanto a exposiçao solar sem protetor por curtos períodos de tempo (como a necessária para a síntese de VD) poderia suscitar o aparecimento de câncer de pele11,12. Devido aos diversos hábitos de vida, diferentes posiçoes geográficas e climáticas, a exposiçao solar nao é uniforme em toda a populaçao. E mesmo as pessoas que vivem em áreas mais ensolaradas - como próximo ao Equador - podem ter níveis da vitamina inadequados, por isso, há uma dificuldade em se estabelecer a quanti-dade dietética diária para complementar a produçao endógena da VD.
Para manter níveis de VD entre 30-60 ng/ml, o que seria um nível ótimo, é necessária a dose diária de 400 UI para crianças de até um ano de idade, 600 UI para indivíduos entre um e 70 anos, e 800 UI para aqueles acima de 70 anos1. No entanto, a maioria dos especia-listas orienta que sem uma adequada exposiçao solar, crianças e adultos requerem aproximadamente 800 a 1000 UI por dia. Por isso, crianças com deficiência deveriam ser tratadas agressivamente. Um método eficaz de suplementaçao vitamínica é dar aos pacientes uma cápsula de 50.000 UI de vitamina D2 uma vez por semana, durante 8 semanas, seguido de 50.000 UI de vitamina D2 cada 2 a 4 semanas. Alternativamente, pode-se oferecer 1000 UI de vitamina D3 por dia ou 3000 UI de vitamina D2 por dia6.
A intoxicaçao por VD é extremamente rara, mas pode ser causada pela ingestao acidental ou intencional de doses elevadas. Doses superiores a 50.000 UI por dia ou níveis de VD maiores do que 150 ng/mL estao associadas a hipercalcemia e hiperfosfatemia6.
Em um estudo realizado em Boston com 307 ado-lescentes saudáveis13 e em outro estudo realizado por Sullivan com 23 meninas pré-adolescentes brancas14, os níveis de VD foram abaixo de 20 ng/ml em 42% e 48%, respectivamente, níveis estes considerados insuficientes.
Ao determinar os níveis de vitamina D, Peroni et al. avaliaram 37 pacientes pediátricos portadores de dermatite atópica e encontraram níveis insuficientes de VD em 40%, e níveis deficientes em 21%2. Chiu et al. mostraram que a deficiência de VD ocorreu em 39% das 94 crianças avaliadas, 35% tinham níveis insuficientes da vitamina e em apenas 26% os níveis eram suficientes7. Qual seria a influencia dos níveis de vitamina D na dermatite atópica?
DERMATITE ATOPICA E VITAMINA D
É conhecido o papel da vitamina D no metabolismo do cálcio e fósforo, uma vez que a interaçao da 1,25-dihidroxi-vitamina D com seu receptor aumenta a absorçao intestinal de cálcio em 30-40%, e a de fósforo em até 80%6. Recentemente, além deste papel na homeostase do cálcio, a VD tem sido reconhecida por seu efeito na imunomodulaçao15.
A relaçao entre a VD e a DA está na produçao e funcionamento das catelicidinas1. Peptídeos antimicrobianos relacionados à catelicidina sao uma família de polipeptídeos encontrados nos lisossomos de macrófagos e leucócitos polimorfonucleares (PMN).
As catelicidinas têm capacidade antimicrobiana e sao importantes para a defesa do hospedeiro contra infecçoes da pele por agentes virais e bacterianos, como o Staphylococcus aureus. Elas aumentam a migraçao celular e a secreçao de citocinas e de outras moléculas sinalizadoras das células imunológicas ativadas16,17. Acredita-se que a VD aumente a síntese de catelicidinas, levando ao melhor controle dos sintomas na DA. A VD aumenta a expressao gênica da catelicidina, que exibe uma atividade microbicida de amplo espectro contra bactérias, fungos e vírus18,19.
Níveis baixos de catelicidinas sao expressos nos queratinócitos normais. Porém, durante a inflamaçao a sua produçao pode aumentar devido à liberaçao por neutrófilos e mastócitos20. Alguns estudos têm demonstrado a influência da VD sobre a produçao de catelicidinas pelos queratinócitos21,22. Além disso, a radiaçao UVB induz a expressao de peptídeos antimicrobianos nos queratinócitos humanos in vivo23.
A VD tem açao inibitória sobre o sistema imune adaptativo. A 1,25 (OH)2D3 inibe a interleucina promotora de crescimento (IL-2), que é produzida pelos linfócitos T humanos24. Além de diminuir a proliferaçao de linfócitos, reduz a produçao de interferon gama, IL-5 e aumenta a produçao de IL-425. No entanto, também já foi descrito o efeito inibidor de 1,25 (OH)2D3 na produçao de IL-4 e no desenvolvimento de células Th226. Estes resultados contraditórios podem ter relaçao com diferentes respostas em funçao do receptor de vitamina D. As células T têm receptores que sao alvos diretos da 1,25 (OH)2D3 in vitro, resultando na diferenciaçao das células T CD4. A açao biológica da 1,25 (OH)2D3 é mediada pelo receptor da vitamina D (VDR), que está relacionado com a expressao da proteína do VDR que pode ser autorregulada em uma determinada célula e ainda difere em células ativadas e nao ativadas27. Estes eventos imunes ocorrem nas fases aguda e crônica da DA e podem ser influenciados pelos dos níveis de Vitamina D.
Além dos efeitos sobre o sistema imunológico, reduçao da inflamaçao e a prevençao de infecçoes, há indícios de que a VD possa diminuir a resistência aos esteroides28. Desta maneira, há dados que demonstram os potenciais efeitos da VD em aumentar a atividade dos peptídeos antimicrobianos e suprimir a resposta inflamatória. Portanto, a sua suplementaçao pode trazer benefícios no tratamento da DA.
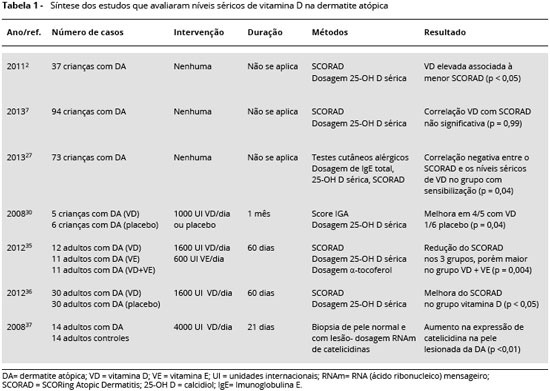
Alguns autores demonstraram que a deficiência de VD pode estar associada com a gravidade da DA15,29-32. Na avaliaçao dos níveis séricos de VD em indivíduos com DA, havia maior intensidade de sintomas (medidos pelo SCORAD - Score em DA que avalia extensao, gravidade da doença e sintomas subjetivos) nos pacientes com menores concentraçoes da vitamina D2. Em um estudo com 73 crianças, os níveis de VD de participantes com DA moderada e grave foram significativamente menores do que aqueles com doença leve (p = 0,01)29.
Isto está de acordo com dados epidemiológicos que relacionam a deficiência de VD e a gravidade de sintomas na DA33-36. Sidbury et al. relataram efeitos benéficos da suplementaçao oral com VD em crianças com DA, no período do inverno. Onze pacientes foram avaliados por meio de um sistema de pontuaçao denominado Eczema Area and Severity Index - EASI - e foram suple-mentados diariamente com ergocalciferol 1000 UI ou placebo durante 1 mês. Os pacientes foram autorizados a continuar terapias anteriormente prescritas para DA, mas foram instruídos a nao iniciar novos tratamentos ao longo de 1 mês. Houve melhora na pontuaçao EASI, favorecendo o grupo que usou vitamina D32.
Um estudo duplo-cego randomizado avaliou os benefícios das vitaminas D e E na DA. Dos 60 pacientes, 12 foram designados para a suplementaçao de VD, com a dose de 1.600 UI/dia. Os pacientes deste grupo, após 60 dias de suplementaçao, mostraram uma melhora significativa nos níveis de VD (p < 0,001) e exibiram diminuiçao significativa na gravidade da doença em 34,8%, na avaliaçao pelo SCORAD (p = 0,004)37.
Amestejani et al. publicaram um ensaio clínico randomizado, duplo-cego controlado com placebo. Neste estudo, 30 pacientes foram randomizados para a suplementaçao de 1600 UI/dia de VD e 30 pacientes receberam placebo. A pesquisa foi realizada durante 60 dias e demonstrou que o SCORAD teve melhora significativa, independentemente da gravidade inicial da DA (p < 0,05)38.
Hata et al. demonstraram que a VD influencia na manutençao da barreira epidérmica e correlacionaram a ingestao oral de VD com a produçao das catelicidinas. Foram realizadas biópsias em indivíduos sem DA (n = 14) e em pacientes com DA, tanto em pele normal como em pele com lesao (n = 14) e estas amostras foram submetidas a dosagem de RNA mensageiro para catelicidina. Em seguida, ambos os grupos receberam suplementaçao com 4000 UI via oral de VD, e foram realizadas novas biópsias e dosagem de RNAm. Houve aumento significante das catelicidinas na pele lesionada de pacientes com DA (p < 0,01), mas nao na pele ou amostras sem lesao no grupo controle. Além disso, houve um pequeno aumento (mas nao estatisticamente significante) da catelicidina na pele lesionada antes da suplementaçao da DA com VD, indicando a capacidade do paciente com DA de aumentar a síntese de catelicidina após rompimento da barreira epidérmica39.
O papel da VD sobre a maturaçao e atividade das células epiteliais e dos tecidos linfoides associados ao desenvolvimento e controle das manifestaçoes alérgicas como a DA é controverso.Estudo transversal submeteu 94 pacientes entre 1 e 18 anos ao SCORAD e a dosagem sérica de VD. A concentraçao sérica de VD nao teve correlaçao significativa com a gravidade da DA (r = 0.001; p = 0,99). A pesquisa também mostrou que uma menor concentraçao sérica de VD foi associada significantemente com a idade de 3 anos ou mais (p < 0,0001), raça negra (p < 0,0001) e meses de inverno (p = 0,0084)7.
Apesar de existirem estudos que investigam o efeito de VD na gravidade da DA, estes possuem uma amostra pequena e a influência de sensibilizaçao alérgica nao foi avaliada. Sabe-se que pacientes com e sem sensibilizaçao podem ter diferentes mecanismos fisiopatológicos com apresentaçoes clínicas semelhantes. Em trabalho realizado por Akan et al., 45,2% dos pacientes pediátricos apresentavam sensibilizaçao alérgica (determinada por teste de puntura positivo) e, neste grupo, houve uma correlaçao negativa entre o escore SCORAD e os níveis séricos de VD. Por outro lado, nao houve correlaçao no grupo que nao apresentava sensibilizaçao29.
A Tabela 1 resume os resultados descritos sobre a suplementaçao da VD na dermatite atópica.
CONCLUSOES
Estudos apontam relaçao inversa entre níveis de VD e a gravidade da DA, e demonstram que a suplementaçao vitamínica promove alteraçao da imunidade e da integridade da barreira epidérmica, podendo levar à melhora clínica da DA. No entanto, estudos prospectivos com casuística maior sao primordiais para esclarecer essa correlaçao e investigar se a suplementaçao de vitamina D reduz de fato a gravidade da DA em indivíduos com deficiência desta vitamina, bem como investigar qual a real influência da insuficiência de vitamina D sobre a dermatose. Além disso, devem ser consideradas as diversas variáveis de confusao, como raça, idade, fototipo, presença de outras doenças atópicas, sexo e história familiar de atopia, com necessidade de estudos longitudinais sobre a influência da suplementaçao oral de VD em pacientes com DA.
AGRADECIMENTO
Ao designer gráfico Diego Carvalho pela elaboraçao da ilustraçao esquemática do artigo.
REFERENCIAS
1. Santos HL, Rosário Filho NA. Vitamina D e doenças alérgicas. Rev bras alerg Imunopatol. 2012;35:15-24.
2. Peroni DG, Piacentini GL, Cametti E, Chinellato I, Boner AL. Atopic dermatitis and vitamin D. Paediatric Dermatology. British Association of Dermatologists. 2011;164:1078-82.
3. Ginde AA, Mansbach JM, Camargo CA Jr. Vitamin D, respiratory infections, and asthma. Curr Allergy Asthma Rep. 2009;9:81-7.
4. Brehm JM, Celedo'n JC, Soto-Quiros ME, et al. Serum vitamin D levels and markers of severity of childhood asthma in Costa Rica. Am J Respir Crit Care Med. 2009;179:765-71.
5. Blanco A. Vitaminas. In: Química biológica. 6a ed. Buenos Aires: El Ateneo; 1998. p. 475-81.
6. Holick MF. Vitamin D Deficiency. N Engl J Med. 2007;357:266-81.
7. Chiu, et al. Serum 25-hydroxyvitamin D concentration does not correlate with atopic dermatitis severity. Am Acad of Dermatol. 2013;69:1-6.
8. Tongkao-on W, Gordon-Thomson C, Dixon KM, Song EJ, Luu T, Carter SE, et al. Novel vitamin D compounds and skin cancer prevention. Dermato-Endocrinol. 2013;5:20-33.
9. Okida F, Madalosso G, Souza TL, Pouza CET, Scaff A, Romiti N. Estudo da prevalência de casos de câncer da pele e análise da eficácia da proteçao solar na prevençao de lesoes causadas por radiaçao ultravioleta em uma amostra da populaçao. An Bras Dermatol. 2001;76:403-12.
10. Morganroth PA, Lim HW, Burnett CT. Ultraviolet radiation and the skin: an in-depth review. AJLM. 2013;7:168.
11. Rosso S, Zanetti R, Martinez C, Tormo MJ, Schraub S, Sancho-Garnier H, et al. The multicentre south European study 'Helios'. II: Different sun exposure patterns in the aetiology of basal cell and squamous cell carcinomas of the skin. Br J Cancer. 1996;73:1447-54.
12. Gonzaga HFS, Nazari ACB, Bonessi ACN, Andreotti AQA, Jorge MA. Skin cancer: the sun exposure as a causal factor and photoprotection prevention. J Bras Med. 2012;100:15-20.
13. Gordon CM, DePeter KC, Feldman HA, Grace E, Emans SJ. Prevalence of vitamin D deficiency among healthy adolescents. Arch Pediatr Adolesc Med. 2004;158:531-7.
14. Sullivan SS, Rosen CJ, Halteman WA, Chen TC, Holick MF. Adolescent girls in Maine at risk for vitamin D insufficiency. J Am Diet Assoc. 2005;105:971-4.
15. Mutgi K, Koo J: Update on the Role of Systemic Vitamin D in Atopic Dermatitis. Pediatr Dermatol. 2012;30:1-5.
16. Schauber J, Gallo RL. Antimicrobial peptides and the skin imune defense system. J Allergy Clin Immunol. 2008;122:261-6.
17. Niyonsaba F, Ushio H, Nakano N, Ng W, Sayama K, Hashimoto K, et al. Antimicrobial peptides human beta-defensins stimulate epidermal keratinocyte migration, proliferation and production of proinflammatory cytokines and chemokines. J Invest Dermatol. 2007;127:594-604.
18. Zasloff M. Antimicrobial peptides of multicellular organisms. Nature. 2002;415:389-95.
19. Kamen DL, Tangpricha V. Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity. J Mol Med. 2010;88:441-50.
20. Lopez-Garcia B, Lee PH, Yamasaki K, Gallo RL. Anti-Fungal Activity of Cathelicidins and their Potential Role in Candida albicans Skin Infection. J Invest Dermatol. 2005;125:108-15.
21. Wang T-T, Nestel F, Bourdeau V, Nagai Y, Wang Q, Liao J, et al. Cutting edge:1,25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J Immunol. 2004;173:2909-12.
22. Weber G, Heilborn JD, Chamorro Jimenez CI, Hammarsjo A, Torma H, Stahle M. Vitamin D induces the antimicrobial protein hCAP18 in human skin. J Invest Dermatol. 2005;124:1080-2.
23. Glaser R, Navid F, Schuller W, et al. UV-B radiation induces the expression of antimicrobial peptides in human keratinocytes in vitro and in vivo. J Allergy Clin Immunol. 2009;123:1117-23.
24. Tsoukas CD, Provvedini DM, Manolagas SC. 1,25-Dihydroxyvitamin D3: a novel immunoregulatory hormone. Science. 1984;224:1438-40.
25. Mahon BD, Wittke A, Weaver V. The targets of vitamin D depend on the differentiation and activation status of CD4 positive T cells. J Cell Biochem. 2003;89:922-32.
26. Staeva-Vieira TP, Freedman LP. 1,25-dihydroxyvitamin D3 inhibits IFN-gamma and IL-4 levels during in vitro polarization of primary murine CD4þ T cells. J Immunol. 2002;168:1181-9.
27. Kongsbak M, von Essen MR, Boding L, Levring TB, Schjerling P, et al. Vitamin D Up-Regulates the Vitamin D Receptor by Protecting It from Proteasomal Degradation in Human CD4+ T Cells. PLoS ONE. 2014;9(5):e96695.
28. Benson AA, Toh JA, Vernon N, Jariwala SP. The role of vitamin D in the immunopathogenesis of allergic skin diseases. Alergy. 2012;67:296-301.
29. Akan A, Azkur D, Ginis T, Toyran M, Kaya A, Vezir E, et al. Vitamin D level in children is correlated with severity of atopic dermatitis but only in patients with allergic sensitizations. Pediatr Dermatol. 2013;30:1:5.
30. Litonjua AA. Vitamin D deficiency as a risk factor for childhood allergic disease and asthma. Curr Opin Allergy Clin Immunol. 2012;12:179-85.
31. Reinholz M, Ruzicka T, Schauber J. Vitamin D and its role in allergic disease. Clin Exp Allergy. 2012;42:817-26.
32. Sidbury R, Sullivan AF, Thadhani RI, Camargo CA Jr. Randomized controlled trial of vitamin D supplementation for winter-related atopic dermatitis in Boston: a pilot study. Br J Dermatol. 2008;159:245-7.
33. Miyake Y, Sasaki S, Tanaka K, Hirota Y. Dairy food, calcium, and vitamin D intake in pregnancy and wheeze and eczema in infants. Eur Respir J. 2010;35:1228-34.
34. Willers SM, Devereux G, Craig LC, et al. Maternal food consumption during pregnancy and asthma, respiratory and atopic symptoms in 5-year-old children. Thorax. 2007;62:773-9.
35. Kuzume K, Kusu M. Before-birth climatologic data may play a role in the development of allergies in infants. Pediatr Allergy Immunol. 2007;18:281-7.
36. Weiland SK, Husing A, Strachan DP, et al. Climate and the prevalence of symptoms of asthma, allergic rhinitis, and atopic eczema in children. Occup Environ Med. 2004;61:609-15.
37. Javanbakht MH, Keshavarz SA, Djalali M, et al. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J Dermatol Treat. 2011;22:144-50.
38. Amestejani M, Salehi BS, Vasigh M, et al. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study. J Drugs Dermatol. 2012;11:327-30.
39. Hata TR, Kotol P, Jackson M, et al. Administration of oral vitamin D induces cathelicidin production in atopic individuals. J Allergy Clin Immunol. 2008;122:829-31.