Número Atual: Setembro-Outubro 2013 - Volume 1 - Número 5
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Deficiência específica de anticorpo antipolissacarídeo de pneumococo e resposta humoral a vacinas pneumocócicas: atualização em diagnóstico
Specific anti-pneumococcal polysaccharide antibody deficiency and humoral response to pneumococcal vaccines: uptdate on diagnosis
Bruno Acatauassú Paes Barreto1; Emanuel Sávio Cavalcanti Sarinho2; Germana Pimentel Stefani3; Herberto José Chong Neto4; Joseane Chiabai5; Maria Luiza Oliva Alonso6; Neusa Falbo Wandalsen7; Victor Nudelman8
DOI: 10.5935/2318-5015.20130035
1. MD, PhD. Universidade do Estado do Pará
2. MD, PhD. Universidade Federal de Pernambuco
3. MD. Faculdade de Medicina Unievangélica, Anápolis, Goiás
4. MD, PhD. Universidade Federal do Paraná
5. MD, MSc. Universidade Federal do Espírito Santo
6. MD. Pontifícia Universidade Católica do Rio de Janeiro (PUC-RJ) e Instituto Prof. Rubem David Azulay da Santa Casa da Misericórdia do Rio de Janeiro
7. MD, PhD. Faculdade de Medicina do ABC
8. MD, PhD. Universidade Federal de Sao Paulo, UNIFESP e Hospital Israelita Albert Einstein, Sao Paulo
Endereço para correspondência:
Bruno Acatauassú Paes Barreto
E-mail: brunopaesbarreto@terra.com.br
Submetido em 5/11/2013.
Aceito em 18/05/2014.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A deficiência específica de anticorpo antipolissacarídeo de pneumococo é o comprometimento da resposta IgG específica aos antígenos polissacarídeos do pneumococo e manifesta-se de maneira semelhante às outras deficiências de imunoglobulinas, com infecçoes recorrentes do trato respiratório. A prevalência é variável, entre 7 a 19%, representando no Brasil 8,7% dos casos de imunodeficiências. O diagnóstico funcional baseia-se na capacidade do organismo montar uma resposta imune constituída pela produçao de anticorpos quando estimulado por antígenos polissacarídeos presentes na vacina pneumocócica polissacarídea pura. No estudo da resposta à vacina pneumocócica polissacarídea pura é necessário testar os sorotipos nao comuns à vacina polissacarídea conjugada para determinar a resposta de anticorpos antipolissacarídeos sem a interferência de anticorpos antiproteínas advindos da vacina polissacarídea conjugada. Sao reconhecidos quatro diferentes fenótipos da doença, denominados memória, leve, moderada e grave. O objetivo do presente trabalho foi realizar revisao da literatura para verificar a epidemiologia, diagnóstico e fenótipos da deficiência específica de anticorpo antipolissacarídeo de pneumococo. Trata-se de revisao narrativa de artigos nos últimos 10 anos sobre a deficiência de anticorpo específica para o pneumococo. Concluímos que a deficiência específica de anticorpo antipolissacarídeo de pneumococo é frequente, com espectro laboratorial variável.
Descritores: Antígeno polissacarídeo, anticorpo específico, pneumococo.
EPIDEMIOLOGIA DA DEFICIENCIA DE ANTICORPO ESPECIFICA
Imunodeficiências primárias (IDP) representam um grupo de doenças com mais de 150 alteraçoes hereditárias, que afetam o desenvolvimento do sistema imunológico, sua funçao, ou ambos1,2.
A incidência é amplamente variável, sendo de 1/250 entre as IDP mais comuns, até 1/ 1.000.000 para as formas mais raras3. Estima-se que seis milhoes de pessoas sao portadoras de alguma imunodeficiência primária, enquanto que somente 27.000 a 60.000 (0,45 a 1%) têm sido identificadas, de acordo com os registros nacionais e a rede de centros Jeffrey Modell4.
Deficiência específica de anticorpo antipolissacarídeo de pneumococo é o comprometimento da resposta de IgG específica aos antígenos polissacarídeos, estando a concentraçao de imunoglobulinas, subclasses de IgG e o número de células B normais, e manifesta-se de maneira semelhante às outras deficiências de imunoglobulinas, com infecçoes recorrentes do trato respiratório. Pode estar associada a outras IDP, como deficiência de subclasses de IgG, síndrome de Wiskott-Aldrich, síndrome parcial de DiGeorge, síndrome de hiper-IgE, asplenia ou deficiência seletiva de IgA sem deficiência seletiva de IgG5,6.
A prevalência de deficiência específica de anticorpo antipolissacarídeo de pneumococo em crianças com infecçoes respiratórias recorrentes varia de 7 a 19%7-14.
No primeiro estudo realizado pelo Latin American Group for Immunodeficiencies (LAGID) em 1998, com a participaçao de 8 países e envolvimento de 1.428 indivíduos, 58% apresentaram deficiência de anticorpos e destes 2,4% tinham deficiência de anticorpo específico com concentraçoes normais de imunoglobulinas e de células B15.
Em 2007, o segundo relato do LAGID descreveu 3.321 pacientes de 12 países da América Latina com IDPs. Houve predomínio das deficiências de anticorpos (53,2%), seguida das imunodeficiências bem definidas (22,6%), imunodeficiências combinadas de células T e B (9,5%), desordens dos fagócitos (8,6%), disregulaçao imune (3,3%) e deficiências de complemento (2,8%)16. Neste estudo, dos 1.764 (53,2%) indivíduos com deficiências de anticorpos, setenta e quatro (4,2%) apresentaram deficiência de anticorpo específico. No Brasil, esta pro-porçao atingiu 8,7%16.
RESPOSTA IMUNOLOGICA AO STREPTOCOCCUS PNEUMONIAE
O Streptococcus pneumoniae é uma bactéria gram-positiva comensal comum da nasofaringe, colonizando, em média, até 50% dos lactentes e 20% dos adultos saudáveis17. O estado de portador, no entanto, representa o primeiro passo para a ocorrência de doença local (otite, sinusite e doença nao-bacterêmica) ou sistêmica (doença bacterêmica, septicemia ou meningite). Os mecanismos geradores de doença incluem a inflamaçao aguda induzida pelos constituintes de sua parede celular (peptideoglicanas e ácido teicoico) e as açoes das enzimas proteolíticas e exotoxinas18. A cápsula é o produto bacteriano que mais caracteriza a virulência, uma vez que é composta por polissacarídeos que inibem a fagocitose e o aprisionamento pelo muco19. O controle da colonizaçao e a defesa durante a infecçao invasiva envolvem os diversos mecanismos de resposta imunológica, incluindo complemento, fagocitose, anticorpos e células T efetoras.
O reconhecimento inicial do patógeno ocorre por receptores de reconhecimento padrao, tais como re-ceptores transmembrana do tipo Toll (TLR2, TLR9 e TL4), receptores citosólicos do tipo NOD (nucleotide-binding oligomerization domain receptors), e sensores de DNA. Tais interaçoes determinam a liberaçao de citocinas pró-inflamatórias (TNF-α, IL-1β, IL-6, IFN-α/β, KC e MCP-1), que por sua vez irao recrutar e ativar neutrófilos e macrófagos, além de células dendríticas, e irao modular a imunidade adaptativa20,21. Na resposta imune inata, a ativaçao do sistema complemento e ligaçao às proteínas do surfactante têm açao fundamental, opsonizando o pneumococo e favorecendo a atuaçao dos fagócitos. A ativaçao da via clássica é a mais importante e ocorre por açao de anticorpos naturais IgM; por ligaçao direta ao C1q do complexo expresso na superfície de alguns macrófagos SIGN-R1/polissacarídeos ou de proteínas de fase aguda; além de anticorpos sorotipo-específicos IgG e IgM, produzidos posteriormente18.
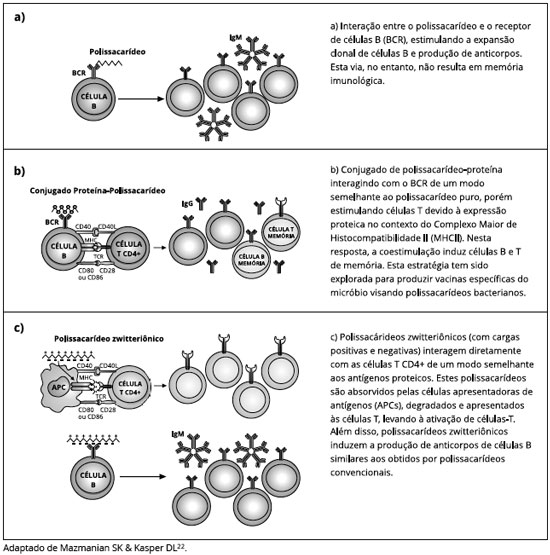
Os anticorpos dirigidos contra o polissacarídeo capsular representam a principal forma de proteçao contra doenças invasivas, e a Figura 1 mostra os mecanismos de ativaçao celular geradores de tais anticorpos. A expansao do linfócito B pode ocorrer após o reconhecimento direto do polissacarídeo pelo receptor de célula B (BCR), conhecida como resposta T-independente; após interaçao com célula T CD4 por estímulo do polissacarídeo conjugado a proteína; ou por estimulaçao direta T e B por polissacarídeos zwitteriônicos22.
Durante a infância, no entanto, a incidência de doenças pneumocócicas causadas pela ampla varie-dade de sorotipos declina anos antes da aquisiçao natural de anticorpos anticapsulares, sugerindo que outros mecanismos forneçam imunidade natural ao pneumococo, tais como anticorpos contra antígenos proteicos de superfície e células T CD4+ secretoras de IL-17 (Th17)23-25. As proteínas de superfície do pneu-mococo A e C, a pneumolisina (Ply), a neuraminidase A (NamA) e antígeno de superfície de pneumococo A têm sido, inclusive, avaliados na composiçao de novas vacinas26 (Figura 1).
FISIOPATOLOGIA DA DEFICIENCIA ESPECIFICA DE ANTICORPO ANTIPOLISSACARIDEO DE PNEUMOCOCO
A avaliaçao da resposta imune adaptativa deve levar em consideraçao a imaturidade inerente ao período neonatal, tanto em relaçao à resposta humoral (anticorpos), quanto à celular e sua progressiva evoluçao durante a infância e adolescência, até a aquisiçao dos níveis de adulto. Há diferenças também qualitativas da resposta de anticorpos, dependendo da idade e do estímulo que desencadeou a resposta imune27,28.
A resposta humoral é iniciada pela ativaçao dos Linfócitos B, que entao proliferam e se diferenciam em células B efetoras, os plasmócitos, cuja funçao principal é a secreçao de imunoglobulinas, e em células B de memória, o que requer uma adequada interaçao entre os linfócitos T e B.
As imunoglobulinas sao glicoproteínas plasmáticas efetoras da resposta humoral, com funçao de anticorpo, caracterizando-se pela grande diversidade e alta especifi-cidade. A Organizaçao Mundial de Saúde (OMS) preconiza que se utilize o termo "imunoglobulina" quando esta se encontra livre no plasma, em outros líquidos corpóreos ou em tecidos, ou ainda, como receptor de membrana de linfócito B (IgM, IgD). Quando a imunoglobulina se une ao antígeno, passa entao a ser denominada "anticorpo", exercendo suas diversas atividades biológicas, como neutralizaçao de patógenos, opsonizaçao, ativaçao de complemento e citotoxicidade celular dependente de anticorpo (ADCC).
A imunidade humoral representa o principal meca-nismo de defesa contra patógenos extracelulares, em especial bactérias encapsuladas como o S. pneumoniae e H.influenzae, sendo frequentes infecçoes recorrentes sinopulmonares por estes microrganismos na presença de deficiência predominantemente de anticorpos5.
A resposta a antígenos proteicos é verificada através da titulaçao de anticorpos específicos a antígenos vaci-nais, aos quais o indivíduo já tenha sido sensibilizado, como tétano, difteria, sarampo, pólio e rubéola28. Sua avaliaçao está indicada quando há suspeita de imuno-deficiência humoral, em particular quando há níveis de IgG normais ou próximos do normal, em pacientes com infecçoes recorrentes por bactérias extracelulares28.
Nas fases iniciais da investigaçao de um paciente com suspeita de IDP, nao se deve aplicar vacinas de agentes vivos pelo risco de infecçao grave pelo agente vacinal. Nestes casos, analisar a carteira de vacinaçao e avaliar a resposta vacinal daquelas vacinas recebidas anteriormente pela criança. Quando necessário, avaliar a resposta vacinal pré e pós-imunizaçao ao toxoide tetânico e à toxina diftérica28,29.
Para avaliar a resposta anticórpica de pacientes em terapia de reposiçao com imunoglobulina, pode-se utilizar a resposta a neoantígenos (ex.: bacteriófago Phi X-174), disponível apenas em alguns centros especializados27,28.
A resposta a antígenos polissacarídeos é avaliada através da dosagem de anticorpos antipneumococos pré e pós-imunizaçao com vacina polissacarídica nao conjugada do S. pneumoniae e está indicada em pacientes maiores de 2 anos de idade com infecçoes sinopulmonares e níveis de imunoglobulinas normais ou perto do normal, com resposta positiva aos antígenos proteicos29.
Os lactentes abaixo de 2 anos sao incapazes de responder aos antígenos polissacarídeos, aos quais sao direcionados predominantemente anticorpos da subclasse IgG2.
DIAGNOSTICO FUNCIONAL DA DEFICIENCIA ESPECIFICA DE ANTICORPO ANTIPNEUMOCOCO
O diagnóstico funcional baseia-se na capacidade do organismo em montar uma resposta imune constituída pela produçao de anticorpos quando estimulado por antígenos polissacarídeos presentes na vacina pneu-mocócica polissacarídea pura (nao conjugada) - VPP29. Casos de infecçao natural por sorotipos específicos de pneumococos teoricamente também poderiam ser válidos para esse estudo, mas na maioria dos casos nao há relato do sorotipo do pneumococo isolado e, quando disponível, dificilmente teríamos um número relevante de sorotipos adquiridos por infecçao natural e que poderiam ser investigados em substituiçao ao estímulo dos vários sorotipos contidos numa vacina. Por outro lado, a ausência de produçao de anticorpos específicos frente a uma infecçao natural por determinado sorotipo de pneumococo já configuraria uma imunodeficiência, ainda que de limitado espectro29.
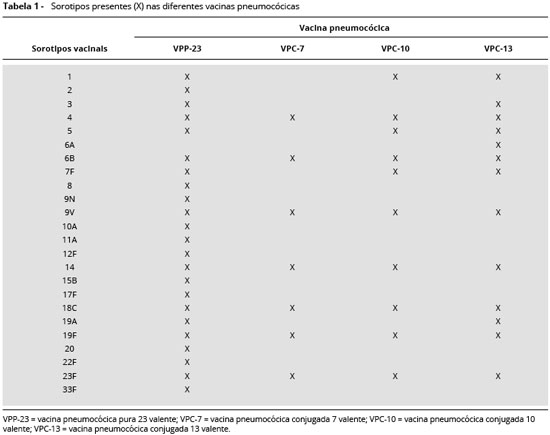
Para o diagnóstico utiliza-se a vacina pneumocócica de polissacarídeos capsulares purificados e que em nos-so meio é encontrada sob a forma de 23 sorotipos de pneumococos (Pneumovax 23r, MSD) com os seguintes sorotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V,10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, e 33F.
Para a interpretaçao da resposta imune, determinam-se os anticorpos sorotipo- específicos na circulaçao antes da aplicaçao da vacina e novamente 4 a 8 semanas após a vacinaçao. As determinaçoes pré e pós-vacinais devem ser feitas preferencialmente no mesmo labo-ratório para evitar interferências analíticas, usando-se padroes internacionais recomendados pela OMS e os mesmos métodos para as determinaçoes, p. ex., ELISA, com valores expressos em mcg/mL. Considera-se uma resposta satisfatória para determinado sorotipo de pneumococo quando um título protetor for atingido, isto é, maior ou igual a 1,3 mcg/mL, valor relacionado com imunoproteçao e proteçao contra infecçao sistêmica e em mucosas29.
Procede-se com a vacinaçao caso os títulos iniciais sejam nao protetores. Para a resposta vacinal ser considerada adequada, a presença de anticorpos protetores para os sorotipos testados deve estar dentro dos valores esperados para a idade. Valores normais para as diversas faixas etárias encontram-se em um número limitado de publicaçoes. Em estudo em nosso meio, Barros-Nunes em 2000 encontrou resposta satisfatória para antígenos polissacarídeos da VPP em 40% de crianças saudáveis de 6 a 14 meses de idade, 63% de 15 a 23 meses, 37% de 24 a 47 meses, 60% de 48 a 71 meses, e acima de 80% para crianças com mais de 6 anos de idade. Na ocasiao, definia-se como resposta imune satisfatória a obtençao de títulos protetores ou a proporçao de elevaçao de 4 vezes entre os títulos pré-vacinais para pós-vacinais30.
O número de respostas a sorotipos de polissacarí-deos necessários para configurar uma avaliaçao segura da resposta de anticorpos ainda nao foi estabelecido, mas atualmente utilizam-se com maior frequência os seguintes critérios para tal resposta:
- em crianças de 2 a 6 anos, considera-se resposta satisfatória quando houver pelo menos 50% dos sorotipos testados com títulos protetores;
- Em crianças acima de 6 anos e adultos até 65 anos, considera-se resposta satisfatória quando houver pelo menos 70% dos sorotipos testados com títulos protetores.
Até pouco tempo atrás a proporçao do título pós-vacinal para o titulo pré-vacinal também era conside-rada para avaliar a resposta à vacina, o que nao é mais recomendado. Pacientes que já têm concentraçoes de anticorpos protetores e sao vacinados (pela primeira vez ou nao) possuem menos chance de apresentar um aumento significativo no título de anticorpos após a vacinaçao31.
Crianças menores de 2 anos ainda encontram-se em uma fase fisiológica de imaturidade imune com hiporesponsividade a antígenos polissacarídeos. Esses antígenos, por induzirem uma resposta de linfócitos B nao dependente inicialmente da colaboraçao com linfócitos T, sao chamados de antígenos T independentes. A colaboraçao posterior de linfócitos T ou de seus produtos pode aumentar a produçao de anticorpos antipolissacarídeos e por isso esses antígenos sao chamados de antígenos T independentes tipo II. Para contornar a hiporresponsividade fisiológica, conjuga-se o polissacarídeo (hapteno) a uma proteína (carreador) para produzir uma resposta T dependente, passando a ser eficiente para esses dois antígenos nessa faixa etária. O exemplo está na vacina pneumocócica conju-gada que aplica-se em lactentes, com bons resultados protetores. No entanto, a determinaçao de anticorpos estimulados por essa vacina é entendida como uma resposta imune a antígenos tanto proteicos como polissacarídicos, isto é, nao pura para polissacarídeos e por isso nao indicada para o diagnóstico da defici-ência funcional de anticorpos antipolissacarídeos. O uso da vacina pneumocócica polissacarídea pura (VPP) deve ser evitado no lactente que estiver sob esquema vacinal da vacina polissacarídea conjugada (VPC), pelo potencial de comprometer a resposta imune induzida por esta última. Assim, o diagnóstico funcional de déficit de anticorpos antipolissacarídeos seria aplicável para crianças maiores 2 anos e na prática, preferencialmente para aquelas que receberam o esquema de imunizaçao com a vacina pneumocócica conjugada29.
Para o estudo da resposta à vacina VPP é necessário testar os sorotipos nao comuns à vacina VPC para determinar a resposta de anticorpos antipolissacarídeos sem a interferência de anticorpos antiproteicos advindos da vacina VPC. Para tanto, deve-se contar com um painel laboratorial que inclua pelo menos 7 desses sorotipos que serao testados. Para crianças previamente imunizadas com a vacina VPC 10 valente, devemos testar a resposta à VPP através da determinaçao dos anticorpos para os sorotipos 2, 3, 8, 9N, 10A, 11A, 12F, 15B, 17F, 19A, 20, 22F e 33F. Para crianças previamente imunizadas com a vacina VPC 13 valente, devemos testar a resposta à VPP através da determinaçao dos anticorpos para os sorotipos 2, 8, 9N, 10A, 11A, 12F, 15B, 17F, 20, 22F e 33F (Tabelas 1 e 2). A vacinaçao com VPP em crianças previamente imunizadas com VPC pode induzir um aumento nos níveis de anticorpos para os sorotipos contidos na VPC31.
Caso nao ocorra uma resposta satisfatória à VPP, nao se recomenda um reforço dessa vacina para o estudo da resposta vacinal na maioria desses pacientes, porque nao há estudos sobre resposta normal a esse reforço, e geralmente os pacientes que mostraram resposta inicial insatisfatória também nao respondem ao reforço vacinal com VPP32. No entanto, há duas exceçoes para essa situaçao:
- crianças de 2 a 5 anos que tiveram uma resposta insatisfatória inicial algumas vezes podem ter uma resposta melhor com um reforço 1 a 2 anos após a primeira dose, talvez por um retardo na maturidade da resposta imune;
- pacientes maiores de 5 anos com títulos pós-vacinais um pouco abaixo de níveis protetores e considerados sem outra alteraçao imunológica podem chegar a títulos protetores após o reforço com VPP29.
Alguns pacientes que inicialmente mostram uma resposta satisfatória à VPP podem apresentar uma queda progressiva nos títulos em 1 ano e voltar a ser suscetíveis à infecçao por pneumococo. Nesses casos indica-se o seguimento da resposta de anticorpos em 6 a 12 meses após a vacina VPP.
A VPC pode ser administrada em pacientes que tiveram resposta insatisfatória à VPP. A resposta à VPC nesses pacientes sugere uma competência para respon-der a antígenos protéicos, permanecendo no entanto o diagnóstico de deficiência funcional de anticorpos antipolissacarídeos.
As vacinas pneumocócicas sao geralmente bem toleradas, mas alguns pacientes podem ter hiperemia e edema no local da aplicaçao, além de febre por 1 a 2 dias após a administraçao; raramente ocorrem rea-çoes anafiláticas. Alguns pacientes com títulos prévios de anticorpos induzidos por vacinaçao pneumocócica prévia podem apresentar uma reaçao local acentuada. Nesses casos pode-se indicar o uso de anti-inflamatório nao hormonal e compressas frias no local29.
DIFERENTES FENOTIPOS DE RESPOSTA DEFICIENTE A VACINA POLISSACARIDICA ANTIPNEUMOCOCICA 23
Recentemente quatro fenótipos foram sugeridos para caracterizar a resposta deficiente a antígenos po-lissacarídeos, após vacinaçao com pneumo23 (VPP23)29 (Tabela 3):
1) Fenótipo de memória: os indivíduos têm uma resposta inicial adequada a VPP23 (> 50% de proteçao para os sorotipos testados em crianças de 2 a 5 anos de idade e > 70% de proteçao para indivíduos entre 6 e 65 anos) mas perdem esta resposta em 6 meses. Eles podem responder a uma segunda administraçao de VPP23 após 1 ano.
2) Fenótipo leve: estes pacientes nao geram títulos pro-tetores (> 1.3 µg/mL) a múltiplos sorotipos contidos na vacina ou sao incapazes de aumentar os títulos em 2 vezes (em > 50% dos sorotipos avaliados para crianças abaixo de 6 anos, e em > 70% para indivíduos entre 6 e 65 anos), considerando que os títulos pré-vacinais sao menores que 4 µg/mL.
3) Fenótipo moderado: estes pacientes têm menos do que o número esperado de títulos protetores para os sorotipos testados (50% para crianças abaixo de 6 anos e 70% para pacientes entre 6 e 65 anos), mas demonstram títulos protetores (> 1,3 µg/mL) a 3 sorotipos ou mais.
4) Fenótipo grave: estes pacientes nao têm mais que 2 sorotipos com títulos protetores e, os títulos, quando presentes, tendem a ser baixos (< 1,3-2,0 µg/mL).
Estes fenótipos representam o consenso de um grupo de trabalho, porém mais pesquisas devem ser feitas para melhoria deste guia. Importante ressaltar também que a correlaçao clínica é essencial para validar a avaliaçao e que, nestes casos, todas as imunoglobulinas, incluindo subclasses de IgG, devem estar dentro dos limites de normalidade.
Nos últimos anos, no entanto, com a introduçao das vacinas conjugadas ao calendário vacinal básico oferecido pelo Ministério da Saúde, esta avaliaçao deve ser feita com cautela, procurando-se caracterizar a resposta deficiente a antígenos polissacarídeos pela avalizaçao de anticorpos a sorotipos que nao estao presentes na vacina conjugada.
A resposta aos polissacarídeos conjugados também tem sido avaliada e identificada como deficiente em alguns indivíduos, configurando uma síndrome de deficiência de anticorpos aos polissacarídeos con-jugados. Neste fenótipo a resposta está normal em apenas 1 ou 2 dos sorotipos testados (4, 6B, 9V, 14, 18C, 19F, 23F)5.
REFERENCIAS
1. Al-Herz W, Bousfiha A, Casanova JL, Chapel H, Conley ME, Cunningham-Rundles C, et al. Primary immunodeficiency diseases: an update on the classification from the International Union of Immunological Societies Expert Committee for Primary Immunodeficiency. Front Immunol. 2011;2:1-26.
2. Notarangelo LD. Primary immunodeficiencies. J Allergy Clin Immunol. 2010;125:S182-94.
3. Condino-Neto A, Franco JL, Trujillo-Vargas C, Espinosa-Rosales FJ, Leiva LE, Rodriguez-Quiroz F, et al. Critical issues and needs in management of primary immunodeficiency diseases in Latin America. Allergol Immunopathol (Madr). 2011;39:45-51.
4. Bousfiha AA, Jeddane L, Ailal F, Benhsaien I, Mahlaoui N, Casanova JL, et al. Primary immunodeficiency diseases worldwide: more common than generally thought. J Clin Immunol. 2013;33:1-7.
5. Leiva LE, Monjure H, Sorensen RU. Recurrent respiratory infections, specific antibody deficiencies, and memory B cells. J Clin Immunol. 2013;33(Suppl 1):S57-61.
6. Knutsen AP. Patients with IgG subclass and/or selective antibody deficiency to polysaccharide antigens: initiation of a controlled clinical trial of intravenous immune globulin. J Allergy Clin Immunol. 1989;84(4 Pt 2):640-5.
7. Carneiro-Sampaio M, Moraes-Vasconcelos D, Kokron CM, Jacob CM, Toledo-Barros M, Dorna MB, et al. Primary immunodeficiency diseases in different age groups: a report on 1,008 cases from a single Brazilian reference center. J Clin Immunol. 2013;33:716-24.
8. Boyle RJ, Le C, Balloch A, Tang M. The clinical syndrome of antibody deficiency in children. Clin Exp Immunol. 2006;146:486-92.
9. Sanders L, Rijkers G, Kuis W, et al. Defective antipneumococcal polysaccharide antibody response in children with recurrent respiratory tract infections. J Allergy Clin Immunol. 1993;91:110-19.
10. Epstein M, Gruskay F. Selective deficiency in pneumococcal anti-body response in children with recurrent infections. Ann Allergy Asthma Immunol. 1995;75:125-31.
11. Tuerlinckx D, Vermeulen F, Pékus V, et al. Optimal assessment of the ability of children with recurrent respiratory tract infections to produce anti-polysaccharide antibodies. Clin Exp Immunol. 2007;149:295-302.
12. Jeurissen A, Moens L, Raes M, et al. Laboratory diagnosis of specific antibody deficiency to pneumococcal capsular polysaccharide antigens. Clin Chem. 2007;53:505-10.
13. Bossuyt X, Moens L, van Hoeyveld E, et al. Coexistence of (partial) immune defects and risk of recurrent respiratory infections. Clin Chem. 2007;53:124-30.
14. Borgers H, Moens L, Picard C, et al. Laboratory diagnosis of specific antibody deficiency to pneumococcal capsular polysaccharide antigens by multiplex bead assay. Clin Immunol. 2010;134:198-205.
15. Zelazko M, Carneiro-Sampaio M, Luigi MC, Olarte DG, Madrigal OP, Perez RB, et al. Primary Immunodeficiency Diseases in Latin America: First Report from Eight Countries Participating in the LAGID. J Clin Immunol. 1998;18:161-6.
16. Leiva LE, Zelazco M, Oleastro M, Carneiro-Sampaio M, Condino-Neto A, Costa-Carvalho BT, et al. Primary immunodeficiency disease in Latin America: the second report of the LAGID directory. J Clin Immunol. 2007;27:101-8.
17. Ferreira LMM, Carvalho ES, Berezin EM, Brandileone MC. Colonizaçao e resistência antimicrobiana de Streptococcus pneumoniae isolado em nasofaringe de crianças com rinofaringite aguda. J Pediatr (Rio J). 2001;77:227-34.
18. Paterson GK, Orihuela CJ. Pneumococci: immunology of the innate host response. Respirology. 2010;15:1057-63.
19. Hyams C, Camberlein E, Cohen JM, Bax K, Brown JS. The Streptococcus pneumoniae capsule inhibits complement activity and neutrophil phagocytosis by multiple mechanisms. Infect Immun. 2010;78:704-15.
20. Koppe U, Suttorp N, Opitz B. Recognition of Streptococcus pneumoniae by the innate immune system. Cell Microbiol. 2012;14:460-6.
21. Paterson GK, Mitchell TJ. Innate immunity and the pneumococcus. Microbiology 2006;152:258-93.
22. Mazmanian SK, Kasper DL. The love-hate relationship between bacterial polysaccharides and the host immune system. Nat Rev Immunol. 2006;6:849-58.
23. Lipsitch M, Whitney CG, Zell E, Kaijalainen T, Dagan R, Malley R. Are anticapsular antibodies the primary mechanism of protection against invasive pneumococcal disease? PLoS Med. 2005;2:e15.
24. Malley R. Antibody and cell-mediated immunity to Streptococcus pneumoniae: implications for vaccine development. J Mol Med (Berl). 2010;88:135-42.
25. Olliver M, Hiew J, Mellroth P, Henriques-Normark B, Bergman P. Human Monocytes Promote Th1 and Th17 Responses to Streptococcus pneumoniae. Infect Immun. 2011;79:4210-7.
26. Goulart C, da Silva TR, Rodriguez D, Politano WR, Leite LC, Darrieux M. Characterization of protective immune responses induced by pneumococcal surface protein A in fusion with pneumolysin derivatives. PLoS One. 2013;8(3):e59605.
27. Ouricuri A, Grumach AS. Imunodeficiências: Diagnóstico. In: Solé D, Bernd LAG, Filho, NAR, eds. Tratado de Alergia e Imunologia Clínica. Associaçao Brasileira de Alergia e Imunopatologia. 1a ed. Sao Paulo: Atheneu; 2011. p. 463-75.
28. Oliveira JB, Fleisher TA. J Allergy Clin Immunol. 2010; 125(2 Suppl 2):S297-305.
29. Orange JS, Ballow M, Stiehm ER, et al. Use and interpretation of diagnostic vaccination in primary immunodeficiency: a working group report of the Basic and Clinical Immunology Interest Section of the American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2012;130:S1-24.
30. Barros-Nunes P, Costa-Carvalho BT, Carneiro-Sampaio MMS, et al. Antibody responses to pneumococcal immunization in healthy Brazilian children is higher in 1 1/2-to-2-year olds than in 2-to-4-year olds. J Allergy Clin Immunology. 1999;103:S200-200.
31. Sorensen RU, Paris K. Assessing the immunologic response to vaccination. In: UpToDate, Stiehm ER (ed), UpToDate, Waltham, MA, 2013.
32. Segundo GRS, Fernandes KP. Deficiência de anticorpos anti-polissacarídicos: relato de casos. Rev Bras Alerg Imunopatol. 2009;32:194-8.
Grupo de Assessoria em Alergia na Infância e na Adolescência da ASBAI.