Número Atual: Setembro-Outubro 2013 - Volume 1 - Número 5
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
- Outros do Autor
Artigo de Revisão
Perspectivas atuais sobre inflamação e remodelamento das vias aéreas na asma e na rinite alérgica
Current perspectives on airway inflammation and remodelling in asthma and allergic rhinitis
Ruby Pawankar
DOI: 10.5935/2318-5015.20130034
MD, PhD, FRCP, FAAAI. Divisao de Alergia, Departamento de Pediatria. Nippon Medical School, Tokyo, Japan
Endereço para correspondência:
Ruby Pawankar
pawankar.ruby@gmail.com
Submetido em 26/05/2014.
Aceito em 30/06/2014.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
O desenvolvimento da rinite alérgica (RA) e da asma requer uma interaçao entre ambiente, sistema imunológico e susceptibilidade genética. Enquanto a rinite induzida por pólen é a mais característica doença alérgica mediada pela imunoglobulina E, na RA perene os desencadeantes da alergia sao mais contínuos e levam à inflamaçao constante. Várias células e mediadores coordenam e mantêm essa inflamaçao. Embora a histamina ainda seja um dos principais mediadores da reaçao alérgica, muitos outros mediadores produzidos por diferentes tipos celulares estao envolvidos. Assim, a intrincada interaçao entre esses mediadores, citocinas, quimiocinas, neuropeptídeos, moléculas de adesao e várias células na forma de uma rede complexa leva ao desenvolvimento de sintomas específicos e à hiper-reatividade nao específica presente na RA. A asma é caracterizada por graus variáveis de inflamaçao crônica e alteraçoes estruturais nas vias aéreas que incluem denudaçao epitelial, metaplasia das células caliciformes, espessamento subepitelial, aumento da massa do músculo liso nas vias aéreas, aumento das glândulas brônquicas, angiogênese, e alteraçoes nos componentes da matriz extracelular envolvendo as pequenas e grandes vias aéreas. Acredita-se que a inflamaçao crônica inicie e perpetue ciclos de dano e reparo tecidual na asma, embora o remodelamento também possa ocorrer em paralelo com a inflamaçao. Ao mesmo tempo em que RA e asma apresentam várias semelhanças em termos de perfil e resposta das células inflamatórias e dos mediadores, o remodelamento como observado na asma nao é característico da RA. Na asma, as relaçoes entre inflamaçao e remodelamento das vias aéreas e funçao pulmonar estao sendo melhor compreendidas. Uma variedade de células inflamatórias e células estruturais atuam na coordenaçao da inflamaçao e das mudanças estruturais na asma. O aumento da responsividade das vias aéreas é um marcador substituto de inflamaçao e pode refletir o desenvolvimento de mudanças estruturais nas vias aéreas. Tal aumento persistente da responsividade brônquica aponta para a ocorrência de remodelamento parcialmente resistente à terapia.
Descritores: Asma, rinite alérgica, remodelamento de vias aéreas, inflamaçao de vias aéreas, citocinas.
INTRODUÇAO
Doenças alérgicas como a rinite alérgica (RA) e asma têm atingido proporçoes epidêmicas em todo o mundo e representam um grande problema de saúde pública tanto em países desenvolvidos quanto em países em desenvolvimento. Considerando o foco de organizaçoes globais como as Naçoes Unidas em doenças nao transmissíveis e os esforços para controlar essas doenças, as doenças alérgicas estao entre as doenças nao transmissíveis que se manifestam mais precocemente na primeira infância. Enquanto a RA é uma inflamaçao crônica da mucosa nasal mediada pela imunoglobulina E (IgE) e caracterizada por sintomas como espirros, rinorreia, prurido e obstruçao nasal, a asma é uma condiçao inflamatória crônica das vias aéreas inferiores caracterizada por obstruçao ao fluxo aéreo altamente reversível, hiper-responsividade das vias aéreas e sintomas respiratórios episódicos, incluindo sibilância, tosse produtiva, e sensaçao de falta de ar e aperto no peito1.
Clinicamente, a RA é uma doença inflamatória do tipo T-helper 2 (Th-2), enquanto a asma pode ser de origem alérgica ou nao alérgica, o que pode ser distinguido pela presença ou ausência de anticorpos IgE para alérgenos ambientais comuns. Cerca de 80% da asma infantil e 50% da asma em adultos tem origem alérgica (isto é, associada à presença de IgE). Na asma nao alérgica, os gatilhos nao se encontram tao bem definidos, mas provavelmente sejam micróbios ou componentes microbianos, vírus, etc. Entretanto, ambas as formas de asma sao caracterizadas por inflamaçao do tipo Th2 e estimulaçao de células inflamatórias como mastócitos. A resposta Th2 causa eosinofilia, leucocitose e aumento na produçao de IgE por células B, e leva à hiper-responsividade das vias aéreas e remodelamento tecidual. Os determinantes para que um indivíduo desenvolva o fenótipo asmático requerem tanto uma exposiçao a estímulos apropriados quanto predisposiçao genética2,3.
O remodelamento das vias aéreas envolve a ocorrência de alteraçoes estruturais na parede das vias aéreas caracterizadas por alteraçoes epiteliais (desprendimento ou denudaçao do epitélio como resultado de proteínas tóxicas liberadas especialmente por eosinófilos), metaplasia de células caliciformes (o seu número aumenta primeiro), aumento das glândulas mucosas brônquicas (produçao excessiva de muco), fibrose subepitelial e deposiçao da matriz extracelular, aumento da massa do músculo liso e aumento da vascularizaçao2. A inflamaçao crônica causa dano aos tecidos, o que é parcialmente reparado entre as exacerbaçoes inflamatórias. O remodelamento das vias aéreas está associado ao estreitamento pouco ou nao reversível das vias aéreas, limitaçao mais grave ao fluxo aéreo e hiper-responsividade das vias aéreas; além disso, pode estar envolvido na asma grave em adultos4. Essas alteraçoes envolvem tanto as vias aéreas superiores quanto as inferiores, mas há uma grande variaçao individual. As secreçoes das vias aéreas também contribuem para a limitaçao ao fluxo aéreo na asma, e o aumento na quantidade e na viscosidade da secreçao desempenha um papel crucial especialmente em exacerbaçoes agudas com risco de vida5. Entretanto, o remodelamento nao é um traço característico da RA.
Embora se saiba muito sobre os mecanismos inflamatórios envolvidos na RA e na asma, ainda há uma lacuna em nossa compreensao sobre as vias celulares e moleculares envolvidas no remodelamento. Tanto a inflamaçao quanto o remodelamento ocorrem na árvore traqueobrônquica de pacientes com asma. A ocorrência de inflamaçao eosinofílica parece ser pré-requisito para o desenvolvimento do remodelamento6. As vias aéreas asmáticas sao caracterizadas pelo aumento da vascularizaçao e da expressao do fator de crescimento endotelial vascular (vascular endothelial growth factor, VEGF), mas pouco se sabe a respeito da contribuiçao desses fatores no remodelamento das vias aéreas. Siddiqui et al.7 demonstraram que o remodelamento vascular é uma característica da asma e está inversamente correlacionado com o volume expiratório forçado no primeiro segundo (VEF1) pós-broncodilatador, indicando que o remodelamento pode desempenhar um papel importante na obstruçao ao fluxo aéreo.
Até recentemente, o remodelamento das vias aéreas foi considerado um fenômeno secundário que se desenvolvia tardiamente no processo da doença como consequência da inflamaçao persistente. A presença de inflamaçao e remodelamento das vias aéreas em crianças8 com asma indica que o processo de remodelamento inicia-se precocemente no processo asmático de forma sincrônica com a inflamaçao das vias aéreas recorrente e contínua, e nao como consequência da inflamaçao das vias aéreas. Alteraçoes estruturais das vias aéreas já estao presentes em seu nível máximo em escolares asmáticos graves9, indicando que alteraçoes iniciam precocemente entre 1 e 3 anos de idade e apresentam associaçao significante com eosinofilia tecidual e espessamento da membrana basal reticular10. Isso cria uma janela de oportunidade para uma intervençao precoce que possa modificar a história natural da asma11.
INFLAMAÇAO CRONICA NA RINITE ALÉRGICA E NA ASMA
Células efetoras da inflamaçao
A mucosa das vias aéreas superiores e inferiores tem uma estrutura semelhante e apresenta reaçoes inflamatórias semelhantes a irritantes e alérgenos. Cada vez mais evidências indicam que há uma semelhança notável entre a mucosa nasal e brônquica quanto ao grau de infiltraçao celular ou à expressao de citocinas durante a inflamaçao alérgica12,13. Entretanto, ocorrem alteraçoes mínimas na mucosa nasal em casos de RA diferentes daquelas presentes em casos de asma.
Na asma alérgica e na RA, os alérgenos inalantes penetram no revestimento mucociliar e ingressam no epitélio através das junçoes estreitas que circundam a zona apical das células ou através da captaçao direta pelas células. Os alérgenos sao apresentados às células T, que entao reagem com expansao de células Th2 (células T secretoras de IL-4, IL-5 e IL-13) que incitam a produçao de IgE através da interaçao com células B. Posteriormente, a IgE se liga a receptores de alta afinidade para IgE (FcεR1) nos mastócitos, e o cross-linking da IgE na superfície de mastócitos por alérgenos específicos causa ativaçao do mastócito e liberaçao de mediadores como histamina e leucotrienos. Eles aumentam a permeabilidade vascular e iniciam um efeito cascata que inclui o recrutamento de mais células inflamatórias e uma maior liberaçao de mediadores pró-inflamatórios.
Mastócitos e basófilos
Mastócitos sao fundamentais em mediar a fase inicial da resposta inflamatória na RA e na asma. Entretanto, descobriu-se mais recentemente que os mastócitos nao sao apenas células efetoras da resposta da fase imediata, mas também tem um papel na inflamaçao alérgica contínua. Eles armazenam e produzem citocinas do tipo Th2 e quimiocinas, induzem a síntese de IgE em células B14,15 e expressam o receptor de cisteinil leucotrieno 1 (cysteinyl leukotriene 1, CysLT1)16, o receptor de glucocorticoide (glucocorticoid receptor, GR)17 e SAF-218, além de promover aumento da produçao de citocinas/quimiocinas nas células epiteliais e fibroblastos19.
O acúmulo de mastócitos no epitélio nasal e brônquico, uma característica da RA e da asma atópica, também é relatado na rinite idiopática20. A quimiocina Regulated on Activation Normal T-Cell Expressed and Secreted (RANTES) e o Transforming Growth Factor beta (TGF-beta) estao envolvidos na migraçao intraepitelial de mastócitos19,21. O aumento no número de mastócitos e basófilos ocorre no período de 1 h após provocaçao nasal com alérgenos22. Pacientes com RA com ou sem asma apresentam um número semelhante de mastócitos intraepiteliais23, e a provocaçao dos brônquios segmentares induz a um aumento no número de basófilos e eosinófilos nos lavados nasal e broncoalveolar24-27.
Os mastócitos das vias aéreas, estimulados através do FcεRI, sao uma fonte importante de citocinas Th2, citocinas pró-inflamatórias como o fator de necrose tumoral [tumor necrosis factor alpha (TNF-alfa), pré-formado nos mastócitos] e quimiocinas como a citocina semelhante à IL-7 denominada linfopoietina estromal tímica (thymic stromal lymphopoietin, TSLP)28,29. A produçao de TSLP mediada por FcεRI nos mastócitos é ainda mais intensificada de forma autócrina pela IL-430. Além disso, os mastócitos podem interagir com células estruturais (por exemplo, células epiteliais) para intensificar a produçao de citocinas e quimiocinas nas células epiteliais. O TNF-alfa, em conjunto com a IL-4 e a IL-13, aumenta a produçao de thymus and activation-regulated cytokine (TARC), TSLP e eotaxina nas células epiteliais19. Isso resulta no aumento da infiltraçao de células Th2 e eosinófilos e também na diferenciaçao de células dendríticas. Além disso, a triptase e a quimase dos mastócitos podem promover aumento da produçao da RANTES e do fator estimulador de colônias de granulócitos e macrófagos (granulocyte-macrophage colony-stimulating factor, GMCSF) nas células epiteliais19. O TNF-alfa também promove neutrofilia dependente do antígeno e da célula Th17 após estímulo alergênico e induz a migraçao das células dendríticas31,32. Foi demonstrado que mastócitos murinos induzem a migraçao de células CD4+T in vitro mas causam diminuiçao da expressao de FcεR1 em células T reguladoras (células Treg), enquanto células Treg ativadas suprimem a expressao de FcεR1 nos mastócitos.
Os mastócitos podem induzir a síntese de IgE em células B e observou-se que a síntese de IgE ocorre localmente na mucosa nasal de pacientes com RA33,34. Tanto a IL-4 quanto a IgE podem promover aumento da expressao do FcεRI em mastócitos, o que sugere que a cascata formada por mastócito-IgE-receptor de IgE exerce um papel fundamental na inflamaçao contínua em casos de RA e de asma34. Também foi sugerido que os mastócitos atuam na apresentaçao antigênica35. Enquanto tradicionalmente a ativaçao dos mastócitos ocorre após o cross-linking de anticorpos IgE ligados ao FcεR1 por alérgenos, mastócitos também podem ser ativados através de muitos outros mecanismos, por exemplo, receptores de complemento e receptores do tipo Toll (Toll-like receptors, TLRs), mesmo na ausência de estimulaçao do FcεR136-40.
Basófilos aumentam na secreçao nasal e no lavado broncoalveolar de pacientes com RA e asma. Assim como os mastócitos, os basófilos também podem iniciar inflamaçao alérgica através da ligaçao de anticorpos IgE específicos para alérgenos ao FcεR1 na superfície do basófilo41. Basófilos também incitam a diferenciaçao Th2 de células T CD4+ virgens através da produçao de IL-4 e do contato direto célula-célula42. Os basófilos também expressam níveis elevados de FcεRI em pacientes com RA ou asma atópica. A diminuiçao da expressao de FcεRI em basófilos e mastócitos representa um dos mecanismos do anticorpo monoclonal anti-IgE (omalizumabe).
Eosinófilos e neutrófilos
O número de eosinófilos aumenta tanto na resposta de fase inicial quanto na de fase tardia da RA44 e está correlacionado com fluxo nasal, níveis de IL-4, IL-5, IL-8 e interferon gama, valores espirométricos, teste de metacolina positivo, porcentagem do VEF1 em relaçao ao predito, e hiper-reatividade brônquica. O número de eosinófilos encontra-se elevado em pacientes atópicos sintomáticos e aumenta tanto no epitélio nasal quanto no brônquico, e também na lâmina própria, após provocaçao nasal com alérgenos22,55-57. Eosinófilos sao uma fonte importante do fator inibidor de migraçao de macrófagos (macrophage migration inhibitory factor, MIF)58 e fator de crescimento neuronal (nerve growth factor, NGF)59; expressam 5-lipoxigenase (5-LO), proteína ativadora da 5-lipoxigenase (five-lipoxygenase activating protein, FLAP), leucotrieno C4 sintase (leukotriene C4 syntase, LTC4S), e receptores de CysLT1 e CysLT260; estao envolvidos na perda de integridade epitelial61; e podem ser observados na mucosa esofágica de pacientes sintomáticos com alergia respiratória62.
A IL-5 exerce um papel chave na modulaçao da diferenciaçao e da sobrevida dos eosinófilos. O uso de terapia anti-IL-5 como estratégia terapêutica para asma alérgica levou a uma notável reduçao no número de eosinófilos no sangue periférico, mas resultou em apenas uma reversao parcial da resposta pulmonar eosinofílica e teve um impacto mínimo nos desfechos clínicos63,64. Mais recentemente, em uma amostra de pacientes com asma eosinofílica refratária, a terapia com anticorpos monoclonais anti-IL-5 (mepolizumab) reduziu os níveis de eosinófilos tanto no sangue periférico quanto no escarro, as exacerbaçao de asma, além de resultar em uma reduçao na dose de corticosteroides orais65,66.
Os quimioatraentes dos eosinófilos incluem eotaxina, proteína quimiotática de macrófagos/monócitos 4 (MCP4), RANTES e CysLT, entre outros67,88. Eles atuam, mas nao de forma exclusiva, em diferentes receptores da superfície celular [por exemplo, receptor de quimiocina CC 3 (CC chemokine receptor 3, CCR3) e CysLT1 presentes do eosinófilo. Provocaçoes com leucotrieno E4 (LTE4) ou LTD4 resultam em um aumento na secreçao e na obstruçao nasal na RA, e em um grande aumento no número de eosinófilos na parede brônquica67,68. O receptor de CysLT1 é expresso em uma variedade de células inflamatórias nasais e brônquicas, incluindo eosinófilos, basófilos, mastócitos, macrófagos, linfócitos B e plasmócitos69. O número dessas células inflamatórias que expressam o receptor CysLT1 também aumenta na RA e na asma, e há um aumento ainda mais significativo em pacientes com exacerbaçao grave da asma que levou à hospitalizaçao70.
Eosinófilos ativados liberam grânulos altamente tóxicos, o que tem como provável funçao evolutiva matar invasores potencialmente perigosos. Especialmente na asma, substâncias derivadas dos eosinófilos danificam a superfície das células epiteliais, o que afrouxa a ligaçao entre elas e resulta no desprendimento de células em direçao ao lúmen das vias aéreas, onde se misturam a eosinófilos, neutrófilos e muco.
Linfócitos T
Em pacientes com RA perene (RAP), há um aumento no número de linfócitos T CD3+, CD25+ (ativadas) e CD45RA+ (virgens) na mucosa nasal. O número de células T de memória na RAP, e o número de células T CD8+ na rinite idiopática apresentam correlaçao com o número de mastócitos de mucosa.71. Enquanto o CD86 é expressado em células T CD19, CD1a, CD14 e CD3 na RAP, CD80, CD28 e CD152 sao expressados após provaçao nasal com alérgenos72. Além disso, há um aumento no número de células CCR4+ CD4 na RA73. Além de citocinas Th2 e quimiocinas, células T expressam IL-1674 e receptores CXCR175 e CX(3)CR(1)76 na RA. Há um aumento no número de células T gama delta na mucosa em casos de RAP e asma; além disso, essas células induzem a síntese de IgE em células B e a proliferaçao de células T77. O número de células B CD23+ aumenta na RAP, mas nao está correlacionado com o número de células Th2 na mucosa73.
Embora, convencionalmente, se considere que tanto a RA quanto a asma alérgica sejam resultantes da ruptura do equilíbrio Th1/Th2 normal, evidências mais recentes apontam para o papel das células Th17, uma subpopulaçao diferente de células T CD4+ que produzem IL-17A, IL-17F, IL-22, TNF-alfa e IL-2178. Foram encontradas células Th17 na mucosa nasal de pacientes com RA79 e em biópsias brônquicas de asmáticos80. A IL-17 induz a liberaçao de citocinas/quimiocinas pró-inflamatórias a partir de uma variedade de tipos celulares e está relacionada ao desenvolvimento de neutrofilia nas vias aéreas. Além disso, sua presença em vias aéreas asmáticas está correlacionada a um aumento na gravidade da doença. As células Treg atuam na determinaçao da autotolerância e na regulaçao de respostas imunes. As células Th17 e Treg têm açoes opostas, e há um aumento no número de células Treg, que secretam IL-10 e TGF-beta, em pacientes após imunoterapia.
Neutrófilos
Embora pacientes com rinite infecciosa nao alérgica e rinossinusite crônica apresentem predominantemente um maior número de neutrófilos, o aumento na expressao de marcadores de ativaçao em neutrófilos e nos níveis de mieloperoxidase (MPO) na RA, assim como o aumento no número de neutrófilos em lavado broncoalveolar após provocaçao nasal com alérgenos, sugerem que os neutrófilos desempenham um papel importante na RA25,81. Nas exacerbaçoes agudas graves da asma, há um aumento no número de eosinófilos e neutrófilos no interior das vias aéreas, com um aumento proporcionalmente maior no número de neutrófilos82. Corticosteroides inalatórios reduzem o número de eosinófilos nas vias aéreas, mas aumentam o número de neutrófilos e do quimioatraente IL-8, levando à perda de controle da asma.
Células epiteliais
Convencionalmente, tem-se considerado que as células epiteliais presentes na interface entre o ambiente externo e o hospedeiro exercem um papel importante como barreira de defesa contra agentes ambientais. Entretanto, ao longo dos últimos anos o papel das células epiteliais como células efetoras tem se tornado mais evidente, diretamente através da açao de mediadores inflamatórios e também através da interaçao célula-célula com células imunes. Além disso, sua posiçao decisiva na sua posiçao decisiva no desenvolvimento do remodelamento das via aéreas e na proliferaçao de fibroblastos também é crucial84.
As células epiteliais das vias aéreas sao fonte importante de uma variedade de mediadores inflamatórios, incluindo citocinas multifuncionais e quimiocinas como IL-1, IL-6, IL-8, TNF-alfa, GMCSF, RANTES, eotaxina, TARC, o que leva ao seu papel crucial na migraçao e ativaçao de células imunes como eosinófilos, basófilos e células Th285,86. Mais recentemente, observou-se um aumento de TSLP derivado de células epiteliais na mucosa nasal de pacientes com RA e nas vias aéreas asmáticas87. O TSLP pode ativar as células dendríticas, promover respostas Th2 e ativar mastócitos30. As células epiteliais também expressam moléculas coestimuladoras como CD86 e HLA-DR; além disso, CD86 e FcεRI podendo apresentar antígenos às células T88,89. Material particulado como partículas de exaustao do diesel podem induzir a liberaçao de mediadores pró-inflamatórios e intensificar a expressao de moléculas coestimuladoras nas células epiteliais. A expressao de IL-17F nas vias aéreas de asmáticos está correlacionada com a gravidade da doença e induz várias moléculas relacionadas à asma, como CCL20, que podem atrair células Th17 para dentro das vias aéreas, amplificando assim a inflamaçao das vias aéreas. Um estudo recente demonstrou que células epiteliais brônquicas expressam IL-17F em resposta a IL-33 através da via sinalizadora ST2-ERK1/2-MSK190. Além disso, a IL-17F está envolvida no remodelamento das vias aéreas e resistência a esteroides, podendo, portanto ser um importante alvo terapêutico para o desenvolvimento de novas estratégias. Recentemente, a importância de medidas de periostina sérica e o papel do tratamento com anti IL-13 em pacientes com altos níveis de periostina, e o efeito do tratamento com anti IL-5 em pacientes sensíveis a esteroides e com altos níveis de eosinófilos, demonstraram que existem fenótipos e endótipos de asma.
REMODELAMENTO NA ASMA
O remodelamento é definido como uma mudança na estrutura que é inapropriada para manter a funçao normal das vias aéreas91,92. Algumas características do remodelamento sao evidentes, mesmo em asmáticos recém-diagnosticados ou leves, como fragilidade epitelial e espessamento da membrana basal reticular. Com o aumento da gravidade da asma, as alteraçoes tornamse mais pronunciadas e evidentes: aumento na massa do músculo liso das vias aéreas, na vascularizaçao, no número de fibroblastos e no colágeno intersticial, além de hipertrofia das glândulas mucosas93. Essas alteraçoes parecem ser mais importantes nas vias aéreas maiores e mais proximais. O espessamento da membrana basal reticular ocorre precocemente na asma, até mesmo antes do diagnóstico, e é detectado em crianças com asma leve94. Em crianças em idade escolar com idade entre 6 e 16 anos com asma grave, o espessamento já atingiu seu nível máximo, mas este nao se encontra relacionado à idade ou à duraçao dos sintomas9. Essas alteraçoes aparecem em pré-escolares com sibilância aos 29 meses de idade7. Bourdin et al.95 demonstraram recentemente que o espessamento da membrana basal reticular é um marco da asma grave mas nao da asma leve ou da doença pulmonar obstrutiva crônica (DPOC).
O músculo liso das vias aéreas circunda as vias aéreas como duas hélices opostas, isto é, em um padrao geodésico, e à medida que encurta, o músculo se contrai e também tende a encurtar as vias aéreas contra uma carga elástica. Observa-se um aumento da massa do músculo liso das vias aéreas em vias aéreas asmáticas96. As células do músculo liso das vias aéreas têm a capacidade de secretar mediadores que podem promover quimiotaxia, proliferaçao e aumento da sobrevida dos mastócitos, enquanto a interaçao célula-célula entre músculo liso das vias aéreas e mastócitos intensifica a ativaçao e degranulaçao dos mastócitos induzida pelo complemento. Mastócitos do pulmao humano migram na direçao de células do músculo liso das vias aéreas de asmáticos estimuladas por citocina Th2, enquanto que sobrenadantes obtidos a partir de culturas de células do músculo liso de nao-asmáticos inibem esta quimiotaxia100. Um grande número de mastócitos foi encontrado entre células da musculatura lisa de brônquios de asmáticos, e mediadores de mastócitos, como triptase e citocinas, pode modular a funçao das células do músculo liso das vias aéreas. Os mastócitos também expressam metalopeptidase da matriz (MMP9) e contribuem para muitas características da asma crônica, além de desempenharem um papel importante no remodelamento tecidual19.
Experimentos com células epiteliais brônquicas demonstraram que a sinalizaçao dos TLRs atua na ativaçao do receptor do fator de crescimento epidérmico, sugerindo que os TLRs atuam na potencializaçao do remodelamento. Nas vias aéreas asmáticas, há um aumento no número de miofibroblastos subepiteliais, e a provocaçao com alérgenos em asmáticos leva a um aumento no acúmulo de miofibroblastos na mucosa das vias aéreas84,102. A histamina pode induzir a transiçao de fibroblastos para miofibroblastos (como a expressao da actina alfa de músculo liso) e induz a expressao do fator de crescimento do tecido conjuntivo em fibroblastos, sugerindo que a histamina tem a capacidade de participar no processo de remodelamento102,103. A infiltraçao fibroblástica do pulmao pode ser secundária ao recrutamento de progenitores circulantes de fibrócitos derivados da medula óssea para as vias aéreas e à proliferaçao e expansao de fibroblastos, ou, possivelmente, as células epiteliais podem sofrer uma alteraçao fenotípica e se transformarem em fibroblastos efetores através de um processo denominado transiçao epitelial-mesenquimal. As células epiteliais das vias aéreas derivadas de asmáticos demonstraram maior susceptibilidade à transiçao epitelial-mesenquimal induzida por TGFβ do que as células derivadas de indivíduos normais104. Além da estimulaçao das células epiteliais e síntese da matriz extracelular, o TGFβ pode provocar outras respostas nos fibroblastos brônquicos, incluindo o estímulo à sua proliferaçao e à síntese de uma série de fatores de crescimento. Além disso, também tem efeito sobre o gene de susceptibilidade para a asma, uma desintegrina e metaloproteinase (a disintegrin and metalloprotease, ADAM)33, que foi implicado no remodelamento da asma.
A medida da funçao pulmonar (por exemplo, VEF1) pode fornecer informaçoes indiretas sobre a inflamaçao das vias aéreas e alteraçoes estruturais a longo prazo, mas nao consegue detectar processos inflamatórios iniciais. Tais alteraçoes inflamatórias podem ocorrem até mesmo em pacientes com funçao pulmonar normal mas com sintomas indicativos de asma105. Por outro lado, lactentes sintomáticos que apresentem obstruçao ao fluxo aéreo reversível podem nao apresentar eosinofilia ou remodelamento da mucosa brônquica8.
O quanto é precoce o início do remodelamento
Estudos de biópsias das vias aéreas em crianças sugerem que alteraçoes patológicas como perda epitelial, espessamento da membrana basal e angiogênese ocorrem precocemente nas vias aéreas asmáticas. Um estudo com crianças com asma de difícil controle (idade média de 13 anos, variaçao de 6-16) recrutadas para investigar se o espessamento na membrana basal reticular poderia ocorrer na asma infantil9 demonstrou a presença desse fenômeno nas vias aéreas. Em outro estudo, Barbato et al. examinaram amostras de biópsias das vias aéreas de um grupo de crianças que incluiu nove crianças com asma (idade de 4-12 anos), seis crianças atópicas sem asma (idade de 4-12 anos), e oito crianças controle sem atopia nem asma para esclarecer se a inflamaçao e o remodelamento das vias aéreas poderiam ocorrer até mesmo na asma infantil leve92, demonstrando que eosinofilia das vias aéreas e espessamento da membrana basal estiveram presentes em crianças com asma leve, e até mesmo em crianças atópicas sem asma. Isso indica que 1) a inflamaçao das vias aéreas demonstrada pela eosinofilia das vias aéreas ocorre tanto na asma leve quanto na asma de difícil controle, 2) a inflamaçao das vias aéreas ocorre nas vias aéreas antes do desenvolvimento de sibilos episódicos, embora a sintomatologia da asma seja difícil de estabelecer em crianças, 3) a presença tanto de inflamaçao quanto de remodelamento das vias aéreas indica que o processo de remodelamento inicia-se precocemente no processo asmático e ocorre de forma sincrônica com a inflamaçao recorrente e contínua das vias aéreas, e nao como um evento subsequente à inflamaçao das vias aéreas.
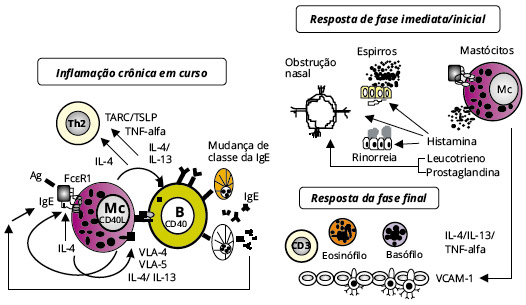
Figura 1 - Mecanismos inflamatórios na rinite alérgica (Modificado de Pawankar et al. Allergic Rhinitis pathomechanisms)
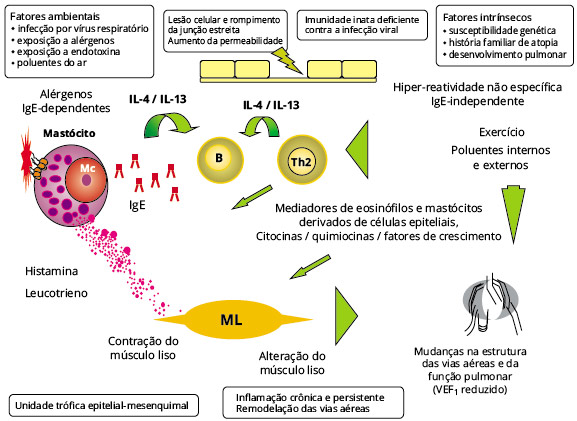
Figura 2 - Mecanismos patológicos da asma
RESUMO
Com um número cada vez maior de evidências a respeito da relaçao entre RA e asma provenientes de estudos epidemiológicos, imunológicos e clínicos, a intervençao precoce e a diminuiçao da inflamaçao sao fundamentais para o melhor controle tanto da RA quanto da asma. Novos modos de terapia imunomoduladora e biológica direcionados a fenótipos específicos como IgE, IL-5, IL-13 e cadeia alfa do receptor de IL-4 demonstraram ser eficazes em pacientes fenotipados. Para aqueles que nao apresentaram evidência de inflamaçao Th2, nao foram identificadas terapias específicas. Anti-IgE, anti-IL-5, anti-IL-13, antagonista do receptor de IL-4 anti-IL4R, e terapias direcionadas a TSLP, IL-33, IL-17, assim como aquelas que induzem tolerância, apresentam resultados mais promissores, mas seu efeito na interrupçao do remodelamento das vias aéreas nao é conhecido. Uma análise de grupos realizada pelo Severe Asthma Research Program (SARP) identificou 5 subfenótipos da asma que representam o espectro de gravidade da asma alérgica de início precoce, asma grave de início tardio, e asma grave com características de DPOC. Uma análise do escarro induzido de um subgrupo de indivíduos do SARP demonstrou 4 padroes de células inflamatórias no escarro. Indivíduos com aumento concomitante na porcentagem de eosinófilos (> 2%) e de neutrófilos (> 40%) apresentam características de asma muito grave. Essa abordagem multivariada identificou 4 subfenótipos de asma representando o espectro de gravidade que vai de asma alérgica de leve a moderada com inflamaçao mínima ou predominância de eosinófilos no escarro até asma de moderada a grave com predominância de neutrófilos ou inflamaçao granulocítica mista106.
Devido às semelhanças imunológicas existentes entre os padroes de inflamaçao na asma e na RA, e também na rinossinusite e na asma crônica, além do impacto da RA na asma, o tratamento deve focar em uma abordagem global para tratar tanto as vias aéreas superiores quanto as inferiores, com vistas a obter melhores resultados.
REFERECIAS
1. Bousquet J, Jeffery PK, Busse WW, Johnson M, Vignola AM. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med. 2000;161(5):1720-45.
2. Kabesch M, Schedel M, Carr D, et al. IL-4/IL-13 pathway genetics strongly infl uence serum IgE levels and childhood asthma. J Allergy Clin Immunol. 2006;117(2):269-74.
3. Loza MJ, Chang BL. Association between Q551R IL4R genetic variants and atopic asthma risk demonstrated by meta-analysis. J Allergy Clin Immunol. 2007;120(3):578-85.
4. Holgate ST. The mechanisms diagnosis, and management of severe asthma in adults. Lancet. 2006;368:780-93.
5. Bai TR, Cooper J, Koelmeyer T, Pare PD, Weir TD. The effect of age and duration of disease on airway structure in fatal asthma. Am J Respir Crit Care Med. 2000,162(2 Pt 1):663-9.
6. Humbles AA, Lloyd CM, McMillan SJ, Friend DS, Xanthou G, McKenna EE, et al. A critical role for eosinophils in allergic airways remodeling. Science. 2004;305(5691):1776-9.
7. Siddiqui S, Sutcliffe A, Shikotra A, Woodman L, Doe C, McKenna S, et al. Vascular remodeling is a feature of asthma and nonasthmatic eosinophilic bronchitis. J Allergy Clin Immunol. 2007;120:813-9.
8. Saglani S, Malmstrom K, Pelkonen AS, Malomberg P, Lindahl H, Kajosaari M, et al. Airway remodeling and inflammation in symptomatic infants with reversible airflow obstruction. Am J Respir Crit Care Med. 2005;171;722-77.
9. Payne DN, Rogers AV, Adelroth E, Bandi V, Guntupalli KK, Bush A, et al. Early thickening of the reticular basement membrane in children with difficult asthma. Am J Respir Crit Care Med. 2003;167(1):78-82.
10. Saglani S, Payne DN, Nicholson AG, Jeffery PK, Bush A. Thickening of the epithelial reticular basement membrane in pre-school children with troublesome wheeze. In: American Thoracic Society. 2005;2005:A515.
11. Saglani S, Payne DN, Zhu J, Wang Z, Nicholson AG, Bush A, Jeffery PK. Early detection of airway remodeling and eosinophilic inflammation in preschool wheezers. Am J Respir Crit Care Med. 2007;176:858-64.
12. Pawankar R. Allergic rhinitis and asthma: are they manifestations of one syndrome? Clin Exp Allergy. 2006 Jan;36(1):1-4.
13. Cruz AA, Popov T, Pawankar R, Annesi-Maesano I, Fokkens W, Kemp J, et al. ARIA Initiative Scientific Committee. Common characteristics of upper and lower airways in rhinitis and asthma: ARIA update, in collaboration with GA(2)LEN. Allergy. 2007;62 Suppl 84:1-41.
14. Wilson AM, Duong M, Crawford L, Denburg J. An evaluation of peripheral blood eosinophil/basophil progenitors following nasal allergen challenge in patients with allergic rhinitis. Clin Exp Allergy. 2005;35(1):39-44.
15. Pawankar R, Yamagishi S, Yagi T. Revisiting the roles of mast cells in allergic rhinitis and its relation to local IgE synthesis. Am J Rhinol. 2000;14(5):309-17.
16. Shirasaki H, Kanaizumi E, Watanabe K, Matsui T, Sato J, Narita S, et al. Expression and localization of the cysteinyl leukotriene 1 receptor in human nasal mucosa. Clin Exp Allergy. 2002;32(7):1007-12.
17. Shirasaki H, Watanabe K, Kanaizumi E, Konno N, Sato J, Narita S, et al. Expression and localization of steroid receptors in human nasal mucosa. Acta Otolaryngol. 2004;124(8):958-63.
18. Kikly KK, Bochner BS, Freeman SD, Tan KB, Gallagher KT, D'alessio KJ, et al. Identification of SAF-2, a novel siglec expressed on eosinophils, mast cells, and basophils. J Allergy Clin Immunol. 2000;105(6 Pt 1):1093-100.
19. Pawankar R. Mast cells in allergic airway disease and chronic rhinosinusitis. Chem Immunol Allergy. 2005;87:111-29.
20. Powe DG, Hiskisson RS, Carney AS, Jenkins D, Jones NS. Idiopathic and allergic rhinitis show a similar inflammatory response. Clin Otolaryngol Allied Sci. 2000;25(6):570-6.
21. Salib RJ, Kumar S, Wilson SJ, Howarth PH. Nasal mucosal immunoexpression of the mast cell chemoattractants TGF-beta, eotaxin, and stem cell factor and their receptors in allergic rhinitis43: J Allergy Clin Immunol. 2004;114(4):799-806.
22. KleinJan A, McEuen AR, Dijkstra MD, Buckley MG, Walls AF, Fokkens WJ. Basophil and eosinophil accumulation and mast cell degranulation in the nasal mucosa of patients with hay fever after local allergen provocation. J Allergy Clin Immunol. 2000;106(4):677-86.
23. Braunstahl GJ, Fokkens WJ, Overbeek SE, KleinJan A, Hoogsteden HC, Prins JB. Mucosal and systemic inflammatory changes in allergic rhinitis and asthma: a comparison between upper and lower airways. Clin Exp Allergy. 2003;33(5):579-87.
24. Braunstahl GJ, Overbeek SE, Fokkens WJ, Kleinjan A, McEuen AR, Walls AF, et al. Segmental bronchoprovocation in allergic rhinitis patients affects mast cell and basophil numbers in nasal and bronchial mucosa. Am J Respir Crit Care Med. 2001a;164(5):858-65.
25. Gorski P, Krakowiak A, Ruta U. Nasal and bronchial responses to flour-inhalation in subjects with occupationally induced allergy affecting the airway. Int Arch Occup Environ Health. 2000;73(7):488-97.
26. Krakowiak A, Ruta U, Gorski P, Kowalska S, Palczynski C. Nasal lavage fluid examination and rhinomanometry in the diagnostics of occupational airway allergy to laboratory animals. Int J Occup Med Environ Health. 2003;16(2):125-32.
27. Palczynski C, Walusiak J, Krakowiak A, Szymczak W, Wittczak T, Ruta U, et al. Nasal lavage fluid examination in diagnostics of occupational allergy to chloramine. Int J Occup Med Environ Health. 2003;16(3):231-40.
28. Bradding P, Holgate ST. The mast cell as a source of cytokines in asthma. Ann N Y Acad Sci. 1996;Oct 31;796:272-81.
29. Pawankar R, Okuda M, Hasegawa S, Suzuki K, Yssel H, Okubo K, et al. Interleukin-13 expression in the nasal mucosa of perennial allergic rhinitis. Am J Respir Crit Care Med. 1995 Dec;152(6 Pt 1):2059-67.
30. Okayama Y, Okumura S, Sagara H, Yuki K, Sasaki T, Watanabe N, et al. FcepsilonRI-mediated thymic stromal lymphopoietin production by interleukin-4-primed human mast cells. Eur Respir J. 2009 Aug;34(2):425-35.
31. Nakae S, Suto H, Berry GJ, Galli SJ. Mast cell-derived TNF can promote Th17 cell-dependent neutrophil recruitment in ovalbumin-challenged OTII mice. Blood. 2007;109(9):3640-8.
32. Suto H, Nakae S, Kakurai M, Sedgwick JD, Tsai M, Galli SJ. Mast cell-associated TNF promotes dendritic cell migration. J Immunol. 2006;176:4102-12.
33. Pawankar R, Okuda M, Yssel H, Okumura K, Ra C. Nasal mast cells in perennial allergic rhinitics exhibit increased expression of the Fc epsilonRI, CD40L, IL-4, and IL-13, and can induce IgE synthesis in B cells. J Clin Invest. 1997;99(7):1492-9.
34. Smurthwaite L, Durham SR. Local IgE synthesis in allergic rhinitis and asthma. Curr Allergy Asthma Rep. 2002;2(3):231-8.
35. Kambayashi T, Baranski JD, Baker RG, et al. Indirect involvement of allergen-captured mast cells in antigen presentation. Blood. 2008;111(3):1489-96.
36. Yang Z, Yan WX, Cai H, et al. S100A12 provokes mast cell activation: a potential amplification pathway in asthma and innate immunity. J Allergy Clin Immunol. 2007;119(1):106-14.
37. Kojima T, Obata K, Mukai K, et al. Mast cells and basophils are selectively activated in vitro and in vivo through CD200R3 in an IgE-independent manner. J Immunol. 2007;179(10):7093-100.
38. Ho LH, Ohno T, Oboki K, et al. IL-33 induces IL-13 production by mouse mast cells independently of IgE-FcepsilonRI signals. J Leukoc Biol. 2007;82(6):1481-90.
39. Iikura M, Suto H, Kajiwara N, et al. IL-33 can promote survival, adhesion and cytokine production in human mast cells. Lab Invest. 2007;87(10):971-8.
40. Allakhverdi Z, Smith DE, Comeau MR, Delespesse G. Cutting edge: the ST2 ligand IL-33 potently activates and drives maturation of human mast cells. J Immunol. 2007;179(4):2051-4.
41. Obata K, Mukai K, Tsujimura Y, et al. Basophils are essential initiators of a novel type of chronic allergic infl ammation. Blood. 2007;110(3):913-20.
42. Oh K, Shen T, Le Gros G, Min B. Induction of Th2 type immunity in a mouse system reveals a novel immunoregulatory role of basophils. Blood. 2007;109(7):2921-7.
43. MacGlashan D Jr. IgE and FcepsilonRI regulation. Clin Rev Allergy Immunol. 2005;29(1):49-60.
44. Milanese M, Ricca V, Canonica GW, Ciprandi G. Eosinophils, specific hyperreactivity and occurrence of late phase reaction in allergic rhinitis. Eur Ann Allergy Clin Immunol. 2005;37(1):7-10.
45. Ciprandi G, Vizzaccaro A, Cirillo I, Tosca M, Massolo A, Passalacqua G. Nasal eosinophils display the best correlation with symptoms, pulmonary function and inflammation in allergic rhinitis. Int Arch Allergy Immunol. 2005;136(3):266-72.
46. Ciprandi G, Marseglia GL, Klersy C, Tosca MA. Relationships between allergic inflammation and nasal airflow in children with persistent allergic rhinitis due to mite sensitization. Allergy. 2005b;60(7):957-60.
47. Ciprandi G, Cirillo I, Vizzaccaro A, Milanese M, Tosca MA. Nasal obstruction in patients with seasonal allergic rhinitis: relationships between allergic inflammation and nasal airflow. Int Arch Allergy Immunol. 2004;134(1):34-40.
48. Kurt E, Bavbek S, Aksu O, Erekul S, Misirligil Z. The effect of natural pollen exposure on eosinophil apoptosis and its relationship to bronchial hyperresponsiveness in patients with seasonal allergic rhinitis. Ann Allergy Asthma Immunol. 2005;95(1):72-8.
49. Di Lorenzo G, Pacor ML, Mansueto P, Esposito Pellitteri M, Lo Bianco C, Ditta V, et al. Determinants of bronchial hyperresponsiveness in subjects with rhinitis. Int J Immunopathol Pharmacol. 2005;18(4):715-22.
50. Sale R, Silvestri M, Battistini E, Defilippi AC, Sabatini F, Pecora S, et al. Nasal inflammation and bronchial reactivity to methacholine in atopic children with respiratory symptoms. Allergy. 2003;58(11):1171-5.
51. Jang AS. Nasal eosinophilic inflammation contributes to bronchial hyperresponsiveness in patients with allergic rhinitis. J Korean Med Sci. 2002;17(6):761-4.
52. Silvestri M, Battistini E, Defilippi AC, Sabatini F, Sale R, Pecora S, et al. Early decrease in nasal eosinophil proportion after nasal allergen challenge correlates with baseline bronchial reactivity to methacholine in children sensitized to house dust mites. J Investig Allergol Clin Immunol. 2005;15(4):266-76.
53. Ciprandi G, Cirillo I, Vizzaccaro A, Milanese M, Tosca MA. Correlation of nasal inflammation and nasal airflow with forced expiratory volume in 1 second in patients with perennial allergic rhinitis and asthma. Ann Allergy Asthma Immunol. 2004;93(6):575-80.
54. Ciprandi G, Cirillo I, Vizzaccaro A, Milanese M, Tosca MA. Airway function and nasal inflammation in seasonal allergic rhinitis and asthma. Clin Exp Allergy. 2004c;34(6):891-6.
55. Tatar M, Petriskova J, Zucha J, Pecova R, Hutka Z, Raffajova J, Brozmanova M. Induced sputum eosinophils, bronchial reactivity, and cough sensitivity in subjects with allergic rhinitis. J Physiol Pharmacol. 2005;56(Suppl 4):227-36.
56. Braunstahl GJ, Overbeek SE, Kleinjan A, Prins JB, Hoogsteden HC, Fokkens WJ. Nasal allergen provocation induces adhesion molecule expression and tissue eosinophilia in upper and lower airways. J Allergy Clin Immunol. 2001;107(3):469-76.
57. Braunstahl GJ, Kleinjan A, Overbeek SE, Prins JB, Hoogsteden HC, Fokkens WJ. Segmental bronchial provocation induces nasal inflammation in allergic rhinitis patients. Am J Respir Crit Care Med. 2000;161(6):2051-7.
58. Nakamaru Y, Oridate N, Nishihira J, Takagi D, Furuta Y, Fukuda S. Macrophage migration inhibitory factor in allergic rhinitis: its identification in eosinophils at the site of inflammation. Ann Otol Rhinol Laryngol. 2004;113(3 Pt 1):205-9.
59. Kobayashi H, Gleich GJ, Butterfield JH, Kita H. Human eosinophils produce neurotrophins and secrete nerve growth factor on immunologic stimuli. Blood. 2002;99(6):2214-20.
60. Figueroa DJ, Borish L, Baramki D, Philip G, Austin CP, Evans JF. Expression of cysteinyl leukotriene synthetic and signalling proteins in inflammatory cells in active seasonal allergic rhinitis. Clin Exp Allergy. 2003;33(10):1380-8.
61. Amin K, Rinne J, Haahtela T, Simola M, Peterson CG, Roomans GM, et al. Inflammatory cell and epithelial characteristics of perennial allergic and nonallergic rhinitis with a symptom history of 1 to 3 years' duration. J Allergy Clin Immunol. 2001;107(2):249-57.
62. Onbasi K, Sin AZ, Doganavsargil B, Onder GF, Bor S, Sebik F. Eosinophil infiltration of the oesophageal mucosa in patients with pollen allergy during the season. Clin Exp Allergy. 2005;35(11):1423-31.
63. Flood-Page P, Swenson C, Faiferman I, et al. International Mepolizumab Study Group. A study to evaluate safety and efficacy of mepolizumab in patients with moderate persistent asthma. Am J Respir Crit Care Med. 2007;176(11):1062-71.
64. Flood-Page PT, Menzies-Gow AN, Kay AB, Robinson DS. Eosinophil's role remains uncertain as anti-interleukin-5 only partially depletes numbers in asthmatic airway. Am J Respir Crit Care Med. 2003;167(2):199-204.
65. Haldar P, Brightling CE, Hargadon B, et al. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009;360(10):973-84.
66. Nair P, Pizzichini MM, Kjarsgaard M, et al. Mepolizumab for prednisone-dependent asthma with sputum eosinophilia. N Engl J Med. 2009;360(10):985-93.
67. Pawankar R. Inflammatory mechanisms in allergic rhinitis. Curr Opin Allergy Clin Immunol. 2007 Feb;7(1):1-4.
68. Nonaka M, Pawankar R, Fukumoto A, Ogihara N, Sakanushi A, Yagi T. Induction of eotaxin production by interleukin-4, interleukin-13 and lipopolysaccharide by nasal fibroblasts. Clin Exp Allergy. 2004 May;34(5):804-11.
69. Parnes SM. Targeting cysteinyl leukotrienes in patients with rhinitis, sinusitis and paranasal polyps. Am J Respir Med. 2002;1(6):403-8.
70. Zhu J, Qiu YS, Figueroa DJ, Bandi V, Galczenski H, Hamada K,et al. Localization and upregulation of cysteinyl leukotriene-1 receptor in asthmatic bronchial mucosa. Am J Respir Cell Mol Biol. 2005 Dec;33(6):531-40.
71. Powe DG, Huskisson RS, Carney AS, Jenkins D, McEuen AR, Walls AF, et al. Mucosal T-cell phenotypes in persistent atopic and nonatopic rhinitis show an association with mast cells. Allergy. 2004;59(2):204-12.
72. Hattori H, Okano M, Yoshino T, Akagi T, Nakayama E, Saito C, et al. Expression of costimulatory CD80/CD86-CD28/CD152 molecules in nasal mucosa of patients with perennial allergic rhinitis. Clin Exp Allergy. 2001;31(8):1242-9.
73. Horiguchi S, Okamoto Y, Chazono H, Sakurai D, Kobayashi K. Expression of membrane-bound CD23 in nasal mucosal B cells from patients with perennial allergic rhinitis. Ann Allergy Asthma Immunol. 2005;94(2):286-91.
74. Karaki M, Dobashi H, Kobayashi R, Tokuda M, Ishida T, Mori N. Expression of interleukin-16 in allergic rhinitis. Int Arch Allergy Immunol. 2005;138(1):67-72.
75. Francis JN, Jacobson MR, Lloyd CM, Sabroe I, Durham SR, Till SJ. CXCR1+CD4+ T cells in human allergic disease. J Immunol. 2004;172(1):268-73.
76. Rimaniol AC, Till SJ, Garcia G, Capel F, Godot V, Balabanian K, et al. The CX3C chemokine fractalkine in allergic asthma and rhinitis. J Allergy Clin Immunol. 2003;112(6):1139-46.
77. Pawankar R. Gamma-delta T cells in allergic airway diseases. Clin Exp Allergy. 2000;30(3):318-23.
78. Miossec P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells. N Engl J Med. 2009;361(9):888-98.
79. Han D, Wang C, Lou W, Gu Y, Wang Y, Zhang L. Allergen-specific IL-10-secreting type I T regulatory cells, but not CD4(+)CD25(+)Foxp3(+) T cells, are decreased in peripheral blood of patients with persistent allergic rhinitis. Clin Immunol. 2010 Aug;136(2):292-301.
80. Pène J, Chevalier S, Preisser L, et al. Chronically inflamed human tissues are infiltrated by highly differentiated Th17 lymphocytes. J Immunol. 2008;180(11):7423-30.
81. Kinhult J, Egesten A, Benson M, Uddman R, Cardell LO. Increased expression of surface activation markers on neutrophils following migration into the nasal lumen. Clin Exp Allergy. 2003;33(8):1141-6.
82. Qiu Y, Zhu J, Bandi V, Guntupalli KK, Jeffery PK. Bronchial mucosal infl ammation and upregulation of CXC chemoattractants and receptors in severe exacerbations of asthma. Thorax. 2007;62(6):475-82.
83. Maneechotesuwan K, Essilfi-Quaye S, Kharitonov SA, Adcock IM, Barnes PJ. Loss of control of asthma following inhaled corticosteroid withdrawal is associated with increased sputum interleukin-8 and neutrophils. Chest. 2007;132(1):98-105.
84. Holgate ST. Epithelium dysfunction in asthma. J Allergy Clin Immunol. 2007;120(6):1233-44.
85. Takizawa H. Bronchial epithelial cells in allergic reactions. Curr Drug Targets Inflamm Allergy. 2005 Jun;4(3):305-11.
86. Pawankar R. Epithelial cells as immunoregulators in allergic airway diseases. Curr Opin Allergy Clin Immunol. 2002 Feb;2(1):1-5.
87. Ying S, O'Connor B, Ratoff J, Meng Q, Fang C, Cousins D, et al. Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J Immunol. 2008 Aug15;181(4):2790-8.
88. Gereke M, Jung S, Buer J, Bruder D. Alveolar type II epithelial cells present antigen to CD4+ T cells and induce Foxp3(1) regulatory T cells. Am J Respir Crit Care Med. 2009;179(5):344-55.
89. Takizawa R, Pawankar R, Yamagishi S, Takenaka H, Yagi T. Increased expression of HLA-DR and CD86 in nasal epithelial cells in allergic rhinitics: antigen presentation to T cells and up-regulation by diesel exhaust particles. Clin Exp Allergy. 2007 Mar;37(3):420-33.
90. Ota K, Kawaguchi M, Matsukura S, Kurokawa M, Kokubu F, Fujita J, et al. Potential involvement of IL-17F in asthma. J Immunol Res. 2014;2014:602846.
91. Mauad T, Bel EH, Sterk PJ. Asthma therapy and airway remodeling. J Allergy Clin Immunol. 2007 Nov;120(5):997-1009.
92. Jeffery PK. Remodeling and inflammation of bronchi in asthma and chronic obstructive pulmonary disease. Proc Am Thorac Soc. 2004;1(3):176-83.
93. Barbato A, Turato G, Baraldo S, Bazzan E, Calabrese F, Tura M, et al. Airway inflammation in childhood asthma. Am J Respir Crit Care Med. 2003,168(7):798-803.
94. Bourdin A, Neveu D, Vachier I, Paganin F, Godard P, Chanez P. Specificity of basement membrane thickening in severe asthma. J Allergy Clin Immunol. 2007;119:1367-74.
95. Panettieri RA Jr, Kotlikoff MI, Gerthoffer WT, Hershenson MB, Woodruff PG, Hall IP, Banks-Schlegel S; National Heart, Lung, and Blood Institute. Airway smooth muscle in bronchial tone, infl ammation, and remodeling: basic knowledge to clinical relevance. Am J Respir Crit Care Med. 2008;177(3):248-52.
96. El-Shazly A, Berger P, Girodet PO, et al. Fraktalkine produced by airway smooth muscle cells contributes to mast cell recruitment in asthma. J Immunol. 2006;176(3):1860-8.
97. Hollins F, Kaur D, Yang W, et al. Human airway smooth muscle promotes human lung mast cell survival, proliferation, and constitutive activation: cooperative roles for CADM1, stem cell factor, and IL-6. J Immunol. 2008;181(4):2772-80.
98. Thangam EB, Venkatesha RT, Zaidi AK, et al. Airway smooth muscle cells enhance C3a-induced mast cell degranulation following cellcell contact. FASEB J. 2005;19(7):798-800.
99. Sutcliffe A, Kaur D, Page S, et al. Mast cell migration to Th2 stimulated airway smooth muscle from asthmatics. Thorax. 2006;61(8):657-62.
100. Koff JL, Shao MX, Ueki IF, Nadel JA. Multiple TLRs activate EGFR via a signaling cascade to produce innate immune responses in airway epithelium. Am J Physiol Lung Cell Mol Physiol. 2008;294(6):L1068-L1075.
101. Schmidt M, Sun G, Stacey MA, Mori L, Mattoli S. Identification of circulating fibrocytes as precursors of bronchial myofibroblasts in asthma. J Immunol. 2003;171(1):380-9.
102. Vancheri C, Gili E, Failla M, et al. Bradykinin differentiates human lung fibroblasts to a myofibroblast phenotype via the B2 receptor. J Allergy Clin Immunol. 2005;116(6):1242-8.
103. Kunzmann S, Schmidt-Weber C, Zingg JM, et al. Connective tissue growth factor expression is regulated by histamine in lung fibroblasts: potential role of histamine in airway remodeling. J Allergy Clin Immunol. 2007;119(6):1398-407.
104. Hackett TL, Warner SM, Stefanowicz D, et al. Induction of epithelialmesenchymal transition in primary airway epithelial cells from patients with asthma by transforming growth factorbeta1. Am J Respir Crit Care Med. 2009;180(2):122-33.
105. Rytila P, Metso T, Heikkinen K, Saarelainen P, Helenius IJ, Haahtela T. Airway inflammation in patients with symptoms suggesting asthma but with normal lung function. Eur Respir J. 2000,16(5):824-30.
106. Moore WC, Hastie AT, Li X, Li H, Busse WW, Jarjour NN, Wenzel SE, Peters SP,Meyers DA, Bleecker ER; National Heart, Lung, and Blood Institute's Severe Asthma Research Program. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol. 2013 Dec 8.pii:S0091-6749(13)01563-7.



