Número Atual: Julho-Agosto 2013 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Determinação de IgE a alérgenos alimentares por microarray (ImmunoCAP-ISAC) em pacientes com rinite alérgica
Evaluation of IgE antibodies to food allergens in patients with allergic rhinitis using microarray analysis (ImmunoCAP ISAC)
Laura Maria Lacerda Araujo1; Nelson Augusto Rosário Filho2
DOI: 10.5935/2318-5015.20130028
1. MD, MSc. Universidade Federal do Paraná (UFPR), Curitiba, PR
2. MD, PhD. Universidade Federal do Paraná (UFPR), Curitiba, PR
Endereço para correspondência:
Laura Maria Lacerda Araujo
E-mail: laura.araujo80@gmail.com
Submetido em 24/10/2013.
Aceito em 25/11/2013.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVO: Determinar a frequência de anticorpos IgE a alérgenos alimentares em pacientes com doenças alérgicas respiratórias por análise molecular.
MÉTODO: Este estudo transversal incluiu 101 participantes, com idades entre 6-18 anos, com diagnóstico de rinite alérgica (89,1% com asma associada), sem história de alergia alimentar. Foi realizada análise de IgE sérica específica por ImmunoCAP ISAC, método que emprega biologia molecular para detecçao de IgE a componentes alergênicos, sendo 42 alimentares e provenientes das seguintes fontes: abacaxi, aipo, amendoim, avela, bacalhau, camarao, carpa, castanha de caju, castanha do Pará, cenoura, gergelim, kiwi, leite de vaca, maça, ovo, pêssego, soja e trigo. Valores > 0,3 ISU (unidades padronizadas do ISAC) foram considerados positivos. Utilizou-se análise estatística descritiva.
RESULTADOS: Vinte e sete (26,7%) pacientes apresentaram IgE específica a pelo menos um dos alérgenos alimentares analisados. Entre os 42 componentes alergênicos testados, 20 (47,6%) foram associados a resposta IgE em pelo menos um dos pacientes. Alérgenos com maior frequência de reatividade IgE foram: camarao (Pen a 1 15,8%, Pen i 1 16,8%, Pen m 1 16,8%) e pêssego (Pru p 3 5,9%).
CONCLUSOES: Este estudo demonstrou que a avaliaçao de alergia alimentar baseada em análise molecular deve considerar vários elementos, particularmente a correlaçao com os sintomas clínicos, e o conhecimento sobre reatividade cruzada IgE entre alérgenos das mais variadas fontes. Presença de IgE específica a determinado componente alergênico significa sensibilizaçao, e nao necessariamente alergia. Diagnóstico incorreto de alergia alimentar pode levar a tratamento inadequado, com dietas restritivas desnecessárias e prejuízo nutricional para os pacientes.
Descritores: Sensibilizaçao, alérgenos alimentares, alergia respiratória, IgE.
INTRODUÇAO
O diagnóstico baseado na alergia molecular (diagnóstico molecular, DM) é utilizado para mapear a sensibilizaçao alérgica de um paciente em nível molecular, por meio de componentes alergênicos em substituiçao a extratos alergênicos totais. Desde a sua introduçao, no final da década de 1980, quando tecnologia de DNA foi aplicada para clonar e caracterizar moléculas alergênicas, DM vem sendo empregado na prática clínica do alergista1,2. Atualmente, mais de 130 componentes alergênicos estao comercialmente disponíveis para utilizaçao em ensaios para dosagens de IgE específica sérica.
Um dos principais papeis da alergia molecular é no diagnóstico e prevençao da alergia alimentar. O conhecimento de componentes alergênicos aos quais o paciente é sensibilizado pode ajudar a diferenciar se há uma predisposiçao a reaçoes locais ou sistêmicas e à persistência de sintomas clínicos. Outro aspecto relevante, difícil de ser definido por meio dos métodos tradicionais de detecçao de IgE específica (in vivo ou in vitro), é a identificaçao de resposta IgE a alérgenos que apresentam estabilidade. Alérgenos que sao estáveis ao calor ou à digestao geralmente provocam reaçoes clínicas mais graves, enquanto os componentes alergênicos lábeis, em sua maioria provocam sintomas mais leves2. O DM pode ainda diferenciar se há sensibilizaçao genuína a um alérgeno ou se ela ocorre por reatividade cruzada entre componentes alergênicos, ajudando a identificar predisposiçao a reaçao após exposiçao a diferentes fontes alergênicas2,3.
O objetivo deste estudo foi verificar a frequência de resposta IgE a alérgenos alimentares por meio de análise molecular em pacientes com doenças alérgicas respiratórias.
MÉTODOS
Estudo transversal, em que o tamanho da amostra foi limitado pela disponibilidade dos testes moleculares. A seleçao dos pacientes nao obedeceu a critérios de randomizaçao.
Foram incluídos por conveniência 101 pacientes com diagnóstico de rinite alérgica classificados segundo o documento internacional ARIA-Rinite Alérgica e seu Impacto na Asma4, em acompanhamento no ambulatório de Alergia Pediátrica do Hospital de Clínicas da Universidade Federal do Paraná. Nenhum dos pacientes apresentava história de alergia alimentar.
Todos os participantes foram submetidos a teste cutâneo de hipersensibilidade imediata com os seguintes alérgenos: Dermatophagoides pteronyssinus, Blomia tropicalis, Blattella germanica, Lolium multiflorum, epitélio de cao e de gato (IPI-ASAC Brasilr). Utilizou-se técnica em que foram aplicadas gotas do extrato glicerinado, separadas por três centímetros de distância, na superfície volar do antebraço direito; em seguida, foi realizada leve puntura com agulhas calibre 27. Como controle positivo, utilizou-se histamina (10 mg/mL) e como controle negativo, soluçao salina com glicerina a 50%5,6. Após 15 minutos, foram medidos os diâmetros da reaçao e o resultado considerado positivo quando a média aritmética entre o maior diâmetro da pápula e a medida perpendicular a ele foi maior ou igual a três milímetros. Foram incluídos os sujeitos que apresentaram teste cutâneo de hipersensibilidade imediata positivo para pelo menos um dos alérgenos testados.
Foi realizada coleta de sangue por punçao venosa e, após retraçao do coágulo, as amostras foram centrifugadas a 2.000 rotaçoes por minuto durante 10 minutos. Os soros foram armazenados em tubos Eppendorf a -80 ºC até o envio, em gelo seco, para o laboratório do Centro de Alergia Molecular em Roma-Itália, onde foram realizadas as análises moleculares.
O método utilizado foi o ImmunoCAP ISACr (sigla traduzida do inglês, que significa imunoensaio em fase sólida de multianalitos), teste in vitro para detecçao de anticorpos IgE específicos, que aplica a tecnologia de microarray proteico. A preparaçao do microarray consiste em dispor um painel de moléculas alergênicas sobre uma lâmina de vidro (75x25 mm) modificada quimicamente através da adiçao de reagentes como os epoxisilanos ou nitrocelulose, com a finalidade de melhorar a ligaçao proteica. Cada alérgeno é colocado em triplicata para garantir a confiabilidade do teste. Para a realizaçao do ensaio, foram adicionados 20 µL do soro a ser testado em lâmina de microarray. Alérgenos reconhecidos por anticorpos IgE do paciente foram detectados por anticorpos anti-IgE marcados com substância fluorescente. Os valores foram medidos por scanner a laser, gerando resultados semi-quantitativos e classificados em unidades padronizadas, com resultados considerados positivos quando maior ou igual a 0,3 ISU (ISAC standardized units)3,7.
Dos 103 componentes alergênicos testados, foi analisada no presente estudo a reatividade IgE aos 42 alérgenos alimentares, originados das seguintes fontes: abacaxi (Ana c 2); aipo (Api g 1.0101); amendoim (Ara h 1, Ara h 2, Ara h 3, Ara h 8.0101); avela (Cor a 1.0101, Cor a 1.0401, Cor a 8.0101, Cor a 9); bacalhau (Gad c 1.0101); camarao (Pen a 1.0101, Pen i 1, Pen m 1); carpa (Cyp c 1.01); castanha de caju (Ana o 2); castanha do Pará (Ber e 1.0101); cenoura (Dau c 1.0101); gergelim (Ses i 1); kiwi (Act d 1, Act d 2, Act d 5, Act d 11); leite de vaca (Bos d 4, Bos d 5, Bos d 6, Bos d 8, Bos d lactoferrin); maça (Mal d 1.0108); ovo (Gal d 1, Gal d 2, Gal d 3, Gal d 5); pêssego (Pru p 1.0101, Pru p 3); soja (Gly m 4.0101, Gly m 5, Gly m 6) e trigo (Tri a 18, Tri a 19, Tri a 19.0101, Tri a 30).
O projeto de pesquisa foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do Hospital de Clínicas da Universidade Federal do Paraná. Os pais ou responsáveis assinaram termo de consentimento livre e esclarecido e os participantes maiores de 12 anos, termo de assentimento livre e esclarecido. O programa Statistica (Statsoftr) foi utilizado para análise descritiva dos dados obtidos.
RESULTADOS
De um total de 101 pacientes com idades entre 6 e 18 anos (média 10,7 anos), 62 eram do sexo masculino. Todos apresentavam rinite alérgica, com classificaçao e diagnóstico conforme ARIA de 42,6% com rinite leve e 57,4% com rinite moderada/grave. A maioria tinha asma associada (89,1%), cuja gravidade foi definida como: 47,5% leve; 33,7% moderada; e apenas 7,9% grave, com diagnóstico e classificaçao conforme GINA8. Nenhum paciente tinha história ou sintomas associados a alergia alimentar.
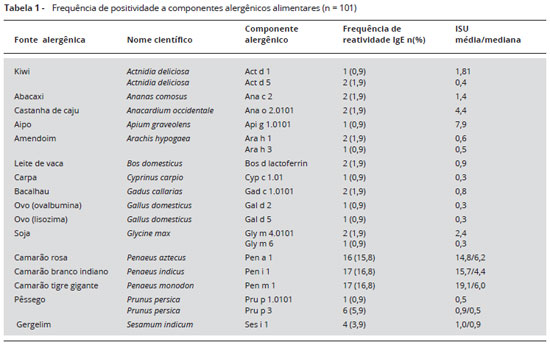
Vinte e sete (26,7%) pacientes apresentaram IgE específica a pelo menos um dos componentes alergênicos derivados de alimentos que foram analisados. Entre os 42 alérgenos alimentares testados, 20 (47,6%) apresentaram reatividade IgE em pelo menos um dos pacientes (Tabela 1). Os que apresentaram maior frequência reatividade IgE foram: camarao (Pen a 1 15,8%; Pen i 1 16,8%; Pen m 1 16,8%) e pêssego (Pru p 3 5,9%).
DISCUSSAO
O DM permite identificar a presença de IgE específica a vários componentes alergênicos a partir de uma pequena quantidade de soro1. No entanto, a interpretaçao dos seus resultados deve ser feita individualmente, de acordo com a história clínica e os sintomas descritos pelo paciente9. No presente estudo, nenhum dos participantes apresentava queixas relacionadas a alergia alimentar, porém cerca de ¼ dos paciente exibia sensibilizaçao a algum dos componentes alergênicos derivados de fontes alimentares que foram testados, embora os níveis de IgE específica tenham sido baixos na maioria dos casos.
Uma exceçao foram os alérgenos obtidos a partir de espécies de camarao: Pen a 1, Pen m 1 e Pen i 1, que apresentaram alta frequência de reatividade e níveis de IgE mais elevados que os demais. Sao tropomiosinas altamente homólogas, com sequência de aminoácidos praticamente idêntica (> 97%). Devido a isso, na versao mais atual do painel ImmunoCAP ISAC foi mantido apenas Pen m1, dado o elevado grau de identidade e reatividade cruzada IgE entre elas.
Provavelmente, a presença de anticorpos IgE específicos para camarao ocorreu por reatividade cruzada IgE a tropomiosinas de ácaro (alérgeno Der p 10) e/ou baratas (alérgenos Per a 7 e Bla g 7). A tropomiosina é uma proteína que regula a contraçao muscular, e é um pan-alérgeno altamente conservado entre invertebrados, com identidade de sequência acima de 80%. É alérgeno principal em camarao, outros crustáceos e moluscos, e está associada à reatividade IgE variável a ácaro e baratas. É também importante proteína associada à resposta IgE a parasitas, incluindo Ascaris lumbricoides e Anisakis simplex10. Portanto, a resposta IgE aos componentes Pen a 1, Pen i 1 e Pen m 1 pode refletir reaçao cruzada com Der p 10, derivado do Dermatophagoides pteronyssinus, que mostrou reatividade IgE em 15,8% dos pacientes estudados (dado nao apresentado nos resultados), todos com diagnóstico de alergia respiratória. Estes resultados sugerem que a positividade aos componentes alergênicos do camarao nestes casos significa sensibilizaçao, e nao alergia alimentar10,11.
Outro componente que apresentou frequência de positividade relativamente alta foi o Pru p 3, derivado do pêssego, cuja proteína é conhecida como LTP (lipid transfer protein) e considerada como um marcador de gravidade para reaçoes alérgicas alimentares2. LTPs sao proteínas estáveis ao calor e à digestao, podendo causar reaçoes cruzadas de maior gravidade com polens7. Como os pacientes do estudo sao crianças e adolescentes, há possibilidade de desenvolverem sintomas de alergia oral (alergia alimentar relacionada a pólen) ou reaçoes anafiláticas futuramente. As LTPs sao consideradas pan-alérgenos e já foi descrita reatividade cruzada entre alimentos e polens que a contém12,13. Embora os participantes do estudo apresentem rinite persistente, encontrou-se que todos os que apresentaram IgE específica ao Pru p 3, eram igualmente positivos ao componente Pla a 2, derivado do plátano (dado nao descrito nos resultados). Talvez, em análise mais detalhada, estes pacientes também refiram sintomas de rinite sazonais, pois sao moradores da regiao sul do Brasil, onde sao encontrados plátanos e já foi descrita doença polínica14. Possivelmente alguns deles apresentem reaçao cruzada entre fruta e pólen pela presença da LTP.
Os alérgenos de aipo Api g 1, pêssego Pru p 1 e soja Gly m 4, encontrados em cerca de 1% dos pacientes, pertencem ao grupo das proteínas PR-10, que têm homólogos em polens e podem causar síndrome da alergia oral após a sua ingestao. Estas proteínas sao sensíveis ao calor, portanto se o alimento é ingerido cozido, é bem tolerado2.
O alérgeno de abacaxi Ana c 2 é uma bromelina, que é um marcador para determinantes carboidratos com reatividade cruzada (CCDs), existindo em polens e outros alimentos. Sensibilizaçao a CCDs é raramente associada a sintomas clínicos2.
É possível que a presença de IgE para esses alérgenos alimentares citados acima reflita reatividade IgE com proteínas PR-10 e LTPs, além de CCDs, presentes em polens, uma vez que os pacientes sao da regiao sul do Brasil.
Por outro lado, os alérgenos de kiwi Act d 1 e Act d 5; castanha de caju Ana o 2.0101; amendoim Ara h 1 e Ara h 3; leite de vaca Bos d lactoferrina; ovo Gal d 2 (ovalbumina) e Gal d 5 (lisozima); soja Gly m 6 e gergelim Ses i 1 sao considerados espécie-específicos2; entretanto, os resultados do ImmunoCAP-ISAC para a maioria desses componentes mostrou níveis médios < 1 ISU (faixa 0,3 a 4,4 USU). O significado clínico da presença de IgE para esses alérgenos, sem presença de sintomas com a ingestao dos mesmos, ainda permanece desconhecido.
Conclui-se que a avaliaçao de alergia alimentar baseada em análise molecular deve considerar vários elementos, particularmente a correlaçao com os sintomas clínicos, e o conhecimento sobre reatividade cruzada IgE entre alérgenos das mais variadas fontes. Presença de IgE específica a determinado componente alergênico significa sensibilizaçao, e nao necessariamente alergia. Diagnóstico incorreto de alergia alimentar pode levar a tratamento inadequado, com dietas restritivas desnecessárias e prejuízo nutricional para os pacientes. Portanto, para que se faça uso adequado deste método detalhado para detecçao de componentes alergênicos, torna-se imprescindível anamnese e coleta de sintomas clínicos rigorosas.
AGRADECIMENTOS
Agradecemos ao Dr. Adriano Mari e ao laboratório do Centro de Alergia Molecular (Roma, Itália), por realizar as dosagens de IgE específicas pelo método ImmunoCAP ISAC.
REFERENCIAS
1. Mari A. When does a protein become an allergen? Searching for a dynamic definition based on most advanced technology tools. Clin Exp Allergy. 2008;38:1089-94.
2. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA2LEN Consensus document on molecular-based allergy diagnosis. World Allergy Organization J. 2013;6:17.
3. Harwanegg C, Hiller R. Protein microarrays for the diagnosis of allergic diseases: state-of-the-art and future development. Clin Chem Lab Med. 2005;43:1321-6.
4. Brozek JL, Bousquet J, Baena-Cagnani CE, Bonini S, Canonica GW, Casale TB, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision. J Allergy Clin Immunol. 2010;126:466-76.
5. Pepys S. Skin testing. Br J Hosp Med. 1975;14:412-8.
6. Bousquet J, Heinzerling L, Bachert C, et al. Practical guide to skin prick test in allergy to aeroallergens. Allergy. 2012;67:18-24.
7. Scala E, Alessandri C, Bernardi ML, et al. Cross-sectional survey on immunoglobulin E reactivity in 23077 subjects using an allergenic molecule- based microarray detection system. Clin Exp Allergy. 2010;40:911-21.
8. Global Iniciative for Asthma - GINA. Bethesda: Global Iniciative for Asthma. Global Strategy for Asthma Treatment and Prevention, 2006. Ultima atualizaçao: http://www.ginasthma.org/pdf/GINA_Report_2010.pdf.
9. Custovic A, Simpson A. Environmental allergen exposure, sensitization and asthma: from whole population to individuals at risk. Thorax. 2004;59:825-72.
10. Arruda LK. The right timing for shrimp tropomyosins. Int Arch Allergy Immunol. 2013;160:301-3.
11. Allessandri C, Zennaro D, Zaffiro A, Mari A. Molecular allergology approach to allergic diseases in paediatric age. It J Pediatr. 2009;35:29-41.
12. Pascal M, Muñoz-Cano R, Reina Z, Palacín A, Vilella R, Picado C, et al. Lipid transfer protein syndrome: clinical pattern, cofactor effect and profile of molecular sensitization to plant-foods and pollens. Clin Exp Allergy. 2012;42:1529-39.
13. Letrán A, Espinazo M, Moreno F. Measurement of IgE to pollen allergen components is helpful in selecting patients for immunotherapy. Ann Allergy Asthma Immunol. 2013;111:295-7.
14. Dutra BMRS, Rosário Filho NA, Zavadniak AF. Alérgenos inaláveis em Curitiba: uma revisao de sua relevância clínica. Rev Bras Alerg Imunopatol. 2001;24:189-95.