Número Atual: Julho-Agosto 2013 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Alérgenos recombinantes: papel no diagnóstico e na imunoterapia alérgeno-específica
Recombinant allergens: role in diagnosis and in allergen-specific immunotherapy
L. Karla Arruda1; Michelle C. R. Barbosa2; Gil Bardini3; Ariana Campos Yang4; Isabel Ruguê Genov5; Adriana Santos Moreno2
DOI: 10.5935/2318-5015.20130027
1. MD, PhD. Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo (FMRP-USP)
2. PhD. Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo (FMRP-USP)
3. MD, MSc. Faculdade de Medicina de Ribeirao Preto, Universidade de Sao Paulo (FMRP-USP)
4. MD, PhD. Faculdade de Medicina da Universidade de Sao Paulo (FMUSP) e Universidade Estadual de Campinas (UNICAMP)
5. MD, PhD. Escola Paulista de Medicina, Universidade Federal de Sao Paulo (UNIFESP)
Endereço para correspondência:
L. Karla Arruda
E-mail: karla@fmrp.usp.br
Submetido em 7/11/2013.
Aceito em 26/11/2013.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
Nos últimos 30 anos tem havido um avanço notável na identificaçao, purificaçao e expressao recombinante de alérgenos relevantes das mais variadas fontes, incluindo ácaros, insetos, mamíferos, polens, alimentos, fungos, látex e outras fontes. Estes avanços resultaram na utilizaçao crescente de alérgenos purificados, naturais ou recombinantes, para melhorar o diagnóstico de alergia pelos métodos que dispomos, incluindo os testes cutâneos de hipersensibilidade imediata, e os métodos in vitro para medida de anticorpos IgE específicos, como ImmunoCAP, ImmunoCAP-ISAC, ELISA e MARIA. Mais recentemente, o uso de alérgenos recombinantes de pólen de bétula (rBet v 1) e de gramas (coquetel de 5 alérgenos) em imunoterapia foi relatado como seguro e eficaz, com resultados comparáveis aos obtidos usando extratos naturais, em pacientes com rinoconjuntivite alérgicos a polens. No presente artigo, apresentamos revisao atualizada do uso de alérgenos recombinantes em diagnóstico de alergia e em imunoterapia alérgeno-específica, incluindo novas estratégias de imunoterapia. Focalizamos na avaliaçao crítica de estudos que investigaram sensibilidade, especificidade, reatividade cruzada e valor prognóstico de métodos diagnósticos com uso de alérgenos recombinantes versus extratos naturais; nas recomendaçoes atuais para o uso destes novos métodos na prática clínica; e na revisao de estudos clínicos com imunoterapia usando alérgenos recombinantes realizados até o momento.
Descritores: Alérgenos, dessensibilizaçao imunológica, imunoterapia alérgeno-específica, alérgenos recombinantes.
INTRODUÇAO
Até recentemente, os métodos para diagnóstico de alergia e tratamento de doenças alérgicas se baseavam no uso de extratos alergênicos naturais. Essas misturas heterogêneas, contendo componentes nao-alergênicos, além dos alérgenos, sao suscetíveis à contaminaçao com alérgenos de outras fontes, e podem conter enzimas proteolíticas com capacidade de reduzir a concentraçao de alérgeno no extrato. Os problemas associados ao uso de extratos naturais incluem dificuldades com a avaliaçao da potência e inconsistências inerentes à produçao de extratos com conteúdo equivalente de alérgeno. Quase todas as fontes alergênicas contêm múltiplos alérgenos maiores e menores e, mesmo com o uso de técnicas modernas, é difícil padronizar essas misturas de diferentes proteínas1.
Podemos aprimorar os produtos alergênicos naturais mediante o uso de alérgenos recombinantes, que podem proporcionar produtos alergênicos definidos com precisao para diagnóstico e tratamento de pacientes alérgicos2. Alérgenos recombinantes têm sido produzidos com alto grau de pureza, em grandes quantidades, com capacidade similar de ligaçao à IgE quando comparados aos seus homólogos naturais, ou com modificaçoes de modo a reduzir a reatividade à IgE (hipoalérgenos)3. Além das aplicaçoes clínicas, o advento da clonagem molecular e da expressao de alérgenos recombinantes tem permitido uma compreensao melhor da funçao e estrutura dos alérgenos, e da contribuiçao dessas propriedades intrínsecas ao desenvolvimento de doença. A estrutura dos complexos alérgeno-anticorpo resolvida por cristalografia de raios-X revelou funçao de alérgenos e mecanismos de reconhecimento pelo anticorpo para o delineamento de hipoalérgenos terapêuticos4,5. Assim, o conhecimento das propriedades intrínsecas dos alérgenos e dos mecanismos patológicos permitirá o desenvolvimento de novas abordagens terapêuticas.
ALÉRGENOS RECOMBINANTES PARA DIAGNOSTICO
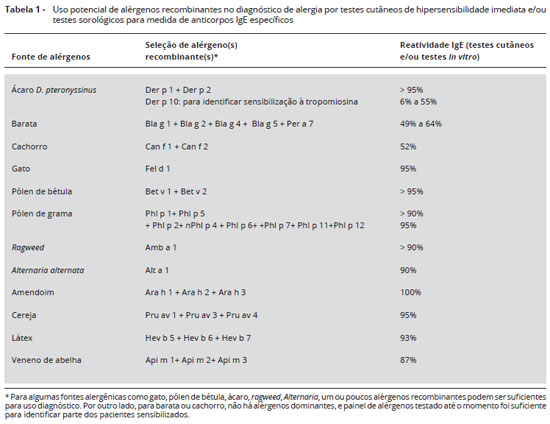
Sao várias as vantagens dos alérgenos recombinantes para finalidades diagnósticas. Esses reagentes podem ser produzidos de forma consistente com elevado grau de pureza. Sao reagentes específicos e mais acessíveis à padronizaçao em unidades de massa. Ao contrário dos produtos alergênicos naturais, que possuem conteúdo variável de alérgenos específicos (mesmo os produtos padronizados), alérgenos recombinantes podem ser produzidos em concentraçoes definidas e com um conteúdo proteico verificável1,2. Para as principais fontes de alérgenos (ácaros, polens, epitélio de animais, baratas e alimentos), é possível identificar alérgenos recombinantes que podem ser utilizados isoladamente ou em coquetéis para finalidades diagnósticas (Tabela 1). Estudos realizados com alérgenos recombinantes para testes cutâneos revelaram que o uso de alérgenos recombinantes é seguro, e demonstraram eficácia variável em comparaçao a extratos naturais para finalidades diagnósticas, com boa eficácia diagnóstica em concentraçoes de 5 a 20 µg/mL em testes cutâneos de puntura2.
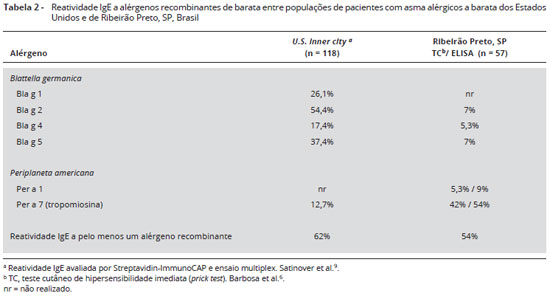
Em estudo recentemente publicado, nós utilizamos alérgenos recombinantes de barata para definir os perfis de reatividade de IgE de pacientes alérgicos a barata no Brasil6. Nossos resultados demonstraram que o alérgeno dominante foi a tropomiosina de barata (alérgeno Per a 7). O teste cutâneo, com uso de um painel de 5 alérgenos recombinantes, foi realizado em 57 pacientes alérgicos a barata, e 24 pacientes (42%) tiveram resposta positiva a rPer a 7. Os resultados dos testes cutâneos acompanharam os resultados dos testes in vitro para IgE anti-Per a 7, com boa taxa de concordância. A frequência de sensibilizaçao a Per a 7, de 43% a 54%, sendo considerados os testes in vivo e in vitro, respectivamente, demonstrou concordância com estudos anteriores de nosso grupo7,8. Por outro lado, a reatividade aos outros alérgenos de barata testados foi notavelmente baixa. Apenas 3 (5,3%), 4 (7%), 3 (5,3%) e 4 (7%) pacientes demonstraram testes cutâneos de puntura positivos para Per a 1, Bla g 2, Bla g 4 e Bla g 5, respectivamente. No total, 28/57 (49,1%) dos participantes tiveram testes cutâneos positivos para pelo menos um alérgeno recombinante6. Surpreendentemente, nossos resultados foram muito diferentes daqueles obtidos entre pacientes alérgicos a barata nos Estados Unidos9. Utilizando ImunoCAP streptavidinr e análise multiplex por citometria de fluxo, foi demonstrado que um painel de 5 alérgenos recombinantes purificados (rBla g 1, rBla g 2, rBla g 4, rBla g 5 e rPer a 7) pôde identificar 62% dos pacientes norte-americanos alérgicos a barata. A prevalência de anticorpos da classe IgE foi mais elevada para rBla g 2 (54,4%) e rBla g 5 (37,4%), e Per a 7 foi um alérgeno menos importante, com apenas 12,7% de reatividade IgE entre os 118 soros analisados (Tabela 2)9. Esses resultados enfatizam a importância da identificaçao de diferenças regionais nos perfis de reatividade a alérgenos individuais10.
A disponibilidade de alérgenos recombinantes ampliou as possibilidades do diagnóstico resolvido por componentes (Component Resolved Diagnosis, CRD), empregando métodos como a tecnologia com microchips e imunoensaios. Tem se tornado evidente que CRD pode melhorar o manejo do paciente alérgico, pois essa ferramenta permite, até certo ponto, discriminar entre resultados específicos para IgE clinicamente significantes daqueles resultados clinicamente irrelevantes, e estabelecer padroes de sensibilizaçao associados a desfechos prognósticos particulares11,12. Nos últimos anos, um crescente número de alérgenos, especialmente de plantas (polens e alimentos), estabeleceu seu papel no diagnóstico de rotina, e perfis individuais de alérgenos com reatividade IgE permitem exame mais detalhados das reaçoes cruzadas, moléculas de risco e sensibilizaçoes com prognóstico significante, implicando em necessidade de aprofundamento do conhecimento por parte do alergista.
A seguir, alguns exemplos:
1. Nas alergias a pólen, a determinaçao de IgE para os alérgenos principais (i.e. Bet v 1: bétula; Phl p 1/5:grama) pode diferenciar clinicamente sensibilizaçoes relevantes daquelas ocorrentes a pan-alérgenos de reaçao cruzada, clinicamente menos relevantes, como as profilinas (i.e. Bet v 2 e Phl p 12)11.
2. Na alergia alimentar, sensibilizaçao a proteínas de armazenamento (i.e. Ara h 2 e 3/amendoim) ou de proteínas de transferência de lipídios (i.e. Pru p 3/pêssego) indica elevado risco de anafilaxia, enquanto que sensibilizaçao a homólogos de Bet v 1 (p.ex., Ara h 8/amendoim) está habitualmente associada a sintomas mais leves13.
3. Em pacientes com alergia a ovo, a presença de IgE contra ovomucoide (Gal d 1), que é estável ao calor e à digestao, foi associada a maior risco de reaçoes graves e persistentes. Níveis de IgE para Gal d 1 > 11 kUA/L estao associados com risco alto de desenvolver reaçoes clínicas tanto a ovo aquecido como cru, com especificidade de 95%. Por outro lado, sensibilizaçao a ovalbumina e possivelmente a ovotransferrina e lisozima é considerada menos séria, porque essas proteínas sao termolábeis e sensíveis à digestao, e pacientes podem tolerar ovos aquecidos. Em crianças com suspeita de alergia a leite de vaca ou a ovo, IgE contra Bos d 8 (caseína) do leite de vaca, e contra Gal d 1 e Gal d 2 de ovo foram os alérgenos mais frequentemente identificados, com boa capacidade de prever os resultados de testes de provocaçao oral com o alimento14-16.
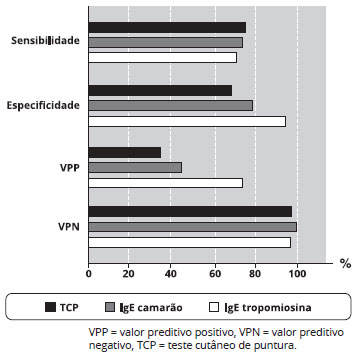
4. Níveis elevados de IgE contra tropomiosina foram relacionados à gravidade dos sintomas em pacientes com alergia a camarao17-19. Yang et al. demonstraram que a especificidade da IgE contra tropomiosina de camarao (92,8%) foi maior do que a de IgE contra camarao (75%) em pacientes com teste de provocaçao oral positivo para camarao (Figura 1)17.
Figura 1 - Capacidade preditiva de testes cutâneos de puntura com camarao, IgE para camarao e IgE para tropomiosina de camarao em relaçao ao teste de provocaçao oral com camarao. O uso de IgE para tropomiosina de camarao foi associado à especificidade diagnóstica aumentada e maior valor preditivo positivo, quando comparado ao uso de testes cutâneos com camarao e IgE para camarao por ImmunoCAP. Além disso, positive likelihood ratios, com respectivos 95% intervalos de confiança, foram 2 (1,01 - 3,95); 2,85 (1,29 - 6,32); e 10 (2,42 - 41,17), para testes cutâneos com camarao, IgE para camarao e IgE para tropomiosina de camarao, respectivamente, indicando um excelente valor preditivo de IgE para tropomiosina de camarao em relaçao ao teste de provocaçao oral positivo com camarao. Dados de Yang et al.17
5. A determinaçao de IgE contra os alérgenos maiores Api m 1 (abelha) e Ves v 1 e Ves v 5 (vespa), possibilitou que duplas sensibilizaçoes pudessem ser diferenciadas de reatividade cruzada nas alergias a veneno de himenópteros11,12.
Além da determinaçao de anticorpos IgE contra alérgenos individuais purificados, atualmente é possível determinar simultaneamente IgE contra mais de 100 componentes alergênicos pelo uso da moderna tecnologia de biochips, utilizando apenas um volume muito pequeno de soro (30 µL). Este ensaio em fase sólida fornece resultados semiquantitativos (unidades padronizadas ISAC/ISU)12,20,21.
IMUNOTERAPIA COM ALÉRGENOS RECOMBINANTES
A imunoterapia alérgeno-específica também se fundamenta no uso de produtos alergênicos naturais de alta qualidade. Diversos estudos definiram dosagens ideais para a terapia de manutençao com extratos naturais (aproximadamente 5-20 µg de alérgeno principal por dose de manutençao), mas desde o tempo de Noon o tratamento permanece essencialmente inalterado. É possível que os produtos de alérgenos naturais ofereçam vantagens para a imunoterapia, pois podem conter substâncias que conferem um efeito adjuvante para downregulation das respostas IgE, ou por conterem peptídeos derivados de alérgenos naturalmente digeridos que exercem efeitos nos linfócitos T. Entretanto, há pouca evidência em apoio a essas possibilidades.
Alérgenos recombinantes podem ser manipulados para a produçao de hipoalérgenos que exibem reduzida capacidade de ligaçao a anticorpos da classe IgE, mas preservam os epitopos de linfócitos T22,23. A justificativa para o uso dos hipoalérgenos é que podem ser utilizadas doses terapêuticas maiores do alérgeno, com risco reduzido de reaçoes adversas. Apesar das numerosas vantagens potenciais do uso de alérgenos recombinantes para a imunoterapia, na última década foi pequeno o número de estudos clínicos com vacinas contendo tanto alérgenos do tipo selvagem como derivados hipoalergênicos de alérgenos recombinantes. As rigorosas exigências de produçao dos alérgenos recombinantes para uso terapêutico - inclusive a preparaçao em condiçoes de boas práticas de manufatura - representam um problema fundamental, que leva a programas de desenvolvimento muito dispendiosos, o que pode limitar o potencial de comercializaçao.
Estudos clínicos bem-sucedidos com alérgenos recombinantes, particularmente os que se concentraram em alérgenos inalantes incluindo os derivados de gato, grama, bétula e ragweed, e na alergia a veneno de inseto (alérgenos de abelha), demonstraram alta eficácia e bom perfil de segurança, além de forte modulaçao das respostas de linfócitos T e B a alérgenos específicos22,23.
Estudos que avaliaram a eficácia, segurança e/ou efeitos na resposta imune de peptídeos de linfócitos T contra Fed d 1 administrados por via subcutânea ou intradérmica chegaram a resultados clínicos variáveis. Grande número de eventos adversos foi associado ao uso dessas preparaçoes. A imunoterapia recombinante para alergia a veneno de abelha também se concentrou no uso da imunoterapia com peptídeos, que parece ser opçao segura e com boa tolerância, embora estudos tenham chegado a resultados clínicos variáveis22,23.
Em um estudo clínico de fase II, ficou demonstrada a eficácia de uma mistura de cinco alérgenos de pólen de grama (Phl p 1, Phl p 2, Phl p 5a, Phl p 5b, Phl p 6) administrados por via subcutânea, pela ocorrência de melhora significante nos escores combinados de sintomas e diminuiçao do uso de medicaçao, e melhora na qualidade de vida, em pacientes com alergia a pólen de grama. A melhora clínica foi acompanhada por um aumento de 4.000 vezes nas concentraçoes de IgG4 e pela ausência de novas sensibiliaçoes ao final do tratamento. Entretanto, foram observadas reaçoes adversas sistêmicas em 24% dos pacientes tratados, sugerindo que os alérgenos recombinantes do tipo selvagem sao tao alergênicos como os alérgenos naturais correspondentes, podendo induzir efeitos colaterais mediados por IgE durante a imunoterapia. A elevada frequência de efeitos colaterais sistêmicos também pode ter sido associada à dose bastante elevada dos alérgenos injetados(40µg de rPhl p)24. Um estudo recente randomizado, duplo-cego e controlado com placebo, para determinaçao de faixa de dosagem, utilizando os mesmos alérgenos de pólen de grama (Phl p 1, 2, 5a, 5b, 6) nas doses de 20, 40, 80 ou 120 µg de proteína recombinante total de pólen grama ou placebo, demonstrou que nao ocorreram efeitos adversos importantes (graus III/IV) com esse coquetel de alérgenos recombinantes principais de grama, mesmo em doses elevadas de até 120 µg25.
Um estudo de fase II duplo-cego e controlado com placebo (DBPC) comparou o alérgeno recombinante de pólen de bétula rBet v 1a com extrato de pólen de bétula, alérgeno natural purificado de pólen de bétula nBet v 1 e placebo na imunoterapia subcutânea para adultos alérgicos a pólen de bétula26. Em comparaçao com placebo, todas as preparaçoes ativas induziram reduçao significativa nos escores combinados de sintomas e uso de medicaçao, tendo ocorrido aumento de IgG1, IgG2 e IgG4 específicos para Bet v 1 em todos os grupos. Esse estudo confirmou a prova de conceito de "nao inferioridade" das vacinas recombinantes com Bet v1 do tipo selvagem em termos de eficácia clínica e de respostas imunológicas. No estudo, foi utilizada uma baixa dose de manutençao de Bet v 1 (15 µg), e isso pode explicar a baixa frequência de reaçoes sistêmicas graves26.
Outra estratégia para imunoterapia para pacientes alérgicos a pólen de bétula foi o desenvolvimento de derivados hipoalergênicos da principal isoforma de Bet v 1, mediante a expressao de três cópias do gene em sequência para a produçao de um trímero, ou pela clivagem do gene, com o fim de criar dois peptídeos (fragmentos) recombinantes que, em conjunto, representam a sequência completa de Bet v 1. Estudos demonstraram melhora significante nos escores de sintomas, escores de medicaçao, parâmetros de qualidade de vida e respostas imunológicas específicas para alérgenos versus placebo. Esses achados foram associados a um bom perfil de segurança. Um estudo DBPC recentemente publicado investigou a eficácia clínica e a dose ideal de uma nova folding variante recombinante hipoalergênica de Bet v 1 (rBet v 1-FV)27. Antes da imunoterapia, os pacientes foram expostos ao pólen de bétula durante 8 horas em uma câmara de exposiçao ambiental (CEE) e em seguida randomizados para quatro doses de manutençao de rBet v 1-FV (20 µg, 80 µg, 160 µg, 320 µg) e placebo. Os pacientes foram tratados durante 10 semanas com injeçoes subcutâneas semanais e, depois, novamente expostos na CEE. Houve diminuiçao significativa no escore total dos sintomas e aumento significativo de IgG1 em todos os grupos ativos versus placebo. Todas as quatro doses ativas foram bem toleradas, nao tendo ocorrido qualquer efeito adverso grave. Os autores concluíram que a dose de manutençao de 80 µg de rBet v 1-FV seria a escolha ideal para a imunoterapia27.
Também foi desenvolvida uma vacina de Bet v 1 recombinante, formulada como comprimido solúvel (tablet) para imunoterapia sublingual, para tratar pacientes adultos com rinoconjuntivite alérgica causada por pólen de bétula. Os resultados de um estudo de fase II multicêntrico, randomizado DBPC, utilizando doses diárias de 50 µg, 25 µg, 12,5 µg ou placebo durante 4 meses antes e ao longo de toda a estaçao do pólen de bétula, revelou eficácia clínica em todos os grupos ativos, sem que fossem notadas diferenças entre as três doses. O efeito médio nos sintomas e na medicaçao de resgate foi estimado em 20% a 33%, respectivamente28.
O uso de um regime de imunoterapia de curta duraçao (6 semanas) utilizando o alérgeno Amb a 1 acoplado a conjugados imunoestimulatórios de oligonucleotídeos fosforotiolatos (AIC) tem sido o foco na alergia a ragweed. Dois estudos envolvendo pacientes com rinite alérgica demonstraram inicialmente que ragweed-AIC foi seguro e bem tolerado; entretanto, um estudo de fase II/III subsequente demonstrou que houve apenas melhora modesta e nao significante nos desfechos clínicos, tendo resultado na descontinuaçao da investigaçao clínica com esta estratégia29.
Estudo recentemente publicado investigou a eficácia da administraçao intralinfática de alérgeno (intralymphatic immunotherapy, ILIT) para a alergia a gato30. O principal alérgeno recombinante de gato, Fel d 1, foi modificado por fusao a peptídeos com açao de aumentar a captaçao citoplasmática da molécula e diminuir a degradaçao por fagossomos. Essas modificaçoes de rFel d 1 resultaram em uma vacina denominada MAT-Fel d 1. Um estudo-piloto de fase I/IIa randomizado DBPC utilizando ILIT com MAT-Fel d 1 demonstrou que nao ocorreram eventos adversos; houve aumento de 74 vezes da tolerância à provocaçao nasal; houve estimulaçao das respostas de células T regulatórias; e ocorreu aumento dos níveis de IgG4 específicos para epitélio de gato, depois de apenas 3 injeçoes intralinfáticas ao longo de um período de 2 meses30.
No desenvolvimento subsequente de alérgenos recombinantes para imunoterapia, é preciso que o enfoque recaia em alérgenos importantes, como os ácaros da poeira domiciliar (House Dust Mites, HDM), que têm, globalmente, um papel causal bem estabelecido em doenças respiratórias alérgicas crônicas31. Embora tenham sido caracterizados 23 alérgenos diferentes de HDM, existem evidências consistentes de que os alérgenos dos grupos 1 e 2 representam os alérgenos de HDM clinicamente mais importantes (Figura 2). Uma combinaçao dos alérgenos Der p 1 e Der p 2 de Dermatophagoides pteronyssinus permite o diagnóstico de mais de 95% dos pacientes com alergia a HDM. Portanto, Der p 1 e Der p 2 representam importantes candidatos à vacina.
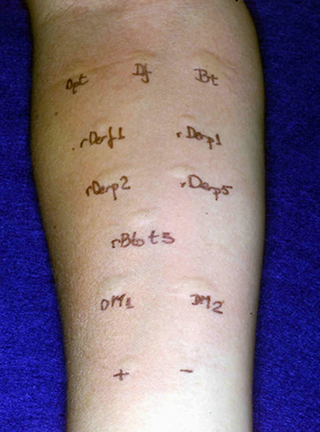
Figura 2 - Testes cutâneos positivos com extratos comerciais e alérgenos recombinantes de ácaros em paciente com rinoconjuntivite. Testes cutâneos de puntura foram realizados com extratos comerciais de Dermatophagoides pteronyssinus (Dpt), D. farinae (Df) e Blomia tropicalis (Bt), e com alérgenos recombinantes Der f 1 de D. farinae; Der p1, Der p 2 e Der p 5 de D. pteronyssinus; e Blo t 5 de B. tropicalis,em concentraçao de 10 µg/mL cada um. DM1 foi uma mistura de alérgenos recombinantes Der f 1, Der p 1 e Der p 2, e DM2 foi uma mistura dos 5 alérgenos recombinantes. Controles positivo histamina (+) e negativo salina (-) foram incluIdos. Alérgenos recombinantes de ácaros induziram fortes reaçoes nos testes cutâneos de hipersensibilidade imediata, comparáveis àquelas causadas por extratos comerciais de ácaros
Um estudo recente relatou o desenvolvimento de duas proteínas hipoalergênicas recombinantes, consistindo de fragmentos reconstruídos de Der p 1 e Der p 2: rDer p 2/1C (com resíduos cisteína) e rDer p 2/1S (sem resíduos cisteína)32. Em particular, rDer p 2/1S, uma molécula híbrida com ausência de todos os resíduos cisteína de ocorrência natural em Der p 1 e Der p 2, pôde ser expressa em grandes quantidades como monômero em Escherichia coli, e nao demonstrou reatividade IgE nem atividade alergênica em pacientes com alergia a HDM; em imunizaçao de animais, demonstrou pouca alergenicidade e induziu anticorpos IgG que bloquearam a ligaçao de IgE a Der p 1 e Der p 2 em pacientes alérgicos. Assim, a vacina recombinante de combinaçao hipoalergênica rDer p 2/1S pode ser considerada como molécula candidata extremamente promissora para estudos clínicos de imunoterapia em pacientes com alergia a HDM32.
Algumas outras condiçoes alérgicas, como a alergia alimentar, poderao ser consideradas no desenvolvimento futuro da imunoterapia com alérgenos recombinantes. Foram desenvolvidas vacinas contendo proteínas recombinantes modificadas de amendoim, com mutaçoes pontuais ou polimerizaçao proteica que modificam os epitopos antigênicos. Foi desenvolvida uma vacina contendo três proteínas recombinantes modificadas de amendoim (Ara h 1, 2 e 3) encapsuladas no interior de E. coli inativada por calor ou fenol (EMP-123) para administraçao retal em humanos; atualmente, esse produto se encontra sob investigaçao em um estudo clínico de fase I. A capacidade de produzir quantidades essencialmente ilimitadas de alérgenos recombinantes também nos permite considerar a investigaçao do uso da vacinaçao profilática em doenças alérgicas33,34.
CONCLUSOES
Ao longo dos próximos anos, é possível antecipar um uso cada vez maior dos alérgenos recombinantes em estudos clínicos. Essa nova situaçao exigirá a produçao de alérgenos em condiçoes de boas práticas de fabricaçao, e a aprovaçao dos órgaos reguladores, permitindo o uso de alérgenos recombinantes tanto para aplicaçoes diagnósticas como terapêuticas. Já foram publicados estudos clínicos de vacinas de peptídeos derivados de alérgenos, conjugados de alérgeno-oligonucleotídeo, moléculas recombinantes do tipo selvagem e hipoalergênicas, alérgenos recombinantes modificados para administraçao intralinfática, etc., demonstrando eficácia clínica e bom perfil de segurança. Portanto, é possível prever a ocorrência de uma contínua incorporaçao de alérgenos recombinantes aos estudos de imunoterapia, que deverao resultar em vacinas mais eficazes para doenças alérgicas estabelecidas e, a longo prazo, com a perspectiva da imunizaçao profilática.
REFERENCIAS
1. Chapman MD, Smith AM, Vailes LD, Arruda LK, Dhanaraj V, Pomés A. Recombinant allergens for diagnosis and therapy of allergic disease. J Allergy Clin Immunol. 2000;106:409-18.
2. Jutel M, Solarewicz-Madejek K, Smolinska S. Recombinant allergens: the present and the future. Hum Vaccin Immunother. 2012;8(10):1534-43.
3. Linhart B & Valenta R. Mechanisms underlying allergy vaccination with recombinant hypoallergenic allergen derivatives. Vaccine. 2012;30:4328-35.
4. Chruszcz M, Pomés A, Glesner J, Vailes LD, Osinski T, Porebski PJ, et al. Molecular determinants for antibody binding on group 1 house dust mite allergens. J Biol Chem. 2012;287(10):7388-98.
5. Mueller GA, Pedersen LC, Lih FB, Glesner J, Moon AF, Chapman MD, et al. The novel structure of the cockroach allergen Bla g 1 has implications for allergenicity and exposure assessment. J Allergy Clin Immunol. 2013 Jul 31. pii: S0091-6749(13)00982-2. doi: 10.1016/j.jaci.2013.06.014. [Epub ahead of print]
6. Barbosa MC, Santos AB, Ferriani VP, Pomés A, Chapman MD, Arruda LK.Efficacy of Recombinant Allergens for Diagnosis of Cockroach Allergy in Patients with Asthma and/or Rhinitis. Int Arch Allergy Immunol. 2013;161:213-9.
7. Santos AB, Chapman MD, Aalberse RC, Vailes LD, Ferriani VP, Oliver C, et al. Cockroach allergens and asthma in Brazil: identification of tropomyosin as a major allergen with potential cross-reactivity with mite and shrimp allergens, J. Allergy Clin. Immunol. 1999:104:329-37.
8. Santos AB, Rocha GM, Oliver C, Ferriani VP, Lima RC, Palma MS, et al. Cross-reactive IgE antibody responses to tropomyosins from Ascaris lumbricoides and cockroach, J. Allergy Clin. Immunol. 2008:121:1040-6.
9. Satinover SM, Reefer AJ, Pomes A, Chapman MD, Platts-Mills TAE, Woodfolk AJ. Specific IgE and IgG antibody-binding patterns to recombinant cockroach allergens. J Allergy Clin Immunol. 2005;115:803-9.
10. Pomés A, Arruda LK. Investigating cockroach allergens: Aiming to improve diagnosis and treatment of cockroach allergic patients. Methods. 2013 Aug 2. pii: S1046-2023(13)00285-5. doi: 10.1016/j.ymeth.2013.07.036. [Epub ahead of print]
11. Canonica GW, Ansotegui IJ, Pawankar R, Schmid-Grendelmeier P, van Hage M, Baena-Cagnani CE, et al. A WAO - ARIA - GA2LEN consensus document on molecular-based allergy diagnostics. World Allergy Organ J. 2013;6(1):17. doi: 10.1186/1939-4551-6-17.
12. Treudler R & Simon JC. Overview of Component Resolved Diagnostics. Curr Allergy Asthma Rep. 2013;13:110-7.
13. Burks AW, Tang M, Sicherer S, Muraro A, Eigenmann PA, Ebisawa M, et al. ICON: food allergy. J Allergy Clin Immunol. 2012;129(4):906-20.
14. Alessandri C, Zennaro D, Scala E, Ferrara R, Bernardi ML, Santoro M, et al. Ovomucoid (Gal d 1) specific IgE detected by microarray system predict tolerability to boiled hen's egg and an increased risk to progress to multiple environmental allergen sensitisation. Clin Exp Allergy. 2012;42(3):441-50.
15. Caubet JC, Kondo Y, Urisu A, Nowak-Wegrzyn A. Molecular diagnosis of egg allergy. Curr Opin Allergy Clin Immunol. 2011;11:210-15.
16. D'Urbano LE, Pellegrino K, Artesani MC, Donnanno S, Luciano R, Riccardi C, et al. Performance of a component-based allergen-microarray in the diagnosis of cow's milk and hen's egg allergy. Clin Exp Allergy. 2010;40(10):1561-70.
17. Yang AC, Arruda LK, Santos AB, Barbosa MC, Chapman MD, Galvao CE, Kalil J, Morato-Castro FF. Measurement of IgE antibodies to shrimp tropomyosin is superior to skin prick testing with commercial extract and measurement of IgE to shrimp for predicting clinically relevant allergic reactions after shrimp ingestion. J Allergy Clin Immunol. 2010;125(4):872-8.
18. Gámez C, Sánchez-García S, Ibáñez MD, López R, Aguado E, López E et al. Tropomyosin IgE-positive results are a good predictor of shrimp allergy. Allergy. 2011;66:1375-83.
19. Arruda LK. The right timing for shrimp tropomyosins. Int Arch Allergy Immunol. 2013;160(4):331-3.
20. King EM, Filep S, Smith B, Platts-Mills T, Hamilton RG, Schmechel D, et al. A multicenter ring trial of allergen analysis using fluorescent multiplex array technology. J Immunol Methods. 2013;387(1-2):89-95.
21. Scala E, Alessandri C, Bernardi ML, Ferrara R, Palazzo P, Pomponi D, et al. Crosssectional survey on immunoglobulin E reactivity in 23,077 subjects using an allergenic molecule-based microarray detection system. Clin Exp Allergy. 2010;40(6):911-21.
22. Makatsori M, Pfaar O, Lleonart R, Calderon MA. Recombinant allergen immunotherapy: clinical evidence of efficacy - a review. Curr Allergy Asthma Rep. 2013;13(4):371-80.
23. Valenta R, Campana R, Marth K, van Hage M. Allergen-specific immunotherapy: from therapeutic vaccines to prophylactic approaches. J Int Med;2012,272:144-57.
24. Jutel M, Jaeger L, Suck R, Meyer H, Fiebig H, Cromwell O. Allergen-specific immunotherapy with recombinant grass pollen allergens. J Allergy Clin Immunol. 2005;116(3):608-13.
25. Klimek L, Schendzielorz P, Pinol R, Pfaar O. Specific subcutaneous immunotherapy with recombinant grass pollen allergens: first randomized dose-ranging safety study. Clin Exp Allergy. 2012;42:936-45.
26. Pauli G, Larsen TH, Rak S, Horak F, Pastorello E, Valenta R, et al. Efficacy of recombinant birch pollen vaccine for the treatment of birch-allergic rhinoconjunctivitis. J Allergy Clin Immunol. 2008;122(5):951-60.
27. Meyer W, Narkus A, Salapatek AM, Häfner D. Double-blind, placebo-controlled, dose-ranging study of new recombinant hypoallergenic Bet v 1 in an environmental exposure chamber. Allergy. 2013;68:724-31.
28. Grönlund H, Gafvelin G. Recombinant Bet v 1 vaccine for treatment of allergy to birch pollen. Hum Vaccin. 2010 6(12):970-7.
29. Creticos PS, Schroeder JT, Hamilton RG, Balcer-Whaley SL, Khattignavong AP, Lindblad R, et al. Immunotherapy with a ragweed-toll-like receptor 9 agonist vaccine for allergic rhinitis. N Engl J Med. 2006;355(14):1445-55.
30. Senti G, Crameri R, Kuster D, Johansen P, Martinez-Gomez JM, Graf N, et al. Intralymphatic immunotherapy for cat allergy induces tolerance after only 3 injections. J Allergy Clin Immunol. 2012;129:1290-6.
31. Vrtala S, Huber H, Thomas WR. Recombinant house dust mite allergens. Methods. 2013 Jul 31. pii: S1046-2023(13)00283-1. doi: 10.1016/j.ymeth.2013.07.034. [Epub ahead of print]
32. Chen K-W, Blatt K, Thomas WR, Swoboda I, Valent P, Valenta R, Vrtala S. Hypoallergenic Der p 1/Der p 2 combination vaccines for immunotherapy of house dust mite allergy. J Allergy Clin Immunol. 2012;130:435-43.
33. Henson M & Burks AW. The future of food allergy therapeutics. Semin Immunopathol. 2012;34:703-14.
34. Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report. Allergy Clin Immunol. 2013;131:1288-96.