Número Atual: Julho-Agosto 2013 - Volume 1 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Anti-IgE na urticária crônica
Anti-IgE in chronic urticaria
Solange Oliveira Rodrigues Valle1; Sergio Duarte Dortas Júnior2; Soloni Afra Pires Levi3; Alfeu Tavares França4
DOI: 10.5935/2318-5015.20130026
1. MD, PhD. Universidade Federal do Rio de Janeiro, RJ
2. MD, MSc. Serviço de Alergia do Hospital Sao Zacharias, Rio de Janeiro, RJ
3. MD. Serviço de Alergia do Hospital Sao Zacharias, Rio de Janeiro, RJ
4. MD, PhD. Serviço de Alergia do Hospital Sao Zacharias, Rio de Janeiro, RJ
Endereço para correspondência:
Solange Oliveira Rodrigues Valle
E-mail: rodriguesvalle@terra.com.br
Submetido em 30/09/2013.
Aceito em 26/11/2013.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
A urticária é uma condiçao frequente; consiste de lesoes eritematopapulosas pruriginosas, isoladas ou agrupadas, fugazes, geralmente circulares, podendo variar em forma e tamanho. Convencionalmente, a urticária pode ser dividida, quanto a sua duraçao, em duas formas: aguda e crônica. Na forma crônica as lesoes estao presentes diariamente ou quase diariamente, permanecendo menos de 24 horas na maior parte dos casos, durante um período superior a seis semanas, frequentemente tendo impacto na qualidade de vida. A anti-IgE é um anticorpo monoclonal humanizado aprovado para o uso em asma de difícil controle. Atualmente, várias linhas de evidência indicam que a anti-IgE pode ser benéfica no tratamento da urticária espontânea crônica e física. Neste artigo revisamos as principais e atuais publicaçoes sobre o uso de anti-IgE para o tratamento da urticária crônica refratária aos tratamentos convencionais. Outros estudos ainda sao necessários para melhor compreender os mecanismos envolvidos na resposta favorável a esta terapia.
Descritores: Urticária crônica, anti-imunoglobulina E (IgE), urticárias físicas, angioedema, mastócitos.
INTRODUÇAO
A Imunoglobulina E (IgE) foi descoberta por dois grupos de pesquisadores, Ishizaka e Johansson, trabalhando em áreas diferentes. Sua importância ficou bem estabelecida em diversas enfermidades. A IgE é produzida por plasmócitos, tem vida média curta e receptores em várias células inflamatórias. A concentraçao sanguínea é baixa, representando cerca de 0,004% do total de Imunoglobulinas (Ig) no sangue, e tem peso molecular de 190 kD. A ligaçao desta molécula a receptores específicos presentes nas superfícies celulares resulta em ativaçao e liberaçao de mediadores que atuam no processo inflamatório1.
Dois tipos de células especializadas envolvidas na resposta alérgica, mastócitos e basófilos, possuem receptores Fc específicos para a IgE. Os mastócitos sao potentes células inflamatórias presentes em vários tecidos, principalmente em locais de grande exposiçao antigênica, expressam em sua superfície uma diversidade de receptores capazes de iniciar, ampliar e perpetuar processos inflamatórios, através da liberaçao de fatores solúveis e da interaçao com outras células imunoefetoras. A desgranulaçao mastocitária e o aumento da histaminemia sao observados em vários tipos de urticária2.
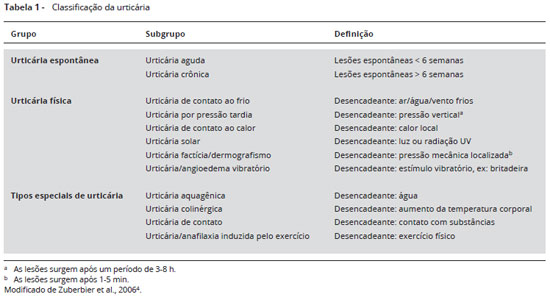
A urticária é uma condiçao frequente, consiste de lesoes ponfosas pruriginosas, isoladas ou agrupadas, fugazes, geralmente circulares, podendo variar em forma e tamanho. Pode ser acompanhada de angioedema, e surgir espontaneamente ou após estímulos físicos. Convencionalmente, a urticária pode ser dividida, quanto a sua duraçao, em duas formas: aguda e crônica3. A Tabela 1 apresenta a classificaçao para uso clínico4. A urticária crônica é mais frequente em adultos, especialmente mulheres de meia idade. A duraçao do quadro clínico é variável. Em 50% dos casos permanece em torno de 12 meses, podendo, em 20% dos casos, persistir por mais de vinte anos5. Os pacientes com urticária crônica têm frequentemente a sua qualidade de vida alterada, decorrente de efeitos negativos sobre o sono, atividades diárias, vida escolar/profissional e interaçao social6.
Os consensos atuais concluem que o objetivo do tratamento é encontrar o completo alívio dos sintomas, e recomendam o uso de anti-histamínicos nao sedantes como terapia de primeira linha. Nos pacientes que nao respondem às doses habituais é recomendado o aumento da dose em até quatro vezes. Ainda, caso nao haja controle adequado dos sintomas, sugere-se o uso de ciclosporina, dapsona, cloroquina, ou mesmo anti-IgE7-8.
A anti-IgE, molécula conhecida como Omalizumabe, é um anticorpo monoclonal humanizado aprovado para o uso em asma de difícil controle. Atualmente, várias linhas de evidência indicam que a anti-IgE pode ser benéfica no tratamento da urticária espontânea crônica e física9.
ANTI-IgE: ESTRUTURA E FUNÇAO
A anti-IgE, molécula conhecida como Omalizumabe, é um anticorpo monoclonal de 149 kD obtido através da técnica de DNA recombinante. O Omalizumabe é uma IgG1 monoclonal humanizada (95% humana e 5% murina) que se liga à IgE livre no soro, evitando a sua ligaçao aos seus receptores e consequentemente inibindo a resposta inflamatória induzida por alérgenos (independentemente da especificidade do alérgeno) e a regulaçao positiva dos FcεRI da superfície das células dendríticas, o que poderá inibir a apresentaçao de antígeno às células T10-15.
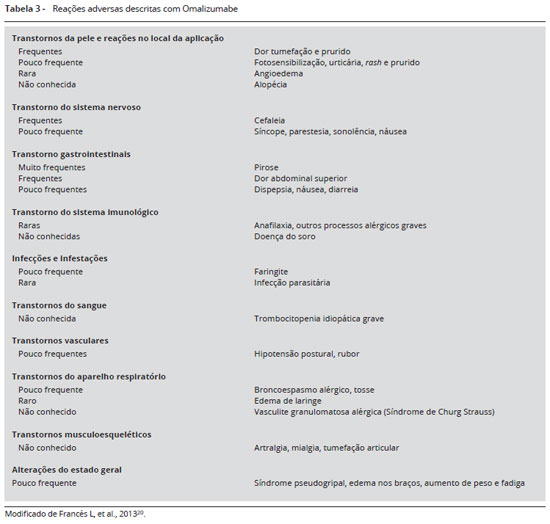
O Omalizumabe foi aprovado em 2006 no Brasil com indicaçao para tratamento da asma alérgica grave persistente. Encontra-se disponível em frasco-ampola com 75 e 150 mg da droga. No Brasil, dispomos apenas da apresentaçao de 150 mg. Parece ser um fármaco seguro e bem tolerado. Estao descritos poucos eventos adversos, e a maior parte de caráter leve. As reaçoes adversas mais frequentemente informadas durante os ensaios clínicos foram reaçoes cutâneas no local da injeçao e urticária. As primeiras incluem dor, eritema e prurido local, e ocorrem em torno de 40% dos pacientes; a urticária acontece em 4,9% dos casos16-17. Apesar do pequeno número de reaçoes adversas descritas, uma grande barreira à adesao e ao emprego da anti-IgE em outras enfermidades sao os custos elevados18.
A anti-IgE liga-se ao domínio Cε3 da IgE humana, bastante próxima da regiao de ligaçao da IgE aos receptores de alta e baixa afinidade (FcεRI e FcεRII, respectivamente), presentes em células inflamatórias (mastócitos, basófilos, eosinófilos). Assim, sao formados pequenos complexos (trímeros ou hexâmeros de menos de 1000 kDa), biologicamente inertes (nao ativam o Complemento), os quais sao lentamente eliminados pelo sistema reticuloendotelial. Consequentemente, a anti-IgE reduz a quantidade de IgE livre que está disponível para desencadear a cascata alérgica19-21.
Ainda, o uso do Omalizumabe tem sido associado à reduçao do número de receptores FcεRI em células inflamatórias. Acredita-se que tal efeito é secundário à diminuiçao da IgE circulante. Estudos prévios observaram uma forte correlaçao entre a concentraçao sérica de IgE e a quantidade de receptores FcεRI presentes em basófilos, visto que a expressao de receptores tende a diminuir consideravelmente quando estas células sao cultivadas na ausência de IgE22-24. O mesmo parece ocorrer em células maduras expostas a uma quantidade muito baixa de IgE, as quais costumam expressar uma quantidade muito reduzida de FcεRI. Um estudo farmacocinético verificou uma média de diminuiçao de receptores de 73%, com um máximo de inibiçao aos 14 dias de tratamento com Omalizumabe25.
Dados clínicos e laboratoriais sugerem que a anti-IgE atua por mecanismos múltiplos sobre outras células do sistema imune ainda nao muito bem estudados. Sanchez-Machín et al. observaram o aumento da atividade de linfócitos TCD4+ no soro de pacientes com urticária crônica nao autoimune que responderam ao uso de anti-IgE 300 mg a cada duas semanas. Iemoli et al. encontraram reduçao na ativaçao de linfócitos B, diminuiçao de TNF-alfa e de IL-4, e aumento da secreçao de IFN-gama no soro de um outro paciente com urticária crônica idiopática tratado com Omalizumabe26-27.
Recentemente, Chan et al. verificaram que o Omalizumabe foi capaz de reduzir o número de células B viáveis em tonsilas de crianças submetidas a tonsilectomia. Os pesquisadores concluíram ainda que esta droga parece reduzir a síntese de IgE por células B humanas através da inibiçao da IgE de membrana, e induçao de um estado de anergia28.
ANTI-IgE NA URTICARIA CRONICA
Mecanismo de açao
O principal mecanismo de açao do Omalizumabe tem sido relacionado à sua açao anti-IgE no tratamento da asma. Os efeitos benéficos desta terapia para o tratamento de asma persistente moderada a grave já foram bem documentados29. Entretanto, desde 2005 tem sido relatada a eficácia desta droga no tratamento de outras enfermidades, dentre elas a urticária crônica30. O exato mecanismo de açao do Omalizumabe na urticária crônica nao está totalmente elucidado, no entanto já existem várias explicaçoes fisiopatológicas descrevendo porque o Omalizumabe parece ser uma opçao adequada no tratamento dos pacientes com esta enfermidade.
Inicialmente foi demonstrado que o Omalizumabe reduz os níveis de IgE livre, assim como promove reduçao do FcεRI nos basófilos do sangue periférico31. Estudos anteriores também têm relatado que após o tratamento com Omalizumabe os mastócitos cutâneos demonstram uma mudança fenotípica e uma reduçao do FcεRI na superfície, embora em uma taxa menor que a observada nos basófilos do sangue periférico32. Saavedra & Sur concluíram que o tratamento com Omalizumabe reduz a expressao do FcεRI neste processo, o que temporalmente foi associado à melhora da urticária33.
Outros mecanismos de açao foram descritos, incluindo induçao da apoptose de eosinófilos, regulaçao negativa de citocinas inflamatórias como IL-2 e IL-13, que interferem com o crescimento e funçao dos linfócitos T, assim como diminuiçao do fator de necrose tumoral alfa e a IL-4, que interferem com a ativaçao de células B e de seu homing, e aumento da síntese de IFN-gama27. Além disso, a melhora clínica é determinada também por um mecanismo independente de IgE, atribuída à diminuiçao na sobrevida dos mastócitos e basófilos, o que explica porque os pacientes com baixos níveis desta imunoglobulina, uma situaçao comum em pacientes com urticária, obtêm melhora clínica com a utilizaçao do Omalizumabe34. Outros estudos ainda sao necessários para se melhor compreender o mecanismo da eficácia com esta nova modalidade de tratamento.
Estudos clínicos
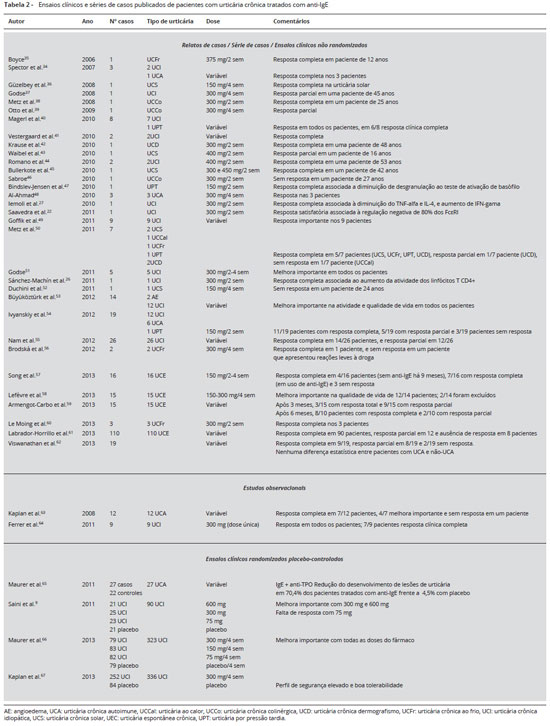
O uso da anti-IgE para o tratamento da urticária crônica tem se mostrado bastante eficaz e com bom perfil de segurança. Vários ensaios clínicos e relatos de casos têm sido publicados nos últimos anos. Os dados mais relevantes destes estudos sao apresentados na Tabela 2. Como se pode observar, a droga tem mostrado eficácia em todos os casos de urticária crônica, inclusive naqueles em que nao se verifica a participaçao de IgE na sua fisiopatogenia.
Posologia
A indicaçao de anti-IgE na urticária crônica está definida após todas tentativas das drogas preconizadas nos consensos, em doses eficazes, sem resultado clínico esperado.
A anti IgE está disponível em frasco-ampola contendo produto liofilizado que requer reconstituiçao com diluente para aplicaçao via subcutânea. A soluçao é levemente viscosa e requer administraçao lenta. Geralmente é administrada na regiao deltoide ou na coxa. Existem duas apresentaçoes: 75 e 150 mg. Uma vez reconstituída, pode ser estocada até 4 horas em temperatura ambiente ou até 8 horas em ambiente refrigerado (2-8 ºC). É absorvida lentamente após administraçao subcutânea, com pico de concentraçao no soro após 7 a 8 dias.
Nao existe critério definido do cálculo da dose em urticária crônica, embora em alguns casos tenham sido seguidos os critérios de tratamento de asma, relacionando ao peso do paciente e a concentraçao basal de IgE (UI/mL). Na asma, a dose é de 0,016 mg/Kg por UI/mL de IgE, nao devendo ultrapassar 1500 UI, sendo aprovada para pacientes com idade acima de 6 anos.
Seu uso tem se mostrado eficaz e a dose preconizada ainda é discutível, variando de 75, 300 a 600 mg/SC, preconizado a cada 2 a 4 semanas. A média na literatura tem sido 300 a 600 mg/dose, com relato de bons resultados. Romano et al. tentaram aumentar o intervalo das doses para mais de 4 semanas em 2 casos graves de urticária crônica e tiveram recaída clínica com reaparecimento das pápulas44. Entretanto, Ferrer et al. utilizaram intervalos variáveis de 300 mg de Omalizumabe, sendo bimensais em 5 pacientes e trimestrais em 3 pacientes, com bons resultados64.
O Omalizumabe tem uma vida média de 26 dias, com uma reduçao média de 2,4±1,1 mL/Kg/dia, sendo metabolizado pelo sistema reticuloendotelial. Tem sido observado que o efeito da droga se mantém durante meses. Nao é necessário o ajuste da dose com relaçao à idade (12-75 anos)20.
O primeiro estudo randomizado foi restrito a pacientes que apresentavam IgE para peroxidase tireoidiana (27 pacientes tratados com anti-IgE e 22 com placebo). A média absoluta de regressao do escore de atividade da urticária, após 24 semanas de tratamento, foi 17,8 pontos no grupo em tratamento ativo e 7,9 pontos no grupo placebo. Segundo os investigadores, 19 (70,4%) dos pacientes no grupo que recebeu tratamento com anti-IgE tiveram completa proteçao para o desenvolvimento de urticária, comparados a 4% do grupo controle65.
Um estudo multicêntrico, duplo cego randomizado de fase III, placebo controlado, envolvendo 323 pacientes foi conduzido para avaliar a eficácia e segurança do Omalizumabe em pacientes com idades entre 12 e 75 anos com urticária crônica idiopática moderada a grave, que permaneciam sintomáticos a despeito de terapia com anti-histamínicos. Pacientes foram randomizados para receberem três injeçoes subcutâneas, a intervalos de 4 semanas, de doses de Omalizumabe de 75 mg, 150 mg, 300 mg, ou placebo. A eficácia foi significantemente maior para as doses de 150 mg e 300 mg, sem efeito significante com 75 mg. Houve diminuiçao do escore de gravidade do prurido, do número e tamanho de pápulas de urticária, e aumento do número de dias sem angioedema (somente no grupo que usou 300 mg), e reduçao do uso de difenidramina de resgate, sendo os efeitos mais marcantes para a dose de 300 mg. A proporçao de pacientes que estavam completamente livres de urticária na 12ª semana foi de 10% no grupo placebo, 18% no grupo que recebeu 75 mg de Omalizumabe, 23% no grupo tratado com 150 mg, e 53% no grupo tratado com 300 mg de Omalizumabe. Nao houve reaçoes adversas graves ou fatais nos participantes do estudo66.
Estudo recente de fase III de maior duraçao avaliou a eficácia e segurança do tratamento com o Omalizumabe por um período de 24 semanas em pacientes com urticária crônica idiopática/espontânea persistente, apesar do uso de anti-histamínicos H1 em doses de até 4 vezes as doses aprovadas, antileucotrienos, ou ambos. Os pacientes foram randomizados para receber 6 injeçoes subcutâneas de 300 mg de Omalizumabe ou placebo, a cada 4 semanas, seguidas de período de observaçao de 12 semanas. Os resultados mostraram que o Omalizumabe foi bem tolerado e causou reduçao significante de sinais e sintomas de urticária quando comparado ao placebo. Duzentos e noventa pacientes completaram o estudo (224 receberam Omalizumabe, 66 placebo). Nas avaliaçoes de 12 semanas e de 24 semanas, houve diminuiçao do escore de gravidade do prurido, do número e tamanho das pápulas de urticária, além de maior número de dias sem angioedema e melhora da qualidade de vida. Um número significantemente maior de pacientes no grupo tratado com Omalizumabe estava completamente livre de urticária e prurido na 12ª semana de tratamento, comparado ao grupo placebo (34% versus 5%). Esta diferença se manteve significante na avaliaçao após 24 semanas de tratamento com Omalizumabe. Entretanto, após o término do tratamento com Omalizumabe, houve recorrência gradual dos sintomas, após período de aproximadamente 10 semanas, para níveis semelhantes àqueles observados no grupo placebo. A incidência de efeitos adversos foi semelhante tanto para o grupo tratado com Omalizumabe como para o grupo placebo67.
O anti-IgE parece ser bem tolerado. Ambos os grupos randomizados relataram pouco ou mais efeitos colaterais: diarreia, cefaleia, dismenorreia e infecçao do trato respiratório superior, entretanto nao diferia do grupo placebo54. As reaçoes adversas mais frequentemente informadas durante os ensaios clínicos foram reaçoes cutâneas no local da aplicaçao: dor, tumefaçao, eritema e prurido, ocorrendo em cerca de 40% dos casos. A urticária ocorre em 4,9% dos casos. A reaçao adversa mais temível é a anafilaxia, e se deve à fraçao murina da estrutura do Omalizumabe (Tabela 3)20.
Em 2007, a Academia Americana de Alergia, Asma e Imunologia criou o "Omalizumab Joint Task Force" (OJTF: The American Academy of Allergy, Asthma and Immunology and the American College of Allergy, Asthma and Immunology Executive Committees) para o registro de anafilaxia com Omalizumabe e observou uma incidência de 0,2%. Comprovaram que cerca de 65% das reaçoes foram nas 2 primeiras horas e nas 3 primeiras aplicaçoes, sendo 14% dentro dos 30 minutos, depois da 4ª aplicaçao. De acordo com esta observaçao, foram estabelecidos os critérios de segurança descritos na Tabela 420.
Paciente do sexo feminino, 49 anos, com urticária espontânea crônica autoimune há 6 anos, urticária por pressao tardia, e vasculite urticariforme (Escore = 6). Sem resposta aos tratamentos convencionais e alternativos (ciclosporina, dapsona, hidroxicloroquina, imunoglobulina humana), optou-se pelo uso de anti-IgE. Após a assinatura do Termo de Consentimento Livre e Esclarecido, foi administrada 300 mg por via subcutânea, e a dose repetida a cada 4 semanas. Houve regressao dos sintomas a partir de 4 horas após a primeira aplicaçao, tornando-se assintomática em 48 h (Escore = 0), e sem efeitos adversos. Após 4 meses assintomática houve tentativa de aumentar o intervalo entre as aplicaçoes para 6 semanas, porém a paciente apresentou recidiva das lesoes (Escore =2). Optamos por retomar o esquema anterior. Encontra-se em acompanhamento há 9 meses mantendo-se assintomática, sem outra medicaçao.
CONCLUSAO
De acordo com os trabalhos publicados até o momento, o uso de anti-IgE em urticária espontânea crônica (UEC) e urticárias físicas refratárias tem mostrado excelente perfil de eficácia e segurança, com resposta positiva em média de 81%, e baixa percentagem (7%) de insucesso. A anti-IgE já está incluída como terceira linha terapêutica para a UEC, no EAACI/GA2LEN/EDF/WAO guidelines e, recentemente, no WAO guidelines. Outros estudos ainda sao necessários para melhor compreender os mecanismos envolvidos na resposta favorável a esta terapia, assim como determinar a dose ideal.
REFERENCIAS
1. Parslow TG. Immunoglobulins & Immunoglobulin Genes. In: Parslow TG, Stites DP, Terr AI, Imboden JB (eds.). Medical Immunology. 10 ed. Lange Medical Books/McGrawHill; 2001. p. 95-114.
2. Black AK, Greaves MW. Urticaria and Angioedema. In: Kay AB (ed.). Allergy and allergic diseases. Oxford: Blackwell Science Ltda; 1997. p. 1586-607.
3. Kaplan AP. Urticaria and angioedema. In: Middleton E Jr, Reed CE, Ellis EF, Adkinson NF Jr, Yungiger JW, Busse WW (eds.). Allergy: principles and practice. 4ed. St Louis: Mosby; 1993. p. 1553-80.
4. Zuberbier T, Bindslev-Jensen C, Canonica W, et al; EAACI/GA2LEN/EDF. EAACI/GA2LEN/EDF guideline: definition, classification and diagnosis of urticaria. Allergy. 2006 Mar;61(3):316-20.
5. Kennard CD. Evaluation and treatment of urticaria. Immunol Allergy Clin N Am. 1995;15:785-801.
6. Mlynek A, Magerl M, Hanna M, et al. The German version of the chronic urticaria quality-of-life questionnaire: factor analysis, validation, and initial clinical findings. Allergy. 2009;64:927-36.
7. Zuberbier T, Asero R, Bindslev-Jensen C, et al. EAACI/GA2LEN/EDF/WAO guideline: management of urticaria. Allergy. 2009:64:1427-43.
8. Sánchez-Borges M, Asero R, Ansotegui IJ, et al. Diagnosis and Treatment of urticaria and angioedema : a worldwide perspective. WAO Journal. 2012;5:125-47.
9. Saini S, Rosen KE, Hsieh HJ, Wong DA, Conner E, Kaplan A, et al. A randomized, placebo-controlled, dose-ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticaria. J Allergy Clin Inmmunol. 2011;128:567-73.
10. Long AA. Monoclonal antibodies and other biologic agents in the treatment of asthma. MAbs. 2009 May-Jun;1(3):237-46.
11. Plosker GL, Keam SJ. Omalizumab - a review of its use in the treatment of allergic asthma. BioDrugs. 2008;22(3):189-204.
12. http://www.portal.novartis.com.br/UPLOAD/ImgConteudos/1815.pdf.
13. Miller CW, Krishnaswamy N, Johnston C, et al. Severe asthma and the omalizumab option. Clin Mol Allergy. 2008;6:4.
14. Holgate S, Casale T, Wenzel S, et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. J Allergy Clin Immunol. 2005 Mar;115(3):459-65.
15. Buhl R, Hanf G, Soler M, et al. The anti-IgE antibody omalizumab improves asthma-related quality of life in patients with allergic asthma. Eur Respir J. 2002 Nov;20(5):1088-94.
16. Stokes J, Casale TB. Anti-IgE therapy. In: Adkinson NFJ,Bochner BS, Busse W, Holgate S, Lemanske RFJ, Simons FER, eds. Middleton's allergy principes and practice. 7th ed. Philadelphia: Mosby Elsevier; 2009. p. 1679-89.
17. Berger W, Gupta N, McAlary M, et al. Evaluationof long-term safety of the anti-IgE antibody, omalizumab inchildren with allergic asthma. Ann Allergy Asthma Inmmunol. 2003;91:182-8.
18. Sullivan SD, Turk F. An evaluation of the cost-effectiveness of omalizumab for the treatment of severe allergic asthma. Allergy. 2008 Jun;63(6):670-84.
19. Presta L, Shields R, O'Connell L, et al. The binding site on human immunoglobulin E for its highaffinity receptor. J Biol Chem. 1994;269:26368-73.
20. Francés L, et al. Omalizumab en el tratamiento de la urticaria crónica. Actas Dermosifiliogr. 2013. http://dx.doi.org/10.1016/j.ad.2013.06.002
21. Mirkina I, Schweighoffer T, Kricek F. Inhibition of human cord blood-derived mast cell responses by anti-Fc epsilonRI mAb 15/1 versus anti-IgE omalizumab. Inmmunol Lett. 2007;109:120-8.
22. Saavedra M, Sur S. Down regulation of the high-affinity IgE receptor associated with successful treatment of chronic idiopathic urticaria with omalizumab. Clin Mol Allergy. 2011;9:2.
23. Malveaux F, Conroy M, Adkinson N, et al. IgE receptor on human basophils: Relationship to serum IgE concentration. J Clin Invest. 1978;62:176-81.
24. MacGlashan Jr D, McKenzie-White J, Chichester K, et al. In vitro regulation of Fc(epsilon)RI expression on human basophils by IgE antibody. Blood. 1998;91:1633-43.
25. Lin H, Boesel KM, Griffith DT, et al. Omalizumab rapidly decreases nasal allergic response and FcepsilonRI on basophils. J Allergy Clin Immunol. 2004;113:297-302.
26. Sánchez-Machín I, Iglesias-Souto J, Franco A, et al. T cell activity in successful treatment of chronic urticaria with omalizumab. Clin Mol Allergy. 2011;9:11.
27. Iemoli E, Piconi S, Fusi A, et al. Immunological effects of omalizumab in chronic urticaria: A case report. J Invest Allergol Clin Immunol. 2010;20:252-4.
28. Chan MA, Gigliotti NM, Dotson AL, et al. Omalizumab may decrease IgE synthesis by targeting membrane IgE+ human B cells. Clin Transl Allergy. 2013 Sep 2;3(1):29.
29. Busse W, Corren J, Lanier BQ, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001,108:184-90.
30. Mankad VS, Burks AW. Omalizumab: other indications and unanswered questions. Clin Rev Allergy Immunol. 2005;29:17-30.
31. MacGlashan DW Jr, Bochner BS, Adelman DC, et al. Downregulationof FcεRI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol 1997;158:1438-45.
32. Beck LA, Marcotte GV, MacGlashan DW Jr, et al. Omalizumab induced reductions in mast cell FcεRI expression and function. J Allergy Clin Immunol. 2004,114:527-30.
33. Saavedra MC, Sur S. Down regulation of the high-affinity IgE receptor associated with successful treatment of chronic idiopathic urticaria with omalizumab. Clinical and Molecular Allergy. 2011;9:2.
34. Spector SL, Tan RA. Effect of omalizumab on patients with chronic urticaria. Ann Allergy Asthma Immunol. 2007;99:190-3.
35. Boyce JA. Successful treatment of cold-induced urticaria/anaphylaxis with anti-IgE. J Allergy Clin Immunol. 2006;117:1415-8.
36. Güzelbey O, Ardelean E, Magerl M, et al. Successful treatment of solar urticaria with anti-immunoglobulin E therapy. Allergy. 2008;63:1563-5.
37. Godse K. Omalizumab in severe chronic urticaria. Indian J Dermatol Venereol Leprol. 2008;74(2):157.
38. Metz M, Bergmann P, Zuberbier T, et al. Successful treatment of cholinergic urticaria with anti-immunoglobulin E therapy. Allergy. 2008;63:247-9.
39. Otto HF, Calabria CW. A case of severe refractory chronic urticaria: a novel method for evaluation and treatment. Allergy Asthma Proc. 2009;30:333-7.
40. Magerl M, Staubach P, Altrichter S, et al. Effective treatment of therapy-resistant chronicspontaneous urticaria with omalizumab. J Allergy Clin Immunol. 2010;126:665-6.30.
41. Vestergaard C, Deleuran M. Two cases of severe refractory chronic idiopathic urticaria treated with omalizumab. Acta Derm Venereol. 2010;90:443-4.
42. Krause K, Ardelean E, Kessler B, et al. Antihistamine-resistant urticaria factitia successfully treated with anti-immunoglobulin E therapy. Allergy. 2010;65(11):1494-5.
43. Waibel KH, Reese DA, Hamilton RG, et al. Partial improvement of solar urticaria after omalizumab. J Allergy Clin Immunol. 2010;125(2):490-1.
44. Romano C, Sellitto A, de Fanis U, et al. Maintenance of remission with low-dose omalizumab inlong-lasting, refractory chronic urticaria. Ann Allergy Asthma Immunol. 2010;104:95-7.
45. Bullerkotte U, Wieczorek D, Kapp A, et al. Effective treatment of refractory severe heat urticaria with omalizumab. Allergy. 2010;65:931-2.
46. Sabroe RA. Failure of omalizumab in cholinergic urticaria. Clin Exp Dermatol. 2010;35(4):e127-9.
47. Bindslev-Jensen C, Skov PS. Efficacy of omalizumab in delayed pressure urticaria: a case report. Allergy. 2010;65:138-9.
48. Al-Ahmad M. Omalizumab therapy in three patients with chronic autoimmune urticaria. Ann Saudi Med. 2010;30(6):478-81.
49. Groffik A, Mitzel-Kaoukhov H, Magerl M, et al. Omalizumab - an effective and safe treatment of therapy-resistant chronic spontaneous urticaria. Allergy. 2011;66(2):303-5.
50. Metz M, Altrichter S, Ardelean E, et al. Anti-immunoglobulin E treatment of patients with recalcitrant physical urticaria. Int Arch Allergy Immunol. 2011;154(2):177-80.
51. Godse KV. Omalizumab in treatment-resistant chronic spontaneous urticaria. Indian J Dermatol. 2011;56(4):444.
52. Duchini G, Bäumler W, Bircher AJ, et al. Failure of omalizumab (Xolairr) in the treatment of a case of solar urticaria caused by ultraviolet A and visible light. Photodermatol Photoimmunol Photomed. 2011;27(6):336-7.
53. Büyüköztürk S, Gelincik A, Demirtürk M, et al. Omalizumab markedly improves urticaria activity scores and quality of life scores in chronic spontaneous urticaria patients: A real life survey. J Dermatol. 2012;39(5):439-42.
54. Ivyanskiy I, Sand C, Francis ST. Omalizumab for chronic urticaria: a case series and overview of the literature. Case Rep Dermatol. 2012;4:19-26.
55. Nam YH, Kim JH, Jin HJ, et al. Effects of omalizumab treatment in patients with refractory chronic urticaria. Allergy Asthma Immunol Res. 2012;4(6):357-61.
56. Brodská P, Schmid-Grendelmeier P. Treatment of severe cold contact urticaria with omalizumab: case reports. Case Rep Dermatol. 2012 Sep;4(3):275-80.
57. Song CH, Stern S, Giruparajah M, et al. Long-term efficacy of fixeddose omalizumab for patients with severe chronic spontaneous urticaria. Ann Allergy Asthma Immunol. 2013 Feb;110(2):113-7.
58. Lefévre AC, Deleuran M, Vestergaard C. A long term case series study of the effect of omalizumab on chronic spontaneous urticaria. Ann Dermatol. 2013 May;25(2):242-5.
59. Armengot-Carbo M, Velasco-Pastor M, Rodrigo-Nicolas B, et al. Omalizumab in chronic urticaria: a retrospective series of 15 cases. Dermatol Ther. 2013 May-Jun;26(3):257-9.
60. Le Moing A, Bécourt C, Pape E, et al. Effective treatment of idiopathic chronic cold urticaria with omalizumab: Report of 3 cases. J Am Acad Dermatol. 2013 Aug;69(2):e99-e101.
61. Labrador-Horrillo M, Valero A, Velasco M, et al. Efficacy of omalizumab in chronic spontaneous urticaria refractory to conventional therapy: analysis of 110 patients in real-life practice. Expert Opin Biol Ther. 2013 Sep;13(9):1225-8.
62. Viswanathan RK, Moss MH, Mathur SK. Retrospective analysis of the efficacy of omalizumab in chronic refractory urticaria. Allergy Asthma Proc. 2013 Sep;34(5):446-52. [Abstract]
63. Kaplan AP, Joseph K, Mayjut RJ, Geba GP, Zeldin RK. Treatment of chronic autoimmune urticarial with omalizumab. J AllergyClin Inmmunol. 2008;122:569-73.
64. Ferrer M, Gamboa P, Sanz ML, Goikoetxea MJ, Cabrera-Freitag P, Javaloyes G, et al. Omalizumab is effective in non autoimmune urticaria. J Allergy Clin Immunol. 2011;127(5):1300-2.
65. Maurer M, Altrichter S, Bieber T, Biedermann T, Bräutigam M,Seyfried S, et al. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Inmmunol. 2011;128:202-9.
66. Maurer M, Rosén K, Hsieh HJ, Saini S, Grattan C, Gimenéz-Arnau A, et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med. 2013 Mar 7;368(10):924-35. [Erratum in N Engl J Med. 2013 Jun 13;368(24):2340-1.]
67. Kaplan A, Ledford D, Ashby M, Canvin J, Zazzali JL, Conner E, et al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013 Jul;132(1):101-9.