Número Atual: Outubro-Dezembro 2024 - Volume 8 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Doenças inflamatórias do tipo 2: perfil de segurança de imunobiológicos e pequenas moléculas na gestação
Type 2 inflammatory diseases: safety profile of biologics and small molecules during pregnancy
Catarina Monteiro Palumbo1; Marcelo Vivolo Aun1,2
1. Hospital Israelita Albert Einstein, Faculdade Israelita de Ciências da Saúde Albert Einstein - São Paulo, SP, Brasil
2. Faculdade de Medicina da Universidade de São Paulo, Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
Endereço para correspondência:
Marcelo Vivolo Aun
E-mail: marcelovivoloaun@gmail.com
Submetido em: 17/09/2024
Aceito em: 26/10/2024.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
As doenças inflamatórias crônicas do tipo 2 são altamente prevalentes em mulheres em idade fértil. Quando mal controladas, se associam a complicações gestacionais, o que justifica o estudo de diferentes alternativas para o seu manejo. Esse artigo objetiva revisar a literatura sobre o uso de terapias avançadas, como imunobiológicos e pequenas moléculas, em doenças do tipo 2, com enfoque em seu perfil de segurança durante a gestação. Foram analisados os estudos observacionais disponíveis na literatura de 2010 a 2024, visando avaliar o risco de complicações maternas e fetais advindas da exposição a estas medicações na gestação. Não foram encontrados ensaios clínicos randomizados em humanos sobre o tema. Em nenhum estudo sobre omalizumabe e dupilumabe a exposição foi diretamente associada a desfechos negativos. Não há dados suficientes em humanos para predizer aumento de risco de complicações no uso de mepolizumabe, benralizumabe, tezepelumabe, reslizumabe ou tralokinumabe. Os inibidores das Janus quinase são absolutamente contraindicados após a concepção, pelo risco observado na exposição de animais.São necessários mais estudos sobre o tema, para melhor compreensão da segurança de terapias avançadas na gestação, visando decisões clínicas mais embasadas no futuro.
Descritores: Terapia de alvo molecular, gravidez, asma, dermatite atópica, hipersensibilidade.
Introdução
As doenças inflamatórias crônicas do tipo 2, como dermatite atópica (DA), asma, rinossinusite crônica com pólipos nasais (RSCcPN) e esofagite eosinofílica (EEo) são um grupo de patologias de fenótipos variados e características fisiopatológicas comuns, que acometem juntas entre 20% e 30% da população mundial1,2. A urticária crônica espontânea (UCE), a despeito de ter uma fisiopatologia distinta, é associada à atopia e também envolve a participação das principais células e moléculas da inflamação do tipo 2, compartilhando alguns de seus alvos terapêuticos3,4.
O mau controle destas doenças se associa à morbidade e à redução da qualidade de vida, gerando custos diretos e indiretos elevados para a sociedade5. Apesar de existirem manejos bem estabelecidos e individualizados, muitos pacientes não toleram as medicações ou não apresentam remissão completa dos sintomas com o uso de terapias convencionais. Neste cenário, o desenvolvimento de terapias avançadas, como imunobiológicos e pequenas moléculas, tem revolucionado o seu tratamento e prognóstico, permitindo controle mais efetivo da atividade da doença6.
Estima-se uma prevalência de 18 a 30% de patologias alérgicas em mulheres em idade fértil7. Na gestação, uma série de adaptações imunológicas resultam em dominância da resposta T helper 2 (Th2) durante o crescimento fetal, podendo predispor à ocorrência de exacerbações, piora dos sintomas ou aparecimento de novas doenças atópicas8. Algumas das opções de manejo de primeira linha também são contraindicadas, tendo o seu uso suspenso após a concepção. O controle inadequado das doenças é consistentemente associado com desfechos adversos maternos e fetais9-12.
Atualmente, das 11 medicações aprovadas pela Food and Drug Administration (FDA) para o manejo de doenças inflamatórias do tipo 26, nenhuma é formalmente indicada para uso durante a gestação. Não existem ensaios clínicos randomizados que comprovem a segurança nessa população13; no entanto, há múltiplos registros de pacientes gestantes que fizeram uso de biológicos e pequenas moléculas, entre os anos de 2010 e 2024. O objetivo deste estudo é revisar extensamente a literatura sobre o uso de terapias avançadas para asma, rinossinusite crônica com pólipos nasais, dermatite atópica, esofagite eosinofílica e urticária crônica espontânea com enfoque em seu perfil de segurança durante a gestação.
Desenvolvimento
Fisiopatologia da inflamação do tipo 2
A resposta imunológica do tipo 2 é classicamente definida como uma resposta adaptativa do organismo, que envolve a ativação de linfócitos Th2 e a liberação de citocinas efetoras do grupo 2, culminando no recrutamento de eosinófilos e na produção de IgE14,15. Esse padrão de resposta imune pode ser desencadeado por helmintos, mas também por outros patógenos e substâncias irritativas16,17. Alérgenos podem ser gatilho para uma resposta inflamatória não direcionada e desregulada de padrão Th2, resultando em alergias, anafilaxia e doenças atópicas14,17. A pele e a barreira epitelial do hospedeiro têm importante papel protetor contra estímulos ambientais nocivos e invasão de parasitas17. Em pacientes com inflamação persistente há dano à barreira epitelial, exacerbando e perpetuando as doenças atópicas18.
A exposição a insultos exógenos desencadeia a liberação de alarminas pelas células epiteliais, como linfopoetina estromal tímica (TSLP -thymic stromal lymphopoietin), Interleucina (IL) 25 e IL33. Essas atuam na ativação das células apresentadoras de antígenos (APCs)19 e das ILC2, importantes fontes de IL5 e IL13,15 antes mesmo do início da resposta imune adaptativa14. As APCs apresentam antígenos nos linfonodos19 resultando na ativação de linfócitos TCD4 naive em linfócitos Th2 e na produção de citocinas efetoras, como IL4, IL5 e IL1314. A polarização para resposta Th2 não é completamente elucidada, porém parece ser mediada pela presença das alarminas14,20.
Linfócitos Th2 interagem com os linfócitos B (LB)21, resultando na produção de IgE por um mecanismo dependente de IL4 e IL136. A IL4, além de incentivar a diferenciação de mais linfócitos T imaturos em Th2, induz a troca de isótipos nos LB. IL13, por sua vez, atua na proliferação de LB produtores de IgE19. A IL5 estimula o desenvolvimento de eosinófilos, promovendo a ativação de seus precursores na medula óssea, maturação e diferenciação6,22. No sangue, os eosinófilos liberam grânulos de proteína citotóxicos que induzem dano e disfunção tecidual22. Também atuam na regulação da proliferação e da degranulação de mastócitos6,22.
Os anticorpos IgE ativam mastócitos e basófilos, com liberação de histamina, leucotrienos, triptase e prostaglandinas, que perpetuam a resposta inflamatória por meio do recrutamento de células imunes6 e atuam na barreira epitelial, resultando em hipersecreção de muco e contração de células musculares lisas16.
Há diversas vias de sinalização envolvidas na inflamação do tipo 2. Entre elas, destacam-se as proteínas Janus quinase (JAK - Janus kinase) e tirosina quinase de Bruton (BTK - Bruton's tyrosine kinase), que têm sido estudadas no desenvolvimento de terapias avançadas6. A supressão da resposta imune do tipo 2 é realizada por linfócitos regulatórios Treg e Breg, que secretam IL10 e fator de transformação de crescimento beta (TGF-β transforming growth factor beta). A atividade e concentração destes fatores reguladores parece estar alterada nas doenças inflamatórias do tipo 26,23.
Doenças inflamatórias do tipo 2 na gestação
A prevalência de doenças alérgicas em mulheres em idade fértil varia entre 18 e 30%, sendo asma, DA, rinite alérgica e alergia alimentar as mais frequentes7. Durante a gestação ocorrem diversas adaptações imunológicas, visando um equilíbrio entre a imunidade efetiva contra patógenos e a imunomodulação adequada para cada estágio do desenvolvimento fetal. Enquanto na implantação, placentação e no terceiro trimestre são necessários estados mais pró inflamatórios, durante a fase de crescimento fetal predomina um ambiente imunológico anti-inflamatório8.
Entre 13 e 27 semanas gestacionais, período de crescimento do feto e da placenta, há uma mudança da resposta imunológica, com uma dominância do padrão Th2 e com papel central de linfócitos reguladores. Os linfócitos Treg e Th9 controlam as respostas de linfócitos efetores contra antígenos paternos, protegendo as células do feto de rejeição e apoptose, o que ajuda na promoção de um ambiente anti-inflamatório8,24. Acredita-se, ainda, que as citocinas do tipo 2 estejam envolvidas na tolerância materno-fetal24. No entanto, a exacerbação da imunidade Th2 neste período pode se associar com o aparecimento ou piora clínica de doenças autoimunes e/ou atópicas13,24.
A asma é a doença respiratória mais prevalente neste grupo, afetando até 13% das gestantes no mundo. Apesar de seu curso variável, cerca de 30% das pacientes apresentam piora dos sintomas durante a gestação. As exacerbações de asma têm impacto negativo nos desfechos maternos e fetais, que podem estar relacionados com a redução na prescrição e na adesão às medicações durante o período gestacional. Os guidelines, em geral, recomendam a manutenção das drogas utilizadas antes da concepção, porém faltam evidências sobre o perfil de segurança das mesmas25.
Múltiplos estudos demonstraram associação significante entre a presença de asma mal controlada e desfechos negativos maternos e fetais. Uma revisão sistemática e metanálise de Wang e cols.9 com base em 40 coortes prospectivas e retrospectivas correlacionou a asma materna de maneira significativa com o aumento do risco de diabetes gestacional, cesárea, hemorragia anteparto, hemorragia pós-parto, descolamento de placenta e rotura prematura de membranas ovulares. Já a atualização da revisão sistemática e metanálise de Robijn e cols.10 sobre eventos adversos neonatais em gestantes com asma, demonstrou risco elevado de malformações congênitas, mortalidade perinatal e hospitalização neonatal. Em relação ao estudo original26, o risco de morte neonatal perdeu significância estatística.
A DA é a dermatose mais comum na gestação, correspondendo a 30 a 50% das patologias de pele neste grupo27. Em 80% dos casos não há história prévia de doença, enquanto em 20% ocorre recorrência após a concepção28. Entre as portadoras de eczema, o curso da doença é variável, com piora em cerca de 50% dos casos, especialmente no segundo trimestre27. Isso pode ser explicado pelas mudanças imunológicas discutidas anteriormente, mas também pelas consequências das alterações hormonais na pele. Estudos recentes indicam que o estrogênio tem impacto positivo na barreira epitelial, enquanto a progesterona parece ter efeito negativo. Estes hormônios também estimulam os linfócitos Th2 e alteram o balanço das citocinas, contribuindo para a erupção atópica gestacional29.
O planejamento pré-gestacional deve incluir medidas para reduzir a atividade da doença ao mínimo27, pois poucas terapias sistêmicas para DA são comprovadamente seguras durante a gestação. Emolientes e corticoides tópicos de baixa a média potência são considerados tratamentos de primeira linha. As terapias UVA1 e UVB ficam restritas a casos mais graves, assim como a ciclosporina, que se encaixa na categoria C de segurança na gestante. Outras medicações tópicas e sistêmicas podem ser consideradas, porém, a evidência é limitada29.
Os desfechos maternos e fetais de gestações em paciente com eczema são pouco estudados. Em uma coorte retrospectiva dinamarquesa, de Hamann e cols.11,encontrou significância estatística da DA como fator protetor para diabetes mellitus gestacional e como fator de risco para rotura prematura de membrana ovulares e sepse neonatal por estafilococos. Essas associações, no entanto, não se sustentaram na análise ajustada para IMC. Outra possível complicação, com poucos casos relatados, é o eczema herpético na gestação. Este se desenvolve secundariamente ao comprometimento da integridade epitelial30 e pode se relacionar a aborto, parto prematuro e restrição do crescimento intrauterino27.
Existem poucos dados na literatura sobre a RSCcPN durante a gestação. Estima-se que cerca de 18% a 30% das gestantes apresentam sintomas de rinite, que pioram significativamente a qualidade de vida, em especial no terceiro trimestre31. Não há estudos sobre a prevalência de RSCcPN nesta população. Os desfechos maternos e fetais também foram pouco estudados.
O seu manejo durante o período gestacional é por meio de corticoides, sendo os tópicos preferíveis em relação aos sistêmicos32. O estudo de Alhussien e cols.33 concluiu que propionato de fluticasona, mometasona e budesonida são as opções mais seguras na gestação. Não há dados na literatura em relação à manutenção ou introdução de imunobiológicos em gestantes com essa patologia.
A UCE acomete de 3% a 5% da população em algum momento da vida e ocorre com maior frequência em mulheres34. Apesar da gravidade do quadro em pacientes do sexo feminino, há poucos dados em relação ao seu seguimento durante a gestação. O estudo PREG-CU, de Kocatürk e cols.35, avaliou 288 mulheres portadoras da doença em 13 países. Destas, 63% descontinuaram ou trocaram o tratamento após a concepção. Os anti-histamínicos foram as medicações mais utilizadas e não se associaram a piores desfechos maternos ou fetais. Não houve diferenças de complicações em portadoras de UCE, quando comparadas à população geral. Exacerbações da urticária que necessitam de tratamento de emergência se associaram significativamente com o parto pré-termo, sugerindo que o bom controle da doença é essencial durante a gestação35.
Apesar de mais frequente no sexo masculino, a prevalência de EEo em mulheres é de 32.83 casos a cada 100.000 pessoas, com pico de incidência entre a segunda e a terceira décadas da vida36,37. O estudo de Huang e cols.37 não relatou eventos adversos gestacionais relacionados ao uso de corticoides sistêmicos durante a gestação. A coorte de Röjler e cols.36 não demonstrou associação positiva entre a presença de EEo e baixo peso ao nascer, parto instrumentalizado, indução de parto, diabetes mellitus gestacional e pré-eclâmpsia. No entanto, o manejo adequado e as possíveis complicações em gestantes ainda são pouco conhecidos.
Terapias avançadas
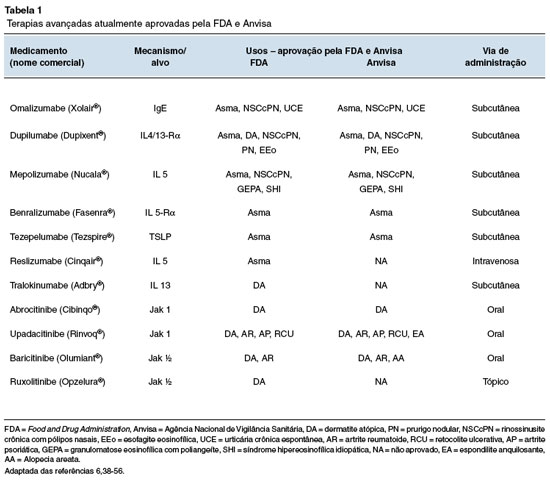
As terapias avançadas têm revolucionado o tratamento e o prognóstico das doenças atópicas, permitindo controle mais efetivo da atividade da doença e remissão dos sintomas em muitos pacientes. Atualmente, há 7 imunobiológicos aprovados pela FDA para uso nos Estados Unidos, sendo eles: omalizumabe, dupilumabe, mepolizumabe, benralizumabe, tezepelumabe, reslizumabe e tralokinumabe. Além disso, há quatro medicações do grupo das pequenas moléculas, sendo elas: abrocitinibe, upadacitinibe, baricitinibe e ruxolitinibe. A Tabela 1 resume as principais informações sobre as terapias avançadas6,38-56.
No Brasil, são aprovados pela Anvisa para o tratamento da asma: omalizumabe, dupilumabe, mepolizumabe, tezepelumabe e benralizumabe49-53,57. Um consenso internacional publicado em 202458, incluindo 141 especialistas envolvidos no tratamento de asma em 32 países, concluiu que os imunobiológicos podem ser usados durante a pré-concepção, a gestação e a amamentação em mulheres com asma grave. Entre eles, omalizumabe, mepolizumabe, benralizumabe, reslizumabe e dupilumabe atingiram consenso ≥ 75% dos respondentes. Há concordância de que o seu uso pode ser iniciado durante a gestação, com os mesmos critérios de indicação aplicados a não gestantes e prezando por uma decisão compartilhada com a paciente.
As medicações aprovadas para manejo da DA no Brasil são o dupilumabe, o abrocitinibe, o upadacitinibe e o baricitinibe50,54-56. Já para RSCcPN, o arsenal terapêutico inclui o omalizumabe, o dupilumabe e o mepolizumabe49-51,59. A FDA e a Anvisa aprovam o uso de dupilumabe na EEo39,50 e de omalizumabe na UCE38,49.
Outras medicações estão em desenvolvimento clínico e ou diferentes fases de pesquisa clínica. Entre os alvos estudados destacam-se: citocinas (TLSP, IL33 e ST2), IL4/IL4 Rα e IL 13/IL13 Rα1, IL5 e IL-5Rα, JAK, IgE, BTK, Mastócitos e outros (IL31, IL-31Rα, NK1R, CCR4, GATA3, OX40, OX40L)6.
Perfil de segurança das terapias avançadas na gestação
O uso de terapias avançadas durante a gestação é pouco embasado e não há indicação formal de sua prescrição neste período38-48. A Tabela 2 sumariza as classificações de risco gestacional atribuídas a cada medicação. A categoria de risco B se refere a medicações em que os estudos em animais não se associaram a maior risco fetal, porém não foram feitos estudos controlados em mulheres grávidas. Também se incluem nessa categoria as drogas em que os estudos em animais demonstraram riscos, que não se confirmaram em estudos controlados em seres humanos. Já a categoria C engloba as medicações em que os estudos com animais demonstraram riscos para o feto, mas não foram feitos estudos controlados em humanos60.
Por serem drogas com alvo biológico específico, acredita-se que podem ter menor risco de desfechos maternos e fetais, quando comparadas a medicações sistêmicas. No entanto, há evidências de passagem de anticorpos monoclonais por via placentária, em especial ao final da gestação, o que poderia gerar riscos para o feto13. A seguir, serão revisados os artigos disponíveis sobre a aplicação destes medicamentos durante o período gestacional.
Omalizumabe
O uso do omalizumabe na gestação tem sido estudado para pacientes com asma e com UCE. Não há ensaios clínicos randomizados sobre o tema. O estudo observacional EXPECT, de Namazy e cols.61, é uma coorte prospectiva publicada em 2015, que analisou 191 pacientes expostas a uma ou mais doses de omalizumabe a qualquer momento da gestação ou em até 8 semanas antes da concepção. Entre as 169 gestações com desfecho relatado foram observados 160 nascidos vivos, incluindo 4 gestações gemelares, 1 natimorto e 11 abortos. Há 21 anomalias congênitas descritas, sendo 4,4% anomalias maiores e 8,8% defeitos constitucionais. Prematuridade, baixo peso ao nascer e tamanho pequeno para a idade gestacional foram vistos, respectivamente, em 14,5%, 3,2% e 10,9% dos casos. Estes achados não se mostraram divergentes em relação a estudos de complicações fetais em pacientes asmáticas sem uso de imunobiológicos.
O estudo QECC (Quebec External Comparator Cohort ), publicado em 2020 por Namazy e cols.62, comparou a coorte do EXPECT (n = 230) com uma população de pacientes asmáticas e gestantes que não faziam uso de imunobiológicos (n = 1.143). A prevalência de anomalias congênitas maiores foi semelhante entre os grupos (8,9% no QECC vs. 8,1% no EXPECT), o que corrobora para a conclusão de que a exposição ao omalizumabe não parece aumentar o risco deste desfecho. Além disso, a proporção de nascidos vivos foi similar nos dois estudos (99,3% no QECC vs. 99,1% no EXPECT), com maior número de crianças pequenas para a idade gestacional no primeiro (15,8% no QECC vs. 9,7% no EXPECT)61-62.
Outro estudo observacional retrospectivo, de Gemicioglu e cols.63, analisou 20 pacientes asmáticas que fizeram uso de, ao menos, uma dose de omalizumabe durante a gestação. Foram observados 8 episódios de exacerbação de asma (36,4%), 5 casos de prematuridade (21,5%) e 3 de baixo peso ao nascer (13%). Não foram relatadas anomalias congênitas ou outros desfechos materno-fetais.
Na análise do perfil de segurança do omalizumabe em portadoras de UCE, o estudo retrospectivo de Patruno e cols.64 encontrou 1 aborto entre as 29 pacientes submetidas a uma ou mais doses da medicação durante a gestação ou em até 8 semanas pré-concepção. Não foi visto nenhum outro evento adverso, levando à conclusão de que o uso de omalizumabe para UCE não aparenta ter desfechos negativos. Um subgrupo do EXPECT, contendo 30 pacientes com UCE, também foi analisado por Namazi e cols.65. Os resultados foram semelhantes aos encontrados na asma e o estudo concluiu que não foi observado aumento de risco no grupo que fez uso de omalizumabe.
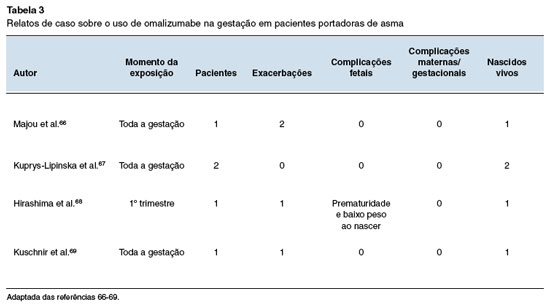
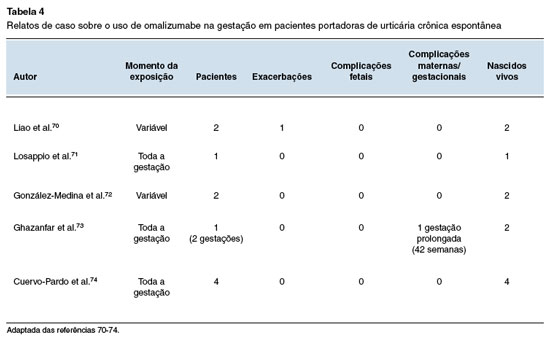
Por fim, foram revisados 9 relatos de caso, cujos dados principais e desfechos estão compilados nas Tabelas 3 e 4. Cinco pacientes com asma grave, de difícil controle e com múltiplas exacerbações, engravidaram durante o uso de omalizumabe, optando por sua manutenção durante a gestação66-69. Três mantiveram a droga até o termo, enquanto uma suspendeu o uso após o primeiro trimestre. Quatro episódios de exacerbação foram relatados. Uma paciente teve parto prematuro68 na 26ª semana, com o da asma prévia à gestação. Não foi observada nenhunascimento de uma menina com baixo peso (544 g). ma anomalia congênita ou outro desfecho deletério materno e fetal.
As 10 pacientes portadoras de UCE acompanhadas fizeram uso de omalizumabe no primeiro trimestre ou por toda a gestação70-74. Em um caso a medicação foi iniciada após a concepção72, e em outro houve aumento de dose com 12 semanas por exacerbação grave70. Não foram relatados natimortos, abortos, prematuridade, baixo peso ao nascer, anomalias congênitas ou outros desfechos negativos.
Não há estudos sobre o perfil de segurança dessa medicação durante a gestação de portadoras de RSCcPN. Atualmente o omalizumabe é classificado como categoria B pela FDA, porém o seu uso não é aprovado na gestação38.
Dupilumabe
O uso de dupilumabe na gestação foi estudado em portadoras de DA e penfigoide gestacional. Um estudo observacional do uso de terapias sistêmicas e tópicas nos Estados Unidos75 estimou que das 3.563 pacientes com a doença, 2% fazia uso da medicação antes da concepção. Os dados demonstram que a droga foi descontinuada na maior parte dos casos, com somente 0,7% de uso no primeiro, e 0,3% no segundo e terceiro trimestres. Isso pode se relacionar com a ausência de evidência robusta comprovando a segurança deste imunobiológico na gestação.
Uma coorte retrospectiva italiana de Avallone e cols.76 avaliou 29 pacientes com DA grave que fizeram uso deste imunobiológico no período gestacional. A medicação foi suspensa em todos os casos após a descoberta da gestação, sendo a mediana de tempo de exposição de 6 [2-24] semanas. Não houve significância estatística para nenhum desfecho gestacional, fetal ou neonatal, mesmo na análise multivariada ajustada para confundidores. Outro estudo observacional analisou uma base de dados mundial de farmacovigilância (VigiBase)77. Nenhum evento adverso perinatal esteve associado de maneira consistente com o uso de dupilumabe na gestação.
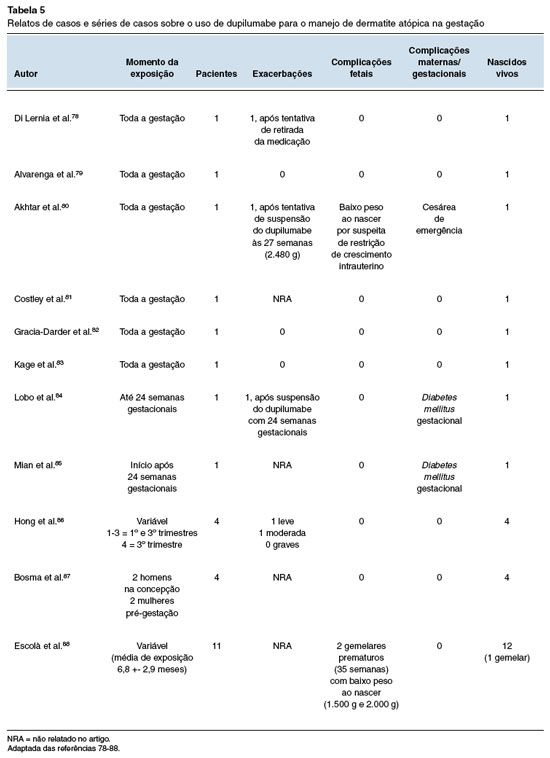
Foram revisados, ainda, 8 relatos de casos78-85 e 3 séries de casos86-88, compilados na Tabela 5. As pacientes analisadas iniciaram o uso de dupilumabe por DA moderada a severa, com altos escores EASI (Eczema Area Severity Index), elevada superfície corpórea acometida, impacto significativo na qualidade de vida e/ou ausência de controle da doença apesar de múltiplas terapias prévias. Entre as comorbidades mais frequentes estavam asma, rinite e conjuntivite. Foram observadas melhora dos sintomas e regressão da DA em todas as mulheres.
A medicação, na maioria dos casos, foi utilizada durante todo o período gestacional. Em apenas uma série de casos87 não ocorreu o uso apenas na preconcepção. Nas três pacientes em que houve suspensão da droga foram observadas exacerbações78,80,84, com necessidade de reintrodução em duas. Em um caso85 o dupilumabe foi iniciado durante a gestação (24 semanas).
Entre as complicações maternas, ocorreram dois casos de diabetes mellitus gestacional e uma cesárea de emergência por suspeita de restrição de crescimento intrauterino80,84,85. Baixo peso ao nascer foi relatado em uma gestação única (2.480 g) e em dois gemelares prematuros de 35 semanas (1.500 g e 2.000 g, respectivamente)80,88. Não foram observadas anomalias congênitas, abortos, natimortos ou qualquer outro evento adverso gestacional e fetal. O seguimento das crianças78,86 não demonstrou alterações de crescimento ou desenvolvimento. O uso de dupilumabe por homens durante a concepção não foi associado a nenhum desfecho87.
Não foram realizados ensaios clínicos randomizados sobre o tema.Também nãohá artigosdisponíveis sobre o uso de dupilumabe na gestação em pacientes asmáticas, com RSCcPN ou com EEo.
Mepolizumabe Não há nenhum ensaio clínico randomizado sobre o uso de mepolizumabe na gestação. Este também não foi estudo para RSCcPN. Encontrou-se apenas um relato de caso de Vittorakis e cols.89 sobre o tratamento com o imunobiológico de uma paciente portadora de asma eosinofílica grave. Durante o planejamento gestacional ocorreu uma tentativa de retirada da droga, que culminou em exacerbação grave da doença e necessidade de reintrodução. A paciente engravidou e gestou enquanto fazia uso da medicação, apresentando apenas duas exacerbações tratadas com ciclos curtos de corticoide sistêmico. A criança nasceu com 40 semanas gestacionais, 2.750 g e sem anomalias congênitas. A contagem de eosinófilos maternos e fetais após o parto foi inferior a 1,5%. Não foram relatados eventos ad-versos gestacionais ou neonatais. Outro artigo, de Ozden90, observou a ocorrência de gestação em duas pacientes previamente inférteis após o início do mepolizumabe. Uma optou pela interrupção da gestação, enquanto a outra suspendeu a medicação, dando à luz a um recém-nascido saudável e sem anomalias congênitas.
Benralizumabe
Na literatura foi encontrada uma série de casos de Naftel e cols.91 sobre o uso de benralizumabe para asma durante a gestação. Nas quatro pacientes analisadas não observou-se nenhum evento adverso neonatal, recém-nascido com baixo peso ou anomalia congênita. Todos os partos ocorreram a termo, com exceção de uma cesárea agendada com 36 semanas. Uma paciente apresentava histórico de múltiplas complicações relacionadas à asma em gestações prévias, incluindo dois partos prematuros (32 e 36 semanas). Após o início da medicação manteve bom controle dos sintomas, sem complicações durante a gestação. Exacerbações foram reportadas em duas mulheres, uma relacionada à tentativa de suspensão da droga. A paciente que manteve pior controle de doença era tabagista e não cessou o hábito, evoluindo com quatro exacerbações.
Há ainda um relato de caso de Saco e Tabatabaian92, que observaram piora importante da asma e eosinofilia após a suspensão do benralizumabe em uma paciente grávida. Com 20 semanas gestacionais optou-se por reintroduzir o imunobiológico, com melhora expressiva do quadro. O estudo não discorre sobre possíveis complicações maternas ou fetais. Não foi publicado nenhum ensaio clínico randomizado sobre o tema.
Tezepelumabe
Não existe nenhum artigo publicado na literatura atual sobre o uso de tezepelumabe durante a gestação em humanos. A FDA adverte que os potenciais eventos adversos seriam piores durante o terceiro trimestre, pois neste período mais substâncias atravessam a barreira placentária. Um estudo com primatas expostos, por toda a gestação, a mais de 168 vezes a dose de tezepelumabe administrada em humanos demonstrou passagem placentária da medicação, porém sem evidência de eventos adversos fetais42.
Reslizumabe
Não há publicações sobre uso de reslizumabe em humanos durante a gestação. Estudos em roedores expostos a 6 a 17 vezes a dose máxima recomendada para humanos não evidenciaram eventos adversos para o feto. Sabe-se, no entanto, que essa medicação possui maior meia-vida e atravessa a barreira placentária, podendo gerar desfechos negativos especialmente no segundo e terceiro trimestres43.
Tralokinumabe
Na literatura, não há estudos publicados a respeito do uso de tralokinumabe durante a gestação em humanos. Existe um estudo em andamento, atualmente em fase de obtenção de dados através de uma plataforma online93. Em macacos que receberam doses até dez vezes maiores do que o máximo recomendado para humanos não foram relatadas complicações gestacionais ou de desenvolvimento fetal44.
Inibidores da JAK (abrocitinibe, baricitinibe, upadacitinibe e ruxolitinibe)
O consenso de especialistas sobre o tratamento sistêmico de DA em populações especiais94 contraindica o uso de todos os inibidores da JAK durante a gestação e lactação. Este se baseia nos efeitos teratogênicos relatados em estudos com animais, orientando o uso de contraceptivos para todas as usuárias das medicações em idade fértil.
Não existe nenhum artigo publicado na literatura sobre o uso de abrocitinibe durante a gestação em humanos. Uma plataforma para registro de desfechos está disponível, porém ainda em fase de captação de dados. A análise de segurança em ratos demonstrou aumento de incidência de variações no esqueleto e de distócia quando submetidos a 11 vezes a dose máxima recomendada para humanos. Também foi observado aumento de letalidade fetal e redução da sobrevivência pós-natal em doses até 17 vezes maiores que a recomendada45.
Foi revisado um estudo de Kammerer95 sobre a exposição acidental a baricitinibe durante a gestação. Os dados extraídos de um sistema de farmacovigilância encontraram 77 exposições maternas e 14 paternas a medicação. Observaram-se incidências de complicações semelhantes às registradas na população geral. Entre os desfechos estudados estavam número de nascidos vivos, abortos espontâneos e abortos eletivos. Identificaram-se duas malformações fetais, respectivamente: anencefalia e displasia de quadril. Nos estudos de desenvolvimento com animais47, roedores expostos a 11 a 46 vezes a dose máxima recomendada da medicação tiveram maior incidência de baixo peso e malformações do esqueleto. Também se relatou o aumento da letalidade fetal em coelhos. Para doses 2 a 7 vezes maiores, nenhuma alteração de desenvolvimento foi observada.
O estudo com animais em uso de 1,6 a 15 vezes a dose máxima recomendada de upadacitinibe resultou em aumento de malformações de esqueleto e baixo peso em ratos. Em coelhos observou-se aumento de incidência de malformações cardíacas, perdas fetais após implantação e baixo peso46.
Por fim, não foram encontrados na literatura estudos sobre o uso gestacional de ruxolitinibe tópico para DA. Durante o desenvolvimento da droga, a administração oral de doses 22 vezes maiores que o recomendado, não resultou em malformações em roedores48.
Comentários finais
As doenças inflamatórias do tipo II são altamente prevalentes em mulheres em idade fértil e o seu manejo durante a gestação ainda é controverso. Apesar de não formalmente recomendados após a concepção, alguns medicamentos imunobiológicos são uma opção de segunda linha de tratamento, especialmente naquelas que não toleram ou não atingem controle das patologias por meio das terapias convencionais. As medicações do grupo das pequenas moléculas, por sua vez, são atualmente contraindicadas na gestação e lactação.
Nesse artigo foram revisados estudos observacionais sobre o uso de imunobiológicos em humanos durante a gestação. O omalizumabe e o dupilumabe são as medicações com maior número de estudos, cujos resultados não demonstram aumento de risco de desfechos adversos diretamente relacionados ao uso das drogas. A gravidade prévia dos casos apresentados é importante confundidor, considerando que o mau controle dessas patologias se associa com complicações gestacionais. Além disso, a amostra de mulheres expostas é pequena e todos os estudos são observacionais, o que limita a validade das conclusões obtidas.
A literatura é escassa em relação ao mepolizumabe e ao benralizumabe, não permitindo conclusões sobre a sua segurança. Não existem publicações sobre o uso de tezepelumabe, reslizumabe ou tralokinumabe em humanos na gestação. Os testes em animais não observaram malformações ou outras complicações. A quantidade de dados limita a elaboração de qualquer conclusão sobre o risco gestacional associado a essas medicações.
Os estudos em animais com inibidores de Janus quinase evidenciaram complicações e malformações fetais, o que é condizente com a atual contraindicação absoluta ao seu uso na gestação.
Por conta dos riscos maternos e fetais, não há ensaios clínicos randomizados sobre o tema, o que é uma importante limitação à generalização dos resultados encontrados. A decisão de manutenção dos imunobiológicos deve ser individualizada e considerar os riscos e benefícios para cada paciente. São necessários mais estudos sobre o tema, visando decisões clínicas mais embasadas no futuro.
Referências
1. Vos T, Lim SS, Abbafati C, Abbas KM, Abbasi M, Abbasifard M, et al. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020;396:1204-22.
2. Bantz SK, Zhu Z, Zheng T. The Atopic March: Progression from Atopic Dermatitis to Allergic Rhinitis and Asthma. J Clin Cell Immunol 2014;5. https://doi.org/10.4172/2155-9899.1000202.
3. Chen Q, Wang W, Yang X, Li S, Deng S, Wang H, et al. Characteristics and Clinical Significance of Atopy in Chronic Spontaneous Urticaria: A Cross-Sectional Observational Study. Int Arch Allergy Immunol. 2024:1-6.
4. Maurer M, Kolkhir P, Pereira MP, Siebenhaar F, Witte-Händel E, Bergmann K-C, et al. Disease modification in chronic spontaneous urticaria. Allergy. 2024;79:2396-413. doi:10.1111/all.16243.
5. Zuberbier T, Lötvall J, Simoens S, Subramanian SV, Church MK. Economic burden of inadequate management of allergic diseases in the European Union: a GA(2) LEN review. Allergy 2014;69:1275-9.
6. Kolkhir P, Akdis CA, Akdis M, Bachert C, Bieber T, Canonica GW, et al. Type 2 chronic inflammatory diseases: targets, therapies and unmet needs. Nat Rev Drug Discov. 2023;22:743-67.
7. Pfaller B, Bendien S, Ditisheim A, Eiwegger T. Management of allergic diseases in pregnancy. Allergy 2022;77:798-811.
8. Mor G, Aldo P, Alvero AB. The unique immunological and microbial aspects of pregnancy. Nat Rev Immunol. 2017;17:469-82.
9. Wang G, Murphy VE, Namazy J, Powell H, Schatz M, Chambers C, et al. The risk of maternal and placental complications in pregnant women with asthma: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2014;27:934-42.
10. Robijn AL, Harvey SM, Jensen ME, Atkins S, Quek KJD, Wang G, et al. Adverse neonatal outcomes in pregnant women with asthma: An updated systematic review and meta-analysis. Int J Gynecol Obstet. 2024;166:596-606.
11. Hamann CR, Egeberg A, Wollenberg A, Gislason G, Skov L, Thyssen JP. Pregnancy complications, treatment characteristics and birth outcomes in women with atopic dermatitis in Denmark. J Eur Acad Dermatol Venereol. 2019;33:577-87.
12. Yawn B, Knudtson M. Treating asthma and comorbid allergic rhinitis in pregnancy. J Am Board Fam Med. 2007;20:289-98.
13. Ramos C, Namazy J. Monoclonal Antibodies (Biologics) for Allergic Rhinitis, Asthma, and Atopic Dermatitis During Pregnancy and Lactation. Immunol Allergy Clin North Am. 2023;43:187-97.
14. Lloyd CM, Snelgrove RJ. Type 2 immunity: Expanding our view. Sci. Immunol.3, eaat1604(2018). doi:10.1126/sciimmunol.aat1604.
15. McKenzie ANJ, Spits H, Eberl G. Innate lymphoid cells in inflammation and immunity. Immunity 2014;41:366-74.
16. Pulendran B, Artis D. New paradigms in type 2 immunity. Science. 2012;337:431-5.
17. Palm NW, Rosenstein RK, Medzhitov R. Allergic host defences. Nature. 2012;484:465-72.
18. Schleimer RP, Berdnikovs S. Etiology of epithelial barrier dysfunction in patients with type 2 inflammatory diseases. J Allergy Clin Immunol. 2017;139:1752-61.
19. Akdis CA, Arkwright PD, Brüggen M-C, Busse W, Gadina M, Guttman-Yassky E, et al. Type 2 immunity in the skin and lungs. Allergy. 2020;75:1582-605.
20. Roan F, Obata-Ninomiya K, Ziegler SF. Epithelial cell-derived cytokines: more than just signaling the alarm. J Clin Invest. 2019;129:1441-51.
21. Abbas AK, Lichtman AH, Pillai S. Imunologia Celular e Molecular. 9ª ed. Rio de Janeiro: Guanabara Koogan; 2019.
22. Rothenberg ME, Hogan SP. The eosinophil. Annu Rev Immunol. 2006;24:147-74.
23. Bellinghausen I, Khatri R, Saloga J. Current Strategies to Modulate Regulatory T Cell Activity in Allergic Inflammation. Front Immunol. 2022;13:912529.
24. Wang W, Sung N, Gilman-Sachs A, Kwak-Kim J. T Helper (Th) Cell Profiles in Pregnancy and Recurrent Pregnancy Losses: Th1/Th2/Th9/Th17/Th22/Tfh Cells. Front Immunol. 2020;11:2025.
25. Robijn AL, Murphy VE, Gibson PG. Recent developments in asthma in pregnancy. Curr Opin Pulm Med. 2019;25:11-7.
26. Murphy VE, Wang G, Namazy JA, Powell H, Gibson PG, Chambers C, et al. The risk of congenital malformations, perinatal mortality and neonatal hospitalisation among pregnant women with asthma: a systematic review and meta-analysis. BJOG. 2013;120:812-22.
27. Weatherhead S, Robson SC, Reynolds NJ. Eczema in pregnancy. BMJ. 2007;335:152-4.
28. Munera-Campos M, Carrascosa JM. Atopic Dermatitis: Fertility, Pregnancy, and Treatment Perspectives. Am J Clin Dermatol. 2024;25:55-66.
29. Balakirski G, Novak N. Atopic dermatitis and pregnancy. J Allergy Clin Immunol. 2022;149:1185-94.
30. Gurvits GE, Nord JA. Eczema herpeticum in pregnancy. Dermatol Reports. 2011;3:e32. 31. Gilbey P, McGruthers L, Morency A-M, Shrim A. Rhinosinusitisrelated quality of life during pregnancy. Am J Rhinol Allergy. 2012;26:283-6.
32. Carroll Jr. MP, Bulkhi AA, Lockey RF. Rhinitis and Sinusitis. In: Asthma, Allergic and Immunologic Diseases During Pregnancy. A Guide to Management. Springer Cham; 2019. p.61-86.
33. Alhussien AH, Alhedaithy RA, Alsaleh SA. Safety of intranasal corticosteroid sprays during pregnancy: an updated review. Eur Arch Otorhinolaryngol. 2018;275:325-33.
34. Robson M, Bernstein JS, Bernstein JA. Chronic Urticaria in Special Populations: Pediatric, Pregnancy, and the Elderly. Immunol Allergy Clin North Am. 2024;44:469-81.
35. Kocatürk E, Al-Ahmad M, Krause K, Gimenez-Arnau AM, Thomsen SF, Conlon N, et al. Treatment patterns and outcomes in patients with chronic urticaria during pregnancy: Results of PREG-CU, a UCARE study. J Eur Acad Dermatol Venereol. 2023;37:356-64.
36. Röjler L, Uchida AM, Garber JJ, Stephansson O, Söderling J, Roelstraete B, et al. Pregnancy Outcomes in Females with Eosinophilic Esophagitis: A Nationwide Population-Based Study. Inflamm Intest Dis 2023;8:143-52.
37. Huang J, White AA. Symptoms and treatment of eosinophilic esophagitis prior to, during, and after pregnancy. J Allergy Clin Immunol Pract. 2024;12:1931-2.e2.
38. US Food and Drug Administration. Xolair (Omalizumab): full prescribing information/Supplement SUPPL-5245, 2024 [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/103976s5245lbl.pdf. Acessado em: 07/07/2024.
39. US Food and Drug Administration. Dupilumab full prescribing information/Supplement SUPPL 59 (2024) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761055s059lbl.pdf. Acessado em: 07/08/2024.
40. US Food and Drug Administration. Mepolizumab full prescribing information/Supplement SUPPL 21 (2023) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/125526Orig1s021,761122Orig1s011Corrected_lbl.pdf. Acessado em: 07/08/2024.
41. US Food and Drug Administration full prescribing information/Supplement SUPPL 20 (2024) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761070Orig1s020correctedlbl.pdf. Acessado em: 07/08/2024.
42. US Food and Drug Administration. Tezepelumab full prescribing information/Supplement SUPPL-3 [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/761224s003lbl.pdf. Acessado em: 07/08/2024.
43. US Food and Drug Administration. Reslizumab full prescribing information/Supplement SUPPL 10 (2019) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/0761033s010lbl.pdf. Acessado em: 07/08/2024.
44. US Food and Drug Administration. Tralokinumab full prescribing information/Supplement SUPPL 6 (2024) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761180s006lbl.pdf. Acessado em: 07/08/2024.
45. US Food and Drug Administration. Abrocitinib full prescribing information/Supplement SUPPL 4 (2023) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/213871s004lblcorrected.pdf. Acessado em: 07/08/2024.
46. US Food and Drug Administration. Upadacitinib full prescribing information/Supplement SUPPL 22 [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211675s000lbl.pdf. Acessado em: 07/08/2024.
47. US Food and Drug Administration. Baricitinib full prescribing information/Supplement SUPPL 7 (2022) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/207924s007lbl.pdf. Acessado em: 07/08/2024.
48. US Food and Drug Administration. Ruxolitinib (OPZELURA) full prescribing information/Supplement SUPPL 4 (2023) [Internet]. Disponível em: https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/215309Orig1s000correctedlbl.pdf. Acessado em: 07/08/2024.
49. Novartis Biociencias S.A. Xolair® (omalizumabe) Bula profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Xolair. Acessado em: 13/08/2024.
50. Sanofi Medley Farmacêutica Ltda. Dupixent® (dupilumabe). Bula profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Dupixent. Acesso em: 13/08/24 n.d.
51. Glaxosmithkline Brasil Ltda. Nucala (Mepolizumabe). Bula profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Nucala. Acessado em: 13/08/2024.
52. Astrazeneca do Brasil Ltda. Fasenra® Pen (benralizumabe). Bula do profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Fasenra. Acessado em: 13/08/2024.
53. Astrazeneca do Brasil Ltda. Tezspire® tezepelumabe. Bula do profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=TEZSPIRE. Acessado em: 13/08/2024.
54. Pfizer Brasil Ltda. CIBINQO® abrocitinibe. Bula do profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=CIBINQO. Acessado em: 13/08/2024.
55. Abbvie Farmacêutica Ltda. RINVOQ® (upadacitinibe). Bula do profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Rinvoq. Acessado em: 13/08/24.
56. Eli Lilly do Brasil Ltda. Olumiant® (baricitinibe). Bula do profissional [Internet]. Disponível em: https://consultas.anvisa.gov.br/#/bulario/q/?nomeProduto=Olumiant. Acessado em: 13/08/24.
57. Global Initiative for Asthma. 2024 GINA Main Report. Global Strategy for Asthma Management and Prevention [Internet]. Disponível em: https://ginasthma.org/wp-content/uploads/2024/05/GINA-2024-Strategy-Report-24_05_22_WMS.pdf. Acessado em: 06/07/2024.
58. Naftel J, Jackson DJ, Coleman M, d'Ancona G, Heaney LG, Dennison P, et al. An international consensus on the use of asthma biologics in pregnancy. Lancet Respir Med. 2025 Jan;13(1):80-91.
59. Sarinho FW, Rubini N de PM, Costa AJF, Silva EC de F, Monteiro FP, Serpa FS, et al. Guia prático para o uso de imunobiológicos em doenças alérgicas - ASBAI. Arq Asma Alerg Imunol. 2023;7(4): 339-66. doi 10.5935/2526-5393.20230054.
60 Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada - RDC N° 60, de 17 de dezembro de 2010 [Internet]. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/anvisa/2010/rdc0060_17_12_2010.pdf. Acessado em: 13/08/2024.
61. Namazy J, Cabana MD, Scheuerle AE, Thorp JM Jr, Chen H, Carrigan G, et al. The Xolair Pregnancy Registry (EXPECT): the safety of omalizumab use during pregnancy. J Allergy Clin Immunol. 2015;135:407-12.
62. Namazy JA, Blais L, Andrews EB, Scheuerle AE, Cabana MD, Thorp JM, et al. Pregnancy outcomes in the omalizumab pregnancy registry and a disease-matched comparator cohort. J Allergy Clin Immunol. 2020;145:528-36.e1.
63. Gemicioglu B, Yalçın AD, Havlucu Y, Karakaya G, Özdemir L, Keren M, et al. Country-based report: the safety of omalizumab treatment in pregnant patients with asthma. Turk J Med Sci. 2021;51:2516-23.
64. Patruno C, Guarneri F, Nettis E, Bonzano L, Filippi F, Ribero S, et al. Safety of omalizumab in chronic urticaria during pregnancy: a real-life study. Clin Exp Dermatol. 2024;49:344-7.
65. Namazy J, Scheuerle A, Spain V, Janampally P, Ahmed A, Gupta S, et al. Pregnancy and infant outcomes among pregnant women with Chronic Spontaneous Urticaria (CSU) treated with omalizumab: a descriptive analysis from the EXPECT pregnancy registry. J Allergy Clin Immunol. 2021;147:AB145.
66. Majou D, Moreira B, Martin C, Chhun S, Treluyer JM, Tsatsaris V, et al. Safety of Omalizumab During Pregnancy and Breast-Feeding With Assessment of Placental Transfer: A Case Report. Allergy Asthma Immunol Res. 2021;13:515-6.
67. Kuprys-Lipinska I, Tworek D, Kuna P. Omalizumab in pregnant women treated due to severe asthma: two case reports of good outcomes of pregnancies. Postepy Dermatol Alergol. 2014;31:104-7.
68. Hirashima J, Hojo M, Iikura M, Hiraishi Y, Nakamichi S, Sugiyama H, et al. [A case of an asthma patient receiving omalizumab during pregnancy]. Arerugi. 2012;61:1683-7.
69. Kuschnir F, Emerson F, Cordeiro N, Rocha MV, Filho SL, Rios JL. 273 fetal loss in severe asthma and posterior healthy pregnancy and birth with the use of omalizumab - case report. World Allergy Organ J. 2012;5:S89.
70. Liao S-L, Yu M, Zhao Z-T, Maurer M. Case Report: Omalizumab for Chronic Spontaneous Urticaria in Pregnancy. Front Immunol. 2021;12:652973.
71. Losappio LM, Mirone C, Schroeder JW, Scibilia J, Balossi L, Pastorello EA. Omalizumab Use in Chronic Spontaneous Urticaria during Pregnancy and a Four Years' Follow-Up: A Case Report. Case Rep Dermatol. 2020;12:174-7.
72. González-Medina M, Curto-Barredo L, Labrador-Horrillo M, Giménez-Arnau A. Omalizumab use during pregnancy for chronic spontaneous urticaria (CSU): report of two cases. J Eur Acad Dermatol Venereol. 2017;31:e245-6.
73. Ghazanfar MN, Thomsen SF. Successful and Safe Treatment of Chronic Spontaneous Urticaria with Omalizumab in a Woman during Two Consecutive Pregnancies. Case Rep Med. 2015;2015:368053.
74. Cuervo-Pardo L, Barcena-Blanch M, Radojicic C. Omalizumab use during pregnancy for CIU: a tertiary care experience. Eur Ann Allergy Clin Immunol. 2016;48:145-6.
75. Schoder K, Zhu Y, Schneeweiss S, Merola JF, Savage TJ, Gibbs LR, et al. Use of systemic immunomodulating medications in pregnant women with atopic dermatitis: A nationwide US study. J Am Acad Dermatol. 2023;89:178-81.
76. Avallone G, Cavallo F, Tancredi A, Maronese CA, Bertello M, Fraghì A, et al. Association between maternal dupilumab exposure and pregnancy outcomes in patients with moderate-to-severe atopic dermatitis: A nationwide retrospective cohort study. J Eur Acad Dermatol Venereol. 2024 Sep;38(9):1799-808.
77. Khamisy-Farah R, Damiani G, Kong JD, Wu J-H, Bragazzi NL. Safety profile of Dupilumab during pregnancy: a data mining and disproportionality analysis of over 37,000 reports from the WHO individual case safety reporting database (VigiBaseTM). Eur Rev Med Pharmacol Sci. 2021;25:5448-51.
78. Di Lernia V, Peccerillo F. Long-Term Follow-Up of Dupilumab Treatment During Conception, Pregnancy and Lactation. Indian J Dermatol. 2024;69:193-5.
79 Alvarenga JM, Maria Lé A, Torres T. Dupilumab for Atopic Dermatitis During Pregnancy and Breastfeeding: A Case Report. Actas Dermosifiliogr. 2024 Nov-Dec;115(10):1100-1102.
80. Akhtar NH, Khosravi-Hafshejani T, Akhtar D, Dhadwal G, Kanani A. The use of dupilumab in severe atopic dermatitis during pregnancy: a case report. Allergy Asthma Clin Immunol. 2022;18:9.
81. Costley M, Murphy B. Severe atopic dermatitis treated successfully with dupilumab throughout pregnancy. Clin Exp Dermatol. 2022;47:960-1.
82. Gracia-Darder I, Pons De Ves J, Reyero Cortina M, Martín-Santiago A. Patient with atopic dermatitis, hyper IgE syndrome and ulcerative colitis, treated successfully with dupilumab during pregnancy. Dermatol Ther. 2022;35:e15237.
83. Kage P, Simon J-C, Treudler R. Case of atopic eczema treated with dupilumab throughout conception, pregnancy, and lactation. J Dermatol. 2021;48:E484-5.
84. Lobo Y, Lee RC, Spelman L. Atopic Dermatitis Treated Safely with Dupilumab during Pregnancy: A Case Report and Review of the Literature. Case Rep Dermatol. 2021;13:248-56.
85. Mian M, Dunlap R, Simpson E. Dupilumab for the treatment of severe atopic dermatitis in a pregnant patient: A case report. JAAD Case Rep 2020;6:1051-2.
86. Hong N, Park SY, Kook HD, Lee DH, Jung HJ, Park MY, et al. Atopic dermatitis treated safely with dupilumab during pregnancy and lactation: A case series of four patients. Australas J Dermatol. 2024;65:e100-3.
87. Bosma AL, Gerbens LAA, Middelkamp-Hup MA, Spuls PI. Paternal and maternal use of dupilumab in patients with atopic dermatitis: a case series. Clin Exp Dermatol. 2021;46:1089-92.
88. Escolà H, Figueras-Nart I, Bonfill-Orti M, Coll Puigserver N, Martin-Santiago A, Rodríguez Serna M, et al. Dupilumab for atopic dermatitis during pregnancy and breastfeeding: Clinical experience in 13 patients. J Eur Acad Dermatol Venereol. 2023;37:e1156-60.
89. Vittorakis SK, Giannakopoulou G, Samitas K, Zervas E. Successful and safe treatment of severe steroid depended eosinophilic asthma with mepolizumab in a woman during pregnancy. Respir Med Case Rep. 2023;41:101785.
90. Ozden G, Pınar Deniz P. May mepolizumab used in asthma correct subfertility? Ann Med. 2021;53:456-8.
91. Naftel J, Eames C, Kerley S, Whitfield C, Rayala-Montaniel E, Cook P, et al. Benralizumab treatment of severe asthma in pregnancy: A case series. J Allergy Clin Immunol Pract. 2023;11:2919-21.
92. Saco T, Tabatabaian F. Breathing for two: a case of severe eosinophilic asthma during pregnancy treated with benralizumab. Ann Allergy Asthma Immunol. 2018;121:S92.
93. Adbry® (tralokinumab-ldrm). MotherToBaby 2022 [Internet]. Disponível em: https://mothertobaby.org/ongoing-study/adbrytralokinumab/. Acessado em: 08/07/2024.
94. Adam DN, Gooderham MJ, Beecker JR, Hong CH, Jack CS, Jain V, et al. Expert consensus on the systemic treatment of atopic dermatitis in special populations. J Eur Acad Dermatol Venereol. 2023;37:1135-48.
95. Kammerer S. No adverse pregnancy outcomes in patients exposed to baricitinib. In: van de Kerkhof P, editor. Medicom Conference Report SPIN 2022. Baarn, the Netherlands: Medicom Medical Publishers; 2022. https://doi.org/10.55788/3f9a9e76.