Número Atual: Julho-Setembro 2023 - Volume 7 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Perfil de pacientes com urticária crônica espontânea submetidos ao tratamento com omalizumabe em Chapecó, SC
Profile of patients with chronic spontaneous urticaria treated with omalizumab in Chapecó, south of Brazil
Laura Maria Girardello; Natascha Rubas Colpani; Leda das Neves Almeida Sandrin
Universidade Comunitária da Região de Chapecó, UNOCHAPECÓ - Medicina - Chapecó, SC, Brasil
Endereço para correspondência:
Laura Maria Girardello
E-mail: lauramgirardello@gmail.com
Submetido em: 15/09/2023
Aceito em: 19/09/2023.
RESUMO
INTRODUÇÃO: A urticária crônica espontânea é caracterizada por lesões máculo-papulares eritematosas, associadas a prurido e angioedema, que não possui estímulo externo reconhecido e de difícil controle. A primeira e a segunda linha terapêutica, disponibilizadas pelo Sistema Único de Saúde, não apresentam resultados significativos, os quais se tornam refratários. O omalizumabe, considerado terceira linha terapêutica e que não é amplamente disponibilizado pelo Sistema Único de Saúde, pode apresentar resultado significativo na interrupção dos sintomas da doença.
OBJETIVO: O presente estudo tem como objetivo avaliar pacientes com urticária crônica espontânea que usaram ou estão em uso de omalizumabe.
MÉTODOS: Trata-se de um estudo observacional transversal do tipo série de casos, cuja análise foi feita através dos prontuários, com população de 34 pacientes com urticária crônica espontânea submetidos ao tratamento com omalizumabe no Instituto de Olhos de Santa Catarina (IOSC).
RESULTADOS: Constatou-se no estudo que a maioria dos pacientes com urticária crônica espontânea em uso de omalizumabe é constituída do sexo feminino (76,5%) e idade média de 41 anos. A doença mais associada à urticária crônica espontânea foi depressão (38,2%). O sucesso do tratamento com omalizumabe é medido pelo questionário UAS7 (Urticaria Activity Score), o qual, segundo os dados dos prontuários, todos os pacientes apresentavam resultado maior que 35 pontos antes do uso da medicação, e 32 conseguiram alcançar um índice de 0 após o uso do omalizumabe, variando apenas no tempo de tratamento.
CONCLUSÃO: A urticária crônica espontânea é uma doença que não tem cura e possui alta refratariedade, mas pode ter seus sintomas reduzidos, principalmente com o uso do omalizumabe, que se mostrou eficiente nos casos analisados.
Descritores: Urticária crônica, omalizumabe, anticorpo monoclonal.
Introdução
A urticária crônica é uma doença de alta morbidade, que acomete de 0,5 a 1% da população e, em muitos casos, possui um difícil controle. É caracterizada por lesões máculo-papulares eritematosas, associadas a prurido, que podem apresentar angioedema e geralmente tem duração menor que 24 horas1. A urticária pode ser classificada em dois grandes grupos: urticária aguda (UA), que possui duração inferior ou igual a 6 semanas, e urticária crônica (UC), cuja duração é igual ou maior que 6 semanas. Ainda, pode-se dividir a urticária crônica em Indutível (UCI), que apresenta um fator causal exógeno identificado, e em espontânea (UCE), quando não há um estímulo externo reconhecido, sendo que as duas formas podem coexistir em um mesmo indivíduo2. O diagnóstico de UCE e de todas as formas de urticária crônica é essencialmente clínico, não havendo exames complementares específicos.
O tratamento pode ser desafiador. Os anti-histamínicos-H1 de segunda geração são considerados a primeira linha terapêutica para a UCE. Minimamente ou não sedativos e livres de efeitos anticolinérgicos, possuem um bom perfil de segurança, ao contrário dos anti-histamínicos-H1 de primeira geração que, atualmente, não são recomendados devido a seus efeitos adversos3. Porém, apesar de serem distribuídos pelo SUS, são medicamentos com alto valor agregado e alguns pacientes não respondem ao tratamento, sendo necessário quadruplicar a dose para tentar alcançar o efeito desejado4. Mesmo assim, uma grande parcela dos pacientes continuam refratários aos anti-histamínicos-H1, precisando recorrer aos tratamentos de segunda ou terceira linha terapêutica que incluem omalizumabe, ciclosporina ou montelucaste1.
A ciclosporina é uma droga imunossupressora e anti-inflamatória. Possui melhor relação risco-benefício que os corticosteroides, mas a incidência de efeitos colaterais como nefrotoxicidade e hipertensão são motivos de preocupação e necessitam de monitorização5. Estudo mostrou eficácia do medicamento em 44% dos doentes com urticária moderada a grave6.
O montelucaste, antagonista do receptor de leucotrienos, talvez seja o mais custo-efetivo das medicações. Porém, as evidências acerca da eficácia e segurança dessa medicação não são estabelecidas por estudos clínicos de boa qualidade. Mesmo assim, ele é utilizado em alguns casos refratários de UCE7.
Nas exacerbações da urticária crônica, é recomendado a utilização de corticoides sistêmicos pelo período de no máximo dez dias e em doses mínimas possíveis, tendo em vista os potenciais efeitos adversos de um tratamento em longo prazo1.
A urticária crônica espontânea tem um componente autoimune associado à Imunoglobulina-E, onde o imunobiológico omalizumabe (Anti-IgE) pode ter algum efeito, pois possui ação direta nos mecanismos fisiopatológicos da doença, e no tratamento para UCE é considerado terceira linha de escolha terapêutica3. Porém, mesmo que a droga seja segura com resultados positivos, deve-se colocar que possui elevado custo, o qual varia entre R$ 1.795,83 até R$ 2.244,79 por frasco, dependendo da dose necessária, e possui dificuldade de acesso através do Sistema Único de Saúde, o qual apenas distribui amplamente para o tratamento de asma grave8.
A rotina do paciente é prejudicada devido à imprevisibilidade e cronicidade dos surtos e ao comprometimento da imagem corporal, ocasionados principalmente pelo prurido e pelo angioedema, que afetam o desempenho das atividades diárias e a quantidade e qualidade do sono, ocasionando custos diretos no consumo de medicação, na utilização dos serviços de saúde, e custos indiretos associados ao menor desempenho escolar e profissional1. O objetivo deste estudo é avaliar pacientes com urticária crônica espontânea que usaram ou estão em uso de omalizumabe, bem como verificar os efeitos positivos, adversos e impactos nos diferentes casos de urticária crônica espontânea e comparar a efetividade do omalizumabe com outros medicamentos no tratamento da urticária crônica espontânea.
Material e métodos
Trata-se de um estudo observacional transversal do tipo série de casos, cuja população analisada foi constituída de 34 pacientes submetidos ao tratamento com omalizumabe e que possuem urticária crônica espontânea, do Instituto de Olhos Santa Catarina (IOSC) - Hospital Dia.
Foram incluídos na amostra pacientes que utilizaram omalizumabe e possuem urticária crônica espontânea, no período de julho de 2018 a maio de 2021. Foram excluídos os pacientes que não completaram três meses de tratamento com omalizumabe ou que não seguiram o protocolo de tratamento de forma adequada.
A coleta de dados foi realizada pela seleção dos pacientes com UCE que utilizaram o omalizumabe, através da análise de prontuário para identificar a evolução clínica dos pacientes. Posteriormente, foram extraídas informações do prontuário com base em um roteiro acerca da doença e do uso do medicamento. Tais informações foram mantidas em confidencialidade conforme o termo de confidencialidade.
Foram analisados dados como sexo, idade, tempo de diagnóstico da urticária crônica espontânea, medicamentos utilizados antes e associados ao omalizumabe, sintomas e doenças associados à UCE e o tempo necessário para o omalizumabe fazer efeito. Também, foi analisado o escore Urticaria Activity Score (UAS7), o qual avalia os sintomas e a intensidade da UCE no período de 7 dias, aplicado previamente pela médica responsável nos pacientes antes e após o uso do omalizumabe, registrado no prontuário.
A interpretação dos resultados foi realizada através de cálculos percentuais de média, moda e mediana das variáveis citadas anteriormente, com o auxílio das plataformas Microsoft Excel e Epi-Info.
O projeto foi desenvolvido de acordo com a Resolução CNS 466/201223 e a Resolução 510/201624, analisado pelo Comitê de Ética em Pesquisa Envolvendo Seres Humanos - CEP/UNOCHAPECÓ e aprovado sob parecer n° 4.822.997 (CAAE 48046721.2.0000.0116).
Resultados e discussão
A manifestação da UCE resulta da liberação de mediadores pró-inflamatórios do mastócito encontrado da derme nas mucosas. A indução das células mastocitárias pode ser por fatores distintos, a partir da ativação de terminações nervosas e vasos da derme, recrutando células inflamatórias como endoteliais, eosinófilos e os próprios mastócitos. Os sinais clínicos mais visíveis na UCE são pápulas eritematosas, prurido e angioedema. Nas pápulas, encontram-se a desgranulação do mastócito e eosinófilo, ativação das células endoteliais, proliferação vascular e ativação da coagulação sanguínea. Além disso, a UCE desenvolve um ambiente proliferado de citocinas, que indica uma ativação da resposta inata por interleucinas (IL), principalmente as IL-33 e IL-251.
No estudo foram incluídos 34 pacientes que utilizaram omalizumabe e possuem urticária crônica espontânea (UCE) no período de julho de 2018 a maio de 2021. Como apresentado na Tabela 1, 26 (76,5%) pacientes eram do sexo feminino, e 8 (23,5%) do sexo masculino. A média das idades foi de 41 anos, com desvio padrão de 5,66. O intervalo de idades com maior número de pacientes foi de 41 a 60 anos (44,1%). Os resultados estão em consonância com Ozlem S. e cols., que também tiveram o sexo feminino como prevalente e a média de idades de 44,3 anos9. Também se assemelhou na faixa etária aos estudos de Souza D.L. e cols., que descrevem a maior prevalência entre a segunda e quinta décadas de vida10.
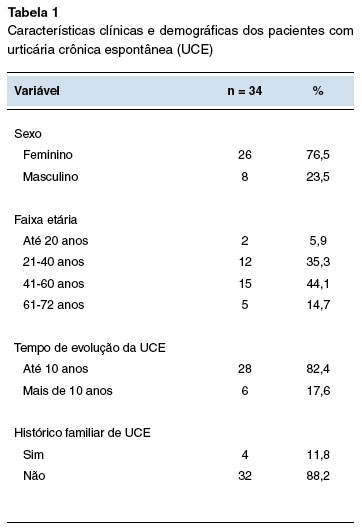
Curiosamente, quatro pacientes (11,8%) possuem histórico familiar de UCE, sendo que todos eram de terceiro grau, embora ainda não haja dados para referenciar que a UCE possui uma herança genética associada. A maioria dos pacientes (82,4%) possui um histórico de evolução da UCE de até 10 anos, sendo que a média foi de 4 anos, com desvio padrão de 10,38.
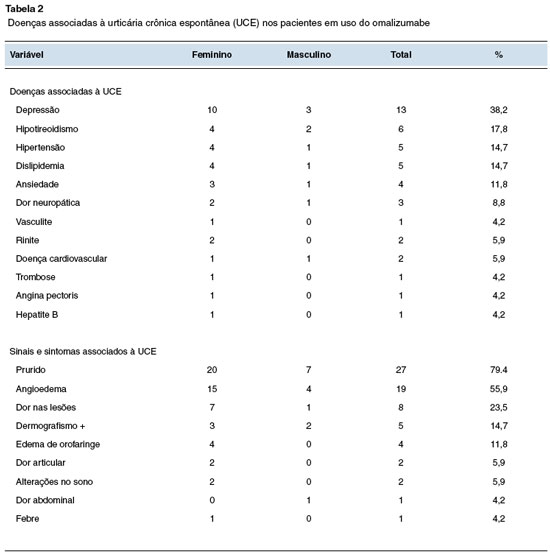
Conforme demonstrado na Tabela 2, o sintoma associado à UCE mais frequente foi o prurido, o qual 27 (79,4%) dos pacientes manifestaram, seguido por angioedema (55,9%), dor nas lesões (23,5%), dermografismo positivo (14,7%) e edema de orofaringe (11,8%). Os sintomas que apareceram com menor frequência foram dor articular (5,9%), alterações no sono (5,9%), dor abdominal (4,2%) e febre (4,2%).
A alta prevalência do prurido como sintoma da UCE se dá, principalmente, pela liberação de histamina e citocinas inflamatórias. O prurido agudo é primariamente mediado por receptores da histamina H1 e H4, que desencadeiam outros sintomas como edema e o eritema11.
Apesar de a histamina ser o mediador mastocitário mais presente na UCE, a ineficácia da primeira linha terapêutica indica que há a participação de outros mediadores pró-inflamatórios, como os PAF (platelet activating factor), leucotrienos, prostaglandinas, quimiocinas e citocinas, entre outros. Tais mediadores se encontram aumentados no sangue periférico mediante a atividade urticária1.
Os percentuais de angioedema foram superiores aos achados de Souza e cols.10 (2019), onde 28,6% dos pacientes apresentaram. Em relação à fisiopatologia do angioedema, no caso da UCE, bem como no prurido, está relacionado com a liberação da histamina como mediadora inflamatória, chamado de angioedema histaminérgico. Possui melhor prognóstico e, geralmente, boa resposta ao tratamento com anti-histamínicos e corticosteroides12. O resultado sobre dermografismo positivo no presente estudo foi inferior ao de Duarte P.P., o qual apresentou 20% entre sua amostra estudada13.
Ao serem avaliadas as doenças crônicas que acometem os pacientes estudados concomitantemente à urticária crônica espontânea, também apresentadas na Tabela 2, foi observado que as doenças mais prevalentes foram depressão (38,2%), seguida de hipotireoidismo (17,8%), hipertensão e dislipidemia (ambos com 14,7%), e ansiedade (11,8%). Dor neuropática, vasculite, rinite, doença cardiovascular, trombose, angina pectoris e hepatite B demonstraram resultados inferiores a 8,8%. Os resultados sobre depressão foram superiores ao estudo de Vieira H.A.S, que encontrou uma prevalência de doenças psiquiátricas em 22,5% da população estudada, as quais incluíam depressão e/ou síndrome do pânico e/ou ansiedade14. Já em relação à ansiedade, a porcentagem de pacientes encontrados se encaixa no estudo supracitado.
No estudo de Farril-Romanillos e cols.15 (2019), foram encontrados resultados superiores ao presente trabalho em relação à associação da UCE com hipotireoidismo, sendo que 82% dos pacientes estudados apresentaram ambas as doenças. Destes pacientes, 28% apresentaram anticorpos positivos e eram todos do sexo feminino, o que também difere do nosso estudo, no qual 2 pacientes (5,9%) eram do sexo masculino15. Essa associação entre UCE e hipotireoidismo existe, pois na urticária ocorre a ativação de mastócitos, responsáveis pela liberação de mediadores inflamatórios como a histamina, principalmente pela ligação de diversos tipos de anticorpos IgE, inclusive IgE antitireoperoxidase (anti-TPO) à sua superfície. Estes anticorpos sensibilizam os mastócitos e induzem a degranulação após exposição ao antígeno circulante específico, e os anti-TPO são os mesmos produzidos contra a tireoide em doenças que causam hipotireoidismo, em que são liberados como resultado de dano autoimune à tireoide. Por isso, não se pode afirmar que existe apenas uma relação entre ambas doenças, e, sim, uma coexistência16.
Os fatores de agravo mais prevalentes apontados para UCE foram uso de anti-inflamatório não esteroidal (23,0%), infecção viral (15,4%), verão (15,4%), suor (11,5%) e estresse (7,7%).
As porcentagens da Tabela não somam 100% pois alguns pacientes apresentam mais de uma doença e/ou sintoma associado. Não se pode afirmar que estas medicações induzem diretamente a UCE, devido a prevalência do fator autoimune da doença, porém, estes fatores podem ser potentes gatilhos para piora do quadro clínico.
Todos os pacientes seguiram o padrão recomendado de tratamento, utilizaram anti-histamínicos de segunda geração, tiveram a dose aumentada em até quatro vezes, para, então, recorrer ao omalizumabe como terceira opção terapêutica. Além disso, quatro pacientes tentaram utilizar os medicamentos de 4ª linha terapêutica antes do omalizumabe, como ciclosporina e montelucaste, mas seguiram sem apresentar melhora.
O omalizumabe é um anticorpo monoclonal anti-IgE humanizado que é capaz de reduzir a liberação de mediadores inflamatórios da UCE. Seu mecanismo de ação se dá através da ligação do domínio C3 da IgE livre, o que impede a ligação desta imunoglobulina aos receptores presentes nas membranas principalmente dos mastócitos17. O omalizumabe apresenta também como competência a diminuição dos níveis de IgE livre e de receptores de alta afinidade para IgE, que estão localizados na superfície de mastócitos e basófilos18.
A administração do omalizumabe é via subcutânea, com intervalos de duas a quatro semanas, dependendo da necessidade do paciente. No Brasil, ele está amplamente liberado pelo SUS desde 2012 como 5º passo para o tratamento de asma grave refratária aos fármacos usuais19.
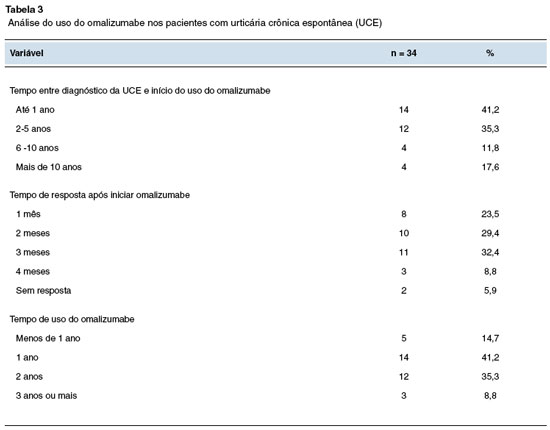
Conforme demonstra a Tabela 3, a maioria dos pacientes (41,2%) levaram até 1 ano para iniciar o omalizumabe após o diagnóstico de UCE. Em média, 3,8 anos, com desvio padrão de 59,1. Foi necessário, em média, 2,3 meses para começar a fazer efeito, com desvio padrão de 1, sendo que a maioria dos pacientes (32,4%) demorou 3 meses para apresentar resposta. Diferente dos resultados de Labrador-Horrillo e cols.20 (2013) e Büyüköztürk e cols.21 (2012), onde a maioria dos pacientes (53,4%) levou 1 semana para apresentar resposta ao omalizumabe.
Dois pacientes não tiveram resposta à medicação, pois interromperam o uso por não conseguir acesso público a mesma e por não ter condições financeiras de prosseguir com o tratamento. No estudo de Ensina e cols.22 (2016) dois pacientes também interromperam a utilização do medicamento pelo mesmo motivo, falta de acesso. Por também ser um estudo brasileiro, reforça uma limitação encontrada pelos usuários que é o elevado custo e a dificuldade de obtenção do medicamento pelo SUS22.
Apenas um paciente apresentou reação adversa (hipotensão) associada ao uso de omalizumabe, e posteriormente foi constatado que a urticária era de origem vasculítica, para qual a medicação não possui efeito. A maior parte dos pacientes faz uso da medicação há 2 anos (35,3%), sendo a média há 1 ano.
Em relação ao sucesso do tratamento com omalizumabe, medido pelo escore UAS7, todos os pacientes apresentaram resultado maior que 35 pontos antes do uso das medicações de primeira linha, até 25 pontos mesmo após o uso de anti-histamínicos de segunda geração, e 32 conseguiram alcançar um índice de 0 após o uso do omalizumabe, variando apenas no tempo de tratamento. Esses resultados apresentaram melhor efetividade do omalizumabe em relação ao estudo de Su e cols.23 (2020), o qual relatou que a média do UAS7 anterior ao uso do omalizumabe era de 31 pontos, e, após 6 meses do uso da medicação, os pacientes alcançaram uma média de resultados de 3,9, sendo que a amostra analisada era de 50 pacientes.
Os resultados elevados do UAS7 antes do uso do omalizumabe, mesmo após dose plena dos anti-histamínicos, refletem a piora considerável da qualidade de vida dos pacientes, visto que esta escala mede os sinais e sintomas apresentados por eles durante uma semana de exacerbação da UCE. A consequência disso, além da automedicação e do uso de drogas indevidas, é a elevada procura por atendimentos de emergência de saúde, para tentar aliviar os piores sintomas como angioedema, prurido e edema de orofaringe que, por consequência, geram redução da produtividade.
A Figura 1 apresenta os medicamentos que foram utilizados associados ao omalizumabe nas exacerbações da UCE. A maioria dos pacientes (67,3%) fez uso de anti-histamínico de 2ª geração, e oito pacientes (16,3%) não precisaram de nenhum medicamento associado. Também em relação aos estudos de Su e cols.22 (2020), os presentes resultados demonstraram que menos pacientes necessitaram do uso concomitante de anti-histamínicos e omalizumabe, pois no estudo comparado foi relatado que 46% dos pacientes utilizaram anti-histamínico de forma regular e 44% fizeram o uso irregularmente e por pouco tempo, totalizando 90% da amostra. Além disso, apenas 5 pacientes do outro estudo não precisaram de nenhum tratamento associado ao omalizumabe, demonstrando quantidade inferior a esta avaliação.
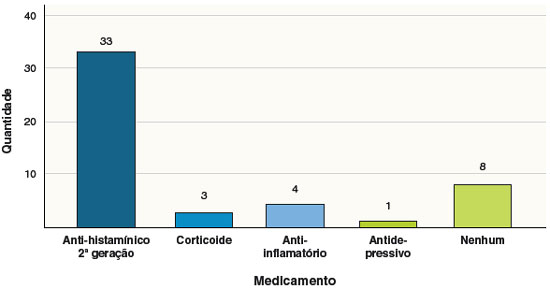
Figura 1
Medicamentos associados ao uso de omalizumabe
Conclusão
A UCE é uma doença de elevada morbidade, causada por distúrbios autoimunes, com períodos de piora e remissão, cuja agudização pode durar anos. O perfil dos pacientes acometidos pela doença é composto em sua maioria por mulheres jovens, em idade produtiva, que demoraram até 10 anos para obter o diagnóstico de UCE, com consequente diminuição na qualidade de vida neste período e piora na produtividade. Em muitos casos, estes pacientes não são responsivos aos tratamentos usuais de primeira e segunda linha.
Este estudo demonstrou que o omalizumabe, terceira linha terapêutica para a UCE, foi eficaz no controle dos sintomas dos pacientes, alguns já na administração da primeira dose, com redução do uso de anti-histamínicos. Em vista disso, este imunobiológico diminuiu a automedicação, os usos indevidos de outras drogas e os custos com a saúde, como idas frequentes em pronto atendimentos e outras consultas especializadas.
Referências
1. Costa AC, Campina S, Andrade P, Filipe P, Guilherme A, Gonçalo M. Urticária crônica - do Diagnóstico ao Tratamento. Revista SPDV. 2016;74(4):315-25.
2. Magerl M, Borzova E, Giménez-Arnau A, Grattan CEH, Lawlor F, Mathelier-Fusade P, et al. The definition and diagnostic testing of physical and cholinergic urticaria - EAACI/GA2LEN/EDF/UNEV consensus panel recommendations. Allergy. 2009;64(12):1715-21.
3. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer-Weber B, et al. The AACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73(3):1393-414.
4. Valle SOR, Motta AB, Amaral CSF, Ensina LFC, Mallozi MC, Spengler MGMT, et al. O que há de novo na urticária crônica espontânea? Braz J Allergy Immunol. 2016;4(1):9-25.
5. Viegas LP, Ferreira MB, Kaplan AB. The maddening itch: an approach to chronic urticaria. J Investig Allergol Clin Immunol. 2014;24(1):1-5.
6. Ferreira BR, Ribeiro MI, Gonçalo M. Ciclosporina no Tratamento da Urticária Crónica Espontânea na Era do Omalizumab. Revista SPDV. 2018;76(2):157-64.
7. Barbosa AM, Araújo FM, Vieira L. Eficácia, segurança e custo-efetividade do omalizumabe para urticária crônica espontânea em pacientes maiores de 12 anos refratários aos anti-histamínicos: revisão rápida de evidências. Revista Científica da Escola Estadual de Saúde Pública de Goiás. 2019;5(2):64-82.
8. Agência Nacional de Vigilância Sanitária. Preços máximos de medicamentos por princípio ativo [internet]. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/cmed/precos/arquivos/lista_conformidade_2021_03_v2.pdf. Acessado em: 17/03/2021.
9. Ozlem S, Bahali AG, Onsun N. The effect of at least 1-year use of omalizumab without interruption on relapse in patients with chronic spontaneous urticaria. Dermatologic therapy. 2020;33(6):1-5.
10. Souza DL, Muniz JP, Sakae TM, Menezes MM. Efetividade da administração de omalizumabe para tratamento de pacientes com urticária crônica espontânea. Revista Brasileira de Análises Clínicas. 2019;51(6):81-6.
11. Valente C, Rosmaninho I. Prurido crônico - da etiologia ao tratamento. Rev Port Imunoalergologia. 2019;27(3):219-32.
12. Ferraro MF, Arruda LK, Maia LSM, Moreno AS. Angioedema hereditário e outras formas de angioedema por bradicinina: atualização no diagnóstico e tratamento. Arq Asma Alerg Imunol. 2014;1(1):6-20.
13. Duarte PP. Urticária crônica: experiência de consulta nos CHUC [dissertação]. Coimbra: Faculdade de Medicina da Universidade de Coimbra; 2014.
14. Vieira HAS. Avaliação da relação entre a gravidade da urticária crônica e o impacto na qualidade de vida (tese). Florianópolis: Faculdade de Medicina, Universidade Federal de Santa Catarina; 2021.
15. Farril-Romanillos PMO, Álvarez-Chávez FE, Xichihua-García JJ. Thyroid disorders in spontaneuos chronic urticaria. Rev Alerg Méx. 2019;66(4):403-8.
16. Rottem M. Chronic urticaria and autoimmune thyroid disease: is there a link? Autoimmun Rev. 2003;2(2):69-72.
17. Silva NL, Damayanthi H, Rajapakse AC, Rodrigo C, Rajapakse S. Leukotriene receptor antagonists for chronic urticaria: a systematic review. Allergy Asthma Clin Immun. 2014;10(4):1-6.
18. Arruda LKP, Juliana AS, Mendonça TN, Melo JML, Ferriani MPL. Mecanismo de ação da terapia com omalizumabe na urticária crônica espontânea: há um papel para autoimunidade? Arq Asma Alerg Imunol. 2016;1(4):1-8.
19. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention [Internet]. 2022. Disponível em: www.ginasthma.org.
20. Labrador-Horrillo M, Valero A, Velasco M, Jáuregui I, Sastre J, Bratra J, et al. Efficacy of omalizumab in chronic spontaneous urticaria refractory to conventional therapy: analysis of 110 patients in real-life practice. Expert Opinion Biol Ther. 2013;13(9):1225-8.
21. Buyukozturk S, Gelincik A, Demirturk M, Kocaturk E, Colakoglu B, Dal M. Omalizumab markedly improves urticaria activity scores and quality of life scores in chronic spontaneous urticaria patients: A real life survey. Dermatol J. 2012;39(5):439-42.
22. Ensina LF, Valle SOR, Juliani AP, Galeane M, Santos RV, Arruda LK, et al. Omalizumab in Chronic Spontaneous Urticaria: a Brazilian Real-Life Experience. Int Arch Alergia Immunol. 2016;169(1):121-4.
23. Su O, Bahali AG, Onsun N. O efeito de pelo menos 1 ano de uso de omalizumabe sem interrupção na recidiva em pacientes com urticária crônica espontânea. Dermatologic therapy. 2020;33(6).
24. Brasil. Ministério da Saúde. Gabinete do Ministro. Resolução nº 466, de 12 de dezembro de 2012. Dispõe sobre as diretrizes e normas regulamentadoras de pesquisa envolvendo seres humanos. Diário oficial da república federativa do Brasil [internet]. Brasília (DF):MS; 2012. Disponível em: https://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf.
25. Brasil. Ministério da Saúde. Gabinete do Ministro. Resolução nº 510, de 07 de abril de 2016. Dispõe sobre as normas aplicáveis a pesquisas em Ciências Humanas e Sociais. Diário oficial da república federativa do Brasil [internet]. Brasília (DF): MS; 2016. Disponível em: https://conselho.saude.gov.br/resolucoes/2016/Reso510.pdf.