Número Atual: Janeiro-Fevereiro 2013 - Volume 1 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Avaliação da resposta clínica dos pacientes com imunodeficiência comum variável submetidos à vacinação com antígenos proteicos e polissacarídicos
Clinical evaluation of patients with common variable immunodeficiency before and after immunization with polysaccharide and protein antigens
Ana Karolina B.B. Marinho1; Maíra Pedreschi2; Andrea Cohon3; Jorge Kalil3; Myrthes T. Barros3; Cristina M. Kokron3
DOI: 10.5935/2318-5015.20130010
1. MD. Disciplina de Imunologia Clínica e Alergia, Faculdade de Medicina da Universidade de Sao Paulo (FMUSP), Sao Paulo, SP
2. BSc, MSc. Disciplina de Imunologia Clínica e Alergia, Faculdade de Medicina da Universidade de Sao Paulo (FMUSP), Sao Paulo, SP
3. MD, PhD. Disciplina de Imunologia Clínica e Alergia, Faculdade de Medicina da Universidade de Sao Paulo (FMUSP), Sao Paulo, SP
Endereço para correspondência:
Ana K.B.B. Marinho
E-mail: akbarreto@terra.com.br
Submetido em 05.02.2013.
Aceito em 08.04.2013.
Agência financiadora: FAPESP.
Nao foram declarados conflitos de interesse associados à publicaçao deste artigo.
RESUMO
OBJETIVO: Avaliar a resposta clínica a imunizaçao com antígenos proteicos e polissacarídicos após administraçao de vacinas de antígenos específicos (Pneumococo e Influenza H2N3 e H1N1) em pacientes com imunodeficiência comum variável (ICV) acompanhados no ambulatório de Imunodeficiências Primáriasdo Serviço de Imunologia Clínica e Alergia, Hospital das Clínicas da Faculdade de Medicina da Universidade de Sao Paulo (HC-FMUSP).
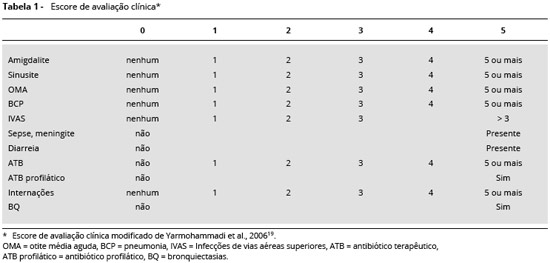
MÉTODOS: Os pacientes foram diagnosticados segundo critérios da OMS, PAGID e ESID. Os pacientes foram vacinados contra Influenza H2N3, Influenza H1N1 e Pneumococo. A avaliaçao clínica foi realizada a partir de um escore clínico no qual os parâmetros considerados foram: pneumonias, sinusites, otite média aguda, infecçoes de vias aéreas superiores virais (IVAS), amigdalite, diarreia, bronquiectasias, hospitalizaçoes, uso de antibiótico terapêutico, uso de antibiótico profilático, sepse e meningite. Avaliaçao do escore clínico foi realizada durante o ano que precedeu a vacinaçao e um ano após a administraçao das vacinas.
RESULTADOS: Participaram do estudo 45 pacientes (51% mulheres), com idade entre 20 a 78 anos (média 36,3 anos). Observamos mediana de 7 anos de retardo no diagnóstico dos pacientes com ICV. IVAS, pneumonias e sinusites foram as manifestaçoes infecciosas mais frequentes em mulheres (80%, 78% e 55% respectivamente). IVAS, sinusites e pneumonias foram os achados mais frequentes em homens (78%, 65% e 35% respectivamente). Houve reduçao significativa do escore clínico em relaçao ao número de sinusites e IVAS após a administraçao das vacinas (p < 0,001).
CONCLUSOES: Observamos reduçao do número de infecçoes, especialmente sinusites e IVAS no ano posterior à vacinaçao. Esta observaçao reforça o benefício da vacinaçao e sugere modificaçao na orientaçao quanto às indicaçoes de vacinas nos pacientes com ICV.
Descritores: Imunodeficiência comum variável, vacinas, infecçoes.
INTRODUÇAO
A imunodeficiência comum variável (ICV) faz parte de um grupo de imunodeficiências primárias onde há defeito na produçao e funçao das células B, resultando em hipogamaglobulinemia, maior susceptibilidade a infecçoes bacterianas e ausência de resposta aos antígenos específicos1. Acomete um grupo heterogêneo de indivíduos em qualquer idade, porém há maior incidência nas faixas etárias de 6 a 10 anos e 18 a 35 anos de idade, em igual proporçao em relaçao aos gêneros masculino e feminino. Os pacientes apresentam níveis reduzidos de imunoglobulina G, em associaçao à reduçao de imunoglobulina A (IgA) e/ou imunoglobulina M (IgM)2.
Por se tratar de doença rara, o diagnóstico, tratamento eacompanhamento desses pacientes acarretam custos elevados para o sistema de saúde e grande impacto socioeconômico3.
As manifestaçoes clínicas predominantes da ICVsao: infecçoes bacterianas recorrentes, principalmente do trato respiratório, dentre as quais as sinusites, otites, amigdalites e pneumonias causadas por Streptococcus pneumoniae e Haemophylus influenzae sao as mais frequentes4. Diarreia crônica ou intermitente é outro sintoma frequente, decorrente de infecçoes por micro-organismos como Giardia lamblia, Salmonella, Shigella e Campylobacter, podendo levar à síndrome de má-absorçao. Alguns pacientes podem apresentar infecçoes oportunistas envolvendo micro-organismos pouco comuns,como micoplasmae fungos (Cryptococcus neoformans) e infecçoes por protozoários, Pneumocystis jiroveci, Toxoplasma gondii e Cryptosporidium spp5,6. Infecçoes virais sao comuns e herpes simples, Epstein-Barr e Citomegalovírus estao entre os mais frequentemente reportados7,8.
Os estudos mostram que aproximadamente 20 a 50% dos pacientes com ICV irao desenvolver algum fenômeno autoimune (AI), incluindo anemia hemolítica, púrpura trombocitopênica, vitiligo, hepatiteautoimune, tireoidite, entre outras9.
Os granulomas sao comuns em cerca de 10% dos pacientes com ICV, principalmente no sítio pulmonar, embora possamos encontrá-los no fígado, baço e pele3.
Vários estudos mostraram que os pacientes com ICV têm maior risco de desenvolver neoplasias hematológicas ou tumores sólidos (ovário, próstata, pele e cólon). A incidência de linfomas é elevada nos pacientes com ICV, principalmente os linfomas nao Hodgkin e gástrico3.
Diversas alteraçoes imunológicas já foram descritas em pacientes com ICV: alteraçoes de linfócitos T, linfócitos B, monócitos, imunidade inata, células reguladoras, produçao de citocinas e expressao de receptores celulares7.
Nos últimos anos, foram descritos genes relacionados à ICV: ICOS (inducible costimulator), membros do receptor da superfamília do TNF 13B (TNFRSF13B- TACI) e 13C (TNFRSF13C- BAFF) e CD19, Msh57.
Algumas classificaçoes têm sido propostas, principalmente baseadas na distribuiçao de subtipos de linfócitos B10-12. Mouillot et al. (2010)13 avaliaram o fenótipo de células T e B em pacientes com ICV e observaram associaçoes entre algumas complicaçoes destes pacientes com os fenótipos distintos de células B e T.
O tratamento da ICV baseia-se na reposiçao de gamaglobulina humana por via endovenosa com intervalos de 3 a 4 semanas, na dose de 300 a 600 mg/Kg/peso. Por se tratar de doença rara, o diagnóstico muitas vezes é dado em estágios avançados em que as complicaçoes já fazem parte do quadro clínico. As bronquiectasias sao as complicaçoes encontradas frequentemente devido às infecçoes pulmonares recorrentes. No tratamento adjuvante devem-se considerar antibioticoterapia profilática, acompanhamentos fisioterápico, nutricional e psicológico do paciente14.
A segurança e eficácia das vacinas em indivíduos com deficiências imunológicas sao determinadas pela natureza e grau de imunossupressao. A experiência com administraçao de vacinas nos imunocomprometidos é limitada. A grande discussao com relaçao à indicaçao de vacinaçao com patógenos inativados de pacientes com ICV está na capacidade destes pacientes em responder a antígenos específicos e, portanto, na eficácia da vacinaçao. Estudos recentes demonstraram resultados satisfatórios in vitro em pacientes com deficiência de anticorpos que receberam vacinas contra o meningococo. Devido à heterogeneidade da etiologia e mecanismos imunológicos da doença, alguns pacientes teriam a capacidade de resposta a tais antígenos15.
O foco da vacinaçao tem sido a produçao de anticorpos, mas também geraçao de resposta T potente e duradoura16. A administraçao de vacinas nestes pacientes poderia ser útil no diagnóstico e possivelmente na prevençao de doenças, haja vista os mecanismos imunológicos da ICV. O objetivo deste trabalho foi verificar se podemos caracterizar uma resposta clínica à vacinaçao em pacientes com ICV, apesar de nao esperarmos produçao adequada de anticorpos específicos.
CASUISTICA E MÉTODOS
Foram selecionados 45pacientes com diagnósticode ICV acompanhados no ambulatório de Imunodeficiências Primárias do Serviço de Imunologia Clínica e Alergia do HC-FMUSP.Os critériosdiagnósticos utilizadosforamos de acordo com a Organizaçao Mundial de Saúde (WHO, 1997)17, Grupo Panamericano de Imunodeficiências (PAGID) e Sociedade de Europeia de Imunodeficiências (ESID) (Conley et al.,1999)18.
Todos os pacientes assinaram o termo de consentimento livre e esclarecido segundo o comitê de ética do HC-FMUSP.
Os pacientes foram orientados a procurar, quinze dias após a reposiçao de gamaglobulina humana, o Centro de Imunizaçoes do Hospital das Clínicas de Sao Paulo, para administraçao das vacinas: antipneumocócica, contra H1N1 e anti-influenza (H2N3) por via intramuscular, simultaneamente. Os lotes das vacinas utilizadas foram: Influenza -Lote: VA349400; H1N1 -Lotes: A80CA184-A; 107.058P1 e S. pneumoniae - Lotes: TO234.1; NR 5600; NN 14220; NL 15710; P1418.50; YO 237.1.
Avaliaçao clínica
Para avaliaçao do número de infecçoes,osindivíduos foram interrogados sobre o início, frequência anual de infecçoes e uso de antibioticoterapia. Revisao do prontuário médico também foi realizada. Como critérios de avaliaçao para infecçoes recorrentes, foram utilizados parâmetros descritos na literatura18.
Os pacientes foram avaliados quanto ao número e gravidade de infecçoes e fatores associados, a partir de um escore de sintomas já validado na literatura e modificado de acordo comasnecessidades do presente estudo19. O tratamento padrao, que consiste na administraçao de imunoglobulina endovenosa mensalmente, foi mantido para todos os pacientes.
Os parâmetros avaliados foram: pneumonias (BCP), sinusites, otite média aguda (OMA), infecçoes de vias aéreas superiores virais (IVAS), amigdalite, diarreia, bronquiectasias, hospitalizaçoes, uso de antibiótico terapêutico, uso de antibiótico profilático, sepse e meningite (Tabela 1).
O escore de sintomas foi aplicado em três momentos:
a) Escore de sintomas antes da instituiçao do tratamento padrao (reposiçao de gamaglobulina). Esses dados foram analisados retrospectivamente por entrevista ao paciente e revisao do prontuário. Foi feita uma média do número de infecçoes em um período de 1 ano;
b) Escore de sintomas após o início da reposiçao de gamaglobulina humana, mas durante o ano que precedeu a administraçao das vacinas;
c) Escore de sintomas um ano após a administraçao das vacinas.
Para cada item do escore foi dada uma pontuaçao. Cada paciente teve um escore pré-gamaglobulina, pr vacina e pós-vacina.
Análise estatística
Os teste estatísticos utilizados foram obtidos através do programa GraphPad Prism5.
Para comparaçao da frequência entre pacientes foi realizado o teste Kruskal-Wallis. Havendo diferença estatística entre os grupos, foi utilizado o teste Dunn's Multiple Comparison Test.
Para a análise das características clínicas foi realizado teste 2WAY ANOVA, e para a identificaçao dos grupos que apresentaram diferença estatística foi realizado o teste de Bonferoni post test. Foram considerados valores estatísticos de p < 0,05.
RESULTADOS
Caracterizaçao dos pacientes
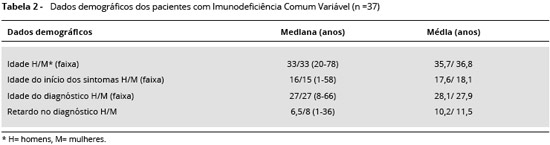
Em relaçao aos dados demográficos, 45 pacientes foram selecionados para o estudo. Destes, 37 completaram o estudo, sendo que 19 foram indivíduos do gênero feminino e 18 do gênero masculino. A mediana de idade foi de 33 anos (20 a 78 anos), nao havendo diferença entre homens e mulheres. A mediana da idade de início dos sintomas foi 15 anos (1 a 58 anos), e a mediana da idade ao diagnóstico foi 26 anos (8 a 66 anos). Portanto, a mediana de retardo no diagnóstico foi de 7 anos, sendo que em mulheres foi superior aos homens (Tabela 2).
Fenótipo dos pacientes com ICV
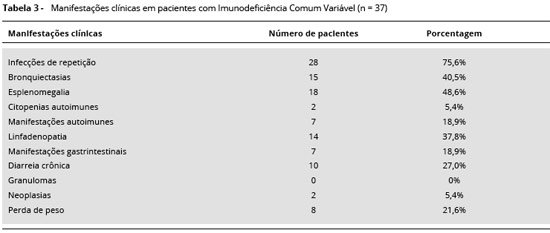
Dos 37 pacientes avaliados, todos eram sintomáticos e as manifestaçoes mais frequentes foram as infecçoes respiratórias de repetiçao, acometendo 95% dos indivíduos. A manifestaçao infecciosa mais comum foi pneumonia, seguida de sinusite, diarreia e IVAS. Diarreia crônica foi observada em 27% dos pacientes e em 18,9% observamos outras alteraçoes gastrintestinais, como gastrite crônica e síndrome de má-absorçao.
Em relaçao às bronquiectasias, 40,5% dos pacientes apresentavam imagens radiológicas sugestivas e compatíveis com o quadro clínico. Esplenomegalia foi confirmada por exame de USG abdominal em 48,6% dos pacientes. Linfadenopatia foi encontrada em 37,8% dos pacientes.
Doenças autoimunes foram observadas em 24,3%, dentre elas tireoidite, pancitopenia autoimune, gastrite atrófica e vitiligo. Neoplasias tinham sido diagnosticadas e tratadas em dois pacientes, um com neoplasia intestinal e outro com neoplasia de tireoide. Em nenhum paciente notou-se a presença de granulomas (Tabela 3).
Dosagem de imunoglobulinas
A dosagem sérica de imunoglobulinas foi avaliada antes do tratamento padrao (gamaglobulina endovenosa), após o início do tratamento e ao longo do estudo. A dosagem sérica média de IgG durante o estudo foi de 690 mg/dl (Figura 1).
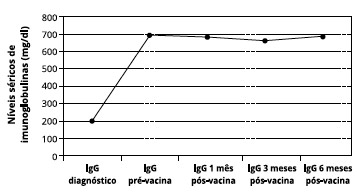
Figura 1 - Gráfico de imunoglobulina G sérica antes do início do tratamento padrao e durante o período do estudo
Análise das manifestaçoes clínicas
Em relaçao às infecçoes e outras características, observamos que houve reduçao significativa do escore de sintomas quando avaliamos as sinusites pré-tratamento com gamaglobulina, pós-tratamento com gamaglobulina e após a administraçao das vacinas citadas no estudo (p < 0,001) (Figura 2).
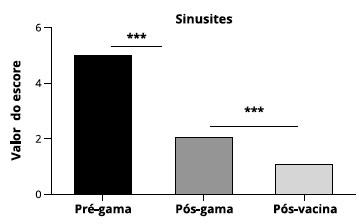
Figura 2 - Escore de sintomas referente a sinusites pré-tratamento com gamaglobulina humana, pós-tratamento com gamaglobulina humana e pós-vacinas. Valores estatisticamente significantes sao representados por (***) para p < 0,001
Quando analisamos o escore de sintomas referente às IVAS, houve reduçao significativa do número de IVAS em relaçao ao pré-vacina e pós-vacina demonstrado na Figura 3 (p < 0,001).
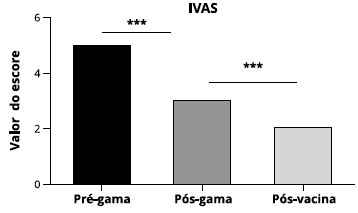
Figura 3 - Escore de sintomas referente a IVAS antes da reposiçao de gamaglobulina humana, após início da reposiçao de gamaglobulina humana e um ano após a administraçao das vacinas. Houve reduçao estatisticamente significante entre os scores pré-gamaglobulina e pósgamaglobulina, e pós-gamaglobulina e pós-vacina. (***) para p < 0,001, n = 37
Os pacientes apresentaram reduçao do número de amigdalites após o início do tratamento convencional com gamaglobulina, porém nao houve diferença quando comparamos o escore de amigdalites após a administraçao das vacinas. Os mesmos resultados foram observados em relaçao às otites.
Em relaçao ao uso de antibióticos, observamos que houve reduçao significante quando comparamos o uso pré-tratamento convencional, pós-tratamento eumano após uso das vacinas (Figura 4).
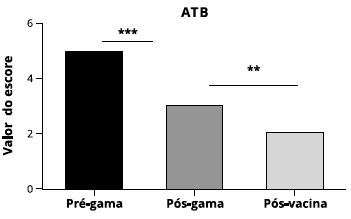
Figura 4 - Escore de sintomas referente a uso de antibiótico (ATB) terapêutico. Observamos reduçao do uso de antibiótico quando comparamos valores pré-gamaglobulina humana, pós-gamaglobulina humana, e pós-vacina (um ano após vacinas). Esses valores sao estatisticamente significantes com p < 0,001 (***) e p < 0,01 (**) (n = 37)
Houve reduçao do número de hospitalizaçoes quando comparamos o escore pré-tratamento e pós-tratamento; porém, nao houve diferença estatisticamente significante antes e após a administraçao das vacinas avaliadas no estudo.
Nao foram observadas diferenças estatisticamente significantes quando comparamos o escore referente à diarreia, presença de bronquiectasias e ao uso de antibióticos profiláticos entre o pré e pós-vacinas.
Quando comparamos o escore geral de sintomas entre indivíduos do gênero masculino e feminino, observamos que o escore de sintomas das mulheres foi mais elevado do que o dos homens, como observado na Figura 5.
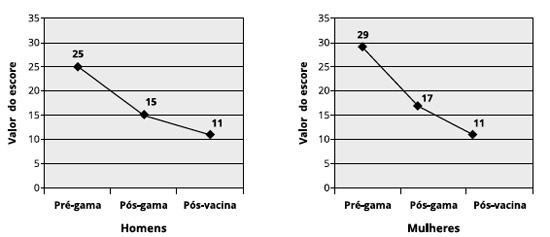
Figura 5 - Escore geral de sintomas comparando homens e mulheres. Observamos que o escore das mulheres apresenta valores maiores do que o dos homens
Analisando a frequência de infecçoes em mulheres, observamos que as IVAS foram mais frequentes pré-gamaglobulina, comparadas às outras infecçoes e ao escore pós-início do tratamento com reposiçao de gamaglobulina e um ano pós-vacina (Figura 6).
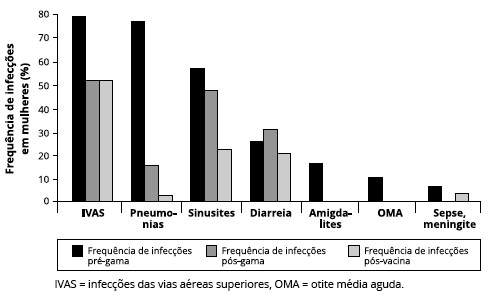
Figura 6 - Frequência de infecçoes em mulheres, nos períodos pré-gamaglobulina humana, pós-gamaglobulina humana e pós-vacinas. Observamos maior frequência de IVAS, seguidas de pneumonias. Houve reduçao importante da frequência após início do tratamento e após as vacinas (n = 19)
Quando observamos a frequência de infecçoes em homens, observamos maior frequência de IVAS, seguidas de pneumonias e sinusites nos três momentos: pré-gamaglobulina, pós-gamaglobulina e pós-vacina, como podemos ver na Figura 7.
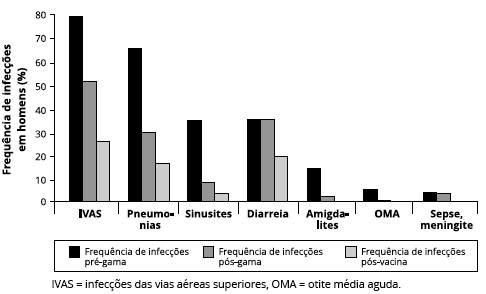
Figura 7 - Frequência de infecçoes em homens, nos períodos pré-gamaglobulina humana, pós-gamaglobulina humana e pós-vacinas. Observamos maior frequência de IVAS, seguidas de sinusite e pneumonias. Houve reduçao importante da frequência após início do tratamento e após as vacinas (n = 18)
DISCUSSAO
A imunodeficiência comum variável é a imunodeficiência clinicamente relevante mais prevalente. É caracterizada principalmente por infecçoes de repetiçao como sinusites, pneumonias, e infecçoes de vias aéreas superiores7. Existem vários estudos que tentam correlacionar fenótipos clínicos e imunológicos destes pacientes com o intuito de caracterizar melhor a doença20. Nosso estudo avaliou a resposta clínica de pacientes com ICV após a imunizaçao com as vacinas pneumocócica 23 valente (PneumoVax), H1N1 e H2N3. Considerando que as infecçoes mais comuns sao as sinusites e pneumonias, esperávamos encontrar um menor número de infecçoes nesses indivíduos após a vacinaçao contra o pneumococo, H1N1 e Influenza, mesmo sabendo que estes pacientes têm pobre produçao de anticorpos específicos7.
As características epidemiológicas do grupo de pacientes foram semelhantes às encontradas na literatura. Dos pacientes avaliados, nao houve predileçao por gênero e a média de idade foi de 33 anos, caracterizando adultos jovens, observaçoes que estao de acordo com a literatura.
Um dado que tem nos preocupado é o retardo no diagnóstico, que foi de sete anos. Os custos para o sistema de saúde e o prejuízo para os pacientes sao enormes. Além de interferir na qualidade de vida em relaçao à própria doença, o indivíduo sofre um grande prejuízo no trabalho e nas atividades sociais3.
Em relaçao às manifestaçoes clínicas, as infecçoes respiratórias foram as mais frequentes, acometendo cerca de 95% dos pacientes. Fenômenos autoimunes foram observados em 26,6%. Esses dados sao semelhantes aos encontrados em outros estudos, embora tenhamos encontrado apenas 6% de pacientes com citopenias autoimunes. Bronquiectasias foram observadas em 40% dos pacientes e foram mais comuns nos indivíduos que tiveram mais pneumonias. Esse dado nos mostra a importância do diagnóstico e tratamento precoce para indivíduos com ICV a fim de se evitar sequelas graves e incapacitantes, como por exemplo, as bronquiectasias. Esplenomegalia foi encontrada em 48,8% dos indivíduos, e linfadenopatia em 37,8%. Esses dados sao semelhantes a outros achados e refletem uma provável linfoproliferaçao benigna, cuja causa poderia ser as infecçoes recorrentes, ou, talvez, poderia ser o resultado da desregulaçao imunológica característica da ICV9.
Em relaçao aos níveis séricos de imunoglobulinas, observamos que antes da reposiçao de gamaglobulina humana os níveis séricos eram cerca de 200 mg/dl, e após o início do tratamento elevaram-se para 690 mg/dl. Verificamos que os níveis de imunoglobulina G sérica dos pacientes durante o estudo mantiveram-se estáveis, nao interferindo na análise do número e gravidade das infecçoes.
Sousa F. (2007)21 avaliou a resposta linfoproliferativa de pacientes com ICV antes e após vacinaçao antitetânica. Observou que apenas 14% dos pacientes testados nao responderam à estimulaçao com toxoide tetânico após a vacinaçao, e 66% tiveram resposta excelente, com índice de estimulaçao acima de 10. Sao raros os estudos para classificar e avaliar adequadamente a resposta clínica e laboratorial após exposiçao a antígenos específicos desses pacientes23. Essas afirmativas reforçam a importância de classificar e entender melhor a ICV, e o estímulo antigênico com vacinas pode contribuir para esse entendimento, além de trazer possíveis benefícios em relaçao à proteçao contra infecçoes para os pacientes22.
Rezaei et al. sugeriram classificar os pacientes com ICV com base na resposta à vacina polissacarídica contra o meningocco. Os autores avaliaram 25 pacientes com ICV que receberam a vacina referida. Dezesseis pacientes tiveram títulos protetores de anticorpos contra o meningococo após três semanas da vacinaçao. Entre os pacientes em que nao foi observada resposta específica, houve maior frequência nos achados de bronquiectasias, doenças autoimunes e esplenomegalia comparados ao outro grupo. Os mesmos autores avaliaram os níveis séricos de anticorpos contra o meningococo C um ano após a vacinaçao. Dos 23 pacientes vacinados, os autores concluiram que a maioria foi respondedor da vacina e manteve a resposta após um ano. Talvez esse fato esteja relacionado com um melhor prognóstico dos pacientes do ICV23,15.
No presente estudo, quando analisamos as manifestaçoes clínicas infecciosas, observamos uma reduçao do escore para sinusites quando comparamos os períodos pré-gamaglobulina e pós-gamaglobulina (50%), fato que já poderíamos esperar devido aos benefícios conhecidos da reposiçao de gamaglobulina humana, e uma reduçao de cerca de 50% quando comparamos os períodos pré-vacinas e pós-vacinas. Esse achado nos chama atençao para o fato de que mesmo sabendo que a produçao de anticorpos é deficiente nos pacientes com ICV, houve reduçao do número de sinusites um ano após a vacinaçao, com um resultado estatisticamente significante. Além disso, a sinusite é a infecçao de vias aéreas superiores mais frequente nos pacientes com ICV, mesmo com a reposiçao de gamaglobulina. Talvez a administraçao da vacina contra o pneumococo e agentes virais seja de grande auxílio na prevençao de infecçoes. A mesma reduçao do escore ocorreu quando analisamos as IVAS. Cerca de 50% de reduçao no escore ao comparar o número de IVAS antes da reposiçao de gamaglobulina e após a reposiçao, e quando comparamos às infecçoes nos períodos pré epós-vacinas, ambos os resultados estatisticamente significantes. A reduçao do escore que encontramos referente ao uso de antibióticos possivelmente se deve à reduçao do número de eventos infecciosos. Com base nos dados da literatura, possivelmente outros mecanismos imunológicos podem estar envolvidos na proteçao do indivíduo após estímulos com polissacarídeos e proteínas. Um desses mecanismos seria que os linfócitos T modulassem uma resposta imune independente da produçao de anticorpos24. Outra via seria a resposta imune inata. Hong e cols. (2010) demonstraram que monócitos ativados após estímulo com a Pneumovax 23 foram capazes de produzir IL6, IL-10 e TNF-alfa em pacientes com ICV, caracterizando uma resposta imunológica25.
Outros dados analisados como diarreia, presença de bronquiectasias e uso de antibiótico profilático nao sofreram alteraçoes no período do estudo.
Houve reduçao estatisticamente significante no número de hospitalizaçoes após o início da reposiçao da gamaglobulina humana. Esse dado nos mostra mais uma vez os benefícios consideráveis da reposiçao da gamaglobulina nos pacientes com ICV.
Na avaliaçao do escore geral de sintomas, vimos que o escore de mulheres foi mais elevado do que o de homens. Avaliando as manifestaçoes clínicas por gênero, observamos que em homens e mulheres há maiorfrequênciadeIVAS.Porém,asegundamaiorcausa de infecçoes em mulheres foram as pneumonias, e em homens, as sinusites. Ainda nao há dados na literatura que justifiquem tal diferença.
Concluindo, houve uma reduçao do número de infecçoes, especialmentesinusiteseIVASno anoposterior à vacinaçao. Esta observaçao reforça o benefício da vacinaçao e sugere modificaçao na orientaçao quanto às indicaçoes de vacinas nos pacientes com ICV.
REFERENCIAS
1. IUIS. Primary Immunodeficiency Diseases: Report of the IUIS Scientific Committee. Clin Exp Immunol. 1999,118(Suppl 1):1-28.
2. Cunningham-Rundles C, Bodian C. Common Variable Immunodeficiency: clinical and immunological features of 248 patients. J Clin Immunol. 1999;92:34-48.
3. Miguel A Park, James T Li, John B Hagan, Daniel E Maddox, Roshini S Abraham. Common Variable Immunodeficiency: a new look at an old disease. Lancet. 2008;372:489-502.
4. Kokron CM, Errante PR, Toledo-Barros M, Barcho GV, Camargo MM, Kalil J, Rizzo LV. Clinical em laboratory aspects of commom variable immunodeficency. An Acad Bras Ciênc. 2004;76:1-20.
5. Esolen LM, Fasano MB, Flynn J, Burton A, Lederman HM. Pneumocystiscariniostemyelitis inapatient withCommon Variable Immunodeficiency. N Engl J Med. 1992;326:999-1001.
6. Macura Ab, Macura-Biegun A, Pawlik B. Susceptibility to fungal infections of nails in patients with primary antibody deficiency. Obesit Surg. 2003;26:223-32.
7. Bonilla FA, Geha RS.Common Variable Immunodeficiency. Pediatric Res. 2009;65:13-9.
8. Chapel H and Cunnigham-Rudles C. Update in understanding Common Variable Immunodeficiency Disorders (CVIDs) and the management of patients with these conditions. Br J Haematol 2009;145:709-27.
9. Rizzo LV e Silva SL. Autoimmunity in Common Variable Immunodefiency. J Clin Immunol. 2008;1:S46-S55.
10. Warnatz K, Denz A, Drager R, Braun M, Groth C, Wolff-Vorbeck G, et al. Severe deficiency of switched Memory B Cells (CD27+IgM-IgD-) in subgroups of patients with Common Variable Immunodeficiency: a new approach to classify a heterogeneous disease. Blood. 2002;99:1544-51.
11. Piqueras B, Lavenu-B ombled C, Galicier L, Bergeron-vander Cruyssen F, Mouthon L, Chevret S, etal. Common Variable Immunodeficiency: patient classification based on impaired Bcell memory differentiation correlates with clinical aspects. J Clin Immunol. 2003;23:385-400.
12. Wehr C, Kivioja T, Schimitt C, et al. The EUROclass trial: Difining subgroups in Common Variable Immunodeficiency. Blood. 2008;11:77-85.
13. Mouillot G et al. B-Cell and T-Cell Phenotypes in CVID patients correlate with the clinical phenotype of the disease. J Clin Immunol. 2010;30:746-55.
14. Muscaritoli M, Fanfarillo F, Luzi G, Sirianni MC, Iebba F, Laviano A, et al. Impareid nutritional status in Common Variable Immunodeficiency patients correlates with reduced levels of serum IgA and of circulating CD4+ T lymphocytes. Eur J Clin Invest. 2001;31:544-9.
15. Rezaei N, Aghamohammadi A, Siadat SD, Nejati M, Ahmadi H, Moin M, et al. Serum bactericidal antibody response to serogroup C polysacharide meningococal vaccination in children with primary antibody deficiencies. Vaccine. 2007;25:5308-14.
16. Seder R A, Darrah P A, Roederer M. T-Cell quality in memory and protection: implications for vaccine design. Nature Rev Immunol. 2008;8:247-58.
17. WHO Scientific Group. Primary Immunodeficiency Diseases: Report of a WHO Scientific Group. Clin Exp Immunol. 1997;99:1-124.
18. Conley ME, Notarangelo LD, Etzoni A. Diagnostic criteria for the Primary Immunodeficiencies. Representing PAGID (Pan-American Group for Immunodeficiency) and ESID (European Society for Immunodeficiencies). Clin Immunol. 1999;93:190-7.
19. Yarmohammadi H, Estrella L, Doucette J, Cunningham-Rudles C. Recognizing Primary Immune Deficiency in clinical practice. Clin Vaccine Immunol. 2006;13:329-32.
20. Chapel H, Lucas M, Patel S, Lee M, Cunningham-Rundles C, Resnick E, et al. Confirmation and improvement of criteria for clinical phenotyping in common variable immunodeficiency disorders in replicate cohorts. J Allergy Clin Immunol. 2012;130:1197-8.
21. Souza F. Vacinaçao antitetânica em pacientes com Imunodeficência Comum variável. Trabalho de aprimoramento. Sao Paulo (SP): Faculdade de Medicina da Universidade de Sao Paulo; 2007.
22. Goldacker S, Draeger R, Warnatz K, Huzly D, Salzer U, Thiel J, et al. Active vaccination in patients with Common Variable Immunodeficiency (CVID). Clin Immunol. 2007;124:294-303.
23. Rezaei N, Aghamohammadi A, Siadat SD, Moin M, Pourpak Z, Nejati M, et al. Serum bactericidal antibody responses to meningococcal polysaccharide vaccination as a basis for clinical classification of common variable immunodeficiency. Clin Vaccine Immunol. 2008;15:607-11.
24 Rezaei N, Siadat SD, Aghamohammadi A, Moin M, Pourpak Z, Norouzian D, et al. Serum bactericidal antibody response 1 year after meningococcal polysaccharide vaccination of patients with common variable immunodeficiency. Clin Vaccine Immunol. 2010;17:524-8.
25. Hong R, Agrawal S, Gollapudi S, Gupta S. Impaired Pneumovax23-induced monocyte-derived cytokine production in patients with Common Variable Immunodeficiency. J Clin Immunol. 2010;30:435-41.
Este trabalho foi vencedor do Prêmio Antônio Oliveira Lima, XXXVIII Congresso Brasileiro de Alergia e Imunopatologia 2011.