Número Atual: Janeiro-Março 2023 - Volume 7 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Mastócitos e síndrome de ativação mastocitária: o que há de novo?
Mast cells and mast cell activation syndrome: what's new?
Sofia Couto1; Tiago Rama2,3,4,5; Catarina Martins6; Luís Miguel Borrego7,8
1. Hospital Cuf Descobertas, Imunoalergologia - Lisboa, Lisboa, Portugal
2. Centro Hospitalar Universitário de São João, Imunoalergologia - Porto, Porto, Portugal
3. Faculdade de Medicina do Porto, Serviço de Imunologia Básica e Clínica, Departamento de Patologia - Porto, Porto, Portugal
4. EPIUnit - Instituto de Saúde Pública da Universidade do Porto (ISPUP) - Porto, Porto, Portugal
5. ISPUP, Laboratory for Integrative and Translational Research in Population Health (ITR) - Porto, Porto, Portugal
6. NOVA Medical School - Faculdade de Ciências Médicas, Universidade NOVA de Lisboa, Comprehensive Health Research Centre (CHRC) - Lisboa, Lisboa, Portugal
7. NOVA Medical School - Faculdade de Ciências Médicas, Universidade NOVA de Lisboa - Lisboa, Lisboa, Portugal
8. Hospital da Luz Lisboa, Serviço de Imunoalergologia - Lisboa, Lisboa, Portugal
Endereço para correspondência:
Sofia Couto
E-mail: sofia.couto.gp@gmail.com
Submetido em: 29/08/2022
Aceito em: 20/02/2023
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
Os mastócitos são as principais células efetoras da resposta alérgica aguda, desempenhando também um papel importante na angiogênese, tolerância imunológica, regulação da fibrinólise, regeneração neuronal e osteoclastogênese. Localizam-se maioritariamente na pele e nas mucosas do intestino e pulmões, onde exercem uma função "sentinela". As síndromes de ativação mastocitária são caracterizadas pela ocorrência de episódios recorrentes de manifestações clínicas resultantes da libertação de mediadores mastocitários. Esta constitui-se como entidade complexa com um espectro de sintomas associados, representando um desafio diagnóstico e terapêutico. Nesta revisão, os autores pretendem apresentar uma visão geral sobre a estrutura e função dos mastócitos e sobre os critérios diagnósticos e abordagem terapêutica da síndrome de ativação mastocitária.
Descritores: Mastócitos, mastocitose, síndrome de ativação mastocitária.
Introdução
Os mastócitos são células do tecido conjuntivo, com origem nas células hematopoiéticas, situadas na medula óssea, que podem desempenhar papéis importantes na defesa do hospedeiro, nomeadamente nas infeções parasitárias, e nas reações alérgicas. Localizam-se de forma ubíqua no tecido conjuntivo, na pele e em redor dos vasos sanguíneos, mas também nas superfícies mucosas do intestino e dos pulmões1. Numa resposta inflamatória, os mastócitos são células muito importantes, uma vez que a sua ativação promove a libertação de uma grande variedade de mediadores pró-inflamatórios, destacando-se a histamina, a triptase, citocinas como as interleucinas IL-4 e IL-13, e o fator de necrose tumoral (TNF)-a, ou mesmo mediadores lipídicos, como os leucotrienos, o fator ativador das plaquetas e as prostaglandinas1‑3.
Nos últimos anos, tem surgido evidência de que a ativação e proliferação dos mastócitos pode surgir em alguns indivíduos de forma patológica, podendo ser desencadeada por diversos estímulos como o stress, o calor ou o frio2.
O termo síndrome de ativação mastocitária (SAM) refere-se a um conjunto heterogêneo de patologias caracterizadas clinicamente pela ocorrência de episódios recorrentes de manifestações clínicas resultantes da libertação de mediadores mastocitários. Face à presença de clonalidade, podem ser classificadas como SAM clonais (SAMc) e não clonais (SAMnc)1‑4.
As SAMc incluem a SAM monoclonal (SAMmc), e as mastocitoses cutâneas (MC) sistêmicas (MS), nas quais se verificam manifestações clínicas decorrentes da ativação mastocitária5,6. Por outro lado, as SAMnc podem ser agrupadas em secundárias (ex: associadas a hipersensibilidade mediada por IgE), ou idiopáticas1‑3.
Até ao momento foram sugeridos vários critérios diagnósticos, carecendo muitas vezes de validação4. Esta é uma necessidade urgente e relevante, uma vez que um número crescente de indivíduos está a ser incorretamente diagnosticado com SAM, com base em critérios inespecíficos. Assim, neste artigo, pretende-se abordar de forma crítica a literatura atual relacionada com a SAM, comparando os critérios apresentados pelos dois grupos de autores mais dedicados a esta área.
Métodos
Os autores efetuaram uma pesquisa bibliográfica através do portal PubMed até 31 de maio 2022, utilizando os seguintes termos: mast cell, mastocytosis, anaphylaxis, combinados com os termos activation syndrome, tryptase, consensus. Foram utilizados artigos subordinados a questões relacionadas com a síndrome de ativação mastocitária publicados nos últimos 10 anos, com particular enfoque em artigos publicados por autores provenientes de centros de referência e em publicações de consenso. Pontualmente, foram utilizados artigos publicados há mais de 10 anos que mantêm relevância no momento atual.
Importância dos mastócitos na resposta inflamatória
Os mastócitos são as principais células efetoras envolvidas nas reações alérgicas agudas. Porém, podem desempenhar outras funções na promoção da angiogênese, imunomodulação, regulação dos mecanismos fibrinolíticos, regeneração de fibras nervosas e promoção da diferenciação osteoclástica6.
Estas células originam-se na medula óssea, sendo provenientes da linhagem hematopoiética (progenitor CD34+/CD117+). Após uma breve fase na circulação sanguínea, diferenciam-se no tecido conjuntivo em geral (inclusivamente nas mucosas), onde adquirem o seu fenótipo específico, na presença de fatores de crescimento locais, incluindo IL-9, IL-10, IL-3, IL-4, IL-33, CXCL12, fator de crescimento neuronal (NGF) e fator de transformação do crescimento (TGF)-β1,3,8. Em termos estruturais, apresentam grânulos que contêm histamina, triptase, heparina, condroitina, sulfatos e outros glicosaminoglicanos8.
Podem ser classificados de diversas formas, nomeadamente tendo por base a concentração granular das proteases de serina triptase e quimase3,9. Os mastócitos cujos grânulos contêm, maioritariamente, triptase (MCT) residem predominantemente nos septos alveolares e na mucosa do intestino delgado, e os que contêm ambas as proteases (MCTC) podem encontrar-se na pele, camadas submucosas do intestino delgado e também no tecido conjuntivo3,9. Os MCT, que se encontram maioritariamente nas mucosas, interagem de forma estreita com os linfócitos T, nomeadamente células Th25. Globalmente, localizam-se nos tecidos, na pele, nos vasos sanguíneos e nas mucosas3.
Receptores de membrana dos mastócitos
Os mastócitos possuem uma diversidade de receptores membranares e citoplasmáticos, o que permite a sua ativação por múltiplos estímulos, como anafilotoxinas (C3a e C5a), IgG, fármacos, veneno de insetos, estímulos físicos (variações de pressão e temperatura), neuropéptidos, citocinas (IL-4Rα, IL-5Rα, IFN-γRα e ST2) e fatores de crescimento endotelial vascular (VEGFR1 e VEGFR2)7. Expressam também receptores para diversos ligandos, como toll-like receptors (TLR), que são ativados por pathogen-associated molecular patterns (PAMPs), estando assim envolvidos na resposta a bactérias, parasitas e vírus10.
A ativação alergênica (mediada por IgE) promove a desgranulação dos mastócitos com libertação de moléculas pré-formadas, como histamina, serotonina, proteases (triptase, quimase, carboxipeptidase) e fator de necrose tumoral (TNF), e a secreção de novo de inúmeros mediadores vasoativos e pró-inflamatórios, incluindo leucotrienos, prostaglandinas, fator ativador de plaquetas (PAF), citocinas (IL-6, IL-9, IL-13) e quimiocinas (CXCL8, CCL2, CCL5)11‑13.
Para além das reações IgE dependentes, nas quais os receptores membranares de alta afinidade para a IgE (FCεRI) dos mastócitos apresentam uma elevada relevância (complexos tetraméricos não covalentes que juntamente com a IgE vão acoplar o antigênio e provocar a ativação mastocitária), temos ainda reações não mediadas pela IgE onde se verifica a ativação do complemento e respectiva desgranulação mastocitária3. Para além destes dois tipos de reações temos ainda as reações não imunológicas, onde se verifica desgranulação direta dos mastócitos mediada pelo receptor MAS-related G Protein-Coupled Receptor-X2 (MRGPRX2)3.
Todos os mastócitos expressam o receptor KIT (CD117), enquanto apenas alguns tipos de mastócitos (por exemplo, os que estão na pele ou no líquido sinovial), expressam o MRGPRX2, que é ativado por neuropéptidos, como a substância P7.
Maturação e regulação de células imunológicas e não imunológicas
Os mastócitos assumem um papel muito diversificado na maturação e na ativação/regulação de várias células, nomeadamente das células dendríticas ou dos linfócitos T e B, através da libertação de numerosos mediadores (histamina, prostaglandinas, leucotrienos, triptase, quimase, carboxipeptidase e numerosas interleucinas) que contêm no seu interior14.
Podem ativar os macrófagos (por intermédio de histamina, IL-13, IL-6, PAF e PGD2), as células dendríticas (após libertação de histamina, PGE2, PGD2, VEGF-C e IL-13), e as células linfoides inatas (ILCs), via IL-1β, IL-9, PGD2 e LTD4. Por outro lado, estimulam as células NK através da libertação de histamina e heparina e também as células T, através da libertação de histamina, LTC4, LTD4 e TNF-α15.
As células endoteliais também sofrem regulação mastocitária, através da libertação de mediadores como histamina, LTC4, LTD4, PGD2, PAF, VEGF-A, IL-13, e IL-1β. O mesmo efeito regulador é exercido sobre células epiteliais brônquicas, células do músculo liso, fibroblastos, ou células endoteliais linfáticas, entre outras, com a libertação de VEGF-C e VEGF-D a promover a angiogênese através da proliferação celular endotelial15.
Estas células, pela sua distribuição, versatilidade de resposta a múltiplos estímulos e diversidade de moléculas que libertam, exercem não só um papel de "sentinela" do sistema imunológico, como de manutenção da homeostasia. Estão envolvidas em diversos processos fisiológicos e patológicos, no âmbito da imunidade inata, autoimunidade, neuroinflamação, imunomodulação e atividade antimicrobiana10,11,16‑20.
Tipos de ativação mastocitária
Os mastócitos estão localizados em tecidos que interagem continuamente com o exterior. Adicionalmente, os mastócitos são também estimulados por um vasto número de diferentes triggers que incluem bactérias, fármacos, alimentação e agentes físicos que originam a secreção de mediadores21. Podemos verificar que existem duas grandes formas de desgranulação dos mastócitos: a primeira designa-se de desgranulação, é um evento rápido e imediato e ocorre após ativação IgE, e a desgranulação saca-bocados que é mais lenta22. Alguns exemplos de triggers de desgranulação dos mastócitos são a acetilcolina, fatores de complemento, fármacos (alguns antibióticos e anestésicos), péptidos como por exemplo a endorfina, endotelina e somatostanina, e estímulos físicos como o calor, frio, pressão, stress e vibração. Os mastócitos também respondem a ativadores não alérgicos através de mediadores que podem ser libertados sem desgranulação. Podem ser identificados como triggers de mastócitos sem desgranulação a CRH (corticotropin-releasing hormone), citoquinas e alguns microrganismos21,22.
Síndrome de ativação mastocitária
A SAM é uma entidade complexa, que se caracteriza pela ocorrência de episódios agudos e graves, de carácter recorrente, cujos sintomas heterogêneos envolvem pelo menos dois sistemas de órgãos, apresentando múltiplos agentes desencadeantes, tendo desafios diagnósticos e terapêuticos importantes. Existem ainda dois tipos de SAM a considerar. A SAM clonal (ou primária) caracteriza-se pela presença de marcadores clonais, como a presença de mutação KITD816V, a expressão anômala de CD25 ou CD2 pelos mastócitos da medula óssea, ou morfologia atípica (ex: fusiforme, binucleada)1,2. A SAM não clonal subdivide-se em dois tipos: o primeiro, que é devido a um estímulo conhecido (SAM secundária), e um segundo cujo estímulo de desgranulação mastocitária é desconhecido (SAM idiopática)23.
A SAM é uma patologia de etiologia complexa, sendo geralmente o seu diagnóstico tardio e desafiante1,2,21. Os doentes podem ter sintomas e sinais que mimetizam doenças cardiovasculares, gastrointestinais, respiratórias ou cutâneas, assim como compatíveis com reações alérgicas e episódios recorrentes de anafilaxia, que pode ser IgE mediada, ou não21.
Fatores desencadeantes e sintomas
Existem diversos estímulos que podem desencadear a desgranulação mastocitária, incluindo alergênios (semelhantes em frequência à população geral), bactérias, vírus, toxoides, alimentos, álcool, fármacos (anti-inflamatórios não esteroides) - AINEs, opiáceos, meios de contraste, entre outros) ou mesmo agentes físicos como pressão, fricção, frio ou calor21. O stress também parece ter um papel importante, assim como as alterações hormonais24‑26.
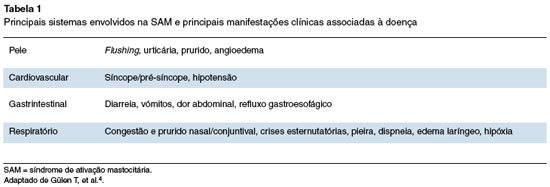
As manifestações típicas de SAM podem incluir urticária aguda, flushing, prurido, dor abdominal, diarreia, dispneia e hipotensão. Nenhuma destas é absolutamente específica, mas o aparecimento simultâneo de um conjunto de sinais e sintomas pertencentes a pelo menos dois órgãos ou sistemas, de forma recorrente, torna o diagnóstico sugestivo4,27.
Na Tabela 1 encontram-se descritas as principais manifestações clínicas da SAM.
Para além das manifestações clínicas referidas acima, é necessário haver evidência laboratorial objetiva de envolvimento mastocitário, nomeadamente com um aumento substancial transitório dos mediadores, e com o controle sintomático com terapêutica farmacológica. Só desta forma será possível diagnosticar uma SAM4.
Existe uma outra constelação de sintomas/patologias que são inespecíficos e que não são parte desta patologia (Tabela 2).
Diagnósticos diferenciais
Estes mesmos sintomas podem estar presentes em outras entidades clínicas, onde se incluem algumas doenças cardiovasculares, endocrinológicas, cutâneas, gastrointestinais e neuropsiquiátricas.
Em geral, a SAM é uma síndrome definida por uma reação sistêmica grave e recorrente (geralmente na forma de anafilaxia), resultante de uma libertação clinicamente significativa de mediadores mastocitários com ação vasodilatadora e pró-inflamatória1,4. Quando não há sinais de anafilaxia, existe uma menor probabilidade deste ser o diagnóstico correto. Para formas menos graves ou localizadas de SAM, (por exemplo, limitado à pele ou ao trato respiratório) que não preencham os critérios de SAM, deverão ser realizadas pesquisas adicionais para avaliar estes pacientes.
Nos últimos anos, foi descrito um tipo específico de SAMnc, a alfa-triptasemia hereditária (HaT). Esta constitui-se como uma patologia de hereditariedade autossômica dominante, com penetrância ainda indeterminada, causada pelo aumento do número de cópias do gene TPSAB14. A sua prevalência ronda 5% a 6% da população geral e resulta em níveis elevados de triptase basal, na sua maioria superiores a 10 ng/mL4. Até dois terços destes doentes podem ter sintomas mínimos ou serem completamente assintomáticos4. Os restantes podem apresentar disautonomia com hipotensão postural ortostática, hipermobilidade articular, urticária vibratória, síndrome do colón irritável, dor musculo-esquelética crônica e uma miríade de manifestações compatíveis com doença alérgica respiratória e/ou cutânea, como dispneia, tosse, sibilos, rinorreia anterior/posterior ou crises esternutatórias4.
Segundo alguns autores, poderá ser recomendável avaliar a presença do gene TPSAB1, para determinar a existência concomitante de HaT nestes doentes. No entanto, em indivíduos com mastocitose ou com alergia a veneno de himenópteros é mandatória a avaliação da presença de HaT4,21,25. Desconhece-se atualmente a percentagem de doentes com SAM clonal e idiopático que apresentem HaT em simultâneo4.
Critérios de diagnóstico
Foram propostos de critérios de diagnóstico de SAM pela Rede Europeia de Competência em Mastocitose (ECNM)4,25,28 e por Molderings e cols. (2020)2,29.
Segundo a ECNM, existem três critérios diagnósticos obrigatórios para os casos suspeitos de SAM: episódios recorrentes e graves com sintomas típicos e sistêmicos de ativação mastocitária, em que dois ou mais órgãos estejam envolvidos; aumento superior a 20% do valor basal de triptase sérica acrescido de um aumento de 2 ng/mL (em relação ao basal) num intervalo de 4 horas após crise sintomática (por exemplo, uma subida de 10 ng/mL para valores acima de 14 ng/mL ou de 30 ng/mL para valores acima de 38 ng/mL); e uma resposta terapêutica favorável à terapêutica antimediadora (ex: anti-histamínicos H1 e H2, agentes estabilizadores da membrana mastocitária, anti-leucotrienos) (Tabela 3)4,25.
A SAM pode ser classificada em 3 subtipos: (1) SAM primária (ou monoclonal) com mutação KITD816V, com ou sem diagnóstico de mastocitose; (2) SAM secundária a uma alergia IgE-dependente, reação de hipersensibilidade ou patologia imunológica passível de induzir ativação mastocitária (ex: Tiroidite de Hashimoto); (3) SAM idiopática em que não se identifica mutação KIT ou outra condição subjacente4,25. Os doentes que apresentam simultaneamente hipersensibilidade dependente da IgE e clonalidade mastocitária podem ser classificados como tendo uma forma de SAM mista4.
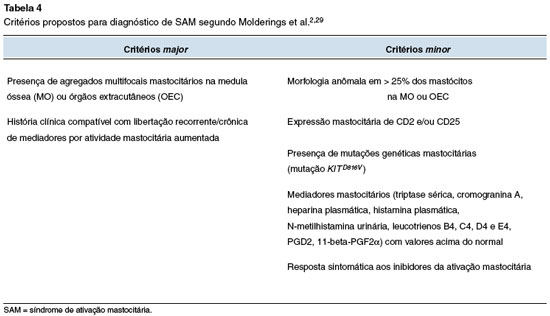
Segundo Molderings e cols., o diagnóstico de SAM envolve critérios major e minor (Tabela 4). Para poder fazer o diagnóstico é necessário cumprir os 2 critérios major, ou, em alternativa, o segundo critério major juntamente com um minor29.
Segundo Molderings e cols., esta patologia poderá inclusivamente atingir 17% da população geral2, o que traduz, na opinião dos autores deste artigo, um sobrediagnóstico da patologia, uma vez que os marcadores sugeridos de diagnóstico apresentam baixa sensibilidade. Por outro lado, para a ECNM, ao incluir uma elevação de mediadores relativamente específicos para os mastócitos, também seria importante definir os respectivos limites. A ECNM considera que os pacientes com sintomas típicos de SAM, mas sem elevação aguda confirmada de biomarcador validado, não devem receber este diagnóstico. Um argumento contra o uso de tais marcadores é também o acesso limitado aos mesmos. Além disso, os pacientes com SAM podem ter episódios demasiadamente seguidos, com sintomatologia praticamente crônica, não sendo possível obter um nível de triptase basal real, que permita a comparação entre estes mesmos episódios4.
No entanto, muitos estados inflamatórios reativos e neoplasias, bem como indivíduos sem sintomas específicos, podem apresentar um aumento mastocitário local sem SAM e sem cumprir os critérios para esta patologia4.
Abordagem geral
A abordagem da SAM envolve a aplicação de medidas profiláticas e terapêuticas para o seu controle. Excluídas outras patologias que possam mimetizar a SAM, é crucial que cada doente conheça e evite os agentes passíveis de desencadear os seus episódios de SAM. No entanto, e tal como acontece na mastocitose, não se preconiza a evicção generalizada destes estímulos potenciais30.
Existe, porém, uma variedade considerável de estímulos, nomeadamente exposição a temperaturas extremas ou variações de temperatura, exposição solar excessiva, stress emocional, privação de sono, estímulos físicos, álcool e fármacos suscetíveis. Os AINEs, opioides, agentes anestésicos e meios de contraste iodados podem também desencadear episódios de SAM31,24.
Para o tratamento da mastocitose, é usual recomendarem-se esquemas de pré-medicação. Apesar de ainda não estarem igualmente protocolados para a SAM, os doentes na prática cumprem esquemas de pré-medicação em certas condições, nomeadamente antes de procedimentos invasivos (cirúrgicos e diagnósticos), exames radiológicos com contraste, procedimentos dentários e vacinação. Os esquemas incluem geralmente anti-histamínicos anti-H1 e anti-H2, antagonistas dos leucotrienos, benzodiazepinas e prednisolona, consoante os casos1,30.
De referir que o nível de evidência é baixo e baseado na opinião de alguns especialistas, e que qualquer esquema a instituir deverá ser cuidadosamente adaptado ao doente e revisto pela equipa médica antes do seu início30.
Tratamento farmacológico
O controle farmacológico depende da utilização de diferentes agentes, de forma isolada ou combinada, de acordo a intensidade, gravidade e o tipo de sintomas de cada doente. Os anti-histamínicos (anti-H1) de 2ª geração são os principais agentes farmacológicos a utilizar nestas situações. Quando necessário, a sua dose habitual pode ser quadriplicada, sem efeitos secundários significativos. Existem casos reportados de doentes que têm de tomá-los de forma crônica1,25.
Existem poucos estudos para suportar a escolha e a dose do anti-H1. A desloratadina e o cetotifeno mostraram propriedades na estabilização dos mastócitos31. A rupatadina exerce um efeito antagonista no receptor do PAF, mediador envolvido na hipotensão episódica e flushing, e associou-se a uma melhoria da qualidade de vida e de sintomas em doentes com mastocitose e sintomas de SAM32,33. Tanto a rupatadina como a levocetirizina, em menor extensão, mostraram ter um efeito inibidor da FAP na desgranulação dos mastócitos, o que não se verifica com a desloratadina31‑35.
Os antagonistas dos receptores H2, como a famotidina ou a cimetidina são úteis particularmente na sintomatologia gastrointestinal dispéptica, dor abdominal, diarreia e nos episódios recorrentes graves28.
Os antagonistas dos receptores dos leucotrienos, como o montelucaste, mostraram ser úteis no controle de sintomas respiratórios, cutâneos e gastrointestinais1,28,36.
O ácido acetilsalicílico (AAS) pode ajudar no controle do flushing e da hipotensão em casos selecionados, com tolerância conhecida ao fármaco. No passado era considerado no tratamento dos casos de anafilaxia em doentes com MS, mas as doses necessárias para bloquear a ativação mastocitária eram elevadas e nem sempre toleradas27,36. Foi ainda relatado o caso de um doente com mastocitose, cuja ação do celecoxibe constituiu uma opção viável na diarreia intratável36. Os corticosteroides sistêmicos são um recurso reservado aos indivíduos com sintomas refratários28.
A terapêutica com anticorpo monoclonal anti-IgE, omalizumabe, tem-se revelado eficaz e com um bom perfil de segurança em doentes com SAM secundário, que têm subjacente uma alergia IgE-dependente, particularmente anafilaxia refratária à terapêutica convencional, bem como em SAM primário e idiopático37. Um estudo francês, incluindo 55 doentes diagnosticados com SAM com sintomas persistentes, tratados com omalizumabe ao longo de 3 anos, mostrou uma resposta em 78% dos doentes (mantida pelo menos 3 meses em 77% destes), e uma taxa de resposta no último follow-up em 58% dos doentes37.
Os doentes com reações compatíveis com anafilaxia devem ser portadores de dispositivos de autoadministração injetável de adrenalina, eventualmente duas unidades. Estes doentes têm tendência a desenvolver formas mais graves de anafilaxia, potencialmente fatais, especialmente em doentes com alergia a veneno de insetos (himenópteros)30,38.
Perante anafilaxia induzida por veneno de himenópteros (IgE-dependente), neste caso SAM secundário, deve ser recomendada imunoterapia específica para o veneno (VIT) em causa, e que deve ser mantida ao longo da vida, uma vez que existe persistência de reações graves em caso de interrupção39.
A VIT demonstrou eficácia em doentes com MS que apresentam reações IgE mediadas, apesar de saber-se que existe um risco acrescido de reações adversas nos doentes com MS submetidos a tratamento com VIT, em comparação com a população em geral39. Desta forma, o omalizumabe poderá ser bastante útil na redução dos efeitos adversos associados e facilitando a subida até à dose de manutenção da VIT39.
A vacinação contra a COVID-19 é recomendada de um modo geral nos indivíduos com SAM, bem como nos indivíduos com mastocitose. A única exceção a considerar é quando se verifica uma alergia suspeita ou conhecida a um dos constituintes da vacina. Os doentes poderão ter de fazer pré-medicação de acordo com o risco individual e deverão ficar em período de vigilância após tomarem a vacina, tal como a restante população no geral40.
Considerações finais
A Síndrome de Ativação Mastocitária (SAM) é uma entidade complexa, de prevalência desconhecida41, que se caracteriza pela ocorrência de episódios agudos e graves, de caráter recorrente, cujos sintomas heterogêneos envolvem pelo menos dois sistemas de órgãos, apresentando múltiplos agentes desencadeantes, tendo desafios diagnósticos e terapêuticos importantes.
Existem vários diagnósticos diferenciais que deverão ser cautelosamente avaliados antes de diagnosticar a SAM, nomeadamente a α-triptasémia hereditária. Um diagnóstico incorreto de SAM pode afetar o doente, atrasando o tratamento adequado e, consequentemente, prejudicando a sua qualidade de vida e o prognóstico. Na maioria dos casos, a elevação da triptase sérica durante os eventos confirma o envolvimento mastocitário.
Atualmente existem duas propostas para o diagnóstico de SAM. A primeira, estabelecida pela ECNM, apresenta critérios diagnósticos mais robustos e específicos. A outra proposta, de Molderings e cols., apresenta critérios mais abrangentes e que não foram validados no contexto particular de SAM, podendo apresentar o sério risco de sobrediagnóstico da patologia. Atualmente, verifica-se que existem muitos doentes diagnosticados com SAM, mas que não apresentam envolvimento comprovado de ativação mastocitária.
Recentemente, foi sugerido que esta patologia tinha sido identificada num número significativo de doentes com COVID-19. O receio da comunidade científica é que estes doentes identificados estejam na verdade a atrasar o seu verdadeiro diagnóstico, de acordo com os critérios estabelecidos no consenso de Viena pela ECNM.
A abordagem terapêutica de SAM passa pela utilização de anti-histamínicos anti-H1 de 2ª geração, antagonistas dos receptores H2, montelucaste, corticoides, omalizumabe (anti-IgE), e terapêuticas dirigidas aos mastócitos. O controle sintomático depende ainda da identificação e evicção criteriosa dos desencadeantes.
A terapêutica inicial pode ser aplicada antes do diagnóstico definitivo de SAM, sendo a resposta um dado útil para suportar o diagnóstico. De acordo com o tipo e a gravidade da síndrome, pode ser necessário combinar terapêuticas, incluindo terapêutica anti-IgE e terapêutica dirigida.
O diagnóstico de SAM continua a ser complexo, multidisciplinar e exigente. No futuro será importante a descoberta de novos biomarcadores que permitam ao médico distinguir claramente a SAM de outras patologias mimetizadoras.
Referências
1. Castells M, Butterfield J. Mast Cell Activation Syndrome and Mastocytosis: Initial Treatment Options and Long-Term Management. J Allergy Clin Immunol Pract. 2019;7:1097-106.
2. Afrin LB, Ackerley MB, Bluestein LS,Brewer JH, Brook JB, Molderings G, et al. Diagnosis of mast cell activation syndrome: a global "consensus-2". De Gruyter. 2020:1-16.
3. Adkinson N, Bochner B, Burks AW, Busse WW, Holgate ST, Lemanske RF, et al. Middleton's Allergy: principles and practices. 8ª ed. Elsevier Inc.; 2013. p. 1896.
4. Gülen T, Akin C, Bonadonna P, Siebenhaar F, Broesby-Olsen S, Brockow K, et al. Selecting the Right Criteria and Proper Classification to Diagnose Mast Cell Activation Syndromes: A Critical Review. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3918-28.
5. Valent P, Akin C, Escribano L, Fodinger M, Hartmann K, Brockow K, et al. Standards and standardization in mastocytosis: consensus statements on diagnostics, treatment recommendations and response criteria. Eur J Clin Invest. 2007;37:435-53.
6. Alvarez-Twose I, Jara-Acevedo M, Morgado JM, Garcia-Montero A, Sanchez-Munoz L, Teodosio C, et al. Clinical, immunophenotypic, and molecular characteristics of well-differentiated systemic mastocytosis. J Allergy Clin Immunol. 2016;137:168-78.
7. Varricchi G, Raap U, Rivellese F, Marone G, Gibbs BF. Human mast cells and basophils. How are they similar, how are they different? Immunol Rev. 2018;282(1):8-34.
8. Reber LL, Sibilano R, Mukai K, Galli SJ. Potential effector and immunoregulatory functions of mast cells in mucosal immunity. Mucosal Immunol. 2015;8(3):444-63.
9. Gri G, Frossi B, D'Inca F, Danelli L, Betto E, Mion F, et al. Mast cell: an emerging partner in immune interaction. Front Immunol. 2012;3:120-2.
10. Abraham SN, St John AL. Mast cell-orchestrated immunity to pathogens. Nat Rev Immunol. 2010;10:440-52.
11. da Silva EZ, Jamur MC, Oliver C. Mast cell function: a new vision of an old cell. J Histochem Cytochem. 2014;62:698-738.
12. Migalovich-Sheikhet H, Friedman S, Mankuta D, Levi-Schaffer F. Novel identified receptors on mast cells. Front Immunol. 2012;3:238‑42.
13. Gilfillan AM, Beaven MA. Regulation of mast cell responses in health and disease. Crit Rev Immunol. 2011;31(6):475-529.
14. Halova I, Draberova L, Draber P. Mast cell chemotaxis-chemoattractants and signaling pathways. Front Immunol. 2012;3:119.
15. Varricchi G, Rossi FW, Galdiero MR, Granata F, Criscuolo G, Spadaro G, et al. Physiological Roles of Mast Cells: Collegium Internationale Allergologicum Update 2019. Int Arch Allergy Immunol. 2019;17:247-61.
16. Galli SJ, Borregaard N, Wynn TA. Phenotypic and functional plasticity of cells of innate immunity: macrophages, mast cells and neutrophils. Nat Immunol. 2011;12:1035-44.
17. Rottem M, Mekori YA. Mast cells and autoimmunity. Autoimmun Rev. 2005;4:21-7.
18. Bachelet I, Levi-Schaffer F, Mekori YA. Mast cells: not only in allergy. Immunol Allergy Clin North Am. 2006;26:407-25.
19. Theoharides TC, Tsilioni I, Bawazeer M. Mast Cells, Neuroinflammation and Pain in Fibromyalgia Syndrome. Front Cell Neurosci. 2019;13:353.
20. Galli SJ, Grimbaldeston M, Tsai M. Immunomodulatory mast cells: negative, as well as positive, regulators of immunity. Nat Rev Immunol. 2008;8:478-86.
21. Theoharides T, Tsilionia I, Rene H. Recent advances in our understanding of mast cell activation - or should it be mast cell mediator disorders? Expert Rev Clin Immunol. 2019;15(6):639‑56.
22. Flores JA, Balseiro-Gomez S, Ales E. Emerging Roles of Granule Recycling in Mast Cell Plasticity and Homeostasis. Crit Rev Immunol. 2016;36(6):461-84.
23. Weiler CR. Mast Cell Activation Syndrome: Tools for Diagnosis and Differential Diagnosis. J Allergy Clin Immunol Practice. 2019;8:498‑507.
24. Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, et al. Definitions, criteria and global classification of mast cell disorders with special reference to mast cell activation syndromes: a consensus proposal. Int Arch Allergy Immunol. 2012;157:215-25.
25. Valent P, Akin C, Bonadonna P, Hartmann K, Brockow K, Niedoszytko M. Proposed Diagnostic Algorithm for Patients with Suspected Mast Cell Activation Syndrome. J Allergy Clin Immunol Pract. 2019;7(4):1125-33.
26. Akin C, Valent P, Metcalfe DD. Mast cell activation syndrome: proposed diagnostic criteria. J Allergy Clin Immunol. 2010;126:1099‑104.
27. Valent P, Akin C, Nedoszytko B, Bonadonna P, Hartmann K, Niedoszytko M, et al. Diagnosis, Classification and Management of Mast Cell Activation Syndromes (MCAS) in the Era of Personalized Medicine. Int J Mol Sci. 2020;21:9030.
28. Valent P, Akim C, Hartmann K, Alvarez-Twose I, Brockow K, Hermine O. Updated Diagnostic Criteria and Classification of Mast Cell Disorders: A Consensus Proposal. Hemasphere. 2021;13,5(11):e646.
29. Afrin LB, Butterfield JH, Ralthel M, Molderings GJ. Often seen, rarely recognized: mast cell activation disease - a guide to diagnosis and therapeutic options. Ann Med. 2016;48:190-201.
30. Rama TA, Moreira A, Delgado L. Abordagem diagnóstica e terapêutica das mastocitoses - Uma proposta de orientação clínica. Rev Port Imunoalergologia. 2020;28(1):31-49.
31. Nurmatov UB, Rhatigan E, Simons FE, Sheikh A. H1-antihistamines for primary mast cell activation syndromes: a systematic review. Allergy. 2015;70:1052-61.
32. Siebenhaar F, Fortsch A, Krause K, Weller K, Metz M, Magerl M, et al. Rupatadine improves quality of life in mastocytosis: a randomized, double-blind, placebo-controlled trial. Allergy. 2013;68:949-52.
33. Mullol J, Bousquet J, Bachert C, Canonica GW, Gimenez-Arnau A, Kowalski ML, et al. Update on rupatadine in the management of allergic disorders. Allergy. 2015;70 Suppl 100:1-24.
34. Mullol J, Muñoz-Cano R, Torres-Atencio I, Ainsua E, Martin M, Sanchez-Lopez J, et al. Platelet activating factor-induced mast cell degranulation is inhibited by rupatadine, and to a lower extent by levocetirizine and desloratadine, in a mast cell line (LAD-2). Clin Transl Allergy. 2013;3(Suppl 2):O6.
35. Weller K, Maurer M. Desloratadine Inhibits Human Skin Mast Cell Activation and Histamine Release. J Invest Dermatol. 2009;129:2723-6.
36. Matito A, Escribese MM, Longo N, Mayorga C, Luengo-Sánchez O, Pérez-Gordo M, et al.; Comité de Inmunología de la Sociedad Española de Alergología e Inmunología Clínica (SEAIC). Clinical Approach to Mast Cell Activation Syndrome: A Practical Overview. J Investig Allergol Clin Immunol. 2021;31(6):461-70.
37. Lemal R, Fouquet G, Terriou L, Vaes M, Livideanu CB, Frenzel L, et al. Omalizumab Therapy for Mast Cell-Mediator Symptoms in Patients with ISM, CM, MMAS, and MCAS. J Allergy Clin Immunol Pract. 2019;7:2387-95.
38. Giannetti A, Filice E, Caffarelli C, Ricci G, Pession A. Mast Cell Activation Disorders. Medicina (Kaunas). 2021;57:124.
39. González-de-Olano D, Padial-Vilchez MA, Núñez-Acevedo B, de-Calzada-Bustingorri MP, de-Andrés-Martín A, Caldas C, et al. Usefulness of Omalizumab and Sting Challenge Test in Hymenoptera Venom Allergy and Mastocytosis. J Investig Allergol Clin Immunol. 2019;29:318-20.
40. Bonadonna P, Brockow K, Niedoszytko M, Gulen T, Hartmann K, Valent P. COVID-19 Vaccination in Mastocytosis: Recommendations of the European Competence Network on Mastocytosis (ECNM) and American Initiative in Mast Cell Diseases (AIM). J Allergy Clin Immunol. 2021;9(6):2139-44.
41. Leru PM, Anton VF, Ureche C, Zurac S, Bratu O, Neagoe CD. Mast cell activation syndromes - evaluation of current diagnostic criteria and laboratory tools in clinical practice. Exp Ther Med. 2020;20(3):2348‑51.