Número Atual: Janeiro-Março 2023 - Volume 7 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Ana Karolina Barreto Berselli Marinho
- Adriana Azoubel Antunes
- Bianca Noleto Ayres Guimarães
- Clarissa Morais Busatto Gerhardt
- Claudia França Cavalcante Valente
- Claudia Leiko Yonekura Anagusko
- Emanuel Sarinho
- Fátima Rodrigues Fernandes
- Gilberto Saciloto
- Gisele Feitosa Zuvanov Casado
- Irma Cecilia Douglas Paes Barreto
- Ronney Corrêa Mendes
- Mônica de Araújo Álvares da-Silva
- Aluce Loureiro Ouricuri
- Lorena de Castro Diniz
ARTIGO ESPECIAL
Reações de hipersensibilidade a vacinas
Hypersensitivity reactions to vaccines
Ana Karolina Barreto Berselli Marinho1; Adriana Azoubel Antunes2; Bianca Noleto Ayres Guimarães3; Clarissa Morais Busatto Gerhardt4; Claudia França Cavalcante Valente5; Claudia Leiko Yonekura Anagusko1; Emanuel Sarinho6; Fátima Rodrigues Fernandes7; Gilberto Saciloto8; Gisele Feitosa Zuvanov Casado9; Irma Cecilia Douglas Paes Barreto10; Ronney Corrêa Mendes11; Mônica de Araújo Álvares da-Silva5; Aluce Loureiro Ouricuri12; Lorena de Castro Diniz13
1. Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Serviço de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
2. Faculdade de Ciências Médicas, Universidade de Pernambuco, Centro de Ciências Médicas - UFPE e Centro de Pesquisas em Alergia e Imunologia - CPAI - Recife, PE, Brasil
3. Secretaria Municipal de Saúde, Hospital Municipal Rocha Maia, Centro de Referência para Imunobiológicos Especiais - Rio de Janeiro, RJ, Brasil
4. Instituto da Criança, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo (HC-FMUSP), Divisão de Alergia e Imunologia, Departamento de Pediatria - São Paulo, SP, Brasil
5. Hospital da Criança de Brasília José Alencar, Setor de Alergia e Imunologia - Brasília, DF, Brasil
6. Universidade Federal de Pernambuco, Programa de Pós-Graduação em Saúde da Criança e do Adolescente (PPGSCA) - Recife, PE, Brasil
7. Hospital Infantil Sabará, Fundação José Luiz Egydio Setúbal, Instituto PENSI - São Paulo, SP, Brasil
8. Clínica de Alergia e Imunologia - Guarapuava, PR, Brasil
9. Clínica ImunoSim - Maceió, AL, Brasil
10. Centro Universitário do Estado do Pará (CESUPA), Departamento de Pediatria, Serviço de Alergia e Imunologia Pediátrica - Belém, PA, Brasil
11. Clínica Alergocenter Vacinação - São Luís, MA, Brasil
12. Hospital dos Servidores do Estado do Rio de Janeiro - Rio de Janeiro, RJ, Brasil
13. Centro de Referência para Imunobiológicos Especiais - CRIE - Goiânia, GO, Brasil
Endereço para correspondência:
Ana Karolina Barreto Berselli Marinho
E-mail: ana.marinho@hc.fm.usp.br
Submetido em: 28/11/2022
Aceito em: 11/02/2023
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
O desenvolvimento e a ampliação do uso das vacinas durante décadas contribuíram para o controle e erradicação de doenças infecciosas, causando um grande impacto na saúde pública no mundo. A análise de segurança das vacinas percorre criteriosos processos e fases dos estudos clínicos, um dos pilares essenciais para aprovação regulatória e utilização do produto na população. O evento supostamente atribuído à vacinação e imunização (ESAVI), terminologia atual, é definido como qualquer ocorrência médica indesejada após a vacinação que possui, ou não, uma relação causal com o uso de uma vacina ou outro imunobiológico. Cabe ressaltar que eventos adversos mais raros ou inesperados, incluindo os eventos de hipersensibilidade, poderão ocorrer na fase pós-comercialização, quando as vacinas são aplicadas em milhões de pessoas. Neste artigo, serão discutidos os principais aspectos relacionados aos eventos adversos de hipersensibilidade pós-vacinais de interesse do especialista, e os desafios frente ao reconhecimento do agente causal e conduta a ser adotada. Além disso, serão revisados os potenciais alérgenos presentes nas vacinas de uso rotineiro para auxiliar o profissional de saúde na identificação de pacientes com potencial de risco de ESAVI por tais componentes. A atualização do conhecimento acerca da segurança e dos benefícios das vacinas pelos profissionais de saúde, sobretudo em populações especiais, contribui para condutas em imunização mais apropriadas, reduzindo o risco de exposição a um possível alérgeno em pessoas comprovadamente alérgicas às vacinas ou a alguns dos seus componentes, além de evitar contraindicações desnecessárias em eventos coincidentes ou não graves.
Descritores: Hipersensibilidade, vacinas, imunização.
Introdução
A vacinação é uma das ações de saúde pública mais exitosas, tendo contribuído para a redução da incidência das doenças imunopreveníveis no Brasil, através da obtenção de altas coberturas vacinais1.
As vacinas disponíveis na rede pública e privada no Brasil passaram por diversos testes clínicos de eficácia e segurança antes de serem aprovadas pelos órgãos regulatórios para uso na população, no entanto, eventos supostamente atribuídos a vacinação e imunização podem ocorrer2,3.
O evento supostamente atribuído à vacinação e imunização (ESAVI) é definido como qualquer ocorrência médica indesejada após a vacinação que possui, ou não, uma relação causal com o uso de uma vacina ou outro imunobiológico (imunoglobulinas e soros heterólogos). Qualquer evento indesejável ou não intencional, como por exemplo, sintoma, doença ou um achado laboratorial anormal, pode ser classificado como ESAVI4,5. Um ESAVI pode ser causado por vários fatores: (1) fatores relacionados à vacina: incluindo o tipo (atenuada ou inativada), a cepa, o meio de cultura dos microrganismos, o processo de inativação ou atenuação, adjuvantes, estabilizadores ou substâncias conservadoras, o lote da vacina; (2) fatores relacionados aos vacinados: idade, sexo, número de doses e doses anteriores da vacina, eventos adversos às doses prévias, doenças concomitantes, doenças alérgicas, autoimunidade, deficiência imunológica; (3) fatores relacionados à administração: agulha e seringa, local de inoculação, via de inoculação (vacinação intradérmica, subcutânea ou intramuscular)5.
A experiência acumulada ao longo do desenvolvimento do Programa Nacional de Imunizações (PNI) permitiu o acúmulo de conhecimentos sobre os ESAVI que podem ser classificados em esperados e inesperados, tendo em vista a natureza e características do imunobiológico. Entre os eventos esperados, pode haver eventos relativamente triviais, como febre, dor e edema local, ou eventos graves, como convulsões febris, episódio hipotônico-hiporresponsivo (EHH), anafilaxia, etc. Os eventos inesperados são aqueles não identificados anteriormente, como no caso da vacina rotavírus rhesus/humana (invaginação intestinal), ou mesmo com vacinas de uso mais antigo, como por exemplo, visceralização e falência múltipla de órgãos, raramente observada após a vacina contra febre amarela (FA). Ainda dentre os eventos inesperados estão aqueles decorrentes de problemas ligados à qualidade do produto, como contaminação de lotes que podem provocar abscessos locais, ou teor indevido de endotoxina em certas vacinas, levando a reações febris e sintomatologia semelhante a sepse5.
Os eventos adversos também podem ocorrer coincidentemente após as vacinas e não ter relação direta com o seu efeito biológico (ou seja, ocorreriam mesmo na ausência de vacinação)6.
Os ESAVI podem se apresentar de forma grave ou não grave. Os eventos adversos graves (EAG) são aqueles que requerem hospitalização por mais de 24 horas ou prolongamento de hospitalização já existente, disfunção significativa e/ou incapacidade persistente, resultam em anomalia congênita, causam risco de morte e/ou causa o óbito. Os eventos adversos não graves são qualquer outro evento que não esteja incluído nos critérios de EAG5.
Outra característica dos eventos é a forma como as reações se manifestam, podendo ser locais ou sistêmicas. Após a administração de algumas vacinas é comum ocorrerem reações locais como edema, hiperemia e sensibilidade no local da injeção. Estes sintomas não são contraindicações para vacinações subsequentes7. As reações sistêmicas são em sua maioria leves e podem variar desde febre, mialgia, irritabilidade, anorexia, sonolência, choro persistente, cefaleia, até eventos moderados e graves (raros) como anafilaxia, convulsões, episódio hipotônico-hiporresponsivo, doença viscerotrópica aguda e doença neurológica aguda.
Neste artigo, serão discutidos os principais aspectos relacionados aos eventos adversos de hipersensibilidade pós-vacinais de interesse do especialista e desafios frente ao reconhecimento do agente causal e manejo ao paciente. Além disso, revisaremos os principais alérgenos presentes nas vacinas de uso rotineiro para auxiliar a identificação de pacientes com potencial de risco de ESAVI por tais componentes.
Reações de hipersensibilidade do tipo I
As reações de hipersensibilidade do tipo I são mediadas por anticorpos IgE pré-formados contra componentes da vacina. Raramente ocorrem, mas são considerados eventos adversos potencialmente graves que requerem investigação e compreensão da relação risco versus benefício para a administração de doses subsequentes7. Podem ocorrer após qualquer vacina ou soro, especialmente os de origem não humana (equina).
Tipicamente, as reações podem ocorrer imediatamente ou em até 4 horas após a exposição ao alérgeno e podem se manifestar com sintomas cutâneos ou sistêmicos (anafilaxia)7,8. A taxa estimada de anafilaxia varia de 1 para 100.000 a 1 para 1.000.000 de doses para a maioria das vacinas comumente administradas9‑11. Um estudo avaliou os casos de anafilaxia reportados no sistema de notificação de eventos adversos dos Estados Unidos no período de 1990 a 2016, e identificou 8 casos fatais, dos quais 4 não tinham história pessoal de hipersensibilidade12.
Outro estudo demonstrou a incidência de anafilaxia para vacinas de 1,31 casos para cada 1.000.000 de doses de vacinas aplicadas (95% CI - 0,90 - 1,84). Embora a anafilaxia seja uma reação potencialmente grave, pode ser tratada com um desfecho sem sequelas ou fatalidades8.
Durante a investigação de uma reação alérgica à vacina, é fundamental uma anamnese detalhada para excluir que a reação não estava associada a outras etiologias não relacionadas aos componentes vacinais (por exemplo, exposição ao látex em pacientes alérgicos, uso de anti-inflamatórios).
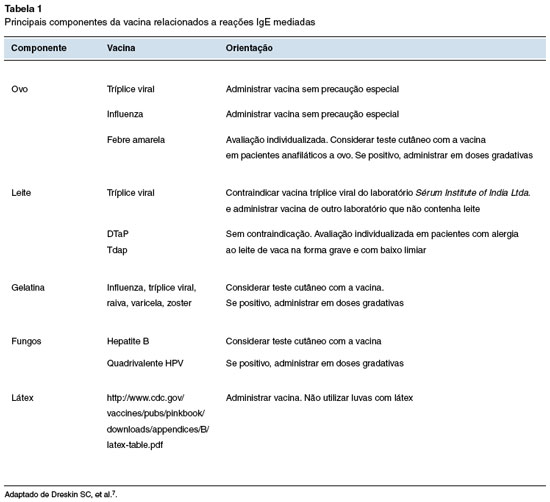
A principal causa de reação adversa imediata à vacina é a gelatina. Outros constituintes presentes em determinadas vacinas também podem ser implicados em reações, como antígenos vacinais, proteínas carreadoras, ovo, leite, leveduras, látex, antimicrobianos e polietilenoglicol8,13. As reações alérgicas a vacinas podem ser decorrentes do componente ativo (o antígeno) ou componentes adicionais7,8. Os antígenos das vacinas contêm o microrganismo inteiro ou partes dele, toxinas inativadas (toxoide) ou ambos, e tem a função de induzir resposta imunológica protetora. Esses antígenos raramente são a causa das reações de hipersensibilidade. Geralmente, a causa da hipersensibilidade à vacina está relacionada aos componentes adicionais utilizados8. A Tabela 1 resume os principais componentes da vacina que podem causar reações IgE mediadas.
Componentes das vacinas e reações de hipersensibilidade imediata
Ovo
Algumas vacinas comumente usadas contêm pequenas quantidades residuais de proteína de ovo (ovalbumina) decorrente do processo de manufatura. As concentrações de ovalbumina geralmente são mais altas em vacinas cultivadas em ovos embrionados de galinha (vacina contra influenza, febre amarela e raiva) e menor em vacinas cultivadas em fibroblasto de embrião de galinha (vacina contra sarampo, caxumba e rubéola - tríplice viral)8.
A vacina tríplice viral é considerada segura para pacientes alérgicos a ovo, já que contém quantidades mínimas de proteína, que não são capazes de gerar resposta alérgica7,13,14. Diversos estudos comprovaram a segurança da vacina em pacientes alérgicos ao ovo e não há contraindicação ao seu uso7,14,15. A maioria das reações anafiláticas da vacina tríplice viral foram atribuídas à alergia a gelatina7.
A vacina influenza já foi considerada contraindicação aos alérgicos a ovo por muitos anos, porém atualmente sabe-se que essa vacina também é segura nesse perfil de pacientes. Uma revisão de 28 estudos que administraram vacina influenza em 4.315 pacientes alérgicos a ovo, sendo que 656 tinham antecedente de anafilaxia a ovo, mostrou que não houve reações graves com a vacina16. Além disso, nos estudos que continham pacientes controles, não alérgicos a ovo, a taxa de reação leve foi semelhante aos alérgicos16. Portanto, a recomendação atual é que a vacina influenza pode ser realizada em pacientes alérgicos o ovo7,8.
A vacina da febre amarela contém quantidades maiores de proteína e a avaliação da indicação ou não, deve ser realizada com cautela. A vacina da febre amarela não é aquecida em nenhum momento de seu processo de fabricação, por isso mesmo o paciente que tolera o ovo cozido/frito pode apresentar reação à vacina17. Um estudo brasileiro avaliou o perfil de segurança na aplicação da vacina em pacientes alérgicos ao ovo. No protocolo do estudo, todos pacientes foram submetidos ao teste de puntura (prick-test) com a vacina na apresentação pura. Se negativo, era realizado o teste intradérmico (ID) com a vacina na diluição de 1:100. Se o teste ID fosse negativo, a vacina era aplicada em dose plena. Se o teste de puntura ou ID fosse positivo, a vacina era aplicada de forma fracionada, segundo o protocolo de dessensibilização. No estudo, todos os 58 pacientes tiveram teste de puntura negativo e 10 apresentaram ID positivo e foram dessensibilizados. Desses 10 pacientes, 4 não apresentaram reações de hipersensibilidade, 4 apresentaram reações locais (urtica no local da aplicação) e 2 apresentaram urticária com sintomas subjetivos. Dos outros 48 pacientes com teste ID negativo, nenhum teve reação à vacina que foi feita em única aplicação18. Portanto, pacientes alérgicos a ovo com indicação de vacina contra a febre amarela devem ser encaminhados para o especialista para a avaliação através de testes cutâneos e para a avaliação de necessidade de dessensibilização18.
Leite
Pacientes com alergia ao leite de vaca (ALV) não devem usar a vacina tríplice viral do laboratório Sérum Institute of India Ltda. que pode conter alfa-lactoalbumina. Estudos no Brasil e no Chile reportaram casos de reações alérgicas após exposição a essa vacina nesse perfil de pacientes19,20. No Chile, foi relatado uma série de 9 casos de reações de hipersensibilidade imediata após a vacina tríplice viral em pacientes alérgicos ao leite. Todos tinham o diagnóstico de ALV antes da aplicação da primeira dose da vacina tríplice viral, porém nenhum desses pacientes tinha antecedente de anafilaxia. Todos os casos ocorreram em menos de 2 horas da aplicação da vacina tríplice viral do laboratório Sérum Institute of India Ltda., sendo que 6 tiveram anafilaxia, 2 casos apresentaram apenas manifestações respiratórias e 1 caso apenas manifestação cutânea20. Portanto, pacientes com ALV que têm indicação dessa vacina devem realizar a vacina tríplice viral provenientes de outros laboratórios, que não contenham proteínas do leite.
As proteínas do leite podem ser usadas como meio de crescimento das vacinas difteria tétano-coqueluche (DTaP e Tdap). Uma série de casos com 8 pacientes com ALV grave reportou reações anafiláticas com vacinas DTPa ou dTpa. No estudo, foi identificado que essas vacinas continham derivados da caseína, que potencialmente poderiam justificar as reações imediatas graves nos pacientes com ALV21. Porém, a metodologia utilizada para a identificação de causalidade das reações descritas é controversa. Sendo assim, de acordo com uma posição da EAACI, a vacinação com as vacinas DTaP e Tdap não contribuem para a patogênese de doenças alérgicas, e a atopia não é uma contraindicação para o uso destas vacinas22.
Dessa forma, pacientes com ALV IgE mediada, especialmente os pacientes com a forma grave e com baixo limiar para o desenvolvimento de reações, devem estar atentos a medicações e vacinas que potencialmente podem ter traços ou mínimas quantidades de proteína do leite de vaca. Nestes casos, recomenda-se uma avaliação individual de risco e a vacinação sob supervisão pode ser indicada.
Gelatina
A gelatina é adicionada à vacina como estabilizante, na maioria das vezes, em vacinas de vírus atenuado, e é a principal responsável pelas reações alérgicas7. Estudos demonstraram que a gelatina era o agente desencadeador de reações anafiláticas à vacina tríplice viral23‑25 e varicela26,27.
Deve-se avaliar a história prévia de reação à gelatina antes de indicar vacinas que contenham este componente, porém o fato de não ter esse antecedente não exclui a possibilidade de ter reação a esse tipo de vacina, já que a ingestão da gelatina permite a digestão da gelatina em fragmentos de peptídeos menos alergênicos7. Pacientes com alergia ao alfa-gal também devem ser avaliados com cautela8.
Pacientes com história prévia de alergia após a ingestão de gelatina ou a uma vacina que contenha gelatina e que tenham indicação de realizar vacina que contenha este componente devem ser investigados. Pode-se realizar a dosagem de IgE específica para gelatina, prick-test com a vacina pura e, se negativo, teste ID com a vacina diluída a 1:1007. Se os testes cutâneos forem negativos, a vacina pode ser realizada da forma usual em dose única e deve-se manter o indivíduo vacinado em observação por 30 a 60 minutos. Se os testes cutâneos forem positivos, pode-se realizar um esquema de doses fracionadas em ambiente preparado para atendimento de anafilaxia7.
Fungos
No processo de fabricação de vacinas como a hepatite B, HPV e um dos tipos de meningocócica conjugada, os antígenos são proteínas recombinantes expressas em Saccharomyces cerevisiae8. Em um estudo de revisão, DiMiceli e cols. identificaram 180.895 eventos adversos, sendo 15 relatos de anafilaxia provável ou possível após vacinação em pacientes com história de alergia a fungos. Desses pacientes, 11 tinham recebido vacina de hepatite B que continham traços de proteína de levedura, porém nesses casos não foram realizados testes para comprovar sensibilização à proteína em questão28. Portanto, reações alérgicas a vacina suspostamente causadas por leveduras ou fungos são muito raras. Em alguns casos, pode-se considerar a avaliação de testes cutâneos em pacientes com antecedente de alergia S. cerevisiae e se positivo, considerar a administração supervisionada com doses fracionadas da vacina que possa conter a levedura8.
Látex
A exposição ao látex durante a vacinação pode estar relacionada à embalagem do frasco ou da seringa da vacina, porém casos de reações alérgicas devido a esse contato são extremamente raras. Diferente de balões e luvas, em que o alérgeno do látex pode ser facilmente eluído, não é possível eluir este componente das embalagens de vacinas. Portanto, a recomendação é que a aplicação de vacinas em pacientes alérgicos a látex seja realizada com luvas sem látex (latex free)7. Em caso de vacinas com a apresentação multidoses, uma sugestão é a administração da primeira dose do frasco ao paciente alérgico ao látex.
Antimicrobianos
No processo de produção de vacinas, alguns antimicrobianos, como gentamicina, tetraciclina, neomicina, estreptomicina e polimixina B, são usados para prevenir crescimento bacteriano ou fúngico. No processo de purificação, a maioria desses agentes antimicrobianos são removidos, mas traços desses agentes podem estar presentes em algumas vacinas, porém raramente causam reações sistêmicas. Pessoas com história de alergia grave (anafilaxia) a agentes antimicrobianos contidos em alguma vacina poderão ter uma conduta de imunização individualizada, podendo ser considerada a substituição do imunógeno ou a vacinação sob supervisão8.
Polietilenoglicol (PEG) e Polissorbato 80 (PS80)
O polietilenoglicol, utilizado como estabilizante em formulações de medicamentos, cosméticos e outros produtos, foi recentemente implicado como possível causa de reações anafiláticas após vacinas de mRNA COVID-19. No entanto, as evidências que apoiam esta hipótese são contraditórias, e outros fatores podem estar envolvidos nas reações imediatas29.
Um estudo correlacionou um episódio de reação anafilática após vacina Pfizer/BioNTech em uma mulher com a presença de anticorpos anti-PEG, determinados por testes cutâneos de leitura imediata. No entanto, o estudo também demonstrou que três outros participantes que tiveram eventos adversos sistêmicos semelhantes, não apresentaram anticorpos anti-PEG. Apesar do número limitado de casos descritos neste estudo, os resultados sugerem que o papel do PEG na ocorrência de reações anafiláticas pode ser limitado. O monitoramento contínuo de dados sobre o raro potencial de risco de anafilaxia e a vigilância ativa da população vacinada com as vacinas COVID‑19, poderá auxiliar na identificação de fatores de risco para o desenvolvimento de reações alérgicas graves pós-vacinais. Cabe ressaltar que pessoas com histórico de alergia grave comprovada ao PEG não devem receber vacinas que contenham este componente. O melhor entendimento da frequência, características e mecanismos das reações ao PEG poderão auxiliar no desenvolvimento de vacinas cada vez mais seguras para os pacientes alérgicos29.
Neste contexto, o polissorbato (PS80) é uma molécula estruturalmente relacionada ao PEG e pode ser encontrado em algumas vacinas. Já foram descritos na literatura alguns eventos adversos (anafilaxia) após vacinação com produtos que continham o PS80, o que leva os pesquisadores a levantar a hipótese do papel do PS80 em induzir anafilaxias30,31.
Eventos adversos compatíveis com reações de hipersensibilidade de tipo II (citotóxica)
As reações de hipersensibilidade de tipo II são caracterizadas pela formação de anticorpos que se fixam a células do organismo, levando à sua destruição por ação do complemento e por linfócitos que se fixam aos anticorpos provocando destruição celular. Esse mecanismo provavelmente está envolvido na destruição da bainha de mielina dos nervos que pode ocorrer após certas vacinas virais vivas ou após vacina antirrábica preparada em tecido nervoso, ocasionando doenças como a encefalomielite disseminada aguda (ADEM) ou Síndrome de Guillain-Barré (SGB). As vacinas cujas descrições na literatura reportam a associação temporal (vacina e eventos neurológicos descritos acima) são: febre amarela, influenza, DTP e meningocócica5.
Embora sejam raros os casos de púrpura trombocitopênica idiopática (PTI) associados às vacinas, devemos considerar que existe um risco aumentado de PTI até seis semanas após vacinação contra sarampo, caxumba e rubéola (SCR). Em revisão sistemática de 2010, a mediana de incidência de PTI após vacina SCR foi de 2,6 casos por 100.000 doses aplicadas. Essa incidência é menor do que a causada pela infecção natural por sarampo e rubéola e semelhante à incidência de PTI na população geral32.
Eventos adversos compatíveis com reações de hipersensibilidade de tipo III (complexo imune)
São reações provocadas pela formação de complexos imunes, que levam à vasculite e à necrose tecidual no sítio da aplicação, como pode ocorrer após múltiplos reforços de vacinas contra a difteria e o tétano (fenômeno de Arthus), ou a manifestações generalizadas, como na doença do soro. Reações de Arthus têm sido reportadas após a administração de vacinas como: tétano, difteria, hepatite B, pneumocócica 23 valente e meningocócica conjugada33.
A conduta nas reações de Arthus baseia-se no uso de corticosteroides tópicos para aliviar o desconforto causado pelo prurido e erupção cutânea, anti-histamínicos que também auxiliam no alívio da erupção cutânea e do prurido, e anti-inflamatórios não esteroides para aliviar a dor articular, quando presente5.
A doença do soro, caracterizada por erupções cutâneas, artralgia ou artrite, febre, linfadenopatia e inapetência cerca de 1 a 2 semanas após a exposição ao antígeno, pode manifestar-se após vacinação antirrábica e mais raramente após a administração das vacinas influenza, tétano e pneumocócica34.
Eventos adversos compatíveis com hipersensibilidade de tipo IV (tardia)
Reações de hipersensibilidade do tipo IV são reações inflamatórias iniciadas por leucócitos mononucleares. O termo "tardia" é usado para diferenciar uma resposta celular secundária, que aparece entre 48-72 horas após a exposição ao alérgeno, de uma resposta de hipersensibilidade imediata, que geralmente aparece dentro de 12 minutos. Estas reações são mediadas por células T e monócitos / macrófagos, e não por anticorpos5.
As reações de hipersensibilidade tardia podem ser localizadas, como em indivíduos que apresentam reações cutâneas à neomicina e ao timerosal, usados como conservantes em algumas vacinas5.
As vacinas contendo adjuvantes de alumínio podem induzir a formação de nódulos subcutâneos crônicos no local da injeção35. As vacinas contra difteria, tétano e coqueluche (isoladas ou em combinação com outras vacinas), bem como papilomavírus humano e vacinas contra hepatite A e B podem conter alumínio. O risco desta complicação é estimado em torno de 0,03% a 0,83%. Os nódulos geralmente aparecem após cerca de 3 meses de vacinação e podem durar muitos anos (até 3-4 anos). Prurido intenso e eczema local, hipertricose e descoloração podem estar presentes no local do nódulo. A sensibilidade de contato ao alumínio pode ser confirmada na prática clínica através do teste de contato36.
Manifestações graves como Síndrome de Stevens-Johnson (SSJ), Necrólise Epidérmica Tóxica (NET) e Pustulosa Exantemática Generalizada são relatadas como eventos adversos pós-vacinais, embora a frequência dessas reações seja extremamente rara. Os mecanismos supostamente envolvidos nas reações pós-vacinais tardias não são bem estabelecidos, embora a alergia pré-existente aos componentes da vacina ou possíveis variações genéticas na apresentação de antígenos ou processamento podem ser fatores predisponentes para o desenvolvimento do quadro clínico grave31.
Vacinas relacionadas a eventos adversos de hipersensibilidade
Vacina Febre Amarela
A vacina Febre Amarela (FA) é cultivada em ovos embrionados de galinha. Devido o processo de produção, quantidades residuais de proteína do ovo podem estar presentes nesta vacina. No Brasil, existem duas vacinas disponíveis, e as quantidades de ovalbumina podem variar entre 2,43 e 4,42 μ g/mL de acordo com o lote. Além da ovalbumina, podem ser considerados como possíveis causadores de reação de hipersensibilidade à vacina Febre Amarela o próprio agente vacinal (vírus vivo atenuado da Febre Amarela), gelatina bovina, eritromicina, canamicina e látex (sendo estes quatro últimos presentes apenas em algumas apresentações)5.
O questionamento sobre alergia grave após a ingestão ou contato com o ovo é considerado adequado para as pessoas com história de outras alergias graves que irão receber a vacina Febre Amarela. Devemos lembrar que em crianças sem qualquer história clínica compatível com alergia a ovo e que estejam em introdução da alimentação complementar, não existe nenhuma evidência sobre a necessidade de ingestão prévia do ovo à vacinação contra a Febre Amarela. Do mesmo modo, não há recomendação para realização de IgE específica para ovo em crianças sem história de alergia após a ingestão do alimento antes da realização da vacina37.
Se o indivíduo tem diagnóstico ou suspeita clínica de alergia a ovo, deve ser encaminhado ao especialista para a realização de investigação de possível sensibilização a ovo empregando-se os testes cutâneos de leitura imediata ou IgE específica sérica. Se os testes forem negativos, a vacina poderá ser administrada com a dose padrão e o indivíduo mantido sob supervisão por 30 a 60 minutos. Caso o diagnóstico de alergia IgE mediada ao ovo seja confirmado com critérios clínicos e laboratoriais pelo médico alergista, o indivíduo poderá receber a vacina FA por meio de protocolos de dessensibilização ou fracionamento da dose em ambiente apropriado para o manejo de possível anafilaxia16,17,37.
Um aspecto importante a ser considerado é se o paciente refere tolerar o ovo cozido ou frito, mas não sabe se tolera o ovo cru. A vacina FA não é submetida a altas temperaturas em nenhum momento de seu processo de fabricação, portanto mesmo que o paciente tenha tolerância ao ovo cozido/frito, poderá apresentar uma reação imediata após a aplicação da vacina37.
Vacina Influenza
A vacina Influenza é cultivada em fluido alantoide de ovos embrionados de galinha e contém diferentes quantidades de ovalbumina, dependendo do fabricante. Em geral, as vacinas contra Influenza comercializadas atualmente contêm menos do que 1,2 µg/mL.
A alergia ao ovo já foi considerada uma contraindicação à vacinação contra Influenza, porém estudos que incluíram 4.300 indivíduos com história de alergia a ovo, dos quais 650 referiram reação anafilática, mostraram ter boa tolerância à vacina. A recomendação atual é que pessoas com história de alergia grave (anafilaxia) ao ovo de galinha recebam a vacina influenza e permaneçam em observação por 30 a 60 minutos. A Academia Americana de Pediatria (AAP) orienta que a vacinação contra Influenza em alérgicos ao ovo é um procedimento seguro sem necessidade de precauções adicionais, uma vez que já existe a recomendação formal sobre a necessidade de precaução padrão para todos os pacientes que recebam qualquer tipo de imunizante38.
Vacina tríplice viral (sarampo, caxumba, rubéola - SCR)
A vacina tríplice viral contém quantidades desprezíveis de proteína do ovo. Em muitos estudos, indivíduos alérgicos ao ovo, mesmo com história de hipersensibilidade grave, tiveram risco insignificante de reações anafiláticas. O teste cutâneo com a vacina SCR não é recomendado, pois não tem valor preditivo estabelecido16. Muitas reações atribuídas à vacina tríplice viral possivelmente são decorrentes de outros componentes, como a gelatina37.
Em 2014 foram documentados alguns casos de crianças alérgicas ao leite que tiveram anafilaxia após receberem a vacina tríplice viral do fabricante Sérum Institute of India Ltda.19,20. Após a investigação dos casos observou-se que a vacina continha traços de lactoalbumina em sua composição. Deste modo, a orientação do Ministério da Saúde é de que as crianças com ALV recebam outra marca de vacina tríplice viral que não contenha proteínas do leite, ou, na indisponibilidade da vacina substituta, seja adiada a vacinação39.
Vacina Varicela
Trata-se de uma vacina com cepa de vírus vivo atenuado (Oka) e pode conter gelatina e traços de neomicina. A taxa estimada de anafilaxia à vacina varicela relatada ao VAERS de 2006 a 2016 foi de 1,2 por 1 milhão de doses distribuídas7,12. Ozaki e cols. descreveram 28 reações anafiláticas graves e 139 reações alérgicas não graves após a vacina varicela contendo gelatina de 1994 a 1999 em 1,41 milhão de doses da vacina no Japão (11,6 / 100.000). Todos os nove soros disponíveis nas crianças com anafilaxia foram IgE específico-positivo para gelatina, enquanto 55 dos 70 soros disponíveis de crianças com alergia não grave foram positivos. Por outro lado, foram descritas 5 reações alérgicas não graves e nenhuma grave em 1,3 milhão de doses da vacina varicela sem gelatina no período de 1999 a 2002 (0,38/100.000). Os autores concluíram que a vacina sem gelatina era mais segura e forneceram dados de que a imunogenicidade era comparável à vacina anterior contendo gelatina40.
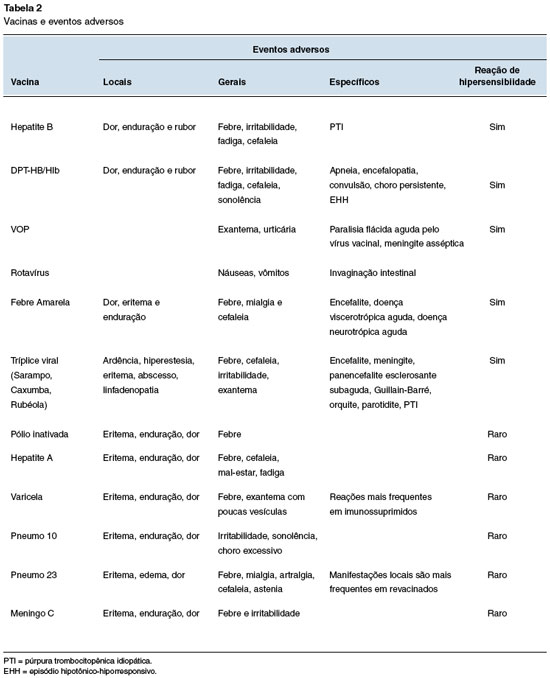
Os ESAVI graves e não graves já descritos para cada vacina estão citados na Tabela 2.
Vacinas pneumocócicas
Streptococcus pneumoniae é a maior causa de morbimortalidade em crianças no mundo. Sendo a principal causa de otites e doença bacteriana invasiva nas crianças (pneumonia, bacteremia e meningite)7.
Mais de 90 sorotipos de pneumococo já foram identificados, mas aproximadamente 20 sorotipos causam a maioria das infecções em todo o mundo8.
No momento, temos dois tipos de vacinas pneumocócicas disponíveis comercialmente no Brasil: vacina polissacarídica 23 valente (VPPS), disponível desde os anos 1980, e vacinas pneumocócicas conjugadas (VPC) 10 e 13 valente37.
A vacina pneumocócica polissacarídica 23-valente contém os 23 sorotipos mais prevalentes do pneumococo e tem em sua formulação, o fenol como preservativo. A vacina pneumocócica conjugada 13-valente contém polissorbato 80. Na vacina pneumocócica conjugada 10-valente a conjugação é com a lipoproteína D não tipável do Haemophilus influenzae em 8 sorotipos de pneumococo e 2 com a proteína CRM197. No geral, as vacinas pneumocócicas são bem toleradas, tendo sido mais descritos eventos adversos locais41,42.
Dois casos de anafilaxia associados à vacina pneumocócica polissacarídica 23-valente foram relatados em crianças, em 2001 e 2010, e os testes cutâneos de leitura imediata demonstraram sensibilização aos polissacarídeos pneumocócicos. Os casos descritos ressaltam que as reações de hipersensibilidade ao antígeno vacinal são eventos raros, e sua comprovação é desafiadora na prática clínica43.
O primeiro caso de anafilaxia à vacina pneumocócica conjugada 13-valente relatado na literatura ocorreu em uma criança de 1 ano de idade que recebeu várias vacinas ao mesmo tempo. A investigação pelo especialista com testes cutâneos e teste de ativação de basófilos concluiu como sendo a proteína CRM197 o agente causal da anafilaxia44.
Vacina Adsorvida Difteria e Tétano Adulto (dT)
A vacina difteria e tétano adulto é composta por anatoxina diftérica, anatoxina tetânica, hidróxido de alumínio, timerosal e solução fisiológica tamponada pH 6,4. As reações de hipersensibilidade são raras, sendo a maioria causada pelos timerosal e alumínio presentes em sua composição5.
Vacinas com componente pertussis
Vacina tríplice bacteriana acelular DTPa
A maioria das reações alérgicas a vacinas é relatada em pacientes imunizados contra tétano, difteria e coqueluche45. Entretanto, as reações de hipersensibilidade são extremamente raras, 2 por 1 milhão de doses de DTPa35, e estão associadas a reações alérgicas como urticária, ou, em casos mais graves, a anafilaxia45.
Além do princípio ativo (toxoide diftérico, toxoide tetânico, componentes da cápsula da bactéria Bordetella pertussis, hemaglutinina, pertactina, fenoxietanol) os excipientes variam, inclusive em concentração, de acordo com o fabricante, e são os principais causadores de reações alérgicas. Os utilizados são: hidróxido de alumínio, fosfato de alumínio, cloreto de sódio e água para injeção. As seguintes substâncias são encontradas como resíduos: formaldeído, polissorbato 80, glutaraldeído e glicina5.
O alumínio pode estar presente como excipiente e como adjuvante para potencializar a imunogenicidade do componente ativo e pode induzir a hipersensibilidade do tipo IV (alergia de contato). Portanto, devemos ter atenção aos indivíduos com história pregressa de hipersensibilidade ao alumínio (mais comum aos antitranspirantes)3. Em raras situações (< 1%) as crianças vacinadas podem apresentar prurido e formação de nódulo no local de aplicação devido ao alumínio da composição e sua causa ainda não está bem definida22. Hipersensibilidade de contato foi demonstrada em 77% das crianças com nódulos pruriginosos, e em 8% dos irmãos assintomáticos que receberam as mesmas vacinas35. Os nódulos subcutâneos podem se desenvolver e persistir por meses ou anos antes de desaparecer gradualmente. Os fatores de risco para a sensibilização ao alumínio durante a vacinação parecem estar relacionados à quantidade de alumínio na vacina, número de vacinações e o tipo do componente de alumínio, sendo o hidróxido de alumínio mais propenso de induzir sensibilização do que o fosfato de alumínio22.
Muitos fabricantes incluem glicina na sua composição (gelatina), aumentando o potencial alergênico. Investiga-se a correlação da imunização pregressa com doses de DTPa com desenvolvimento de hipersensibilidade à gelatina, fato que poderia justificar a alergia a outras vacinas que contêm glicina, como por exemplo, a vacina contra sarampo, rubéola e caxumba (tríplice viral). A maioria das reações anafiláticas e de urticária relacionadas à tríplice viral estão relacionadas a níveis elevados de IgE específica à gelatina, e não ao antígeno vacinal46.
Vacina tríplice bacteriana DTP
A vacina DTP, composta por células inteiras do componente celular pertussis, apresenta maior frequência de reações adversas reportadas em relação à DTPa. No entanto, a composição dos adjuvantes é semelhante entre as duas vacinas e o risco de reações alérgicas pode ser o mesmo. Em alguns países, a DTP com células inteiras não possui alumínio na sua composição47, portanto as reações alérgicas são relatadas em menor frequência.
Vacina adsorvida difteria, tétano, pertussis (acelular), hepatite B (recombinante), poliomielite 1, 2, 3 (inativada) e Haemophilus influenzae b (conjugada) (DTPa-HB-IPV+Hib) - Hexavalente
A vacina hexavalente tem como composição o componente ativo toxoide diftérico, toxoide tetânico, toxoide pertussis, hemaglutinina filamentosa, pertactina, antígeno de superfície da hepatite B, poliovírus, polissacarídeo Haemophilus influenzae tipo b. Adjuvante hidróxido de alumínio hidratado. Excipientes: lactose, cloreto de sódio, Meio 199 (M-199), hidróxido de alumínio, fosfato de alumínio e água para injeções. Componentes residuais: cloreto de potássio, fosfato dissódico, fosfato monopotássico, polissorbato 20 e 80, glicina, formaldeído, sulfato de neomicina e sulfato de polimixina B. Reações locais a antibióticos não contraindicam a vacinação. As reações ao alumínio e à glicina são semelhantes às que ocorrem com a DTPa37.
Vacina adsorvida difteria, tétano, pertussis (acelular), poliomielite 1, 2, 3 (inativada) e Haemophilus influenzae b (conjugada) (DTPa-IPV+Hib) - Pentavalente
Os componentes ativos da vacina pentavalente são toxoide diftérico, toxoide tetânico, antígenos da Bordetella pertussis, toxoide pertussis (PT) 25 µg, Hemaglutinina filamentosa Pertactina (PRN), poliovírus (inativado) (IPV) Tipo 1 (cepa Mahoney) 2, polissacarídeo de Haemophilus influenzae tipo b (fosfato de polirribosilribitol), hidróxido de alumínio. Os excipientes: lactose, cloreto de sódio, sais de alumínio, meio 199 (M-199) e água para injeção. Resíduos: cloreto de potássio, fosfato de sódio dibásico, fosfato de potássio monobásico, polissorbato 80, glicina, formaldeído, sulfato de neomicina, sulfato de polimixina B. Reações locais a antibióticos não contraindicam a vacinação46. As reações ao alumínio e à glicina são semelhantes às que ocorrem com a DTPa.
Em um estudo prospectivo de 4.758 crianças, 0,66% (n = 38) desenvolveram granuloma pruriginoso após aplicação da vacina pentavalente, Pentavac® (DTaP-Hib-Polio). Sugeriu-se a realização de teste de contato para alumínio elementar e cloridrato de alumínio hexahidratado 2%, mas alguns casos podem não ser diagnosticados e identificadas a sensibilização. Neste caso, uma alternativa para melhorar a sensibilidade do teste, seria utilizar como antígeno o cloridrato de alumínio hexahidratado a 10%. Para auxiliar na confirmação do diagnóstico de hipersensibilidade, recomenda-se que o teste de contato realizado com o hidróxido de alumínio a 10% seja lido após 3 a 4 dias e 1 semana47.
COVID-19
No atual cenário de pandemia do novo coronavírus 2019 (COVID-19), as vacinas têm sido uma das principais medidas promissoras para o controle da transmissão, redução de casos graves e óbitos. As vacinas COVID-19 foram desenvolvidas com diversas tecnologias, pela vasta experiência com as plataformas anteriores e pelo grande impacto social e econômico da pandemia. Os principais tipos de vacina em uso na população mundial são de vírus inativado, vetor viral recombinante, baseadas em ácido nucleico (RNAm), partículas semelhantes ao vírus e subunidades de proteínas. Outras vacinas estão em fases distintas de desenvolvimento, como as de vírus atenuado e vacinas de DNA48.
Reações com características de anafilaxia após a administração de vacinas de mRNA COVID-19 (Moderna e Pfizer/BioNTech) foram relatadas no Reino Unido e nos Estados Unidos. A incidência dessas reações indica que, embora ainda rara, a taxa pode ser maior com essas vacinas em relação às descrições anteriormente relatadas na literatura, em torno de 2,5 a 4,7 eventos por milhão de doses49.
Alguns casos caracterizados e tratados como anafilaxia foram posteriormente resolvidos e os pacientes receberam a segunda dose das vacinas sem intercorrências50. Outros casos foram descritos com início rápido dos sintomas e necessidade de intubação orotraqueal que parecem claramente reações anafiláticas, embora nenhuma investigação do mecanismo tenha sido descrita49.
Ocasionalmente, os pacientes desenvolvem urticária com ou sem angioedema leve algumas horas ou dias após receber a vacina. A maioria das reações alérgicas sistêmicas potencialmente graves relatadas às vacinas de RNAm COVID-19 ocorreram dentro de 30 minutos após a vacinação (a maioria dentro de 15 minutos). A ocorrência do início dos sintomas em curto espaço de tempo pode auxiliar no reconhecimento da anafilaxia, além de definir as medidas de precaução necessárias na sala de vacinação37.
O edema tardio intermitente persistente (ETIP) facial em áreas previamente injetadas com preenchimentos dérmicos cosméticos foi relatado após a administração da vacina mRNA, Moderna. A fisiopatologia ainda não está clara e pode não envolver mecanismos alérgicos, embora tenha sido observado inflamação local51.
As reações locais tardias são eventos raros e descritas em diversas vacinas. No estudo de fase 3 com a vacina mRNA-1273 (Moderna), as reações locais tardias foram observadas em 0,8% dos pacientes após a primeira dose, e em 0,2% após a segunda dose52. Blumenthal e cols. descreveram 12 pacientes com reações locais extensas tardias, após a aplicação da vacina mRNA-1273 (Moderna). A mediana do início da reação foi de 8 dias (intervalo de 4 a 11 dias), após a primeira dose. Alguns pacientes tiveram sintomas sistêmicos concomitantes e dois pacientes tiveram outras alterações cutâneas. A maioria dos pacientes foi tratada com sintomáticos (por exemplo, aplicação de gelo no local e anti-histamínicos). Os sintomas se resolveram com uma média de 6 dias do início dos sintomas (intervalo 2 a 11 dias). Todos os pacientes foram vacinados com a segunda dose, já que esse tipo de reação não contraindica a vacinação subsequente. Apesar de metade dos pacientes não apresentarem reação, três pacientes tiveram reações semelhantes à inicial, e três pacientes tiveram recorrência da reação local em menor grau comparado à reação da primeira dose53.
A maioria das reações ocorre nas primeiras doses, o que sugere que os pacientes eram previamente sensibilizados a algum componente vacinal ou o mecanismo envolvido nas reações poderá ser diferente dos mecanismos de hipersensibilidade conhecidos. As reações alérgicas às vacinas geralmente não são atribuídas aos componentes ativos, mas aos excipientes. A Tabela 3 demonstra as vacinas existentes com seus tipos, componentes e reações de hipersensibilidade relatados até janeiro de 2021.
As reações de hipersensibilidade imediata têm sido mais frequentes com as vacinas de mRNA do que com as outras vacinas comumente aplicadas, conforme descrito anteriormente. Por esse motivo, tem se buscado entender os mecanismos de hipersensibilidade envolvidos com estas vacinas. As vacinas da Pfizer-BioNTech e da Moderna não contêm nenhum alimento, droga ou látex, mas ambas contêm o polietilenoglicol (PEG), que foi utilizado como excipiente com o objetivo de estabilizar as nanopartículas lipídicas que contêm RNAm. O tipo específico de PEG utilizado nessas vacinas foi diferente do PEG usado na maior parte de outros produtos comerciais. Existem numerosos produtos contendo PEG, também chamado de macrogol, como medicamentos, cosméticos e alimentos54. Apesar do uso em diversos produtos, a alergia ao PEG é muito rara. A maior parte das reações ao PEG descritas na literatura está relacionada ao PEG de alto peso molecular, sendo o PEG de baixo peso molecular, mais comum nos produtos do cotidiano, uma menor causa de reações adversas. O mecanismo fisiopatológico da alergia ao PEG ainda não está claro, mas já foi descrita a presença de IgE ao PEG em alguns pacientes com anafilaxia induzida por esta substância. O PEG também parece induzir mecanismos de ativação de complemento in vitro 55. A maior parte das alergias ao PEG usualmente são descobertas durante a avalição de pacientes que aparentemente tem reações a produtos não associados como: corticoides injetáveis, alimentos processados, cosméticos, drogas e outras substâncias54.
O polissorbato, assim como o PEG, é um excipiente usado em múltiplas preparações de medicamentos (incluindo vacinas), cremes, loções e comprimidos de medicamentos. Os polissorbatos são derivados do PEG, mas têm um peso molecular muito baixo e por isso é muito menos comum desencadearem reação alérgica. A vacina da AstraZeneca ChAdOx1 é produzida por meio de um vetor viral, o adenovírus de chimpanzés, não replicante e contém histidina, sacarose, cloreto de sódio, cloreto de magnésio, polissorbato 80, edetato dissódico (EDTA) e etanol. O polissorbato 80 está em uma concentração menor do que 100 µg por dose, que é a mesma quantidade encontrada em outras vacinas, como a vacina Influenza, com a qual não se observou taxas mais altas de reações alérgicas55.
A vacina Janssen (Johnson & Johnson) também utiliza a tecnologia de vetor viral (adenovírus recombinante) e apresenta o polissorbato 80 em sua composição. Nos estudos de Fase III, reações de hipersensibilidade (urticária) foram eventos raros (entre 1/10.000 e 1/1.000) e reações anafiláticas têm sido notificadas, mas a frequência ainda não pôde ser calculada através dos dados disponíveis56.
A vacina CoronaVac é manufaturada a partir de vírus inativado, e possui em sua composição hidróxido de alumínio, hidrogenofosfato dissódico, di-hidrogenofosfato de sódio, cloreto de sódio, água para injeção e hidróxido de sódio. Nos estudos de Fase III de análise de segurança, realizado em 5.051 participantes, 50,8% apresentaram eventos adversos em até 7 dias, sendo que 40,1% das reações foram dor no local da aplicação. Reações de hipersensibilidade foram raras e ocorreram em uma frequência entre 1/1.000 e 1/100)57,58.
Dos 221 participantes de um estudo turco, 62 (28,1%) relataram reações alérgicas ou cutâneas (dor no local da injeção e/ou reações inflamatórias) temporalmente relacionadas à vacina CoronaVac. Dos 62 pacientes que apresentaram reações cutâneas, 25 (11,3%) não tinham histórico pessoal de alergia ou qualquer histórico familiar, enquanto os 37 restantes referiam antecedentes de alergia. Os 25 pacientes sem antecedentes pessoais/familiares relataram os seguintes eventos (alguns pacientes tiveram >1 reação): urticária (n=12, 5,4%); reações papuloescamosas (ex.: pitiríase rósea) (n=8; 3,6%); infecção por herpes (n=4; 1,8%), composta por herpes zoster (HZ) (n=2) e herpes simples (HS) (n=2); angioedema (n=3; 1,4%); reações de hipersensibilidade tipo IV, como eritema multiforme, erupção liquenoide a drogas e síndrome de hipersensibilidade a drogas (n=3; 1,4%); eritema palmar (n=2; 0,9%); anafilaxia (n=1; 0,5%); conjuntivite (n=1; 0,5%); e vasculite de pequenos vasos (n=1; 0,5%). No entanto, cabe ressaltar que os eventos reportados neste estudo foram temporalmente relacionados à vacinação, sem investigação e comprovação de causalidade59.
Racional de investigação de reações de hipersensibilidade pós-vacinais
Quando o paciente é encaminhado ao alergista e imunologista para avaliação de uma possível reação de hipersensibilidade a uma vacina, o raciocínio deve sempre iniciar pelas questões relacionadas a seguir7,17,22,37,60‑62.
(a) O esquema vacinal está incompleto, ainda são necessárias novas doses da mesma vacina?
(b) Qual o risco versus benefício de seguir com a vacinação (risco da doença)?
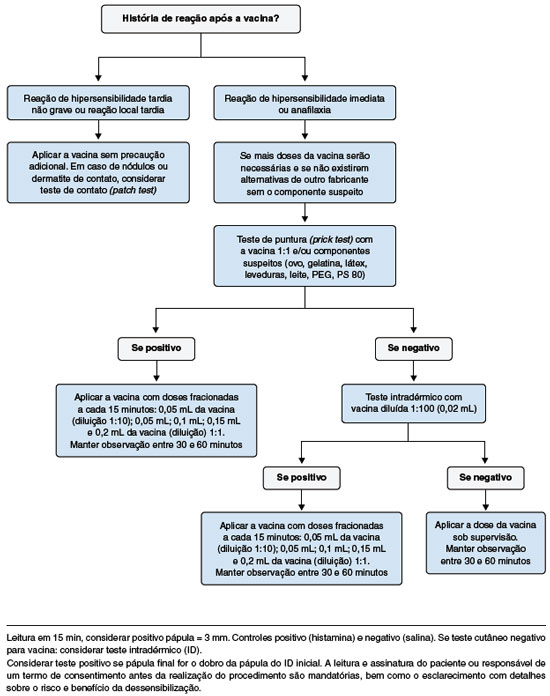
A investigação inicia-se com a história clínica, como a de uma reação a medicamento ou reação pós-vacinal anterior, sendo importante avaliar a extensão da reação (local x sistêmica), tempo de início da reação (imediata ou tardia) e a necessidade de uso de medicações (anti-H1, adrenalina) para o tratamento. Neste contexto é fundamental a checagem e anotação do fabricante e lote da vacina em questão. A bula da vacina deve ser checada para análise dos constituintes como adjuvantes (alumínio), preservativos (formaldeído, timerosal e 2-fenoxietanol), estabilizadores (lactose, gelatina), antibióticos, látex e meios de cultura (ovo, fungos)61,62. Se a história for compatível com reação de hipersensibilidade à vacina, deve-se proceder à investigação diagnóstica de acordo com o mecanismo de hipersensibilidade envolvido (Figura 1).
Na avaliação de reações de hipersensibilidade, testes cutâneos com as vacinas ou seus componentes, quando recomendados, devem ser realizados em ambiente preparado e equipe treinada, com acompanhamento do médico alergista. Todos os testes cutâneos precisam ser interpretados cuidadosamente, com controles positivo e negativo. Resultados positivos devem ser considerados como indicativos de sensibilização, mas não como comprovação de alergia, pois resultados falso-positivos podem ocorrer em pessoas sem manifestação clínica relevante ou por efeitos irritativos do antígeno utilizado para o teste.
Nas reações de hipersensibilidade imediata deve ser feita avaliação com os testes puntura ou intradérmico de leitura imediata, com a vacina e seus constituintes, e se comprovada a sensibilização à determinada vacina, pode-se proceder a vacinação com a aplicação em doses escalonadas61,62. Pré-medicação com anti-histamínicos após testes cutâneos e antes do fracionamento é controverso e não está recomendado antes da aplicação da dose inicial ou de reforço.
Uma série de abordagens para testes cutâneos com vacinas têm sido sugerida, mas as diretrizes atuais recomendam que o teste de puntura seja iniciado com a vacina pura 1:1, a menos que o paciente tenha histórico de anafilaxia grave. Neste caso é apropriado diluir a vacina 1:10 ou mesmo 1:100, que são consideradas concentrações não irritantes63.
Se o teste cutâneo de puntura for negativo, um teste intradérmico com a vacina diluída 1:100 deve então ser realizado7,60,62. O teste intradérmico não diluído é desencorajado devido à alta taxa de irritabilidade. Resultados falso-positivos por reações irritativas foram mais frequentes com a vacina pura ou diluída 1:10, especialmente com as vacinas Influenza, SRC e Varicela. Nas diluições 1:100, reações por irritabilidade foram menos comuns, 5% para DT e DTPa e 15% para Influenza7,22,55,63,64. Sempre que possível, fazer o teste com a mesma vacina do mesmo fabricante do momento da reação.
Caso a reação de hipersensibilidade seja confirmada, outra opção para seguir com a imunização do paciente é recomendar a troca da vacina por um produto que não contenha o alérgeno possivelmente envolvido da reação7,22,55,63. As reações não alérgicas locais como vermelhidão, dor e edema, assim como a febre não contraindicam a aplicação de doses subsequentes da vacina7,22,55,63.
A imunização não deve ser retardada, sendo o papel do alergista proceder a avaliação e abordagem adequada dos casos. Com a queda das coberturas vacinais em nosso país desde a década de 1990, houve aumento dos indivíduos suscetíveis às doenças infecciosas, muitas vezes com alta transmissibilidade e morbimortalidade. Em 2020, até o mês de outubro já haviam sido confirmados 8.000 casos de sarampo no Brasil. O médico especialista em alergia e imunologia deve ser acionado para elucidação do caso em conjunto com as unidades de vacinação ou os centros de referência em imunobiológicos especiais (CRIE)65.
Lembrando mais uma vez que as reações graves às vacinas são eventos raros e que os locais de imunização devem dispor de material necessário para uso em caso de reações de hipersensibilidade imediata: adrenalina, anti-histamínicos, corticoides, beta 2-agonistas e fonte de oxigênio7.
Testes diagnósticos
Para avaliação de uma reação anafilática à vacina, recomenda-se, quando possível, a dosagem de triptase sérica dentro de 2 horas e a dosagem da triptase sérica basal 48 horas após a reação22.
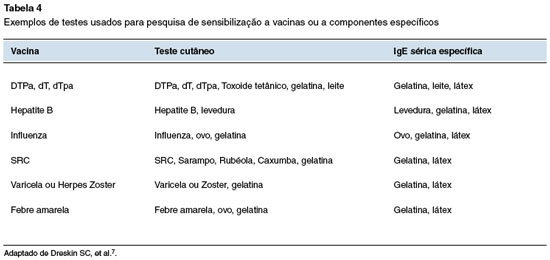
Na suspeita de uma reação alérgica grave à vacina, a identificação do alérgeno causal é importante, pois pode permitir o uso de outras formulações da vacina e o paciente pode evitar outros produtos que contenham o mesmo alérgeno. Se for determinado que doses adicionais da vacina devem ser administradas, testes cutâneos com a vacina e/ou componentes devem ser realizados. Este processo pode ser relativamente simples se apenas uma única vacina (antígeno) foi administrada, ou mais complicado, se a vacinação simultânea ou combinada (por exemplo, SRC) foi realizada, situação que ocorre frequentemente na Pediatria7.
A investigação do alérgeno presente na vacina pode ser realizada in vitro e/ou in vivo, a depender da disponibilidade de extratos alergênicos. Testes de IgE específica para a maioria dos componentes antimicrobianos não estão disponíveis comercialmente, e frequentemente são inúteis em prever reações alérgicas às vacinas. Para alguns outros constituintes (por exemplo, ovoalbumina e gelatina), a capacidade preditiva de reação às vacinas é muito baixa22. No entanto, se a vacina suspeita da reação contém constituintes específicos conhecidos por serem potencialmente alergênicos (por exemplo, ovo, gelatina, látex ou levedura), a pesquisa alérgica deve ser conduzida para estes componentes. Teste de puntura para gelatina pode ser preparado dissolvendo uma colher de chá de gelatina em pó em 5 mL de solução salina normal.
Reações locais não imediatas como dermatite de contato, nódulos subcutâneos ou reações de hipersensibilidade tipo IV a conservantes, alumínio e antibióticos podem ser avaliadas por meio do teste de contato. Embora o teste de contato alérgico não seja essencial para decisões terapêuticas, ele pode ajudar na escolha de vacinas alternativas, quando disponíveis7.
A pesquisa de IgE específica in vitro está disponível na maioria dos laboratórios comerciais para ovo, gelatina, látex e levedura. Exemplos de testes cutâneos e sorológicos que seriam apropriados na avaliação de reações suspeitas a vacinas específicas são apresentadas na Tabela 47.
Tratamento da anafilaxia
A anafilaxia é uma reação de hipersensibilidade sistêmica, que progride com rapidez e é potencialmente fatal, envolvendo vários órgãos (ao menos dois) - pele e mucosa: é o acometimento mais frequente e ocorre em mais de 90% dos casos com eritema, prurido, urticária e angioedema; trato respiratório: ocorre em 40% a 70% dos casos, com disfonia, tosse, estridor, sibilos, dispneia, opressão, asfixia, morte; trato digestório: acomete em 30% dos casos, com náuseas, vômitos, cólicas e diarreias; sistema cardiovascular: taquicardia, hipotensão, tontura, lipotímia, choque (10%) e morte; sistema nervoso: síncope, convulsões, coma. A incidência estimada da anafilaxia é de 10 a 20 casos por 100.000 pessoas por ano, com observação de tendência a aumento desta entidade nas últimas décadas. Com vacinas, esta incidência é ainda mais baixa - cerca de um caso por milhão de doses. A rapidez no tratamento é fator fundamental para a recuperação do paciente, sendo o atraso na administração de adrenalina identificado como um fator relacionado ao desfecho desfavorável. Importante ressaltar que a primeira droga a ser utilizada é a adrenalina IM, seguida de anti-histamínicos e corticoides37.
Outros fatores que podem impactar de modo negativo o desfecho da anafilaxia são o uso de doses ou vias de administração inadequadas para a adrenalina (subcutânea, por exemplo), e o uso concomitante de outros medicamentos, como betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), inibidores da monoamina oxidase (MAO) e antidepressivos. Após a fase aguda, pode ocorrer uma fase tardia, após 6 a 12 horas, com o reaparecimento dos sintomas. Portanto, os pacientes devem permanecer supervisionados na unidade de saúde por pelo menos 12 horas após o evento inicial da anafilaxia37.
Notificação
Em 1992, atendendo às recomendações da Organização Mundial da Saúde (OMS), o Programa Nacional de Imunizações/Ministério da Saúde (PNI/MS) iniciou a estruturação do Sistema Nacional de Vigilância de Eventos Adversos Pós-Vacinais - EAPV (SNVEAPV). Dentre os seus objetivos, destacam-se normatizar o reconhecimento e a conduta em casos suspeitos de ESAVI, permitir maior conhecimento sobre a natureza dos eventos e identificar possíveis falhas no transporte, armazenamento, manuseio ou administração (erros de imunização) que resultem em eventos adversos. Através de uma cuidadosa análise, é realizada a verificação da causalidade do evento adverso e a relação com o produto administrado, além disso há posterior divulgação das informações, incluindo incidência e gravidade das reações observadas5.
Reconhecendo a importância da vigilância desse tipo de evento adverso, a Secretaria de Vigilância em Saúde (SVS) do MS o incluiu como agravo de notificação compulsória na Portaria nº 33/SVS/MS de 2005, revogada pela Portaria nº 1.271/SVS/MS de 20145.
Pontualmente:
- Qualquer efeito adverso causado pela imunização deve ser notificado à Agência Nacional de Vigilância Sanitária (ANVISA), através do Sistema de Notificação em Vigilância Sanitária (NOTIVISA). Deve ser considerado o intervalo entre a vacinação e o início dos sintomas.
- Reações locais como abscesso, celulite ou nodulação no sítio de administração; enduração ou edema próximo ou no sítio de administração; granuloma; reação de Arthus; dor no local e no momento da aplicação, ou logo após receber a vacina devem ser notificadas.
- Reações sistêmicas como anafilaxia, assim como reações anafilactoides e choque anafilático também devem ser notificadas. Assim como: choro persistente, com duração de 3 horas ou mais, até 48 horas após aplicação da vacina; convulsões, encefalite, mielite, encefalomielite aguda disseminada; encefalopatia; episódio hipotônico-hiporresponsivo; febre; invaginação intestinal; meningite asséptica; narcolepsia; neurite óptica; paralisia facial; polirradiculoneuropatias inflamatórias, como Síndrome de Guillain-Barré; síncope vasovagal; Síndrome Dolorosa Complexa Regional; Síndrome de Reação Sistêmica Precoce; Trombocitopenia ou Plaquetopenia.
- Também devem ser notificados óbitos temporariamente associados a eventos adversos vacinais, como Morte súbita inexplicável, Síndrome da Morte Súbita na Infância e óbitos com causas mal definidas. Nestes casos, deve ser realizado em coordenação com o departamento médico legal: Instituto Médico Legal (IML) e Serviço de Verificação de Óbitos (SVO). Nos locais onde forem disponíveis, recomenda-se a realização de necrópsia nas primeiras 72 horas, para se evitar a produção de lesões dos tecidos, o que pode dificultar o diagnóstico.
Conclusões
Faz parte da atuação do profissional de saúde a avaliação da situação vacinal dos seus pacientes e cuidadores e a recomendação formal das vacinas indicadas nos calendários de imunizações, considerando faixas etárias, situações especiais (alérgicos e imunocomprometidos) e possíveis contraindicações e precauções. Além de contribuir para a recomendação da imunização necessária, o alergista/imunologista deve estar preparado para lidar com os eventos adversos relacionados às vacinas, de tal modo que possa estabelecer o diagnóstico com precisão e orientar adequadamente os pacientes.
Referências
1. Barreto ML, Teixeira MG, Bastos FI, Ximenes RAA, Barata RB, Rodrigues LC. Sucessos e fracassos no controle de doenças infecciosas no Brasil: o contexto social e ambiental, políticas, intervenções e necessidades de pesquisa. Lancet. 2011;47-60.
2. Veve MP, Athans V. Vaccines. In: Sidhartha R, ed. Side Effects of Drugs Annual 40. Elsevier; 2018. p. 694.
3. Teuwen DE, Barrett ADT. Vaccine Safety. In: Milligan GN, Barrett ADT (eds). Vaccinology: An Essential Guide. Wiley-Blacwell; 2014. p. 400.
4. Council for International Organizations of Medical Sciences (CIOMS). Definition and Application Pharmacovigilance. Definition and Application of Terms for Vaccine Pharmacovigilance. CIOMS, WHO; 2012. p.193.
5. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Imunizações e Doenças Transmissíveis. Manual de vigilância epidemiológica de eventos adversos pós-vacinação [recurso eletrônico] - 4ª ed. - Brasília: Ministério da Saúde; 2020; p.340. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_epidemiologica_eventos_vacinacao_4ed.pdf. Acessado em: novembro/2022.
6. Miler ER, Haber P, Hibbs B, Broder K. Surveillance for Adverse Events Following Immunization Using the Vaccine Adverse Event Reporting System (VAERS). VPD Suveillance Man. 2011;1-14.
7. Dreskin SC, Halsey NA, Kelso JMJM, Wood RA, Hummell DS, Edwards KM, et al. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016;9(1):32.
8. McNeil MM, DeStefano F. Vaccine-associated hypersensitivity. J Allergy Clin Immunol. 2018;141(2):463-72.
9. McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016;137(3):868-78. doi: 10.1016/j.jaci.2015.07.048.
10. Erlewyn-Lajeunesse M, Hunt LP, Heath PT, Finn A. Anaphylaxis as an adverse event following immunisation in the UK and Ireland. Arch Dis Child. 2012;97(6):487-90. doi: 10.1136/archdischild-2011-301163.
11. Cheng DR, Perrett KP, Choo S, Danchin M, Buttery JP, Crawford NW. Pediatric anaphylactic adverse events following immunization in Victoria, Australia from 2007 to 2013. Vaccine. 2015;33(13):1602-7.
12. Su JR, Moro PL, Ng CS, Lewis PW, Said MA, Cano M V. Anaphylaxis after vaccination reported to the Vaccine Adverse Event Reporting System, 1990-2016. J Allergy Clin Immunol. 2019;143(4):1465‑73.
13. Giavina-Bianchi P, Kalil J. Polyethylene Glycol Is a Cause of IgE-Mediated Anaphylaxis. J Allergy Clin Immunol Pract. 2019;7(6):1874‑5.
14. James JM, Burks AW, Roberson PK, Sampson HA. Safe administration of the measles vaccine to children allergic to eggs. N Engl J Med. 1995;332(19):1262-6. doi: 10.1056/NEJM199505113321904.
15. Baxter DN. Measles immunization in children with a history of egg allergy. Vaccine. 1996;14(2):131-4.
16. Kelso JM. Administering influenza vaccine to egg-allergic persons. Expert Rev Vaccines. 2014;13(8):1049-57. doi: 10.1586/14760584.2014.933079.
17. Marinho AKBB, Ouricuri AL, Valente CFC, Fernandes FR, Saciloto G, Diniz L de C, et al. Vacina contra a febre amarela: reações adversas e populações de risco. Arq Asma, Alerg e Imunol. 2017;1(3):245‑56.
18. Gerhardt CMB, Feitosa G de SJ, Aquilante BP, Dorna M de B, Santos C de JN dos, Pastorino AC. Segurança da vacina de febre amarela em pacientes comprovadamente alérgicos à proteína do ovo. Arq Asma, Alerg e Imunol. 2019;3(2):143‑50.
19. Fantinato FFST, Vargas A, Carvalho SMD, Domingues CMAS, Barreto G, Fialho AS, et al. Anafilaxia relacionada à vacina sarampo, caxumba e rubéola, Santa Catarina, Brasil, 2014 e 2015. Cad Saude Publica. 2018;34(3):e00043617. doi: 10.1590/0102-311X00043617.
20. Piñones M, Landaeta M, Bustos P, Toche P, Morales P, Escobar C, et al. Hypersensitivity reactions to measles-mumps-rubella vaccine in patients with IgE-mediated cow's milk allergy. J Allergy Clin Immunol Pract. 2020;8(1):349-51.
21. Kattan JD, Konstantinou GN, Cox AL, Nowak-Węgrzyn A, Gimenez G, Sampson HA, et al. Anaphylaxis to diphtheria, tetanus, and pertussis vaccines among children with cow's milk allergy. J Allergy Clin Immunol. 2011 Jul;128(1):215-8. doi: 10.1016/j.jaci.2011.04.046.
22. Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, et al. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017;28(7):628‑40. doi: 10.1111/pai.12762.
23. Sakaguchi M, Nakayama T, Inouye S. Food allergy to gelatin in children with systemic immediate-type reactions, including anaphylaxis, to vaccines. J Allergy Clin Immunol. 1996;98(6 Pt 1):1058‑61.
24. Kelso JM, Jones RT, Yunginger JW. Anaphylaxis to measles, mumps, and rubella vaccine mediated by IgE to gelatin. J Allergy Clin Immunol. 1993;91(4):867‑72.
25. Kumagai T, Yamanaka T, Wataya Y, Umetsu A, Kawamura N, Ikeda K, et al. Gelatin-specific humoral and cellular immune responses in children with immediate- and nonimmediate-type reactions to live measles, mumps, rubella, and varicella vaccines. J Allergy Clin Immunol. 1997;100(1):130‑4.
26. Sakaguchi M, Yamanaka T, Ikeda K, Sano Y, Fujita H, Miura T, et al. IgE-mediated systemic reactions to gelatin included in the varicella vaccine. J Allergy Clin Immunol. 1997;99(2):263‑4.
27. Pool V, Braun MM, Kelso JM, Mootrey G, Chen RT, Yunginger JW, et al.; VAERS Team. US Vaccine Adverse Event Reporting System. Prevalence of anti-gelatin IgE antibodies in people with anaphylaxis after measles-mumps rubella vaccine in the United States. Pediatrics. 2002;110(6):e71. doi: 10.1542/peds.110.6.e71.
28. DiMiceli L, Pool V, Kelso JM, Shadomy SV, Iskander J. Vaccination of yeast sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS). Vaccine 2006;24(6):703‑7.
29. Blumenthal KG, Robinson LB, Camargo CA Jr, Shenoy ES, Banerji A, Landman AB, et al. Acute Allergic Reactions to mRNA COVID-19 Vaccines. JAMA. 2021;325(15):1562‑5. doi: 10.1001/jama.2021.3976.
30. Bigini P, Gobbi M, Bonati M, Clavenna A, Zucchetti M, Garattini S, et al. The role and impact of polyethylene glycol on anaphylactic reactions to COVID-19 nano-vaccines. Nat Nanotechnol. 2021;16(11):1169‑71. doi: 10.1038/s41565-021-01001-3.
31. Des Roches A, Graham F, Begin P, Paradis L, Gold M. Evaluation of Adverse Reactions to Vaccines. J Allergy Clin Immunol Pract. 2021;9(10):3584‑97.
32. Mantadakis E, Farmaki E, Buchanan GR. Thrombocytopenic Purpura after Measles-Mumps-Rubella Vaccination: A Systematic Review of the Literature and Guidance for Management. J Pediatr. 2010;156(4):623‑8.
33. Peng B, Wei M, Zhu FC, Li JX. The vaccines-associated Arthus reaction. Hum Vaccin Immunother. 2019;15(11):2769‑77.
34. Fishbein DB, Yenne KM, Dreesen DW, Teplis CF, Mehta N, Briggs DJ. Risk factors for systemic hypersensitivity reactions after booster vaccinations with human diploid cell rabies vaccine: A nationwide prospective study. Vaccine. 1993;11(14):1390‑4.
35. Bergfors E, Trollfors B, Inerot A. Unexpectedly high incidence of persistent itching nodules and delayed hypersensitivity to aluminium in children after the use of adsorbed vaccines from a single manufacturer. Vaccine. 2003;22(1):64‑9.
36. Bergfors E, Trollfors B. Sixty-four children with persistent itching nodules and contact allergy to aluminium after vaccination with aluminium-adsorbed vaccines-prognosis and outcome after booster vaccination. Eur J Pediatr. 2013;172(2):171‑7.
37. SBIM/ASBAI. Guia de Imunização SBIm/ASBAI - Asma, Alergia e Imunodeficiências 2020-2021 [Internet]. 2020. Disponível em: https://sbim.org.br/images/guias/guia-sbim-asbai-miolo-201013b-web.pdf. Acessado em: novembro/2022.
38. ASBAI. Posicionamento da ASBAI em relação à aplicação de vacina Influenza em pacientes alérgicos ao ovo [Internet]. 2016. Disponível em: http://www.sbai.org.br/imagebank/2016-09-26-PARECER-VACINA-INFLUENZA-X-ALERGIA-OVO-ASBAI-2016-Fatima.pdf. Acessado em: novembro/2022.
39. Brasil. Ministério da Saúde. Crianças ainda devem ser vacinadas contra sarampo e poliomielite em 2015 [Internet]. 2014 Disponível em: http://portalms.saude.gov.br/noticias/svs/16091-estados-que-nao-atingiram-meta-devem-continuar-vacinando. Acessado em: novembro/2022.
40. Ozaki T, Nishimura N, Muto T, Sugata K, Kawabe S, Goto K, et al. Safety and immunogenicity of gelatin-free varicella vaccine in epidemiological and serological studies in Japan. Vaccine. 2005;23(10):1205‑8.
41. Huu TN, Toan NT, Tuan HM, Viet HL, Le Thanh Binh P, Yu TW, et al. Safety and reactogenicity of primary vaccination with the 10-valent pneumococcal non-typeable Haemophilus influenzae protein D conjugate vaccine in Vietnamese infants: a randomised, controlled trial. BMC Infect Dis. 2013;13(1):95.
42. Ponvert C, Scheinmann P, de Blic J. Anaphylaxis to the 23-valent pneumococcal vaccine: a second explored case by means of immediate-reading skin tests with pneumococcal vaccines. Vaccine. 2010;28(52):8256-7.
43. Ponvert C, Ardelean-Jaby D, Colin-Gorski AM, Soufflet B, Hamberger C, De Blic J, et al. Anaphylaxis to the 23-valent pneumococcal vaccine in child: A case-control study based on immediate responses in skin tests and specific IgE determination. Vaccine. 2001;19(32):4588‑91.
44. Arroabarren E, Anda M, Sanz ML. Anaphylaxis to pneumococcal vaccine; CRM(197): Novel cause of vaccine allergy. Pediatr Allergy Immunol. 2016;27(4):433‑7.
45. Ponvert C. Les réactions d'hypersensibilité allergique et non allergique aux vaccins contenant des anatoxines. Arch Pédiatrie. 2009;16(4):391‑5.
46. Nakayama T, Aizawa C. Change in gelatin content of vaccines associated with reduction in reports of allergic reactions. J Allergy Clin Immunol. 2000;106(3):591‑2.
47. Netterlid E, Hindsén M, Björk J, Ekqvist S, Güner N, Henricson KÅ, et al. There is an association between contact allergy to aluminium and persistent subcutaneous nodules in children undergoing hyposensitization therapy. Contact Dermatitis. 2009;60(1):41‑9.
48. Lurie N, Saville M, Hatchett R, Halton J. Developing Covid-19 Vaccines at Pandemic Speed. N Engl J Med. 2020;382(21):1969‑73.
49. Shimabukuro TT, Cole M, Su JR. Reports of Anaphylaxis After Receipt of mRNA COVID-19 Vaccines in the US-December 14, 2020-January 18, 2021. JAMA. 2021;325(11):1101‑2.
50. Kelso JM. Misdiagnosis of systemic allergic reactions to mRNA COVID-19 vaccines. Ann Allergy Asthma Immunol. 2021;127(1):133‑4.
51. Delayed Large Local Reactions to mRNA Vaccines. N Engl J Med. 2021;384(24):e98.
52. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384(5):403‑16.
53. Blumenthal KG, Freeman EE, Saff RR, Robinson LB, Wolfson AR, Foreman RK, et al. Delayed Large Local Reactions to mRNA-1273 Vaccine against SARS-CoV-2. N Engl J Med. 2021;384(13):1273‑7.
54. Banerji A, Wickner PG, Saff R, Stone CA, Robinson LB, Long AA, et al. mRNA Vaccines to Prevent COVID-19 Disease and Reported Allergic Reactions: Current Evidence and Suggested Approach - PubMed [Internet]. Vol. 9; p. 1423-37. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33388478/. Acessado em: 25/10/2022.
55. Turner PJ, Ansotegui IJ, Campbell DE, Cardona V, Ebisawa M, El-Gamal Y, et al. COVID-19 vaccine-associated anaphylaxis: A statement of the World Allergy Organization Anaphylaxis Committee. World Allergy Organ J. 2021;14(2):100517.
56. Altrichter S, Wöhrl S, Horak F, Idzko M, Jordakieva G, Untersmayr E, et al. Answers to burning questions for clinical allergologists related to the new COVID-19 vaccines. Allergo J Int. 2021;30(5):169‑75.
57. Tuzer C, Terzioglu K. Evaluation of the Autoimmunity and Preexisting Risky Conditions for Hypersensitivity Reactions to COVID-19 Vaccines. Int Arch Allergy Immunol. 2022;183(6):651-61. doi: 10.1159/000521709.
58. Bellinato F, Fratton Z, Girolomoni G, Gisondi P. Cutaneous Adverse Reactions to SARS-CoV-2 Vaccines: A Systematic Review and Meta-Analysis. Vaccines (Basel). 2022;10(9):1475. doi: 10.3390/vaccines10091475.
59. Durmaz K, Aykut Temiz S, Metin Z, Dursun R, Abdelmaksoud A. Allergic and cutaneous reactions following inactivated SARS-CoV-2 vaccine (CoronaVac®) in healthcare workers. Clin Exp Dermatol. 2022;47(1):171‑3.
60. Kelso JM, Greenhawt MJ, Li JT, Nicklas RA, Bernstein DI, Blessing-Moore J, et al. Adverse reactions to vaccines practice parameter 2012 update. J Allergy Clin Immunol. 2012;130(1):25‑43.
61. Caubet JC, Rudzeviciene O, Gomes E, Terreehorst I, Brockow K, Eigenmann PA. Managing a child with possible allergy to vaccine. Pediatr Allergy Immunol. 2014;25(4):394‑403.
62. Wood RA, Berger M, Dreskin SC, Setse R, Engler RJ, Dekker CL, et al.; Hypersensitivity Working Group of the Clinical Immunization Safety Assessment (CISA) Network. An algorithm for treatment of patients with hypersensitivity reactions after vaccines. Pediatrics. 2008;122(3):e771-7. doi: 10.1542/peds.2008-1002.
63. Wood RA, Setse R, Halsey N. Irritant skin test reactions to common vaccines. J Allergy Clin Immunol. 2007;120(2):478‑81.
64. Michalska-Krzanowska G. Tryptase in diagnosing adverse suspected anaphylactic reaction. Adv Clin Exp Med. 2012;21(3):403-8.
65. Sociedade Brasileira de Imunizações (SBIm). Nota Técnica: recuperação de esquemas de doses atrasados em decorrência da pandemia - SBIm [Internet]. 2020. Disponível em: https://sbim.org.br/images/files/notas-tecnicas/nt-sbim-recuperacao-doses-atrasadas-pandemia-v2.pdf. Acessado em: novembro/2022.