Número Atual: Julho-Setembro 2022 - Volume 6 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Inibidores de JAK no tratamento da dermatite atópica
JAK inhibitors in the treatment of atopic dermatitis
Luiza de Bortolli Nogueira1; Débora Carla Chong-Silva2; Nelson Augusto Rosário Filho3; Herberto José Chong-Neto4
DOI: 10.5935/2526-5393.20220038
1. Residente de Pediatria, Complexo Hospital de Clínicas, Universidade Federal do Paraná - Curitiba, PR, Brasil
2. Professor Adjunto IV de Pediatria, Universidade Federal do Paraná - Curitiba, PR, Brasil
3. Professor Titular de Pediatria, Universidade Federal do Paraná - Curitiba, PR, Brasil
4. Professor Associado I de Pediatria, Universidade Federal do Paraná - Curitiba, PR, Brasil
Endereço para correspondência:
Herberto José Chong Neto
E-mail: h.chong@uol.com.br
Submetido em: 25/07/2022
Aceito em: 01/08/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
A dermatite atópica é a doença inflamatória cutânea mais prevalente mundialmente. A via JAK/STAT tem papel importante no mecanismo da doença e as pequenas moléculas inibidores de JAK são fármacos com grande potencial de uso na dermatite atópica. Foi realizada uma revisão sistemática da literatura na base de dados PubMed, utilizando os termos "atopic dermatitis" e/ou "JAK inhibitors" e/ou "small molecules" entre 2017 e 2022. Foram incluídos os resultados disponíveis de estudos de fase 3, avaliando o uso de inibidores de JAK em apresentações tópicas e sistêmicas. Entre 646 estudos, foram selecionados 37 em humanos que avaliaram a eficácia e segurança dos inibidores de JAK. Os resultados do uso, quando bem indicados, mostraram-se positivos e em alguns casos superiores a outros tratamentos já preconizados para o controle da dermatite atópica, com um bom perfil de segurança.
Descritores: Dermatite atópica, inibidores de JAK, pequenas moléculas.
INTRODUÇÃO
A dermatite atópica é uma doença inflamatória crônica e recorrente. Também conhecida como eczema atópico, é a moléstia inflamatória cutânea mais prevalente, e evidências recentes a incluem entre as trinta principais doenças crônicas que levam a carga de doença não fatal, ou years lived with disease (YLD) no mundo1,2.
É caracterizada pelo prurido e eczema, com morfologia em determinadas localizações anatômicas que podem variar de acordo com a faixa etária, e se manifesta com um vasto espectro de apresentação clínica. Considerando a sua heterogeneidade clínica, os dados epidemiológicos de sua prevalência são variáveis.
O International Study of Asthma and Allergies in Childhood (ISAAC) foi um estudo idealizado para estimar a prevalência de doenças alérgicas em crianças e adolescentes mundialmente. Na primeira fase, crianças entre 6 e 7 anos e adolescentes entre 13 e 14 anos de 56 e 38 países, respectivamente, responderam a um questionário padronizado. Os achados sobre a prevalência de dermatite atópica tiveram variação de 0,3% a 20,5% de prevalência a depender da região geográfica, e a doença mostrou-se mais prevalente em regiões de menor latitude e com menor variação térmica. No Brasil, a prevalência média de eczema foi de 11,5%, dos participantes de 20 cidades brasileiras, entre os anos de 2002 e 20033.
A fisiopatologia da doença é bem compreendida. A dermatite atópica é desencadeada por fatores genéticos, alterações na resposta imunológica e inflamatória e alteração na barreira cutânea. Pacientes com dermatite atópica apresentam resposta imunológica do tipo 2 exacerbada. As citocinas inflamatórias do tipo 2, principalmente a IL-4, IL-5 e IL-13, conseguem inibir proteínas e lipídios na barreira cutânea, contribuindo para sua desestruturação. Além disso, sabe-se que as mesmas citocinas do tipo 2 também participam da ativação de eosinófilos e mastócitos e aumentam a produção de IgE4.
As enzimas Janus Kinase (JAK) são importantes mediadores da ação intracelular de diversas substâncias, entre elas as citocinas inflamatórias. Quando seus receptores são ativados, ocorre a fosforilação das proteínas transdutoras de sinal e ativadoras de transcrição (STAT), que podem ser translocadas para o núcleo celular, induzindo a transcrição e regulação da expressão de genes selecionados. A via estimula a expressão de diversas moléculas e citocinas que facilitam a mobilização de leucócitos e a proliferação celular. Assim, a via JAK/STAT tem um papel fundamental para a função das células hematopoiéticas e imunológicas, e estudos recentes mostram que tal via pode ter mais suscetibilidade para ativação em pacientes com asma, dermatite atópica e rinite alérgica, doenças caracterizadas pelo aumento das interleucinas inflamatórias do tipo 25,6 (Figura 1).
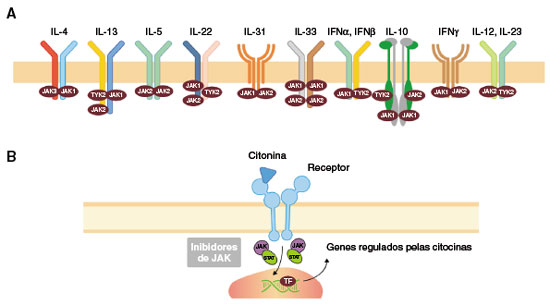
Figura 1
A) Sinalização de JAK's com citocinas envolvidas na resposta imunológica e doenças imunomediadas.
B) via JAK/STAT
Adaptado de Ahn J, et al.56
Os pacientes com dermatite atópica moderada-grave que não respondem a tratamentos tópicos necessitam de medicamentos imunossupressores sistêmicos. Com a melhor compreensão da fisiopatologia da doença, foi aprovado o uso de imunobiológicos para dermatite atópica. O dupilumabe é o único aprovado para o tratamento da dermatite atópica7,8. Foi considerado um divisor de águas no rumo que o tratamento da doença poderia tomar. É um anticorpo monoclonal do tipo IgG4, que inibe o receptor a da IL-4 e a IL-13 na resposta inflamatória do tipo 29. É um medicamento bem tolerado e com boa resposta em grupos de adultos e crianças a partir dos 6 anos. Mesmo com resultados promissores, há um grupo de pacientes que não respondem ao tratamento parcial ou totalmente, reforçando a necessidade da continuação de estudos científicos para o desenvolvimento de novas classes terapêuticas.
Os inibidores de JAK são pequenas moléculas, ou seja, medicamentos com baixo peso molecular, que conseguem facilmente atravessar a membrana celular e atingir alvos intracelulares. Assim, agem inibindo a sinalização mediada por citocinas específicas, agindo em cadeias de receptores específicos dos subtipos da Janus Kinase - JAK-1, JAK-2, JAK-3 e/ou Tirosina-Kinase 2 (TYK-2)10,11. O primeiro medicamento inibidor de JAK aprovado para a prática clínica ocorreu em 2011, para doença autoimune12. Seu uso clínico é abrangente, com aplicações desde a oncologia até o combate a doenças virais, e apresenta grande potencial de ação em doenças alérgicas e de resposta imunológica do tipo 2. As perspectivas futuras dos inibidores de JAK vem sendo crescentemente estudadas em dermatite atópica, e seu uso tem sido recentemente regulamentado em diversos países, tanto em apresentação tópica como sistêmicas.
METODOLOGIA
Foi realizada uma revisão sistemática de literatura, utilizando a base de dados PubMed/MEDLINE como fonte de pesquisa. Foram utilizados os termos "atopic dermatitis" e/ou "JAK inihibitors" e/ou "small molecules", durante o período de 2017 até julho de 2022. Tal data teve como fundamentação o fato do ano de 2017 ser marcado pela liberação tanto pela FDA como pela ANVISA do dupilumabe para o uso em dermatite atópica, primeiro medicamento biológico aprovado.
Foram selecionados os estudos clínicos na dermatite atópica em humanos tratados com inibidores de JAK sistêmicos ou tópicos e que avaliaram a eficácia e segurança do fármaco.
Foram excluídos da seleção os trabalhos que se caracterizavam como revisão de literatura, relatos de caso, opinião de especialistas, trabalhos experimentais laboratoriais ou em animais, estudos focados somente na farmacocinética dos medicamentos e estudos que avaliavam o uso de inibidores de JAK em outras doenças.
RESULTADOS
Foram encontrados 646 estudos, dos quais 609 foram excluídos por serem revisões de literatura, estudos experimentais laboratoriais ou em animais, resultados duplicados ou por não se enquadrarem nos demais critérios de inclusão. Foram selecionadas 37 publicações sobre os resultados de estudos clínicos envolvendo inibidores da JAK. Considerando que algumas publicações retratam pontos de análise diferentes tendo como base uma mesma população, ou seja, são derivadas de um mesmo estudo clínico controlado, foi observado que os 37 artigos selecionados foram baseados em 25 estudos clínicos randômicos e multicêntricos.
Os artigos selecionados analisaram os efeitos de diferentes doses das medicações, comparados com grupo placebo e em alguns casos comparados com outros tratamentos já estabelecidos na literatura. Os principais escores utilizados para avaliação da evolução da doença foram o Eczema Score and Severity Index (EASI) e o Investigator Global Assessment (IGA). O escore EASI consiste na avaliação do examinador que define a extensão da lesão em cada região do corpo e em seguida, classifica a gravidade do eritema, edema, escoriação e liquenificação das lesões de 0 a 3. A somatória dos pontos classifica a gravidade da doença, sendo grave acima de 21 pontos. Os estudos avaliaram a pontuação do EASI dos pacientes pré-tratamento e a melhora em porcentagem após uso das medicações. Um dos desfechos avaliados foi a proporção de pacientes que apresentaram 75% de melhora em relação ao início, denominando de EASI-75, ou 90% de melhora clínica, EASI-90, por exemplo. Já o IGA consiste na descrição morfológica das lesões, variando de 0 a 4. A maioria dos estudos estabeleceu como alvo terapêutico escore de IGA 0/1 (assintomáticos ou leves).
Alguns estudos, além de utilizar também outras escalas para análise do controle das lesões e de qualidade de vida, realizaram avaliação do prurido dos pacientes através da escala Pruritus Numerical Rating Scale (NRS), que consiste em duas perguntas pontuadas de 0-10. Considerou-se melhora significativa quando os pacientes apresentavam diminuição de 4 pontos ou mais na escala NRS.
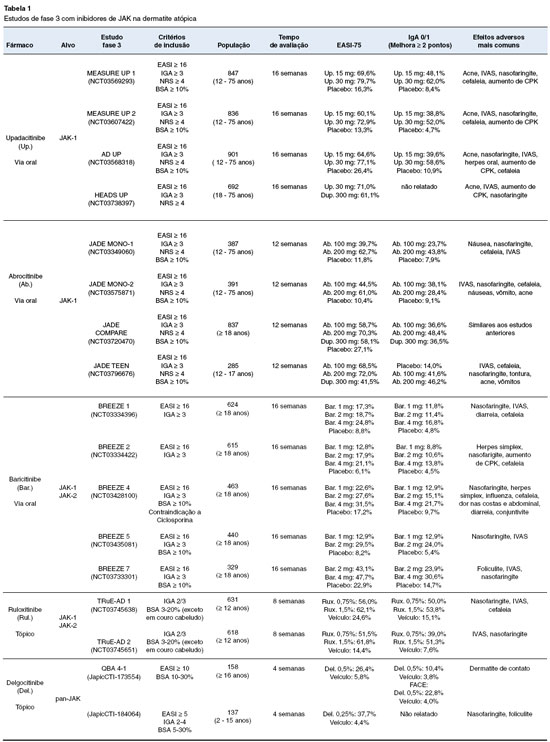
Os principais resultados dos estudos de fase 3 encontrados ao aplicar os termos de busca no PUBMED, considerando medicações sistêmicas e tópicas, encontram-se na Tabela 1.
Upadacitinibe
O upadacitinibe é um inibidor seletivo da JAK-1, bloqueando a ação das principais citocinas pro-inflamatórias. Já foi previamente autorizado para uso em artrite reumatoide em diversos países.
O primeiro estudo de fase 2 do upadacitinibe para dermatite atópica avaliou o uso de doses de 7,5 mg, 15 mg e 30 mg como monoterapia em comparação ao placebo, em 167 pacientes de 18 a 75 anos, com diagnóstico de dermatite atópica moderada-grave, acompanhados por 16 semanas. Notou-se que a melhora clínica dos pacientes foi proporcionalmente maior quanto maior a dose utilizada. Os achados embasaram a decisão de prosseguir com doses de 15 mg e 30 mg nos estudos de fase 3. Cerca de 69% dos pacientes em uso de upadacitinibe 30 mg atingiram EASI-75, seguidos de 52% no grupo tratado com 15 mg, 29% no grupo com dose menor de 7,5 mg e 10% no grupo placebo13,14.
Os estudos Measure UP 1 e 2 foram dois estudos de fase 3, replicados, duplo-cegos, que envolveram 847 e 836 pacientes voluntários, respectivamente, entre 12 e 75 anos, em mais de 150 centros especializados internacionalmente, que foram estratificados em grupos que receberam monoterapia com upadacitinibe com 15 mg, 30 mg, e um grupo placebo, sendo acompanhados inicialmente por 16 semanas. Nos dois estudos, os pacientes que receberam qualquer dose da medicação já começaram a apresentar melhora significativa no EASI com duas semanas de tratamento, sendo que 42,7% dos pacientes tratados com upadacitinibe atingiram EASI-75 no Measure UP 1 e 38,5% no Measure UP 2, comparados a 3,6% dos pacientes com placebo nos dois estudos. Na semana 16, considerando a soma das populações dos dois grupos de estudos, aproximadamente 76,3% dos pacientes tratados com upadacitinibe 30 mg e 64,9% dos pacientes tratados com 15 mg atingiram EASI-75, comparados com apenas 14,8% no grupo placebo. O prurido dos pacientes foi avaliado utilizando a escala NRS, e cerca de 9,8% dos pacientes já começaram a ter melhora de mais de 4 pontos ou mais com 2 dias de tratamento com 30 mg e 9,9% dos participantes com 3 dias de tratamento com 15 mg15.
O estudo AD UP, avaliou uma população de 901 pacientes entre 12-75 anos recebendo corticoesteroide tópico somado ao upadacitinibe em três grupos, de 15 mg, 30 mg ou placebo. Os pacientes apresentaram boa tolerância às medicações combinadas e a eficácia ao fim das 16 semanas também foi maior nos pacientes que usaram o inibidor de JAK, com 77,1% de pacientes obtendo EASI-75 com 30 mg, e 64,6% com 15 mg, versus 26,4% do grupo placebo. Em relação ao controle de prurido, 63,9% dos pacientes recebendo 30 mg apresentaram redução de 4 pontos ou mais no NRS, 51,7% dos pacientes tratados com 15 mg, e apenas 15,0% no grupo placebo ao final das 16 semanas16.
Nos estudos Measure UP 1 e 2, a incidência de efeitos adversos foi semelhante no grupo de 15 mg ou de 30 mg. A incidência de infecções graves foi menor que 1% em todos os grupos que receberam tratamento. Os pacientes que receberam a dose maior mostraram mais alterações hematológicas, e até 5% dos pacientes tratados com 30 mg apresentaram neutropenia no Measure UP 1, a maioria transitória, e nenhuma levou a descontinuação do tratamento. Nos dois grupos, os efeitos adversos mais frequentemente observados foram: acne (9,7% com 15 mg e 15,9% com 30 mg), infecção de vias aéreas superiores e nasofaringite (14,7% com 15 mg e 18,7% com 30 mg), cefaleia (5,7% com 15 mg e 6,9% com 30 mg) e elevação de CPK (4,5% com 15 mg e 4,9% com 30 mg). No estudo AD UP os resultados de efeitos adversos mais comuns se mantiveram semelhantes aos citados e não houve diferença de efeito adversos graves em relação aos grupos com tratamento e placebo15,16.
Um dos principais efeitos adversos encontrados nestes dois grandes estudos de fase 3 (Measure Up e AD UP) foi o aparecimento de acne vulgar (mais de 5%). A maioria dos casos eram de acne leve à moderada, sendo apenas um caso de acne grave. No total, três pacientes descontinuaram tratamento devido a acne. O efeito adverso foi mais comumente observado em mulheres, adultas, de população não branca, e sua incidência foi proporcionalmente maior quanto maior a dose recebida. A face foi o local mais acometido. As lesões tiveram início por volta de 40-43 dias de tratamento e cerca de 40-46% dos casos não necessitou de tratamento complementar17. O eczema herpético foi mais relatado nos estudos que avaliaram upadacitinibe em dermatite atópica do que em outras doenças. Nos estudos Measure Up, 20 pacientes que receberam a medicação apresentaram casos de herpes zoster, versus apenas 2 pacientes no grupo placebo15.
Os estudos foram prorrogados para a observação dos pacientes em uso de upadacitinibe até 52 semanas de tratamento. No estudo Measure UP, 82,0% dos pacientes tratados com 15 mg e 84,9% dos pacientes tratados com 30 mg atingiram EASI-75, mostrando maior potencial de melhora clínica com persistência da medicação em períodos mais prolongados18. Já no estudo AD UP, cerca de 69,0% dos pacientes tratados com upadacitinibe 30 mg e 50,8% com 15 mg atingiram EASI-75 na semana 52, sem mostrar mudança significativa em relação aos resultados da semana 16, apresentando uma leve perda de eficácia com as duas doses19. Não foram notadas diferenças em efeitos adversos nos dois estudos com tratamento mais prolongado. Os participantes dos estudos continuam em acompanhamento, com planos de novas análises ao completar 260 semanas.
O upadacitinibe também foi comparado com o dupilumabe em um estudo com 692 pacientes, entre 18 e 75 anos, que foram divididos em dois grupos, um recebendo tratamento com 30 mg/dia de upadacitinibe e outro 300 mg/14 dias de dupilumabe. Observou-se que ao fim de 16 semanas de tratamento, 60,6% pacientes do grupo tratado com o inibidor de JAK apresentaram EASI-90, comparado a 38,7% no grupo que recebeu o imunobiológico (p = 0,006)20.
Foram encontrados dois estudos publicados na plataforma PubMed que retratavam a experiência do uso do upadacitinibe em populações de países específicos. O estudo Rising UP foi realizado no Japão e contou com 272 pacientes, entre 12 e 75 anos de idade, recebendo 15 mg, 30 mg ou placebo. Os resultados mostraram-se semelhantes aos achados dos estudos com população internacional, e aproximadamente 65,3% de pacientes em uso de 15 mg e 76,2% em uso de 30 mg, atingiram EASI-75 ao fim de 16 semanas21. Na Espanha, um estudo de Pereyra-Rodriguez e cols., com uma amostra menor de apenas 43 participantes acima dos 12 anos, mostrou que 76,3% dos pacientes tratados com 30 mg e 64,9% do grupo que fez uso de 15 mg chegaram ao EASI-75. Neste estudo, todos os pacientes com menos de 18 anos e mais de 65 anos receberam 15 mg22.
Com os promissores resultados publicados, o upadacitinibe foi aprovado para tratamento de dermatite atópica em pacientes acima de 12 anos pela União Europeia em agosto de 202123, pelo FDA em janeiro de 202224, e pela ANVISA em maio do mesmo ano, para uso com doses iniciais de 15 mg/dia25.
Abrocitinibe
O abrocitinibe também é um inibidor seletivo da JAK-1, de ação sistêmica e administração via oral. Um estudo de fase 2 avaliou 267 pacientes, de 18 a 75 anos por 12 semanas. Os pacientes foram estratificados em grupos recebendo 200 mg, 100 mg, 30 mg, 10 mg ou placebo. Os grupos que receberam doses maiores de 100 mg ou 200 mg apresentaram resultados significativos em relação ao placebo, melhorando a gravidade da doença e o prurido, enquanto os pacientes que receberam as doses menores não mostraram melhora significativa26,27.
O grupo de estudos denominado JADE são os maiores estudos clínicos de fase 3 do abrocitinibe e avaliaram diversas populações com objetivos distintos. O JADE MONO-1 foi o primeiro estudo a avaliar o efeito da monoterapia com abrocitinibe em 387 pacientes, entre 12 e 75 anos, predominantemente com dermatite atópica moderada. Os pacientes foram randomizados em grupos para receber 100 mg, 200 mg ou placebo por 12 semanas. Neste estudo, 62,7% dos pacientes tratados com a dose maior e 39,7% dos pacientes com a menor dose atingiram EASI-75, contra 11,8% no grupo placebo. O controle de prurido foi avaliado com 2 semanas de tratamento, apresentando melhora em 46% e 20% dos pacientes tratados com 200 mg e 100 mg, respectivamente. Esta proporção aumentou ao final das 12 semanas, e cerca de 57,2% e 37,7% dos pacientes apresentaram NRS com melhora de 4 ou mais pontos28.
Em relação aos efeitos adversos, 69% dos pacientes tratados com 100 mg, e 78% dos pacientes tratados com 200 mg, relataram alguma reação potencialmente relacionada ao tratamento. O sintoma mais frequente foi náusea, presente em 20% dos pacientes que receberam 200 mg e em 9% dos pacientes com dose reduzida, contra 3% no grupo placebo. Outros sintomas comuns foram nasofaringite (12% com 200 mg e 15% com 100 mg), cefaleia (10% com 200 mg e 8% com 100 mg) e infecção das vias aéreas superiores (7% nos dois grupos). Cerca de 14% dos pacientes tratados com 100 mg apresentaram piora dos sintomas da dermatite. No grupo controle, esse percentual foi de 17%, e caiu para 5% nos pacientes tratados com 200 mg. Houve dois efeitos adversos graves considerados relacionados ao tratamento, onde um paciente desenvolveu doença inflamatória intestinal enquanto fazia uso de abrocitinibe 200 mg, e outro evoluiu com pancreatite durante o uso de 100 mg, não havendo óbitos. No total, 22 pacientes (14%) desenvolveram infecções relacionadas a herpes-vírus (herpes simplex, zoster, oral ou eczema herpético) enquanto receberam tratamento em qualquer dose, e apenas 1 paciente apresentou eczema herpético no grupo placebo. Notou-se uma tendência a plaquetopenia dose-dependente, por volta da quarta semana de tratamento. Um paciente descontinuou o tratamento devido a plaquetopenia persistente28.
O JADE MONO 2 foi um estudo replicado, com a mesma metodologia do anterior, com 391 pacientes e apresentou resultados semelhantes. Ao final das 12 semanas, 61% dos pacientes tratados com 200 mg e 44,5% dos tratados com 100 mg atingiram o EASI-75. O controle do prurido também foi similar, e a mediana de tempo para melhora foi de 29 dias no grupo com 200 mg, e 58 dias com 100 mg29.
Em relação ao escore IGA, no estudo JADE MONO 1, 43,8% dos pacientes com 200 mg e 23,9% dos indivíduos com 100 mg alcançaram IGA0/1 na análise de 12 semanas de tratamento. No JADE MONO 2, ainda menos pacientes atingiram o alvo, com 38,1% no grupo de 200 mg, e 28,4% no grupo tratado com 100 mg. No geral, os pacientes não respondedores no IGA tinham dermatite atópica mais grave no início dos estudos. Considerando toda a população avaliada do estudo de fase 2b somado ao JADE MONO 1 e 2, observou-se que uma maior porcentagem de pacientes que atingiram a pontuação desejada no IGA foi classificada com dermatite atópica moderada no início dos estudos, quando comparados com os não respondedores (72,7% vs. 58,8% de pacientes com IGA 3 no início dos estudos). Ao considerar outras escalas para avaliação da dermatite, observa-se que muitos pacientes que não chegaram no alvo do IGA obtiveram melhora clínica e de pontuações de outras ferramentas, sugerindo que a avaliação da eficácia do medicamento pelo IGA pode ser limitada. Entre não respondedores no IGA, nota-se que 41,0% dos que receberam 200 mg chegaram ao EASI-75 na semana 12, seguidos de 27,0% dos que receberam 100 mg de abrocitinibe30.
O estudo JADE REGIMEN foi feito com o objetivo de avaliar a terapia de manutenção. Em um primeiro momento, foram selecionados pacientes com dermatite atópica moderada/grave para realizarem tratamento com abrocitinibe 200 mg por 12 semanas. Ao final do período, estratificaram somente os pacientes respondedores, considerando os critérios do IGA, EASI e NRS em três grupos: o primeiro continuaria recebendo 200 mg, outro com 100 mg e outro placebo, para serem avaliados por 40 semanas. Neste período, a taxa de falha no tratamento de manutenção foi significativamente maior no grupo de 100 mg em relação ao grupo que recebeu a maior dose (HR 0,36; p < 0,0001). Notou-se que 39,6% dos pacientes tratados com 100 mg tiverem falha terapêutica, definida por redução de 50% do EASI em relação a pontuação obtida na semana 12 ou IGA de 2 ou mais, enquanto apenas 16,5% do grupo tratado com 200 mg. Em relação ao placebo, os dois grupos que receberam o medicamento apresentaram redução significativa de taxa de falha terapêutica, onde 77,5% dos pacientes no grupo placebo apresentaram falha31.
O estudo JADE COMPARE avaliou 837 pacientes estratificados em grupos para receber doses de abrocitinibe de 100 mg e 200 mg, comparados com dupilumabe 300 mg e um grupo placebo. Não houve diferença no desfecho entre os pacientes tratados com abrocitinibe 100 mg e dupilumabe - ambos os grupos englobaram 36% com IGA 0/1 e 58% com EASI-75 após 12 semanas de tratamento. No entanto, o grupo tratado com 200 mg de abrocitinibe apresentou melhores resultados, chegando a 48% no IGA 0/1 e 70% da amostra atingiu EASI-75. Os pacientes com dose mais alta apresentaram pouco mais efeitos adversos leves, como náuseas32. Ao avaliar o tempo de tratamento para melhora clínica, pacientes que usaram abrocitinibe 200 mg também apresentaram resultados melhores, com uma média de 29 dias para atingir EASI-75. No grupo de 100 mg, a média para atingir EASI-75 foi de até 32 dias, podendo chegar até 57 dias para melhora de lesões na cabeça, pescoço e membros superiores, resultado semelhante ao grupo tratado com dupilumabe33.
Os pacientes tratados com dupilumabe após 12 semanas foram novamente estratificados para receber tratamento com abrocitinibe com 100 mg ou 200 mg até completar 40 semanas de tratamento. Dos 54 pacientes que obtiveram melhora de 75 a 90% no EASI com o dupilumabe, cerca de 61,1% chegaram a EASI-90. Entre os 29 pacientes não respondedores em nenhum critério de avaliação ao dupilumabe, 8 tiveram melhora com a troca de medicação. No entanto, alguns pacientes que haviam respondido ao dupilumabe, com EASI-75, IGA 0/1 e/ou NRS com melhora de 4 ou mais pontos, não mantiveram a resposta com o uso do abrocitinibe, com variação de 7,6% a 23,1% a depender da dose e da escala utilizada34.
Os estudos JADE MONO 1 e 2 incluíram uma pequena parcela de adolescentes de 12 a 17 anos (21,7% e 10,2% da amostra). Os achados nessas populações seguiram a tendência de eficácia da população geral, com EASI-75 de 54,5% e 60% com abrocitinibe 200 mg, e de 44,1% e 43,8% com 100 mg no grupo 1 e 2, respectivamente. O estudo JADE TEEN contemplou 295 pacientes exclusivamente adolescentes e evidenciou que a diferença dos resultados com as doses diferentes foi menor (EASI-75 em 72,0% com 200 mg, e 68,5% com 100 mg). No entanto, nesse estudo os participantes puderam utilizar medicação tópica associada, o que se relacionou inclusive com o fato de uma maior porcentagem de pacientes no grupo controle ter melhor resposta clínica, onde cerca de 24,5% dos pacientes que receberam placebo atingiram EASI-75 em semanas35,36.
O medicamento também já está aprovado para uso em pacientes com dermatite atópica pela FDA para pacientes acima dos 18 anos nos Estados Unidos, desde janeiro de 202237.
Baricitinibe
O baricitinibe é um inibidor da JAK-1 e 2 e seu uso em dermatite atópica vem sendo estudado desde 2016, quando iniciaram-se os estudos de fase 238. O programa BREEZE-AD engloba 7 estudos de fase 3 para avaliar a eficácia do baricitinibe. Os primeiros estudos, denominados BREEZE-AD 1 e 2, foram dois estudos idênticos, duplo-cegos, que analisaram 624 e 615 participantes, respectivamente, com mais de 18 anos, por 16 semanas, recebendo placebo, 1 mg, 2 mg ou 4 mg de baricitinibe. Nestes primeiros estudos, o uso do inibidor de JAK mostrou redução significativa nas escalas de prurido com 2 mg e 4 mg de tratamento, mas as melhorias em relação ao EASI não foram igualmente relevantes39.
O estudo BREEZE 4 incluiu 463 participantes, maiores de 18 anos para analisar a resposta dos pacientes ao baricitinibe junto com corticoide tópico versus placebo. Os pacientes que receberam 4 mg do medicamento apresentaram EASI-75 em 32% dos casos. Já entre os pacientes que receberam 2 mg, 28% chegaram ao EASI-75, sem diferença significativa em relação ao placebo (17%)40.
O BREEZE 5 é um estudo que contempla apenas a população dos Estados Unidos e Canadá, com 440 participantes, e analisa o efeito somente de doses menores de baricitinibe de 1 mg e 2 mg, comparadas ao placebo. Observou-se que somente o baricitinibe na dose de 2 mg teve resultado significativo comparado com placebo, após 16 semanas de uso, em pacientes com superfície corporal afetada entre 10-50% - EASI-75 de 37,1% e IGA 0/1 de 31,7% no grupo de 2 mg, comparado com 9,9% e 6,9%, respectivamente, no grupo placebo (p < 0,001). Em pacientes com maior superfície corporal acometida e com dose de 1 mg não houve diferenças significativas em relação ao placebo41,42.
Entre os 329 pacientes do BREEZE 7, cerca de 31% dos que receberam 4 mg apresentaram IGA 0/1, comparado a 15% do grupo placebo. A diferença entre o grupo com 2 mg e placebo também não foi estatisticamente significativa, considerando o escore IGA. Ao considerar o EASI-75, notou-se que 48% e 43% dos pacientes tratados com 4 mg e 2 mg, alcançaram o alvo respectivamente, e apenas 23% do grupo placebo43.
Considerando todos os estudos, a porcentagem de pacientes que alcançou EASI-75 com 4 mg de baricitinibe nos estudos BREEZE AD 1, 2, 4 e 7 foi de 24,8%, 21,1%, 31,1% e 47,7%, respectivamente. Os achados são inferiores se comparados com outros inibidores de JAK44. Em uma comparação indireta com estudos anteriores utilizando dupilumabe, os estudos BREEZE não mostraram superioridade em relação ao imunobiológico (EASI-75 de 51% em SOLO 1 e 44% em SOLO 2, estudos que validaram o dupilumabe na dermatite atópica)45-46.
Apesar de uma eficácia demonstrada menor em relação aos outros dois inibidores de JAK via oral com estudos de fase 3 para dermatite atópica, o baricitinibe foi o primeiro inibidor de JAK aprovado para eczema na Europa, em setembro de 202044.
Ruxolitinibe
O ruxolitinibe é um inibidor tópico da JAK-1 e JAK-2. Foi desenvolvido para otimizar a ação do medicamento diretamente nas áreas afetadas e diminuir os riscos de efeitos adversos sistêmicos. Em estudo de fase 2, o ruxolitinibe apresentou melhora das lesões de forma rápida e sustentada, e não foi observado nenhum efeito adverso significativo47. Realizado com população dos Estados Unidos e Canadá, avaliou 307 pacientes, entre 18 e 70 anos, a fim de comparar o efeito tópico de ruxolitinibe em doses de 0,15%, 0,5% e 1,5%, uma ou duas vezes ao dia, com o Triancinolona 0,1%, e o veículo. Os pacientes foram inicialmente avaliados por um período de 4 semanas e as medicações não foram aplicadas na região facial. Após o primeiro mês de tratamento, as concentrações menores de ruxolitinibe não se mostraram superiores em relação ao corticoide tópico. Entre os pacientes que receberam ruxolitinibe 1,5% duas vezes por dia, 56% atingiram EASI-75, versus 47,1% do grupo com corticoide e 17,3% do grupo veículo. Após a quarta semana, os pacientes que receberam Triancinolona passaram por 4 semanas com veículo e após a oitava semana, todos os pacientes receberam ruxolitinibe 1,5% duas vezes ao dia para completar 12 semanas de análise. Nesse momento, 73,2% dos 252 pacientes que completaram o estudo, apresentaram EASI-75, indicando que a mudança para o inibidor de JAK tópico acarretou melhora adicional das lesões48.
Os estudos TRuE-AD 1 e 2 foram dois estudos em paralelo, duplo-cegos, de fase 3, que avaliaram o efeito do ruxolitinibe tópico em pacientes com 12 anos ou mais, com dermatite atópica leve/moderada, avaliados por 8 semanas. Foram randomizados 631 pacientes no TRue-AD 1, e 616 pacientes no TruE-AD 2, para receber ruxolitinibe creme 0,75%, 1,5% ou um veículo sem o composto ativo, aplicados 2 vezes ao dia49.
As duas concentrações de ruxolitinibe mostraram melhora das lesões em relação ao veículo. Entre os pacientes que usaram 0,75%, no TRuE-AD 1, 50% atingiram IGA 0/1 e 56% chegaram a EASI-75, comparado a IGA 0/1 de 53,8% e EASI-75 de 62,1% entre os indivíduos que receberam concentração de 1,5%. No TRuE-AD 2, observou-se que 39% e 51,5% dos pacientes que receberam a medicação em menor concentração chegaram a IGA 0/1 e EASI-75, respectivamente, e que no grupo que recebeu a dose maior, 51,3% atingiram IGA 0/1 e 61,8% chegaram a EASI-75. No grupo veículo, 15,1% e 24,6% dos pacientes chegaram a IGA 0/1 e EASI-75 no TRuE-AD 1, e 7,6% e 14,4% atingiram os alvos de IGA e EASI no TRuE-AD 2, respectivamente49.
O efeito adverso mais comum observado no estudo foi queimação no local de aplicação, que foi relatado em maior porcentagem inclusive no grupo veículo (4,4% contra 0,6% com ruxolitinibe 0,75%, e 0,8% com ruxolitinibe 1,5%). Nenhum efeito adverso grave foi relacionado ao uso da medicação49.
Em setembro de 2021, o ruxolitinibe foi aprovado para uso em dermatite atópica pela FDA, sendo o primeiro inibidor de JAK aprovado para uso nos Estados Unidos, na concentração de 1,5% em pacientes acima dos 12 anos50.
Delgocitinibe
O delgocitinibe é um inibidor pan-Janus Kinase, ou seja, inibe JAK-1, JAK-2, JAK-3 e TYK-2, de apresentação tópica. Foram encontrados resultados de estudos de fase 1, 2 e 3, realizados no Japão. Nos estudos de fase 1, o medicamento foi testado em adultos, e a aplicação local do medicamento se mostrou segura, sem reações locais imediatas e aparente melhora após 7 dias de uso50.
Um estudo de fase 2 envolveu 38 centros e contou com 366 participantes de 16 a 65 anos, randomizados em grupos para receber delgocitinibe a 0,25%, 0,5%, 1%, 3%, ou ainda, para receber o veículo ou Tracolimus 0,1% por 4 semanas. O grupo veículo demonstrou as maiores taxas de necessidade de tratamento de resgate, que foi caindo progressivamente de acordo com o aumento da dose do delgocitinibe. Neste estudo, 23% dos pacientes tratados com medicação a 3% atingiram IGA 0/1 comparado com 3% do grupo veículo. Apenas a dose mais alta mostrou-se igual ou superior ao Tracolimus51.
Foi encontrado um estudo de fase 2 que avaliou o uso de delgocitinibe na população pediátrica. Foram avaliados 103 pacientes, entre 2 e 15 anos, com EASI maior do que 5, excluindo as regiões de cabeça e pescoço, IGA maior ou igual a 2 e área do eczema entre 5 e 30%. Os pacientes foram estratificados para receberem a medicação a 0,25%, 0,5% ou o veículo. Ao final de 4 semanas, 50% dos pacientes tratados com 0,5% atingiram EASI-75%, 38,2% do grupo que recebeu 0,25% e 8,6% do grupo controle. A melhora do prurido já começou a ser observada na primeira semana de tratamento, com as duas doses52.
O estudo de fase 3 com a população pediátrica englobou uma primeira parte, onde 137 pacientes foram randomizados para receber delgocitinibe 0,25% ou veículo por 4 semanas. Nesta etapa, 37,7% dos pacientes que receberam a medicação chegaram a EASI-75, comparados a 4,4% do grupo controle. Na segunda etapa do estudo, os pacientes foram acompanhados por mais 52 semanas de uso do medicamento, recebendo delgocitinibe a 0,25% ou 0,5%. Cerca de 52,5% dos pacientes atingiram EASI-75. Os efeitos adversos foram leves e relacionados ao tratamento em 9,7% dos pacientes. O mais comum foi foliculite no local de aplicação e um paciente descontinuou o tratamento devido a acne53.
Os pacientes acima de 16 anos também foram incluídos em estudos de fase 3. O estudo QBA4-2 avaliou os pacientes por 52 semanas, onde todos os pacientes receberam delgocitinibe 0,5%, sem grupo controle. A proporção de pacientes que atingiu EASI-75 na semana 4 foi de 10,9%, e após 52 semanas foi de 27,5%. Ocorreram efeitos adversos graves em 1,4% dos pacientes. Um participante apresentou erupção variceliforme de Kaposi considerada relacionada à aplicação, com início após 26 dias de tratamento, e necessitou suspender a medicação. Cerca de 3,4% dos pacientes suspenderam o tratamento devido a efeitos adversos, sendo dermatite de contato o efeito mais comum54,55.
O delgocitinibe foi aprovado para uso tópico em dermatite atópica no Japão, na concentração 0,25% e 0,5% para a população adulta e crianças acima dos dois anos de idade, desde março de 202155.
CONCLUSÃO
O uso dos inibidores de JAK iniciou, recentemente, a ser regulamentado para uso em dermatite atópica na prática clínica em diversos países. Esta classe de pequenas moléculas mostrou-se promissora no tratamento de diversas doenças, desde doenças autoimunes, câncer, doenças virais e alérgicas. No entanto, como toda medicação nova, requer atenção para seus potenciais eventos adversos. Ao estudar o mecanismo de ação destes medicamentos, é possível levantar preocupações quanto aos demais potenciais efeitos em outros sistemas que eles eventualmente podem afetar. Sabe-se que a via JAK-STAT não está presente apenas na inflamação do tipo 2, mas também participa na modulação de outras funções de fundamental importância, como em outras vias da imunidade e hematopoiética. Os resultados do uso, quando bem indicados, mostraram-se positivos, e em alguns casos, superiores a outros tratamentos já preconizados para o controle da dermatite atópica.
REFERÊNCIAS
1. Weidinger S, Beck LA, Bieber T, Kabashima K, Irvine AD. Atopic dermatitis. Nat Rev Dis Primers. 2018;4(1). doi: 10.1038/s41572-018-0001-z.
2. Institute for Health Metrics and Evaluation [Internet]. Atopic dermatitis - Level 4 cause. [Internet]. Disponível em: https://www.healthdata.org/results/gbd_summaries/2019/atopic-dermatitis-level-4-cause. Acessado em: 05/07/2022.
3. Solé D, Wandalsen GF, Camelo-Nunes IC, Naspitz CK, Group IB. Prevalence of symptoms of asthma, rhinitis, and atopic eczema among Brazilian children and adolescents identified by the International Study of Asthma and Allergies in Childhood (ISAAC) - Phase 3. J Pediatr (Rio J). 2006;82(5):341-6. doi:10.2223/jped.1521.
4. Dubin C, Del Duca E, Guttman-Yassky E. The IL-4, IL-13 and IL-31 pathways in atopic dermatitis. Expert Rev Clin Immunol. 2021;17(8):835-52. doi: 10.1080/1744666x.2021.1940962.
5. Howell MD, Fitzsimons C, Smith PA. JAK/STAT inhibitors and other small molecule cytokine antagonists for the treatment of allergic disease. Ann Allergy Asthma Immunol. 2018;120(4):367-75. doi:10.1016/j.anai.2018.02.012.
6. Klein B, Treudler R, Simon JC. JAK inhibitors in dermatology - small molecules, big impact? Overview of the mechanism of action, previous study results and potential adverse effects. J Dtsch Dermatol Ges. 2022;20(1):19-24. doi: 10.1111/ddg.14668.
7. ANVISA. Agência Nacional de Vigilância Sanitária. Dupixent (dupilumabe): nova indicação [Internet]. Disponível em: https://www.gov.br/anvisa/pt-br/assuntos/medicamentos/novos-medicamentos-e-indicacoes/dupixent-dupilumabe-nova-indicacao. Acessado em: 10/07/2022.
8. FDA. Dupilumab - Drugs@FDA: FDA-Approved Drugs [Internet]. Disponível em: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process. Acessado em: 10/07/2022.
9. Stölzl D, Weidinger S, Drerup K. A new era has begun: Treatment of atopic dermatitis with biologics. Allergol Select. 2021;5:265-73. doi.org: 10.5414/alx02259e
10. Soeberdt M, Kilic A, Abels C. Small molecule drugs for the treatment of pruritus in patients with atopic dermatitis. Eur J Pharmacol. 2020;881: 73242. doi: 10.1016/j.ejphar.2020.173242
11. Li Q, Kang C. Mechanisms of Action for Small Molecules Revealed by Structural Biology in Drug Discovery. Int J Mol Sci. 2020;21(15):5262. doi: 10.3390/ijms21155262.
12. FDA. Ruloxitinib. Drugs@FDA: FDA-Approved Drugs; [Internet]. Disponível em: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=215309. Acessado em: 10/07/2022.
13. Guttman-Yassky E, Thaçi D, Pangan AL, Hong HC, Papp KA, Reich K, et al. Upadacitinib in adults with moderate to severe atopic dermatitis: 16-week results from a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2020;145(3):877-84. doi: 10.1016/j.jaci.2019.11.025.
14. Mohamed MF, Gopalakrishnan S, Teixeira HD, Othman AA. Exposure-Response Analyses for Upadacitinib Efficacy in Subjects With Atopic Dermatitis-Analyses of Phase 2b Study to Support Selection of Phase 3 Doses. J Clin Pharmacol. 2021;61(5):628-35. doi: 10.1002/jcph.1782.
15. Guttman-Yassky E, Teixeira HD, Simpson EL, Papp KA, Pangan AL, Blauvelt A, et al. Once-daily upadacitinib versus placebo in adolescents and adults with moderate-to-severe atopic dermatitis (Measure Up 1 and Measure Up 2): results from two replicate double-blind, randomised controlled phase 3 trials. Lancet. 2021;397(10290):2151-68. doi: 10.1016/S0140-6736(21)00588-2
16. Reich K, Teixeira HD, de Bruin-Weller M, Bieber T, Soong W, Kabashima K, et al. Safety and efficacy of upadacitinib in combination with topical corticosteroids in adolescents and adults with moderate-to-severe atopic dermatitis (AD Up): results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2021;397(10290):2169-81. doi: 10.1016/S0140-6736(21)00589-4.
17. Mendes-Bastos P, Ladizinski B, Guttman-Yassky E, Jiang P, Liu J, Prajapati VH, et al. Characterization of acne associated with upadacitinib treatment in patients with moderate-to-severe atopic dermatitis: A post hoc integrated analysis of 3 phase 3 randomized, double-blind, placebo-controlled trials. J Am Acad Dermatol. 2022. doi: 10.1016/j.jaad.2022.06.012.
18. Simpson EL, Papp KA, Blauvelt A, Chu CY, Hong HC, Katoh N, et al. Efficacy and Safety of Upadacitinib in Patients with Moderate to Severe Atopic Dermatitis: Analysis of Follow-up Data From the Measure Up 1 and Measure Up 2 Randomized Clinical Trials. JAMA Dermatol 2022;158(4):404-13. doi: 10.1001/jamadermatol.2022.0029
19. Silverberg JI, de Bruin-Weller M, Bieber T, Soong W, Kabashima K, Costanzo A, et al. Upadacitinib plus topical corticosteroids in atopic dermatitis: Week 52 AD Up study results. J Allergy Clin Immunol 2022;149(3):977-87.e14. doi: 10.1016/j.jaci.2021.07.036.
20. Blauvelt A, Teixeira HD, Simpson EL, Costanzo A, De Bruin-Weller M, Barbarot S, et al. Efficacy and Safety of Upadacitinib vs Dupilumab in Adults with Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol 2021;157(9):1047-55. doi: 10.1001/jamadermatol.2021.3023.
21. Katoh N, Ohya Y, Murota H, Ikeda M, Hu X, Ikeda K, et al. A phase 3 randomized, multicenter, double-blind study to evaluate the safety of upadacitinib in combination with topical corticosteroids in adolescent and adult patients with moderate-to-severe atopic dermatitis in Japan (Rising Up): An interim 24-week analysis. JAAD Int. 2021;6:27-36. doi: 10.1016/j.jdin.2021.11.001.
22. Pereyra-Rodriguez JJ, Herranz P, Figueras-Nart I, Perez B, Elosua M, Munera-Campos M, et al. Treatment of severe atopic dermatitis with upadacitinib in real clinical practice. Short-term efficacy and safety results. J Investig Allergol Clin Immunol. 2022. doi: 10.18176/jiaci.0831.
23. European Medicines Agency [Internet]. Rinvoq - european medicines agency. Disponível em: https://www.ema.europa.eu/en/medicines/human/EPAR/rinvoq. Acessado em: 10/07/2022.
24. FDA. Upadacitinib - Drugs@FDA: FDA-Approved Drugs [Internet]. Disponível em: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process. Acessado em: 15/07/2022.
25. Diário Oficial da União. Ministério da Saúde/Agência Nacional de Vigilância Sanitária/2ª Diretoria/Gerência-Geral de Medicamentos e Produtos. Resolução Re Nº 1.355, de 28 de Abril de 2022; 2022 Disponível em: https://www.in.gov.br/web/dou/-/resolucao-re-n-1.355-de-28-de-abril-de-2022-396547245. Acessado em: 15/07/2022.
26. Gooderham MJ, Forman SB, Bissonnette R, Beebe JS, Zhang W, Banfield C, et al. Efficacy and Safety of Oral Janus Kinase 1 Inhibitor Abrocitinib for Patients with Atopic Dermatitis: A Phase 2 Randomized Clinical Trial. JAMA Dermatol. 2019;155(12):1371-9. doi: 10.1001/jamadermatol.2019.2855.
27. Simpson EL, Wollenberg A, Bissonnette R, Silverberg JI, Papacharalambous J, Zhu L, et al. Patient-Reported Symptoms and disease impacts in adults with Moderate-to-Severe Atopic Dermatitis: results from a Phase 2b study with Abrocitinib. Dermatitis 2021;32:S53-S61. doi: 10.1097/DER.0000000000000725.
28. Silverberg JI, Simpson EL, Thyssen JP, Gooderham M, Chan G, Feeney C, et al. Efficacy and Safety of Abrocitinib in Patients With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. 2020;156(8):863-73. doi: 10.1001/jamadermatol.2020.1406.
29. Simpson EL, Sinclair R, Forman S, Wollenberg A, Aschoff R, Cork M, et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet. 2020;396(10246):255-66. doi: 10.1016/S0140-6736(20)30732-7.
30. Blauvelt A, Boguniewicz M, Brunner PM, Luna PC, Biswas P, DiBonaventura M, et al. Abrocitinib monotherapy in Investigator's Global Assessment nonresponders: improvement in signs and symptoms of atopic dermatitis and quality of life. J Dermatolog Treat. 2022;33(5):2605-13. doi: 10.1080/09546634.2022.2059053.
31. Blauvelt A, Silverberg JI, Lynde CW, Bieber T, Eisman S, Zdybski J, et al. Abrocitinib induction, randomized withdrawal, and retreatment in patients with moderate-to-severe atopic dermatitis: Results from the JAK1 Atopic Dermatitis Efficacy and Safety (JADE) REGIMEN phase 3 trial. J Am Acad Dermatol. 2022;86(1):104-12. doi: 10.1016/j.jaad.2021.05.075.
32. Shi VY, Bhutani T, Fonacier L, Deleuran M, Shumack S, Valdez H, et al. Phase 3 efficacy and safety of abrocitinib in adults with moderate-to-severe atopic dermatitis after switching from dupilumab (JADE EXTEND). J Am Acad Dermatol. 2022;87(2):351-8. doi: 10.1016/j.jaad.2022.04.009.
33. Thyssen JP, Yosipovitch G, Paul C, Kwatra SG, Chu CY, DiBonaventura M, et al. Patient-reported outcomes from the JADE COMPARE randomized phase 3 study of abrocitinib in adults with moderate-to-severe atopic dermatitis. J Eur Acad Dermatol Venereol. 2022;36(3):434-43. doi: 10.1111/jdv.17813.
34. Alexis A, de Bruin-Weller M, Weidinger S, Soong W, Barbarot S, Ionita I, et al. Rapidity of Improvement in Signs/Symptoms of Moderate-to-Severe Atopic Dermatitis by Body Region with Abrocitinib in the Phase 3 JADE COMPARE Study. Dermatol Ther (Heidelb). 2022;12(3):771-85. doi: 10.1007/s13555-022-00694-1.
35 Eichenfield LF, Flohr C, Sidbury R, Siegfried E, Szalai Z, Galus R, et al. Efficacy and Safety of Abrocitinib in Combination With Topical Therapy in Adolescents With Moderate-to-Severe Atopic Dermatitis: The JADE TEEN Randomized Clinical Trial. JAMA Dermatol. 2021;157(10):1165-73. doi: 10.1001/jamadermatol.2021.2830.
36. Cork MJ, McMichael A, Teng J, Valdez H, Rojo R, Chan G, et al. Impact of oral abrocitinib on signs, symptoms and quality of life among adolescents with moderate-to-severe atopic dermatitis: an analysis of patient-reported outcomes. J Eur Acad Dermatol Venereol. 2022;36(3):422-33. doi: 10.1111/jdv.17792.
37. FDA. Abrocitinib - Drugs@FDA: FDA-Approved Drugs. [Internet].Disponível em: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process. Acessado em: 12/07/2022.
38. Guttman-Yassky E, Silverberg JI, Nemoto O, Forman SB, Wilke A, Prescilla R, et al. Baricitinib in adult patients with moderate-to-severe atopic dermatitis: A phase 2 parallel, double-blinded, randomized placebo-controlled multiple-dose study. J Am Acad Dermatol. 2019;80(4):913-21.e9. doi: 10.1016/j.jaad.2018.01.018
39. Reich K, DeLozier AM, Nunes FP, Thyssen JP, Eichenfield LF, Wollenberg A, et al. Baricitinib improves symptoms in patients with moderate-to-severe atopic dermatitis and inadequate response to topical corticosteroids: patient-reported outcomes from two randomized monotherapy phase III trials. J Dermatolog Treat. 2020;22:1-10. doi: 10.1080/09546634.2020.1839008.
40. Bieber T, Reich K, Paul C, Tsunemi Y, Augustin M, Lacour JP, et al. BREEZE-AD4 study group. Efficacy and safety of baricitinib in combination with topical corticosteroids in patients with moderate-to-severe atopic dermatitis with inadequate response, intolerance or contraindication to ciclosporin: results from a randomized, placebo-controlled, phase III clinical trial (BREEZE-AD4). Br J Dermatol. 2022. doi: 10.1111/bjd.21630.
41. Silverberg JI, Boguniewicz M, Waibel J, Weisman J, Strowd L, Sun L et al. Clinical Tailoring of Baricitinib 2 mg in Atopic Dermatitis: Baseline Body Surface Area and Rapid Onset of Action Identifies Response at Week 16. Dermatol Ther (Heidelb). 2022 Jan;12(1):137-48. doi: 10.1007/s13555-021-00640-7.
42. Simpson EL, Forman S, Silverberg JI, Zirwas M, Maverakis E, Han G, et al. Baricitinib in patients with moderate-to-severe atopic dermatitis: Results from a randomized monotherapy phase 3 trial in the United States and Canada (BREEZE-AD5). J Am Acad Dermatol. 2021;85(1):62-70. doi: 10.1016/j.jaad.2021.02.028.
43. Reich K, Kabashima K, Peris K, Silverberg JI, Eichenfield LF, Bieber T, et al. Efficacy and Safety of Baricitinib Combined With Topical Corticosteroids for Treatment of Moderate to Severe Atopic Dermatitis: A Randomized Clinical Trial. JAMA Dermatol. 2020;156(12):1333-1343. doi: 10.1001/jamadermatol.2020.3260.
44. European Medicines Agency. Olumiant. [Internet] Disponível em: https://www.ema.europa.eu/en/medicines/human/EPAR/olumiant. Acessado em: 22/07/2022.
45. de Bruin-Weller MS, Serra-Baldrich E, Barbarot S, Grond S, Schuster C, Petto H, et al. Indirect Treatment Comparison of Baricitinib versus Dupilumab in Adults with Moderate-to-Severe Atopic Dermatitis. Dermatol Ther (Heidelb). 2022;12(6):1481-91. doi: 10.1007/s13555-022-00734-w.
46. Simpson EL, Bieber T, Guttman-Yassky E, Beck LA, Blauvelt A, Cork MJ, et al.; SOLO 1 and SOLO 2 Investigators. Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016;375(24):2335-48. doi: 10.1056/NEJMoa1610020.
47. Kim BS, Howell MD, Sun K, Papp K, Nasir A, Kuligowski ME; INCB 18424-206 Study Investigators. Treatment of atopic dermatitis with ruxolitinib cream (JAK1/JAK2 inhibitor) or triamcinolone cream. J Allergy Clin Immunol 2020;145(2):572-82. doi: 10.1016/j.jaci.2019.08.042.
48. Kim BS, Sun K, Papp K, Venturanza M, Nasir A, Kuligowski ME. Effects of ruxolitinib cream on pruritus and quality of life in atopic dermatitis: Results from a phase 2, randomized, dose-ranging, vehicle- and active-controlled study. J Am Acad Dermatol. 2020;82(6):1305-13. doi: 10.1016/j.jaad.2020.02.009.
49. Papp K, Szepietowski JC, Kircik L, Toth D, Eichenfield LF, Leung DYM, Forman SB, et al. Efficacy and safety of ruxolitinib cream for the treatment of atopic dermatitis: Results from 2 phase 3, randomized, double-blind studies. J Am Acad Dermatol. 2021;85(4):863-72. doi: 10.1016/j.jaad.2021.04.085.
50. Nakagawa H, Nemoto O, Yamada H, Nagata T, Ninomiya N. Phase 1 studies to assess the safety, tolerability and pharmacokinetics of JTE-052 (a novel Janus kinase inhibitor) ointment in Japanese healthy volunteers and patients with atopic dermatitis. J Dermatol. 2018;45(6):701-9. doi: 10.1111/1346-8138.14322.
51. Nakagawa H, Nemoto O, Igarashi A, Nagata T. Efficacy and safety of topical JTE-052, a Janus kinase inhibitor, in Japanese adult patients with moderate-to-severe atopic dermatitis: a phase II, multicentre, randomized, vehicle-controlled clinical study. Br J Dermatol. 2018;178(2):424-32. doi: 10.1111/bjd.16014.
52. Nakagawa H, Nemoto O, Igarashi A, Saeki H, Oda M, Kabashima K, Nagata T. Phase 2 clinical study of delgocitinib ointment in pediatric patients with atopic dermatitis. J Allergy Clin Immunol 2019; 144(6): 1575-83. doi:10.1016/j.jaci.2019.08.004
53. Nakagawa H, Nemoto O, Igarashi A, Saeki H, Kabashima K, Oda M, et al. Delgocitinib ointment in pediatric patients with atopic dermatitis: A phase 3, randomized, double-blind, vehicle-controlled study and a subsequent open-label, long-term study. J Am Acad Dermatol. 2021;85(4):854-62. doi: 10.1016/j.jaad.2021.06.014.
54. Nakagawa H, Nemoto O, Igarashi A, Saeki H, Murata R, Kaino H, Nagata T. Long-term safety and efficacy of delgocitinib ointment, a topical Janus kinase inhibitor, in adult patients with atopic dermatitis. J Dermatol 2020;47(2):114-20. doi: 10.1111/1346-8138.15173.
55. Dhillon S. Delgocitinib: First Approval. Drugs 2020;80(6):609-15. doi: 10.1007/s40265-020-01291-2.
56. Ahn J, Choi Y, Simpson EL. Therapeutic New Era for Atopic Dermatitis: Part 2. Small Molecules. Ann Dermatol 2021;33(2):101-7. doi: 10.5021/ad.2021.33.2.101.