Número Atual: Julho-Setembro 2022 - Volume 6 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Aspectos evolutivos dos fenômenos imunopatológicos com ênfase na COVID-19
Evolutionary aspects of immunopathological phenomena with emphasis on COVID-19
Selma Giorgio; Pedro Henrique Gallo-Francisco
DOI: 10.5935/2526-5393.20220037
Departamento de Biologia Animal, Instituto de Biologia, Universidade Estadual de Campinas, Campinas, SP, Brasil
Endereço para correspondência:
Selma Giorgio
E-mail: sgiorgio@unicamp.br
Submetido em: 23/03/2022
Aceito em: 15/07/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A seleção natural é o principal mecanismo da evolução das espécies, e favorece fenótipos com defesas imunes efetivas contra patógenos. Entretanto, há uma grande variação das respostas imunes entre os indivíduos da espécie humana e a ocorrência de fenômenos imunopatológicos. A infecção com o vírus da família Coronaviridae, SARS-CoV-2, responsável pela doença conhecida como COVID-19, induz a respostas imunes inflamatórias exacerbadas e à tempestade de citocinas, nos casos graves. Nesta revisão discutiremos, à luz da Evolução, esse aparente paradoxo entre as respostas imunes, e os três principais fatores que contribuem para a manutenção dos fenótipos hiperativos: o custo-benefício das respostas imunes, a coevolução e a história de vida da espécie.
Descritores: SARS-CoV-2, citocinas, evolução biológica.
INTRODUÇÃO
O I Simpósio Internacional de Imunopatologia em 1958 reuniu pela primeira vez pesquisadores interessados no impacto da imunologia na clínica médica. A partir desse Simpósio, a imunopatologia foi definida como a área de estudos das reações imunes que causam, modificam ou acompanham os estados patológicos1. Em uma monografia (teaching monography), publicada em 1978 pelo American Journal of Pathology 2, Stewart Sell chamou a atenção para a ambiguidade da palavra imunopatologia, composta de dois termos com significados distintos: a imunidade a qual se refere às respostas imunes protetoras contra agentes externos, e a patologia, que é o estudo de doenças2. As condições patológicas tais como: as doenças autoimunes, as hipersensibilidades e alergias a substâncias inócuas ou alimentos, e os fenômenos imunopatológicos induzidos por patógenos, são resultados de respostas imunes inapropriadas. A resposta imune ideal é aquela que resulta na eliminação do patógeno e no restabelecimento da homeostase do organismo, sem causar danos celular e tecidual3,4.
Há um aparente paradoxo no sistema imune da espécie humana, pois a seleção natural, principal mecanismo da Evolução, deveria selecionar fenótipos com defesas imunes efetivas contra patógenos, mas observa-se grande variação nas respostas imunes entre os indivíduos e a ocorrência dos fenômenos imunopatológicos4,5. A infecção com o vírus da família Coronaviridae, SARS-CoV-2, responsável pela doença conhecida como COVID-19 e pela pandemia que vivemos recentemente6,7, é um dos exemplos disso. A taxa de mortalidade dessa doença é de, aproximadamente, 3,7%, e chegaram a 50% em pacientes em estágio grave8. Os principais sintomas associados à COVID-19 são febre (98% dos pacientes), tosse (76%), dispneia (55%) e mialgia ou fadiga (44%). Nos estágios graves ocorre pneumonia e a síndrome respiratória aguda severa (SARS)8.
O vírus SARS-CoV-2 coloniza as vias áreas superiores e a cavidade naso-faríngea9. O sistema imune inato está envolvido na resposta inicial às infecções, e com a participação dos receptores TLR3 (Toll-Like receptor 3), TLR-4 e TLR-7, os quais se ligam a moléculas do vírus, presentes no citoplasma das células epiteliais infectadas: dsRNA, proteína Spike e ssRNA, respectivamente, resultando na produção de diversas citocinas com efeitos antivirais, como os interferons (IFNs) e a citocina inflamatória IL-6 (interleucina-6) (Figura 1). A resposta imune adaptativa, que é crítica para o clearence viral, tem a participação de linfócitos T CD4, T CD8 e B e os anticorpos8,9. Com a migração de células dendríticas que internalizaram antígenos virais, para linfonodos regionais, inicia-se a ativação dos linfócitos T (Figura 1). Estes proliferam e migram para o pulmão, induzindo a produção local de citocinas e o recrutamento celular8,9. As respostas imunológicas antivirais, entretanto, podem resultar em imunopatologia, quando níveis elevados de citocinas e quimiocinas inflamatórias, tais como IL-1β, IL-6, IL-8, IL-12, TNF-α (fator necrosante de tumor) e os IFNs são produzidos no pulmão e sistemicamente, desencadeando mais ativação imune e inflamação, criando um loop de retroalimentação positiva, que resulta em extensa lise tecidual e perda funcional do órgão8-10 (Figura 1).
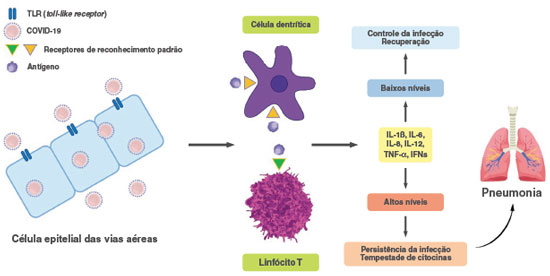
Figura 1
Representação esquemática das respostas imunes contra o vírus SARS-CoV-2
O vírus interage com receptores Toll-Like (TLR) nas células epiteliais das vias aéreas induzindo a produção de citocinas. As células dendritícas, transportando antígenos virais, migram para linfonodos regionais, apresentam esses antígenos e ativam linfócitos T, que migram para os pulmões. Os indivíduos podem exibir diferentes perfis de respostas imunes: um relacionado com a produção de níveis controlados das citocinas inflamatórias, resultando no clearence viral e na recuperação do indivíduo infectado; e o outro, com a produção de níveis muito elevados das citocinas inflamatórias, ocasionando na persistência da infecção viral e pneumonia
Apesar da gravidade das manifestações clínicas da COVID-19 estar relacionada às condições sistêmicas manifestadas nos indivíduos infectados6, também há variação na intensidade e reatividade das respostas imunes entre os indivíduos infectados, e consequentemente, nos desfechos da doença. A inflamação descontrolada associa-se diretamente à mortalidade, é conhecida como síndrome hiperinflamatória ou tempestade de citocinas, e resulta na SARS8. Nosso objetivo nesta revisão é discutir, à luz da Evolução, a seguinte questão: por que as respostas imunes exacerbadas, tais como a produção descontrolada de citocinas inflamatórias, observada na COVID-19, mas também durante o choque séptico e na malária13, são conservadas na população?
Na Medicina Evolutiva aplica-se a teoria da Evolução para o entendimento dos problemas de saúde e o aperfeiçoamento das abordagens médicas14. A princípio, podemos considerar que os fenômenos imunopatológicos conflitam com o Darwinismo e a Evolução4,12, pois a seleção natural opera no sistema imune, para sua otimização e na manutenção de fenótipos mais adaptados ao ambiente em que vivem4,5,11. No entanto, a seleção natural também favorece respostas imunes "defeituosas", que resultam em fenômenos imunopatológicos, isto é, em fenótipos com propensão a respostas inflamatórias excessivas. Os três principais fatores que contribuem para a manutenção de fenótipos com respostas imunes hiper-reativas são: o custo-benefício, a coevolução e a história de vida da espécie4,5,11,12. Nesta revisão, discutiremos esses fatores e responderemos à questão levantada acima.
FONTES DE DADOS
Revisão não sistemática da literatura, com busca e seleção de artigos disponíveis nas bases de dados PubMed, SciELO, Web of Science e Google Scholar System, e publicados entre 1957 e 2022, em inglês ou português, sem restrições de local, tendo como palavras de busca: "SARS-CoV-2", "COVID-19", "immunopathology", "inflammation","cytokines" ou "Biologic Evolution". O levantamento bibliográfico foi realizado em janeiro de 2022.
O CUSTO-BENEFÍCIO
Apesar dos ajustes finos das reações imunes às situações de estresse ocorrerem com frequência, observa-se grande variação, na intensidade das respostas imunes entre indivíduos, de respostas protetoras e estéreis à hiperinflamação, e uma explicação para tal fato é o trade-off 5,15,16. O conceito de trade-off refere-se aos conflitos seletivos em que uma espécie, ao seguir um caminho evolutivo vantajoso, "pagará um preço" por isso, ou seja, existirá alguma desvantagem associada a essa inovação biológica5,17,18. Por exemplo, os custos para o completo clearence de um vírus são os danos teciduais causados pelas células do sistema imune no combate ao patógeno5. Modelagens matemáticas de várias situações relacionadas às infecções5,19,20,21 indicaram que o risco de morte devido às infecções com espécies de vírus os quais têm padrão de transmissão semelhante ao do SARS-CoV-2, é mais acentuado do que o risco de morte por conta dos fenômenos imunopatológicos resultantes das respostas imunes. A seleção natural favorecerá defesas imunes mais reativas e intensas, mesmo com algum risco de morte do hospedeiro5,22. Contudo, há dois custos extras: a probabilidade de erro no reconhecimento de antígenos (reconhecimento do self, ocasionando doenças autoimunes) e um dano colateral exacerbado no tecido infectado5,20-23.
A metanálise de 86 estudos sobre camundongos nocauteados em genes de citocinas mostrou que o risco de morte por infecções foi maior do que o risco de morte pelos fenômenos imunopatológicos24. Por exemplo, em animais IL-10-/-, isto é, que não produziam essa citocina anti-inflamatória, infectados com o citomegalovírus CMV, os efeitos imunopatológicos no fígado reduziram, enquanto a replicação viral e a taxa de mortalidade aumentaram26. Assim, o aumento na carga viral estava diretamente associado com o aumento da mortalidade nesses animais. Em termos evolutivos, a persistência de fenômenos imunopatológicos e seu possível custo existem porque a resposta (proteção) imunológica confere benefícios imediatos, tais como a eliminação dos patógenos24.
A COEVOLUÇÃO
Outro fator que contribui para a persistência das respostas imunes intensas, em indivíduos da espécie humana é a coevolução, e nesta seção, pretende-se expor um pouco sobre essa contribuição. O sistema imune é o resultado da evolução simultânea (coevolução) dos hospedeiros, patógenos e simbiontes4,5,11,22.
A espécie humana atravessou, até o presente, duas importantes transições epidemiológicas27. A primeira aconteceu no período Paleolítico (10.000 a.C.), em que caçadores/coletores viviam em grupos reduzidos e eram nômades, tendo contato com helmintos, bactérias saprófitas, Salmonella e Toxoplasma27. Após o período Neolítico (3.300 a.C.), passaram a viver em assentamentos com número elevado de indivíduos, convivendo com animais de criação, em contato frequente com fezes, lama, água não tratada e organismos de transmissão fecal-oral como os helmintos, além de Mycobacterium tuberculosis as bactérias do tifo e da cólera27,28. Já a segunda transição epidemiológica aconteceu posteriormente, nos anos 1800, quando a espécie humana progressivamente inicia sua vida em grandes aglomerados urbanos, com acesso a água tratada e hábitos de higiene, convivendo menos com animais de criação e utilizando vermífugos e antibióticos, além da ingestão de alimentos industrializados27,28. A consequência dessas mudanças foi o contato reduzido com os helmintos e as bactérias pseudo comensais, conhecidos como "os velhos amigos", presentes na lama e na água não tratada, o que resulta em uma microbiota intestinal mais homogênea27,28.
Com menos exposição aos diversos patógenos e simbiontes velhos amigos, o microambiente do sistema imune também foi alterado e consequentemente o seu perfil regulatório (menos inflamatório). Como é o caso dos helmintos, os quais desenvolveram durante a coevolução com seus hospedeiros, mecanismos imunorregulatórios muito competentes29. Por exemplo, Brugia malayi tem moléculas que mimetizam as citocinas MIF (macrophage-migration inhibition factor ou fator inibidor da migração de macrófagos) e TGF-β (transformig growth factor-beta ou fator de transformação do crescimento-beta), as quais, entre várias funções, são anti-inflamatórias27-29. O parasita intestinal Schistosoma mansoni produz fosfatidilserina, fosforilcolina e diversas glicanas, que interagem com as células dendríticas e ativam linfócitos TH2 e os regulatórios em seus hospedeiros. A oncocistatina de Onchocerca volvulus impede a ativação de linfócitos T e aumenta a produção de citocinas anti-inflamatórias29. Essas estratégias dos parasitas helmintos resultam em respostas imunes regulatórias e menos inflamatórias, o que facilita sua sobrevivência por tempo prolongado em seus hospedeiros e, consequentemente, nas infecções crônicas observadas nas helmintíases. Ademais, houve com isso, uma contribuição para a presença de um perfil imunológico menos reativo e menos inflamatório na população dos hospedeiros27-29.
Como vimos, a seleção natural favorece hospedeiros que montam respostas imunes reativas e intensas, e o principal legado coevolutivo dos "velhos amigos" foi a modulação dessas respostas imunes. Com a perda dos "velhos amigos", isto é, a diminuição do contato com parasitas e simbiontes, deixam de ocorrer imunorregulações, e o perfil imunológico mais reativo e inflamatório prevalece na população. De fato, dados epidemiológicos indicam incidências elevadas de doenças crônicas com perfil inflamatório, tais como diabetes, asma e doenças autoimunes nas populações urbanas de países industrializados27,28.
Outros fatores envolvidos no aparecimento/manutenção do fenótipo "inflamatório" nas populações urbanas são a prevalência de obesidade, condição em que os níveis de citocinas inflamatórias estão aumentados; a carência da vitamina D devido à falta de exposição solar, molécula envolvida na imunorregulação; e o contato com poluentes como a dioxina, que ativa linfócitos inflamatórios TH1727,28,30.
A HISTÓRIA DE VIDA
A história de vida de uma espécie biológica é caracterizada por aspectos que afetam diretamente o seu sucesso reprodutivo, tais como anatomia, período reprodutivo, tamanho da prole, investimento parental, tempo de desenvolvimento, expectativa de vida e comportamento5,16,31. Os programas de reprodução e sobrevivência pelos quais os organismos de uma dada espécie completam o seu ciclo de vida, assim como a energia alocada em cada fase de seu desenvolvimento definem os aspectos de cada estágio de vida. A limitação de recursos do ambiente impõe trade offs e restrições, e assim nenhum indivíduo consegue se desenvolver, reproduzir rapidamente, e investir na longevidade, simultaneamente5,11,16,31. É necessário priorizar um conjunto de características/funções no qual a energia será alocada, em cada fase de vida do organismo31. Ademais, a história de vida explica porque as espécies têm padrões particulares de reprodução, desenvolvimento e longevidade que são determinados pela alocação de recursos para maximizar o sucesso reprodutivo. Os eventos que ocorrem durante a vida de um organismo também são moldados pelos aspectos demográficos31. Os seres humanos são longevos, o tamanho da prole é pequeno e há uma longa fase pós-natal de dependência nutricional com alto investimento parental. Existe ainda, uma forte pressão seletiva no período inicial de desenvolvimento da espécie, pois o custo adaptativo da mortalidade juvenil é mais alto do que o custo adaptativo da mortalidade de indivíduos mais velhos, que não mais se reproduzem22,30,31. Assim, na fase inicial de desenvolvimento deve-se privilegiar um sistema imune muito reativo, com memória e plasticidade, o que de fato é observado na nossa espécie. Os genes envolvidos em respostas imunes reativas e intensas, que combatem patógenos e beneficiam o indivíduo nos anos iniciais de vida, em sua fase de maturidade podem ser deletérios, pois induzem fenômenos imunopatológicos5,19,23,32,33. As características genéticas selecionadas no início do desenvolvimento da vida podem ter efeitos negativos em outras fases.
Mais pesquisas empíricas, experimentais e teóricas são necessárias, mas, sem dúvida, os estudos têm avançado na definição dos aspectos evolutivos e adaptativos que resultaram nos fenômenos imunopatológicos experimentados pela espécie humana.
CONCLUSÕES
Nesta breve revisão avaliamos, à luz da Evolução, o aparente paradoxo das respostas imunes na espécie humana, reações imunes que deveriam controlar infecções, mas que podem resultar em danos imunopatológicos irreversíveis (p. ex. a tempestade de citocinas, que ocorre em casos graves da COVID-19). Há o entendimento de que o custo-benefício das respostas imunes exacerbadas explica, parcialmente, a manutenção dessa característica durante a evolução: os riscos de morte devido às infecções exercem pressão seletiva maior do que os riscos de morte devido aos fenômenos imunopatológicos.
A coevolução de patógenos, simbiontes e hospedeiros contribuiu para o surgimento de respostas imunorregulatórias, e as transições epidemiológicas da espécie humana contribuíram para o aparecimento dos fenótipos menos imunorregulatórios e mais inflamatórios. Além disso, a história de vida da nossa espécie revela como os contextos demográficos e a alocação de recursos são determinantes na manutenção do sistema imune mais reativo. Ademais, o conhecimento das bases evolutivas da variabilidade das respostas imunes auxiliará na reinterpretação dos fenômenos imunopatológicos e na formulação de estratégias adicionais de prevenção e tratamento.
AGRADECIMENTOS
Agradecemos à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) (processo n° 2019/11061-7), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (processo n° 405581/2018-1), ao Fundo de Apoio ao Ensino, Pesquisa e Extensão da Universidade Estadual de Campinas (FAEPEX) (processo n° 2513/21), à Gábor Illia Gonda pela ilustração, e à Janys Kerolyn Ballejos Cruz pela revisão do texto.
REFERÊNCIAS
1. Miescher PA, Muller-Eberhard HJ. Preface. Springer Seminars Immunopatol. 1978;1:1-2.
2. Sell S. Immunopathology Teaching Monography. Am J Pathology. 1978;90(1):211-79.
3. Germain RN. Maintaining system homeostasis: the third law of Newtonian immunology. Nature Immunol. 2012; 13(10):902-6. doi: 10.1038/ni.2404.
4. Barnaba V, Paroli M, Piconese S. The ambiguity in immunology. Front Immunol. 2012. doi: 10.3389/fimmu.2012.00018.
5. Graham AL, Allen JE, Read AF. Evolutionary causes and consequences of immunopathology. Annu Rev Evol Syst. 2005;56:373-97. doi: 10.1146/annurev.ecolsys.36.102003.152622.
6. Aarestrup FM. Imunopatologia da COVID-19 e suas implicações clínicas. Arq Asma Alerg Imunol. 2020;4(2):172-80. doi: 10.5935/2526-5393.20200024.
7. Giavina-Bianchi P. Surfando a terceira onda. Arq Asma Alerg Imunol. 2022;6(1):1-3. doi: 10.5935/2526-5393.20220001.
8. Fara A, Mitrev Z, Rosalia RA, Assas BM. Cytokine storm and COVID-19: a chronicle of pro-inflammatory cytokines. Open Biol. 2020;10:200160. doi: 10.1098/rsob.200160.
9. Wong L-YR, Perlman S. Immune dysregulation and immunopathology induced by SARS-CoV-2 and related coronavirus-are we own worst enemy? Nat Rev Immunol. 2022; 22(1):47-56. doi: 10.1038/s41577-021-00656-2.
10. Finlay BB, Amato KR, Azad M, Blaser MJ, Bosch TCG, Chu H, et al. The hygiene hypothesis, the COVID pandemic, and consequences for the human microbiome. PNAS. 2021; 118(6): e2010217118. doi: 10.1073/pnas.2010217118.
11. Sorci G, Cornet S, Faivre B. Immune evasion, immnopathology and the regulation of the immune system. Pathogens. 2013:2:71-91. doi: 10.3390/pathogens2010071.
12. Brinkworth JF, Barreiro LB. The contribution of natural selection to present-day susceptibility to chronic inflammatory and autoimmune disease. Curr Opin Immunol. 2014;31:76-78. doi: 10.1016/j.coi.2014.09.008.
13. Iwasaki A, Medzhitov R. A new shield for a cytokine storm. Cell. 2011;146(6):861-2. doi: 10.1016/j.cell.2011.08.027.
14. Waizbort RF, Luz MRMP. Medicina Evolutiva: Incorporando a Teoria da Evolução na Formação de Profissionais de Saúde Brasileiros. Rev bras educ med. 2017;41(4). doi: 10.1590/1981-52712015v41n4RB20160074.
15. Lazzaro BP, Tate AT. Balancing sensitivity, risk, and immunopathology in immune regulation. Curr Opinion Insect Sci. 2022;50:100874. doi: 10.1016/j.cois.2022.100874.
16. Okin D, Medzhitov R. Evolution of inflammatory diseases. Curr Biol. 2012:22(17)R733-49. doi: 10.1016/j.cub.2012.07.029.
17. Graham Al. Optimal immunity meets natural variation: the evolutionary biology of host defence. Parasite Immunol. 2013;35:315-7. doi:10.1111/ pim.12073 9.
18. Metcalf CJE, Tate AT, Graham AL. Demographically framing trade-offs between sensitivity and specificity illuminates selection on immunity. Nature Ecol Evol.2017; 1:1766-72. doi:10.1038/s41559-017-0315-3.
19. Aldakak L, Ruhli F, Galipaud M, Bender N. The evolution of immune sensitity under immunopathological and autoimmune costs, BioRxiv. 2020. doi: 10.1101/2020.10.12.335620.
20. Chen X, Liu S, Goraya MU, Maarouf M, Huang S, Chen J-L. Host immune response to Influenza A virus infection. Front Immunol. 2018;9:320. doi: 10.3389/fimmu.2018.00320.
21. Taubenberger JK, Morens DM. The pathology of Influenza virus infections. Ann Rev Pathol. 2008;3:499-522. doi: 10.1146/annurev.pathmechdis.3.121806.154316.
22. Betts A, Rafaluk C, King KC. Host and parasite evolution in a tangled bank. Trends Parasitol. 2016;32(11): 863-73. doi: 10.1016/j.pt.2016.08.003.
23. Paludan SR, Pradeu T, Masters SL, Mogensen TH. Constitutive immune mechanisms: mediators of host defence and immune regulation. Nat Rev Immunol. 2021;21(3):137-50. doi: 10.1038/s41577-020-0391-5.
24. Sorci G, Lippens C, Léchenault C, Faivre B. Benefits of immune protection versus immunopathology costs: A synthesis from cytokine KO models. Infect Genet Evol. 2017;54:491-95. doi: 10.1016/j.meegid.2017.08.014.
25. Dienz O, Rud LG, Eaton SM, Lanthier PA, Burg E, Drew A et al. Essential role of IL-6 in protection against H1N1 influenza virus by promoting neutrophil survival in the lung. Mucosal Immunol. 2012;5(3):258-66. doi: 10.1038/mi.2012.2.
26. Tang-Feldman YJ, Lochlead GR, Lochlead SR, Yu C, Pomeroy C. Interleukin-10 repletion suppresses pro-inflammatory cytokines and decreases liver pathology without altering viral replication in murine cytomegalovirus (MCMV)-infected IL-10 knockout mice. Inflamm Res. 2011;60(3):233-43. doi: 10.1007/s00011-010-0259-4 5.
27. Rook GA. 99th Dahlem conference on infection, inflammation and chronic inflammatory disorders: darwinian medicine and the 'hygiene' or 'old friends' hypothesis. Clin Exp Immunol 2010;160(1):70-9. doi: 10.1111/j.1365-2249.2010.04133.x.
28. Rook GA, Lowry CA, Raison CL. Microbial 'Old Friends', immunoregulation and stress resilience. Evol Med Public Health. 2013; 1:46-64. doi: 10.1093/emph/eot004.
29. Maizels RM, McSorley HJ. Regulation of the host immune system by helminth parasites. J Allergy Clin Immunol 2016: 138(3):666-75. doi: 10.1016/j.jaci.2016.07.007.
30. Veldhoen M, Hirota K, Westendorf AM, Buer J, Dumoutier L, Renauld JC, et al. The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins. Nature. 2008 May 1;453(7191):106-9. doi: 10.1038/nature06881.
31. Ahlstrom T. Life-history theory, past human populations and climatic perturbations. Int J Ostearchaeol. 2011; 21(40):407-19. doi: 10.1002/oa.1147.
32. Williams GC. Pleiotropy, natural selection, and the evolution of senescence. Evolution. 1957;11:398-411.
33. Aoshiba K, Tsuji T, Itoh M, Yamagushi K, Nakamura H. An evolutionary medicine approach to understanding factors that contribute to chronic obstructive pulmonary disease. Respiration. 2015; 89:243-52. doi:10.1159/000369861.



