Número Atual: Julho-Setembro 2022 - Volume 6 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Marcelo Vivolo Aun
- Rosana Câmara Agondi
- Diogo Costa Lacerda
- Ullissis Pádua Menezes
- Maria Inês Perelló
- Adriana Teixeira Rodrigues
- Ana Carolina D'Onofrio-Silva
- Tânia Maria Gonçalves Gomes
- Luiz Alexandre Ribeiro da-Rocha
- Denise Neiva Santos de Aquino
- Fernanda Casares Marcelino
- Gladys Queiroz
- Maria Fernanda Malaman
- Inês Cristina Camelo-Nunes
- Mara Morelo Rocha Felix
ARTIGO ESPECIAL
Atualização em reações de hipersensibilidade aos anti-inflamatórios não esteroidais - Parte 1: definições, farmacologia, epidemiologia, fisiopatologia e fatores genéticos
Update on hypersensitivity reactions to nonsteroidal anti-inflammatory drugs - Part 1: definitions, pharmacology, epidemiology, pathophysiology, and genetics
Marcelo Vivolo Aun1,2; Rosana Câmara Agondi2; Diogo Costa Lacerda2; Ullissis Pádua Menezes3; Maria Inês Perelló4; Adriana Teixeira Rodrigues5; Ana Carolina D'Onofrio-Silva2; Tânia Maria Gonçalves Gomes6; Luiz Alexandre Ribeiro da-Rocha7; Denise Neiva Santos de Aquino8; Fernanda Casares Marcelino9; Gladys Queiroz7; Maria Fernanda Malaman10; Inês Cristina Camelo-Nunes8; Mara Morelo Rocha Felix11,12,13
DOI: 10.5935/2526-5393.20220035
1. Faculdade Israelita de Ciências da Saúde Albert Einstein, Hospital Israelita Albert Einstein - São Paulo, SP, Brasil
2. Universidade de São Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
3. Faculdade de Medicina de Ribeirão Preto (FMUSP - Ribeirão Preto), Serviço de Alergia e Imunologia Clínica e Pediátrica - Ribeirão Preto, SP, Brasil
4. Universidade do Estado do Rio de Janeiro (UERJ), Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
5. Hospital do Servidor Público do Estado de São Paulo (IAMSPE), Serviço de Alergia e Imunologia - São Paulo, SP, Brasil
6. Hospital Central do Exército (HCE), Ambulatório de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
7. Universidade Federal de Pernambuco (UFPE), Centro de Pesquisas em Alergia e Imunologia do Hospital das Clínicas - Recife, PE, Brasil
8. Universidade Federal de São Paulo (UNIFESP-EPM), Disciplina de Alergia, Imunologia Clínica e Reumatologia - Departamento de Pediatria - São Paulo, SP, Brasil
9. Hospital Regional da Asa Norte (HRAN), Serviço de Alergia e Imunologia - Brasília, DF, Brasil
10. Universidade Tiradentes, Faculdade de Medicina - Aracaju, SE, Brasil
11. Hospital Federal dos Servidores do Estado (HFSE), Setor de Alergia e Imunologia Pediátrica - Rio de Janeiro, RJ, Brasil
12. Faculdade Souza Marques, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
13. Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Departamento de Medicina Geral - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Marcelo Vivolo Aun
E-mail: marcelovivoloaun@gmail.com
Submetido em: 17/03/2022
Aceito em: 25/06/2022
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
Os anti-inflamatórios não esteroidais (AINE) estão entre os medicamentos mais utilizados no mundo e são os fármacos mais frequentemente associados à ocorrência de reações de hipersensibilidade na América Latina. As reações têm grande variabilidade de apresentações clínicas e, consequentemente, com abordagem terapêutica difícil. Nesta revisão, abordamos aspectos farmacológicos dos AINE, bem como as definições, epidemiologia e fisiopatologia das reações de hipersensibilidade aos AINE. Por fim, discutimos aspectos genéticos associados à intolerância e alergia a esses fármacos.
Descritores: Anti-inflamatórios não esteroidais, hipersensibilidade, farmacologia/fisiopatologia, genética.
INTRODUÇÃO E DEFINIÇÕES
Os anti-inflamatórios não esteroidais (AINE) estão entre os medicamentos mais utilizados no mundo, são encontrados frequentemente em prescrições e podem ser comercializados sem receita. São usados para tratamento de dor, processos inflamatórios e febre1. Os AINE incluem um grupo variado de medicações, que podem ser classificadas de acordo com sua estrutura química2.
Os AINE apresentam efeito analgésico, anti-inflamatório e antipirético através do bloqueio da enzima ciclo-oxigenase (COX) e subsequente inibição da biossíntese dos eicosanoides pela via metabólica da cascata do ácido araquidônico (AA). Promovem a inibição de prostanoides, derivados do AA, que seriam transformados em prostaglandina (PG) G2 (PGG2) e H2 (PGH2) como resultado da atividade da COX. Isso impede que a PGH2 seja metabolizada pela sintase terminal em prostanoides biologicamente ativos. Essa inibição acarreta redução da vasodilatação, da permeabilidade vascular, da dor e da febre desencadeadas pelas PG3.
Existem pelo menos duas isoformas de COX. A COX-1, expressa constitutivamente por células específicas como plaquetas e células endoteliais. Já a COX-2 é induzível por mediadores pró-inflamatórios em uma ampla variedade de células. Os AINE podem atuar na inibição seletiva de apenas uma COX, ou na inibição de ambas4.
Segundo a Organização Mundial de Alergia (WAO, do inglês World Allergy Organization), o termo hipersensibilidade pode ser aplicado a qualquer reação que possa ser reproduzida através de um estímulo inicial5. Quando o indivíduo apresenta qualquer sintoma reprodutível que se assemelha a uma reação "alérgica" após estímulo de uma medicação, podemos dizer que ocorreu uma reação de hipersensibilidade a medicamentos (RHM). As RHM podem ocorrer por mecanismos imunológicos específicos (RHM alérgicas ou imunológicas) ou não (RHM não alérgicas ou não imunológicas)6.
Os AINE estão entre os principais causadores de RHM. Nesse grupo de fármacos, chama a atenção a grande variabilidade de quadros clínicos e de mecanismos fisiopatológicos envolvidos. Consequentemente, em tempos de medicina de precisão, conhecer esses diferentes cenários permitirá o correto manejo desses pacientes, principalmente quanto à orientação futura para evitar novas reações, mas também para liberar medicações que não precisariam ser excluídas. Nessa revisão, discutiremos aspectos conceituais, epidemiológicos, genéticos e fisiopatológicos da hipersensibilidade aos AINE.
MECANISMO DE AÇÃO FARMACOLÓGICA DOS AINE
Antes de 1971, pouco se sabia sobre o mecanismo de ação dos AINE, exceto que eles produziam um efeito anti-inflamatório que era diferente da ação anti-inflamatória dos corticosteroides. Muitos dos efeitos bioquímicos dos AINE foram documentados7, mas as teorias baseadas sobre esses efeitos foram abandonadas. A hipótese mais razoável na época baseava-se na observação de que os salicilatos podiam inibir várias proteases. Aumento da atividade proteolítica extracelular foi observado em vários modelos de inflamação, e pensava-se que isso era responsável pela destruição de tecido característica de doenças crônicas, como a artrite reumatoide8. Os AINE são uma classe de medicamentos utilizada como agentes antipiréticos, anti-inflamatórios e analgésicos9.
A resposta inflamatória consiste em uma reação vascular e uma reação celular. Na inflamação estão envolvidas muitas células como os neutrófilos, monócitos, eosinófilos, linfócitos, basófilos e plaquetas, células do tecido conjuntivo incluindo os mastócitos, que estão ligados aos vasos sanguíneos, fibroblastos do tecido conjuntivo, macrófagos locais e linfócitos. Esta resposta inflamatória pode ser aguda ou crônica. A primeira, caracterizada por uma vasodilatação local e uma permeabilidade capilar aumentada, é um processo inflamatório mais rápido, pois é mais curta e pode durar minutos, horas ou dias. Já a segunda é caracterizada por apresentar uma duração mais longa e está associada à presença de linfócitos e macrófagos e a proliferação de vasos sanguíneos, fibrose e necrose tissular10.
O principal mecanismo de ação dos AINE é a inibição da enzima COX ou, de forma mais completa, do chamado complexo prostaglandina-endoperóxido sintase (PGHS). A COX é necessária para converter o AA em tromboxanos (TX), PG e prostaciclinas11. Os efeitos terapêuticos dos AINE são atribuídos à falta desses eicosanoides. Especificamente, os TX desempenham um papel na adesão plaquetária, as PG causam vasodilatação, aumentam o ponto de ajuste da temperatura no hipotálamo e desempenham um papel na nocicepção.
Existem duas isoenzimas da COX: COX-1 e COX-2 (PGHS -1 e PGHS-2, respectivamente). A COX-1 é expressa constitutivamente no corpo e desempenha um papel na manutenção do revestimento da mucosa gastrointestinal, função renal e agregação plaquetária. A COX-2 não é expressa constitutivamente no corpo. Por outro lado, expressa-se de forma induzida durante uma resposta inflamatória. A maioria dos AINE não é seletiva para uma das isoenzimas e inibe tanto a COX-1 como a COX-2. No entanto, os AINE seletivos para COX-2 (chamados "coxibes") visam inibir apenas a COX-2 e, portanto, têm um perfil de efeitos adversos diferente. É importante ressaltar que, como a COX-1 é o mediador principal para garantir a integridade da mucosa gástrica e a COX-2 está envolvida principalmente na inflamação, os AINE seletivos para COX-2 devem fornecer alívio anti-inflamatório sem comprometer a mucosa gástrica11,12.
Contudo, evidências emergentes desafiaram a teoria de haver uma maior segurança dos inibidores seletivos da COX-2. No início dos anos 2000, surgiram os primeiros relatos de efeitos adversos cardiovasculares associados aos inibidores da COX-2 e estudos subsequentes controlados por placebo também mostraram que esses inibidores estavam ligados a um risco aumentado de eventos vasculares aterotrombóticos13. Além disso, metanálises e ensaios clínicos randomizados confirmaram ainda mais esses achados, o que levou à retirada de vários inibidores de COX-2 pela US Food and Drug Administration (FDA)14 e, subsequentemente, de outras agências regulatórias, como a ANVISA. Além de complicações gastrointestinais e cardiovasculares, o uso habitual de AINE também está associado à nefrotoxicidade e eventual insuficiência renal15 junto com outros efeitos transitórios no equilíbrio hidroeletrolítico.
Recentemente foi proposta a existência de uma terceira isoforma da COX, denominada COX-3, a qual, ao contrário da COX-1 e COX-2, não produziria prostanoides pró-inflamatórios, mas sim substâncias anti-inflamatórias, o que poderia explicar a remissão de algumas doenças inflamatórias crônicas como a artrite reumatoide. A COX-3 apresenta expressão cerebral, na medula espinal e no coração16.
CLASSIFICAÇÃO ENTRE OS GRUPOS QUÍMICOS
Tradicionalmente, os AINE eram classificados com base em suas características químicas, e a maioria dos AINE mais consumidos no mercado eram classificados como derivados do ácido salicílico, ácido acético, ácido enólico, ácido antranílico ou ácido propiônico. No entanto, com o avanço do conhecimento científico, a classificação também foi alterada com base em sua seletividade para inibir as enzimas COX-1 e COX-2. Além disso, um sistema de classificação também foi formulado para categorizar os AINE com base em sua meia-vida. No entanto, apesar da diversidade entre as classes, suas funções são relativamente semelhantes17.
Com base em sua estrutura química, os AINE podem ser amplamente classificados em salicilatos, derivados do ácido aril e heteroarilacético, derivados do ácido indol/indeno acético, antranilatos e oxicams (ácidos enólicos) (Figura 1)14,18. A estrutura geral de um AINE típico consiste em uma porção ácida (ácido carboxílico, enóis) ligada a um grupo funcional aromático plano. Os salicilatos foram os primeiros AINE identificados após a extração do ácido salicílico da casca do salgueiro7. Na verdade, eles são derivados do ácido 2-hidroxibenzoico (ácido salicílico). Inicialmente, o ácido salicílico foi usado medicinalmente na forma de sal de sódio; posteriormente, esse composto foi substituído terapeuticamente pelo derivado acetilado, ácido acetilsalicílico (AAS) ou aspirina.
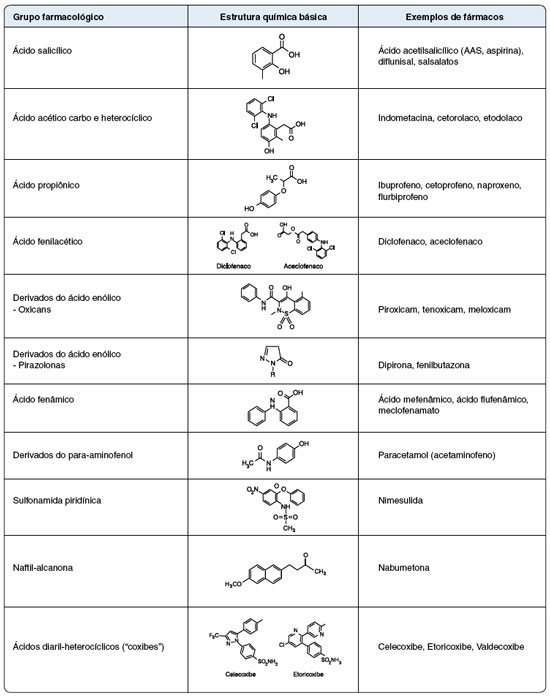
Figura 1
Classificação dos anti-inflamatórios não esteroidais de acordo com o grupo farmacológico e estrutura química
(modificado de Blanca-Lopez N, et al.18)
Depois dos salicilatos, os derivados do ácido aril ou heteroarilacético constituem uma classe importante de AINE. Ibuprofeno, cetoprofeno e naproxeno são alguns derivados estruturais do ácido aril ou heteroarilacético que compreendem alguns dos AINE mais populares. A próxima categoria de AINE é o ácido indol ou indo acético, que inclui analgésicos populares, incluindo indometacina e sulindaco. Além destes, os antranilatos são outra classe de AINE que são derivados N-aril substituídos do ácido antranílico. O diclofenaco, derivado do ácido 2-arilacético, é o AINE antranilato mais amplamente utilizado, encontrado em diversas formulações, incluindo comprimidos analgésicos, injeções, apresentações tópicas e sprays de ação rápida. O ácido mefenâmico e o ácido meclofenâmico também são derivados do ácido antranílico. Finalmente, há os derivados do ácido enólico, como os oxicans (tenoxicam, piroxicam, meloxicam) e as pirazolonas (dipirona)14,18. A classificação dos AINE por grupo farmacológico está sintetizada na Figura 1.
CLASSIFICAÇÃO DOS AINE COM BASE NA SELETIVIDADE DA ISOENZIMA COX
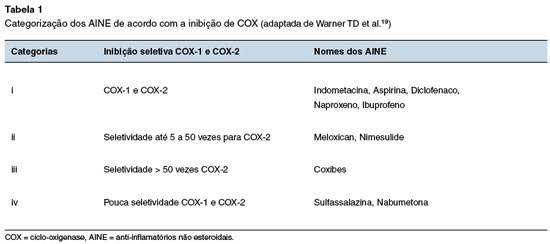
A bioconversão do AA nos prostanoides inflamatórios é mediada pelas enzimas COX-1 e COX-2 que, por sua vez, são inibidas pelos AINE. Quase todos os AINE inibem de forma variável ambas as isoformas de COX em suas doses terapêuticas. Assim, com base na seletividade da COX, é determinada uma razão inibitória que permite uma classificação dos AINE. A razão inibitória é baseada no COX-1 IC 50 / COX-2 IC 50. Se a proporção for 1, então ambas as enzimas PGHS são igualmente inibidas pelo AINE em questão; se a proporção for inferior a 1, significa que o AINE em questão é menos seletivo para COX-2 em comparação à COX-1, e em caso de proporção maior que 1, o AINE é preferencialmente seletivo para COX-219.
Presume-se que os efeitos colaterais dos AINE, como manifestações gastrointestinais, estão associados à inibição da COX-1, enquanto o efeito terapêutico (anti-inflamatório) está correlacionado com o da COX-2, e muitas vezes um alto nível de supressão de PG é necessário para relevância terapêutica. No entanto, essa visão simplista foi questionada recentemente. Em geral, os AINE são terapeuticamente empregados em doses que geram mais de 50% de redução na produção de PG. Nesse contexto, seria importante verificar até que ponto a COX-1 é inibida na mesma concentração de AINE necessária para inibir 80% da atividade da COX-2. No entanto, no caso do diclofenaco, a concentração que inibe 80% da atividade da COX-2 também pode inibir quase 70% da atividade da COX-1 ao mesmo tempo. Assim, a dose terapêutica (80% de inibição da COX-2) pode até levar à toxicidade. Nesse cenário, quando a seletividade relativa varia dentro de uma faixa estreita, outras variáveis, incluindo a dose consumida e a meia-vida plasmática, devem ser consideradas. Por exemplo, piroxicam, que tem meia-vida plasmática longa e se correlaciona com a toxicidade digestiva in vivo, não mostrou seletividade notável para COX-1 no ensaio in vitro. Desse modo, está claro que a potência relativa dos AINE varia com sua dose, concentração e meia-vida plasmática. Portanto, o valor de IC 80 parece ser clinicamente mais relevante na comparação das potências inibitórias dos AINE contra COX-1 e COX-219.
Agora, com base nas potências para inibir as isoformas de COX, os AINE podem ser divididos em quatro categorias principais (Tabela 1): (i) inibidores completos não seletivos de COX-1 e COX-2; (ii) inibidores completos de COX-1 e COX-2, embora com preferência específica para COX-2; (iii) inibidores fortes de COX-2, embora com ação inibidora fraca contra COX-1; e (iv) inibidores fracos de COX-1 e COX-219. No entanto, em termos de cinética, as interações de AINE com ambas as isoformas de COX também podem ser usadas para sua classificação, que é a seguinte: interação livremente reversível (ibuprofeno), interação lentamente reversível (indometacina, diclofenaco, celecoxibe) e interação irreversível (aspirina).
Dois agentes que mostram algum grau de inibição "preferencial" COX-2 são o meloxicam e a nimesulida. Para estes compostos tem sido difícil atribuir relação de "segurança" gastrointestinal quando comparados com os demais AINE convencionais, já que apesar de preferencial inibição COX-2, as doses terapêuticas destas drogas também resultarão em redução na atividade COX-119.
EPIDEMIOLOGIA DAS REAÇÕES DE HIPERSENSIBILIDADE AOS AINE
Os AINE são os medicamentos mais utilizados em todo o mundo para alívio de dor e inflamação e também responsáveis por 25% das reações adversas a drogas, incluindo as RH20. Os AINE compartilham com os antibióticos betalactâmicos a liderança no ranking mundial como causa de RHM21. Segundo pesquisa americana, até 30% dos adultos consomem analgésicos para dor crônica, podendo chegar a 40% em maiores de 65 anos, por prescrição ou automedicação22, de modo que o consumo de AINE sem receita médica é muito comum.
Na população geral, a prevalência de RH aos AINE varia de 0,5 a 5,7%2,23. A estratificação por idade mostra variação significativa de gênero, fenótipo e classe de AINE envolvida. As mulheres são mais acometidas entre os adultos, embora essa relação se inverta na infância, quando os meninos são mais afetados. Em todas as idades, o fenótipo mais prevalente é urticária/angioedema induzidos por AINE (UAIMA) em pacientes sem doença de base. Este fenótipo representa 40% das reações de hipersensibilidade e 60% das reações de mecanismo não imunológico22. Dentro deste grupo, o angioedema palpebral e/ou labial isolado é uma apresentação mais comum em crianças, com aumento da prevalência até adultos jovens, e está frequentemente relacionado à atopia e à sensibilização a aeroalérgenos24. A associação de manifestações cutâneas e respiratórias caracteriza fenótipo blended ou misto (30%), considerado o segundo mais comum tanto em crianças (especialmente em adolescentes) quanto em adultos, com manifestações concomitantes ou de forma sequencial25. Os fenótipos caracterizados pela exacerbação de doença respiratória, também conhecido como doença respiratória exacerbada por AAS/AINE (DREA), ou de urticária crônica espontânea (UCE), chamado de doença cutânea exacerbada por AINE (DCEA), são mais prevalentes entre adultos, e cada um representa 8% do total das reações. A DREA ocorre em até 20% dos indivíduos portadores de asma com polipose nasal22. Por outro lado, a ocorrência de DREA (asma e/ou rinossinusite crônica e/ou polipose) é rara em pacientes pediátricos24. A UCE é rara em crianças e a exacerbação dela por AINE (DCEA), que flutua com períodos de atividade da doença, é menos frequente (24%) se comparada a adultos (até 40% dos portadores de UCE)2,25,26.
Entre pacientes que apresentam hipersensibilidade não imunológica (UAIMA, DCEA e DREA), os inibidores não seletivos ou preferenciais da COX-1 têm papel de destaque na indução das reações. Entretanto, mesmo inibidores fracos da COX-1, preferenciais ou seletivos da COX-2, a depender da dose, são potenciais desencadeantes, já que até 1/3 dos pacientes pode apresentar reação com paracetamol em doses superiores a 1.000 mg2.
A classe de AINE envolvida também varia em frequência conforme o espaço geográfico e a faixa etária. Nas Américas, os AINE são a causa mais prevalente de RHM imediata27. No Brasil e na América Latina, são a principal causa de anafilaxia induzida por drogas. As anafilaxias por AINE de causa não imunológica são mais prevalentes, embora as IgE-mediadas sejam as mais graves. Além disso, destaca-se a dipirona como agente muito imputado nessas reações em nosso continente28-30. Nos EUA, o ibuprofeno e naproxeno lideram a lista, enquanto no Reino Unido o diclofenaco é o mais prescrito22. Considerando a faixa pediátrica, o paracetamol e ibuprofeno são predominantes, enquanto outros AINE (diclofenaco, dipirona, "oxicans" e AAS) crescem em paralelo ao consumo de novas drogas com o aumento da idade25.
As doenças atópicas em adultos e crianças são consideradas um importante fator de risco para hipersensibilidade aos AINE, fato que pode estar ligado a fatores ambientais, étnicos ou genéticos. A UAIMA é muito mais frequente em atópicos sensibilizados aos ácaros. Quanto à DREA, a associação à atopia ainda é controversa. Estudos mais antigos falavam ser menos frequente em atópicos adultos24, mas dados mais recentes sugerem que até 75% dos portadores de DREA são atópicos30. A participação de cofatores como infecção, alergia alimentar e exercício são comuns na faixa pediátrica26. As infecções podem atuar como um cofator, tanto em reações imediatas quanto não imediatas, especialmente em crianças, levando a quadros de urticária, angioedema e exantema maculopapular não reprodutíveis após testes de provocação oral (TPO)25.
As reações seletivas a um AINE ou grupo quimicamente relacionado, com tolerância a outros grupos não relacionados e AAS, podem ser imediatas e se manifestar como urticária, angioedema, anafilaxia (UAAIUA), uma forma de hipersensibilidade imunológica imediata, menos de 1 hora após a ingesta do AINE (20-30%)22. O medicamento mais frequentemente relacionado é a dipirona (metimazol), mas reações seletivas com paracetamol, diclofenaco e ibuprofeno já foram citadas. Ainda dentro deste grupo, a inclusão de fenótipo de pacientes seletivos imediatos a múltiplos grupos com tolerância a AAS foi recentemente sugerida24,26.
As reações seletivas não imediatas, que ocorrem 24 horas ou mais após consumo do AINE, representam um grupo heterogêneo de reações com gravidade variável e frequência inferior a 5% do número total de reações22. Tais reações, também conhecidas como reações tardias induzidas por um único AINE (RTIUA), variam desde reações leves (como exantema maculopapular, urticária tardia, dermatite ou fotodermatite de contato, erupção fixa à droga) até mais graves, como hepatite, pneumonite, nefrite e as chamadas reações cutâneas graves a medicamentos, como pustulose exantemática generalizada aguda, reação cutânea a droga com eosinofilia e sintomas sistêmicos, síndrome de Stevens-Johnson, necrólise epidérmica tóxica e erupção fixa à droga bolhosa generalizada. O exantema maculopapular, raro em adultos, é mais frequente em crianças, no contexto de infecções, muitas vezes não confirmado pelo TPO25.
FISIOPATOLOGIA DAS RH AOS AINE
As RH associadas aos AINE se dividem em reações imunológicas (ou alérgicas) e não imunológicas (ou não alérgicas). As chamadas reações imunológicas aos AINE envolvem os mecanismos de hipersensibilidade de Gell e Coombs do tipo I (reações IgE-mediadas) e do tipo IV (dependentes de células T). Não há até hoje evidência robusta documentada da ocorrência de reações dos tipos II (citotóxica) e III (por imunocomplexos). Já as reações não imunológicas parecem estar associadas ao potencial de inibição da COX-1 por esses fármacos2,23.
Reações imunológicas
As reações imunológicas ou alérgicas induzidas por AINE podem ser imediatas ou não imediatas (tardias). Os pacientes que apresentam tais reações são considerados reatores seletivos, ou seja, suas reações são restritas ao fármaco causador ou a outros da mesma classe farmacológica2,18.
Nas reações imediatas (UAAIUA), sintomas como urticária, dispneia e anafilaxia são geralmente oriundos da degranulação de mastócitos ocasionados pela ligação de IgE específica aos receptores de alta afinidade de IgE presente nos mastócitos. No primeiro contato com o antígeno ocorre um aumento policlonal das células T e B específicas com produção de IgE específica sem causar sintomas. Após 5-6 dias, a IgE secretada sensibiliza os mastócitos. Em um próximo contato, minutos após a administração do fármaco, ocorre a desgranulação dos mesmos com liberação de diversos mediadores, principalmente a histamina, podendo causar sintomas como urticária, dispneia, tosse, anafilaxia, entre outros. O desencadeamento da reação independe da dose administrada, porém está claro que a intensidade dos sintomas tem forte associação com a concentração corporal da medicação. Dentre as diferentes classes de AINE, a ocorrência desse mecanismo está mais bem documentada com as pirazolonas (exemplo: dipirona), através principalmente dos testes cutâneos (punctura e intradérmico), uma vez que ensaios in vitro têm baixa sensibilidade31.
Já as reações tardias (RTIUA) ocorrem após um uso mais prolongado da medicação e parecem ter algum grau de dose-dependência. A ativação das células TCD4 e/ou TCD8 é estimulada pelo uso do medicamento, e os sintomas (por exemplo, exantema) são simplesmente uma consequência da quantidade da droga, número de células T ativadas, migração tecidual e intensidade da afinidade do TCR (Toll like receptor), receptor de células linfoides inatas, para o peptídeo/complexo hapteno/droga32.
Reações não imunológicas
A maioria dos AINE realizam uma inibição não seletiva da enzima COX-1. Eles interferem no metabolismo do AA, levando ao bloqueio da síntese das PG e à regulação positiva da via dos LT, que contribuem para várias manifestações das RH aos AINE33. Em indivíduos susceptíveis, a inibição da COX-1 ocasiona distúrbios do metabolismo do AA, disfunção da 5-lipoxigenase LT C4 sintetase (LTC4S), redução da PGE2 e aumento da produção de leucotrienos cisteínicos (CysLT). Níveis reduzidos da via PGE2 aumentam a resposta da via LTC4S, o que acelera a produção de CysLT. O excesso de produção de CysLT leva a extravasamento vascular, broncoconstrição e secreção excessiva de muco, bem como ativação de mastócitos e eosinófilos, que liberam mediadores químicos e citocinas, aumentando ainda mais a inflamação sistêmica2,34,35.
Esse mecanismo representa o mais comum que explica as RH associadas aos AINE e inclui os fenótipos da UAIMA, DCEA, DREA e até das chamadas reações mistas (mixed-reactions ou blended-reactions), em que os indivíduos apresentam anafilaxia após exposição a mais de um AINE de classes diferentes2,35.
Os AINE que possuem inibição predominante das enzimas COX-1, como AAS, naproxeno, e diclofenaco, apresentam taxas mais altas de RH, enquanto inibidores de COX-1 fracos e inibidores seletivos de COX-2 geralmente são mais bem tolerados, com menor probabilidade de RH33.
O mecanismo patofisiológico proposto para as RH não imunológicas aos AINE (UAIMA, DCEA e DREA) está sumarizado na Figura 2.
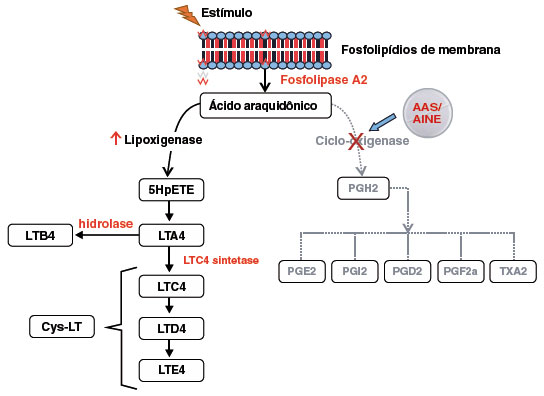
Figura 2
Mecanismo fisiopatológico das reações de hipersensibilidade (RH) não imunológicas ao AAS (ácido acetilsalicílico) e demais AINE (anti-inflamatórios não esteroidais ), que é baseado na ação farmacológica desses fármacos. O metabolismo do ácido araquidônico envolve as ações das enzimas COX (ciclo-oxigenase) e LOX (lipo-oxigenase), que acabam gerando a síntese de prostaglandinas (PG), prostaciclinas, tromboxanos (TX) e leucotrienos (LT). Como a ação principal dos AINE é inibir a COX, ocorre um desvio metabólico para a ação da LOX e, consequentemente aumento da síntese de leucotrienos cisteínicos (Cys- LT). Nos pacientes com RH não imunológicas, esse acúmulo de Cys-LT, que tem ação vasodilatadora e induzem contração de músculo liso, acaba desencadeando os sintomas
Adaptado de Walters KM, et al.35
ASPECTOS GENÉTICOS
A inibição da atividade da COX-1, alvo terapêutico comum à maioria dos AINE, faz supor o mecanismo subjacente para a intolerância cruzada aos AINE de estruturas químicas diversas. Nesse caminho, os polimorfismos em genes que envolvem as vias da COX e da lipoxigenase e geram desequilíbrio entre PG e LT têm sido o foco da maioria dos estudos, especialmente na DREA, e, mais recentemente, na UAIMA.
Um estudo na população espanhola em pacientes com DREA apresentou significativa associação com Single Nucleotide Polymorphisms (SNP) em PTGS1 (rs5789 e rs10306135), o primeiro relacionado à diminuição da atividade enzimática, e o segundo envolvido na regulação da expressão do gene36. Outro estudo identificou, em duas diferentes coortes na Espanha, polimorfismos relacionados ao PTGS1 rs10306194 e ALOX5 rs28395868 associados ao risco de UAIMA, enquanto o último também se relacionou a manifestações respiratórias exacerbadas por AINE, trazendo a esperança de um potencial biomarcador genético para discriminação entre os fenótipos37.
Um estudo, que analisou a sequência completa dos prostaglandin-endoperoxide synthase genes (PTGS), identificou um haplótipo no gene PTGS1, super-representado entre pacientes com intolerância cruzada a AINE associado à importante diminuição da atividade da enzima COX-1 em uma população espanhola. Tal haplótipo contém duas variações de nucleotídeos únicos que podem estar relacionadas também a outros efeitos adversos relativos à diminuição da função da enzima. A identificação de variantes no gene PTGS2 (COX-2), entretanto, não esteve relacionado à reatividade cruzada aos AINE, concordante com a tolerância da maioria dos pacientes aos inibidores seletivos da COX-2. Embora a proporção de pacientes que apresentam o haplótipo de risco seja pequena (5,6%), a forte associação e o efeito de diminuição da atividade enzimática reforçam a hipótese de susceptibilidade genética potencial para investigação de pacientes com história familiar de intolerância cruzada a AINE38.
A identificação de polimorfismos (rs9883222 rs2298954 rs2236944) na subunidade alfa 2 da proteína G (GNAI2), localizadas no mesmo haplótipo no locus 3p21.31, refletem sua influência em mecanismos patológicos da hipersensibilidade aos AINE, como ativação de receptores de LT e recrutamento de células imunes envolvidas. Esta associação identificada no GWAS em pacientes com urticária/angioedema/anafilaxia foi replicada na população espanhola de duas regiões diferentes39.
Poucos estudos de associação genética, ferramenta útil para identificar alvos farmacogenéticos, foram realizados nesta área. Tais estudos necessitam de grandes amostras, não somente para identificar achados de baixa frequência que podem ter impacto relevante no fenótipo, como também para detectar risco de doença36. Um estudo de associação genética foi realizado em uma população coreana para investigação de susceptibilidade genética à intolerância a aspirina e identificou o gene CEP68 (que codifica a proteína centrossomal 68KDa) como um fator de risco em asmáticos. Posteriormente o mesmo estudo em abordagem de gene candidato identificou SNP rs7572857 relacionado à etiologia genética da intolerância a aspirina após provocação oral em asmáticos com declínio acentuado no volume expiratório forçado no primeiro segundo especialmente relacionado à sua variante homozigota AA rs7572857G >A40. Em um estudo numa população com ancestralidade espanhola, foram identificadas 17 variantes do CEP68, incluindo rs7572857, em pacientes com UAIMA, 8 delas também presentes em pacientes com manifestações respiratórias DREA e blended reactions41. Outro estudo na população espanhola do gene candidato CEP68 identificou duas variantes intrônicas (rs2241160 e rs2241161) com associação significativa em pacientes com reação imediata alérgica, seletivos a único AINE, a UAAIUA. Entretanto, não se observou sobreposição entre estas e as variantes anteriormente relacionadas aos pacientes intolerantes cruzados, sugerindo a complexidade do papel do gene e seu potencial uso no desenvolvimento de biomarcadores de utilidade clínica para diagnosticar pacientes de risco42.
Um estudo de associação genética em uma coorte de asmáticos coreanos demonstrou SNP em 30 regiões do HLA-DPB1 significativamente associados com o risco de DREA, e o rs1042151 (Met105Val) foi a variante genética mais importante43. Na população asiática, o HLA-DPB1*0301 foi considerado forte marcador de asma intolerante à aspirina44. Em outro estudo coreano, o haplótipo HLA-DRB1*1302-HLA-DQB1*0609-DPB1*0201 se revelou potencial marcador para fenótipos cutâneos induzidos por AINE. Ainda, em estudo italiano, HLA-B44 e HLA-Cw4 foram positivamente associados à DCEA36.
Neste campo ainda pouco explorado, achados recentes em população hispânica e chinesa han sugerem outras vias além do metabolismo do AA envolvidas nos casos de intolerância cruzada com manifestações de urticária e angioedema. Também podem ter influência variantes genéticas envolvidas no metabolismo da histamina, receptores de IgE, ativação de citocinas, mastócitos e enzimas metabolizadoras de drogas. Ressalta-se que a maioria dos estudos foi realizada em pacientes asiáticos e europeus e não foram replicados em populações de minoria étnica ou miscigenadas36.
Apesar dos avanços nos estudos, a descoberta de variantes genéticas de predisposição individual para hipersensibilidade aos AINE permanece ainda desconhecida. À heterogeneidade dos fenótipos, somam-se dificuldades referentes à genética de doenças complexas26.
CONCLUSÕES
Os anti-inflamatórios não esteroidais são, ao mesmo tempo, os medicamentos mais usados no mundo e os mais frequentemente associados a reações de hipersensibilidade. O conhecimento das ações farmacológicas desses fármacos, da epidemiologia das reações de hipersensibilidade, tanto no Brasil como no mundo, e dos mecanismos fisiopatológicos e fatores genéticos envolvidos nesses eventos é fundamental para o alergista-imunologista poder individualizar o atendimento do seu paciente, e atuar de forma precisa.
REFERÊNCIAS
1. Jin J. Nonsteroidal Anti-inflammatory Drugs. JAMA. 2015 Sep 8;314(10):1084.
2. Kowalski ML, Asero R, Bavbek S, Blanca M, Blanca-Lopez N, Bochenek G, et al. Classification and practical approach to the diagnosis and management of hypersensitivity to nonsteroidal anti-inflammatory drugs. Allergy. 2013 Oct;68(10):1219-32.
3. Bacchi S, Palumbo P, Sponta A, Coppolino MF. Clinical pharmacology of non-steroidal anti-inflammatory drugs: a review. Antiinflamm Antiallergy Agents Med Chem. 2012;11(1):52-64.
4. Smith W. Adverse drug reactions - allergy? side-effect? intolerance? Aust Fam Physician. 2013;42(1-2):12-6.
5. Johansson SG, Bieber T, Dahl R, Friedmann PS, Lanier B, Lockey R, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol. 2004;113(5):832-6.
6. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014;69(4):420-37.
7. Whitehouse MW, Haslam JM. Ability of some antirheumatic drugs to uncouple oxidative phosphorylation. Nature. 1962;196:1323-4.
8. Spector WG, Willoughby DA. Anti-inflammatory effects of salicylate in the rat. In: Dixon A StJ, Martin BK, Smith MJH, Wood PHN, eds. Salicylates: An International Symposium. Boston: Little, Brown, 1963:141-7.
9. Phillips WJ, Currier BL. Analgesic pharmacology: II. Specific analgesics. J Am Acad Orthop Surg. 2004 Jul-Aug;12(4):221-33.
10. Kumar V, Abbas AK, Aster JC. Robbins & Cotran: Patologia - Bases patológicas das doenças. 9ªed. Rio de Janeiro: Elsevier; 2016. p. 71-114.
11. Bjarnason I, Scarpignato C, Holmgren E, Olszewski M, Rainsford KD, Lanas A. Mechanisms of Damage to the Gastrointestinal Tract From Nonsteroidal Anti-Inflammatory Drugs. Gastroenterology. 2018;154(3):500-14.
12. Chaiamnuay S, Allison JJ, Curtis JR. Risks versus benefits of cyclooxygenase-2-selective nonsteroidal antiinflammatory drugs. Am J Health Syst Pharm. 2006 Oct 01;63(19):1837-51.
13. Arfè A, Scotti L, Varas-Lorenzo C, Nicotra F, Zambon A, Kollhorst B, Schink T, Garbe E, et al.; Safety of Non-steroidal Anti-inflammatory Drugs (SOS) Project Consortium. Non-steroidal anti-inflammatory drugs and risk of heart failure in four European countries: nested case-control study. BMJ. 2016 Sep 28;354:i4857.
14. Bindu S, Mazumder S, Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem Pharmacol. 2020;180:114147.
15. Murray MD, Brater DC Renal toxicity of the nonsteroidal antiinflamatórios. Annu. Rev. Pharmacol. Toxicol. 1993;33:435-65.
16. Davies NM, Good RL, Roupe KA, Yáñez JA. Cyclooxygenase-3: axiom, dogma, anomaly, enigma or splice error? Not as easy as 1, 2, 3. J Pharm Pharm Sci. 2004 Jul 9;7(2):217-26.
17. Gupta A, Bah M. NSAIDs in the Treatment of Postoperative Pain. Curr Pain Headache Rep. 2016 Nov;20(11):62.
18. Blanca-Lopez N, Soriano V, Garcia-Martin E, Canto G, Blanca M. NSAID-induced reactions: classification, prevalence, impact, and management strategies. J Asthma Allergy. 2019 Aug 8;12:217-33.
19. Warner TD, Giuliano F, Vojnovic I, Bukasa A, Mitchell JA, Vane JR. Nonsteroid drug selectivities for cyclo-oxygenase-1 rather than cyclo-oxygenase-2 are associated with human gastrointestinal toxicity: a full in vitro analysis. Proc Natl Acad Sci USA. 1999 Jun 22;96(13):7563-8.
20. Blanca-López N, Cornejo-García JA, Plaza-Serón MC, Doña I, Torres-Jaén MJ, Canto G, et al. Hypersensitivity to Nonsteroidal Anti-inflammatory Drugs in Children and Adolescents: Cross-Intolerance Reactions. J Investig Allergol Clin Immunol. 2015;25(4):259-69.
21. Blanca M, Whitaker P. Advances in hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol. 2018 Aug;18(4):281-3.
22. Baldo BA, Pham NH. Non-steroidal Anti-inflammatory Drugs. In: Drug allergy: clinical aspects, diagnosis, mechanisms, structure-activity relationships. 2ª ed. Springer; 2021. p. 439-71.
23. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) - classification, diagnosis and management: review of the EAACI/ENDA(#) and GA2LEN/HANNA*. Allergy. 2011 Jul;66(7):818-29.
24. Cavkaytar O, du Toit G, Caimmi D. Characteristics of NSAID-induced hypersensitivity reactions in childhood. Pediatr Allergy Immunol. 2019 Feb;30(1):25-35.
25. Kidon M, Blanca-Lopez N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal anti-inflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018 Aug;29(5):469-80.
26. Doña I, Pérez-Sánchez N, Eguiluz-Gracia I, Muñoz-Cano R, Bartra J, Torres MJ, et al. Progress in understanding hypersensitivity reactions to nonsteroidal anti-inflammatory drugs. Allergy. 2020 Mar;75(3):561-75.
27. Giavina-Bianchi P, Jares E, Aun MV, Thong B. Drug hypersensitivity reactions in the Americas: Similarities and differences. Ann Allergy Asthma Immunol. 2019 May;122(5):447-8.
28. Aun MV, Blanca M, Garro LS, Ribeiro MR, Kalil J, Motta AA, et al. Nonsteroidal anti-inflammatory drugs are major causes of drug-induced anaphylaxis. J Allergy Clin Immunol Pract. 2014 Jul-Aug;2(4):414-20.
29. Jares EJ, Cardona Villa R, Sánchez-Borges M, de Falco A, Ensina LF, Bernstein JA, et al. Drug-induced anaphylaxis, elicitors, risk factors, and management in Latin America. J Allergy Clin Immunol Pract. 2020 Apr;8(4):1403-5.
30. Agondi RC, Dias GMFS, Assis JP, Pacheco R, Kalil J, Giavina-Bianchi P. Hypersensitivity to dipyrone in aspirin-exacerbated respiratory disease patients is associated with urticaria. Respir Med. 2020 Aug-Sep;170:106041.
31. Ariza A, García-Martín E, Salas M, Montañez MI, Mayorga C, Blanca-Lopez N, et al. Pyrazolones metabolites are relevant for identifying selective anaphylaxis to metamizole. Sci Rep. 2016 Mar 31;6:23845.
32. Pichler WJ. Immune pathomechanism and classification of drug hypersensitivity. Allergy. 2019;74(8):1457-71.
33. Yeung WYW, Park HS. Update on the Management of Nonsteroidal Anti-Inflammatory Drug Hypersensitivity. Yonsei Med J. 2020;61(1):4-14.
34. Lee TH, Christie PE. Leukotrienes and aspirin induced asthma. Thorax. 1993;48(12):1189-90.
35. Walters KM, Woessner KM. An Overview of Nonsteroidal Antiinflammatory Drug Reactions. Immunol Allergy Clin North Am. 2016 Nov;36(4):625-41.
36. Plaza-Serón MDC, García-Martín E, Agúndez JA, Ayuso P. Hypersensitivity reactions to nonsteroidal anti-inflammatory drugs: an update on pharmacogenetics studies. Pharmacogenomics. 2018 Aug 1;19(13):1069-86.
37. Jurado-Escobar R, Doña I, Perkins JR, Laguna JJ, Muñoz-Cano R, García-Sánchez A, et al. Polymorphisms in eicosanoid-related biosynthesis enzymes associated with acute urticaria/angioedema induced by nonsteroidal anti-inflammatory drug hypersensitivity. Br J Dermatol. 2021 Oct;185(4):815-24.
38. García-Martín E, García-Menaya JM, Esguevillas G, Cornejo-García JA, Doña I, Jurado-Escobar R, et al. Deep sequencing of prostaglandin-endoperoxide synthase (PTGE) genes reveals genetic susceptibility for cross-reactive hypersensitivity to NSAID. Br J Pharmacol. 2021 Mar;178(5):1218-33.
39. Blanca M, Oussalah A, Cornejo-García JA, Blanca-López N, Guéant-Rodriguez RM, Doña I, et al. GNAI2 variants predict nonsteroidal anti-inflammatory drug hypersensitivity in a genome-wide study. Allergy. 2020 May;75(5):1250-3.
40. Kim JH, Park BL, Cheong HS, Bae JS, Park JS, Jang AS, et al. Genome-wide and follow-up studies identify CEP68 gene variants associated with risk of aspirin-intolerant asthma. PLoS One. 2010 Nov 3;5(11):e13818.
41. Cornejo-García JA, Flores C, Plaza-Serón MC, Acosta-Herrera M, Blanca-López N, Doña I, et al. Variants of CEP68 gene are associated with acute urticaria/angioedema induced by multiple non-steroidal anti-inflammatory drugs. PLoS One. 2014 Mar 11;9(3):e90966.
42. Perkins JR, Acosta-Herrera M, Plaza-Serón MC, Jurado-Escobar R, Doña I, García-Martín E,et al. Polymorphisms in CEP68 gene associated with risk of immediate selective reactions to non-steroidal anti-inflammatory drugs. Pharmacogenomics J. 2019 Apr;19(2):191-9.
43. Park BL, Kim TH, Kim JH, Bae JS, Pasaje CF, Cheong HS, et al. Genome-wide association study of aspirin-exacerbated respiratory disease in a Korean population. Hum Genet. 2013 Mar;132(3):313-21.
44. Choi JH, Lee KW, Oh HB, Lee KJ, Suh YJ, Park CS, et al. HLA association in aspirin-intolerant asthma: DPB1*0301 as a strong marker in a Korean population. J Allergy Clin Immunol. 2004 Mar;113(3):562-4.