Número Atual: Outubro-Dezembro 2021 - Volume 5 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Ullissis Pádua Menezes
- Marcelo Vivolo Aun
- Mara Morelo Rocha Felix
- Adriana Teixeira Rodrigues
- Ana Carolina D'Onofrio-Silva
- Denise Neiva Santos de Aquino
- Diogo Costa-Lacerda
- Fernanda Casares Marcelino
- Gladys Queiroz
- Inês Cristina Camelo-Nunes
- Luiz Alexandre Ribeiro da Rocha
- Maria Inês Perelló
- Tânia Maria Gonçalves de Souza Gomes
- Maria Fernanda Malaman
Artigo de Revisão
Reatividade cruzada entre betalactâmicos: uma abordagem prática
Cross-reactivity among beta-lactams: a practical approach
Ullissis Pádua Menezes1; Marcelo Vivolo Aun2,3; Mara Morelo Rocha Felix4,5,6; Adriana Teixeira Rodrigues7; Ana Carolina D'Onofrio-Silva3; Denise Neiva Santos de Aquino8; Diogo Costa-Lacerda3; Fernanda Casares Marcelino9; Gladys Queiroz10; Inês Cristina Camelo-Nunes8; Luiz Alexandre Ribeiro da Rocha10; Maria Inês Perelló11; Tânia Maria Gonçalves de Souza Gomes12,13; Maria Fernanda Malaman14
DOI: 10.5935/2526-5393.20210057
1. Faculdade de Medicina de Ribeirão Preto (FMUSP-Ribeirão Preto), Disciplina de Alergia e Imunologia - Ribeirão Preto, SP, Brasil
2. Faculdade Israelita de Ciências da Saúde Albert Einstein, Disciplina Agente Hospedeiro - São Paulo, SP, Brasil
3. Universidade de São Paulo (FMUSP), Disciplina de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
4. Faculdade Souza Marques, Departamento de Pediatria - Rio de Janeiro, RJ, Brasil
5. Hospital Federal dos Servidores do Estado (HSFE), Setor de Alergia e Imunologia Pediátrica - Rio de Janeiro, RJ, Brasil
6. Universidade Federal do Estado do Rio de Janeiro (UNIRIO), Departamento de Medicina Geral - Rio de Janeiro, RJ, Brasil
7. Hospital do Servidor Público de São Paulo (IAMSPE), Serviço de Alergia e Imunologia - São Paulo, SP, Brasil
8. Universidade Federal de São Paulo (UNIFESP-EPM), Disciplina de Alergia, Imunologia Clínica e Reumatologia - Departamento de Pediatria - São Paulo, SP, Brasil
9. Hospital Regional da Asa Norte-HRAN, Serviço de Alergia e Imunologia - Brasília, DF, Brasil
10. Universidade Federal de Pernambuco (UFPE), Hospital das Clínicas, Centro de Pesquisas em Alergia e Imunologia Clínica - Recife, PE, Brasil
11. Universidade do Estado do Rio de Janeiro (UERJ), Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
12. Hospital Central do Exército (HCE), Ambulatório de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
13. Faculdade de Medicina de Petrópolis, UNIFASE - Rio de Janeiro, RJ, Brasil
14. Faculdade de Medicina da Universidade Tiradentes, Clínica Médica - Aracaju, SE, Brasil
Endereço para correspondência:
Marcelo Vivolo Aun
E-mail: marcelovivoloaun@gmail.com
Submetido em: 03/08/2021
Aceito em: 24/09/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
Os betalactâmicos são a classe de drogas que mais causam reações de hipersensibilidade envolvendo um mecanismo imunológico específico, e são os principais desencadeantes entre os antimicrobianos. São representados pelas penicilinas, cefalosporinas, carbapenêmicos, monobactâmicos e inibidores da betalactamase. A estrutura química básica destes fármacos consiste na presença dos seguintes componentes: anel betalactâmico, anel adjacente e cadeias laterais, sendo todos potenciais epítopos. Os anticorpos da classe IgE e linfócitos T estão frequentemente envolvidos no reconhecimento desses epítopos. A reatividade cruzada depende da estabilidade dos produtos intermediários (determinantes antigênicos) derivados da degradação dos anéis betalactâmicos, anéis adicionais e da semelhança estrutural das cadeias laterais entre as drogas. Classicamente acreditava-se num grande potencial de reatividade cruzada dentro de cada classe e até entre as classes, mas estudos da última década mostraram que indivíduos alérgicos à penicilina (com testes cutâneos positivos) reagiam às cefalosporinas em aproximadamente 3% dos casos, aos carbapenêmicos em cerca de 1%, e praticamente não reagiam aos monobactâmicos. Essa reatividade ou tolerância parece estar vinculada ao grau de similaridade entre as cadeias laterais desses antibióticos. Nesta revisão, ressaltamos a importância da investigação sistematizada na confirmação ou exclusão de alergia aos betalactâmicos, descrevemos a prevalência da reatividade cruzada entre estes fármacos e sugerimos um algoritmo de abordagem desses pacientes baseados em sua estrutura química e nos dados publicados na literatura.
Descritores: Betalactamas, penicilinas, cefalosporinas, hipersensibilidade a drogas.
INTRODUÇÃO
Os antibióticos estão entre os medicamentos mais prescritos no mundo nas instituições de cuidados à saúde1. Os betalactâmicos (BL) são considerados fundamentais no tratamento de escolha para diversas situações como: faringites e infecções cutâneas pelo Streptococcus do grupo A; meningites e sepse puerperal pelo Streptococcus do grupo B; endocardite pelo Streptococcus do grupo Viridans; sífilis, particularmente na gestante; osteomielites e infecções cutâneas pelo Staphylococcus aureus, dentre outras2. Aproximadamente 10% da população dos Estados Unidos relata alergia à penicilina, porém em grande parte os sinais e sintomas referidos são inespecíficos como sintomas gastrointestinais, prurido sem lesões, reações indefinidas que ocorreram há mais de 10 anos ou história familiar de alergia aos BL, que raramente configuram reações de hipersensibilidade verdadeiras. Apenas cerca de 5% do total de pacientes com história de alergia aos BL tem suas reações confirmadas após uma investigação sistematizada como reações de hipersensibilidade, seja imediatas envolvendo anticorpos da classe IgE, seja tardias mediadas por linfócitos T2,3. O rótulo de alergia aos BL constitui um problema de saúde pública com as seguintes repercussões: aumento da utilização de antimicrobianos de segunda linha ou de mais amplo espectro, aumento de resistência microbiana (Staphylococcus multirresistentes, Enterococcus resistentes a vancomicina), maior toxicidade e aumento de custos (maiores tempos de internações e readmissões)2,4.
Nosso grupo publicou recentemente uma revisão ampla sobre hipersensibilidade aos BL5. Para realizar esta atualização focada na reatividade cruzada entre os antibióticos do grupo foram feitas buscas por artigos originais, revisões, diretrizes e consensos nas bases de dados MEDLINE e Literatura Latino-Americana e do Caribe em Ciências da saúde (LILACS), utilizando os termos: beta-lactams hypersensitivity, beta-lactam cross-reactivity, penicillins, cephalosporins, carbapenems, monobactams, diagnostic tests, risk stratification.
ESTRUTURA QUÍMICA DOS BETALACTÂMICOS
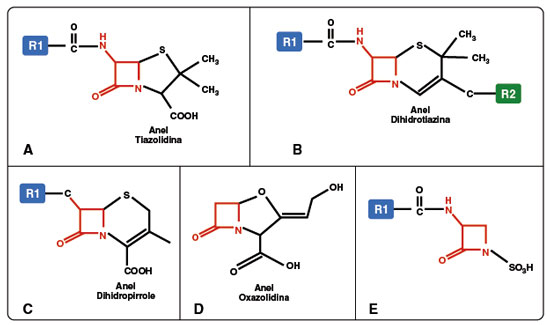
Os BL são os antimicrobianos mais implicados em reações de hipersensibilidade a fármacos envolvendo um mecanismo imune específico6-8. As principais classes de BL de acordo com suas estruturas químicas são: penicilinas, cefalosporinas, carbapenêmicos e os monobactâmicos. A estrutura química básica dos BL consiste na presença dos seguintes componentes: anel BL, anel adjacente e cadeias laterais; que são potenciais sítios imunogênicos capazes de desencadearem sensibilização dos linfócitos aos BL. As penicilinas contêm o anel BL, um anel adjacente (tiazolidina) e uma cadeia lateral R1 que se comunica com o anel BL. As cefalosporinas apresentam o anel BL, outro anel adjacente (dihidrotiazina) e duas cadeias laterais R1 e R2, sendo que a R1 também se liga ao anel BL (de forma similar às penicilinas) e a R2 se comunica com o anel adjacente.
Os carbapenêmicos possuem o anel BL, um anel adjacente (dihidropirrole) e duas cadeias laterais R1 e R2. Já os monobactâmicos apresentam apenas o anel BL associado a uma cadeia lateral R1. Por fim, alguns autores consideram que o inibidor de betalactamase ácido clavulânico seria uma quinta classe de BL, sendo que esse antibiótico não possui anel adjacente. Como esse fármaco só é disponível no mercado em associação a aminopenicilinas, essa classificação em cinco classes não é consensual na literatura. A estrutura química das classes de BL está esquematizada na Figura 15.
MECANISMOS IMUNOLÓGICOS
A reatividade cruzada entre os diferentes BL tem sido relatada em estudos, e a sua abordagem precisa ser feita no contexto do conhecimento dos mecanismos imunológicos envolvidos. As reações de hipersensibilidade aos BL ocorrem principalmente pela produção de anticorpos da classe IgE, ativação de linfócitos T e também a interação direta farmacológica com receptores proteicos nas células (HLA e TCR)7, Acredita-se que anticorpos da classe IgE e linfócitos T reconheçam como epítopos algum segmento da estrutura química dos BL.
Os BL são moléculas pequenas que se ligam a proteínas plasmáticas formando complexos haptenocarreador. A imunorreatividade contra um BL depende da estabilidade dos produtos intermediários (determinantes antigênicos) oriundos da degradação dos anéis BL e anéis adjacentes. Os determinantes das penicilinas são estáveis e já bem definidos, ao passo que os determinantes das cefalosporinas não são bem conhecidos8. Os determinantes principais ou PPL (peniciloil poli-lisina) correspondem a 95% destes metabólitos, e os secundários ou MDM (peniciloato e peniloato), a aproximadamente 5%.
Postula-se que esses determinantes se ligam a proteínas plasmáticas carreadoras podendo estimular a resposta imune2. Os anticorpos da classe IgE podem se ligar ao anel BL, anel adjacente ou às cadeias laterais e constituem a base da reatividade cruzada envolvendo as penicilinas, justificando a utilização dos testes cutâneos na investigação sistematizada das reações imediatas a estes fármacos. Porém, mais recentemente vem sendo demonstrado que a reatividade cruzada entre os BL é desencadeada principalmente pela semelhança ou identidade estrutural entre as cadeias laterais destes fármacos, sugerindo que esse segmento seja o epítopo na maior parte das reações de hipersensibilidade9-12.
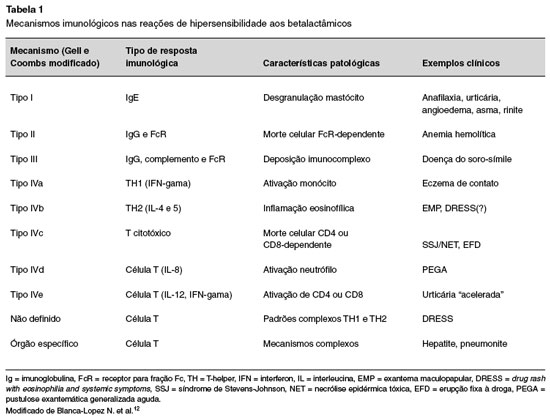
As penicilinas e as cefalosporinas são as duas classes de BL que mais causam reações de hiper-sensibilidade, tanto imediatas como tardias, envolvendo praticamente todos os mecanismos descritos por Gell e Coombs12. Os principais mecanismos imunológicos envolvidos na hipersensibilidade aos BL estão sumarizados na Tabela 1.
MANIFESTAÇÕES CLÍNICAS
As reações imediatas por anticorpos da classe IgE ocorrem geralmente na primeira hora após a exposição à droga, embora possa ocorrer em até 6 horas, mas tende a ocorrer mais precocemente após reexposição. As manifestações cutâneas como urticária, angioedema, prurido e eritema tipo flushing são as mais frequentes. Outras manifestações imediatas incluem: sintomas respiratórios (rinorreia, congestão nasal, tosse, dispneia, rouquidão); gastrointestinais (diarreia, vômitos e dor abdominal); cardiovasculares (hipotensão, taquicardia), e quadros mais graves com associação de sinais e sintomas sistêmicos (anafilaxia)2.
As manifestações tardias mediadas por linfócitos T, geralmente ocorrem mais de 1 a 6 horas após a exposição ao fármaco, aparecendo mais comumente após as primeiras 24 horas do início do tratamento. O exantema maculopapular é a reação mais frequente, porém manifestações graves como Síndrome de Stevens-Johnson (SSJ), necrólise epidérmica tóxica (NET), pustulose exantemática generalizada aguda (PEGA), reação a medicamentos com eosinofilia e sintomas sistêmicos (DRESS), também conhecida como síndrome de hipersensibilidade induzida por drogas (SHID), também podem ocorrer2,13,14.
INVESTIGAÇÃO DIAGNOSTICA
Esta revisão sobre estudos atuais da reatividade cruzada entre os BL aborda a investigação sistematizada utilizando as seguintes ferramentas diagnósticas: testes in vitro quando disponíveis, testes cutâneos de leitura imediata ou tardia, e os testes de provocação, que são o padrão ouro para confirmar ou excluir o fármaco implicado na reação e encontrar um fármaco alternativo seguro entre os BL.
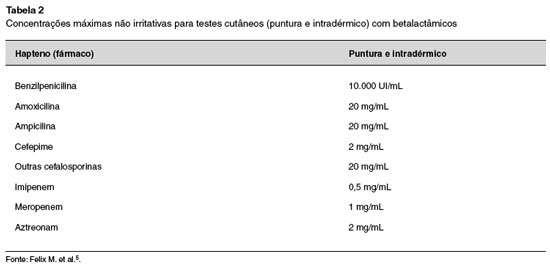
As reações de hipersensibilidade aos BL devem ser abordadas de uma forma sistematizada, através de uma história clínica detalhada seguida pela realização de testes cutâneos de leitura imediata (prick e intradérmico) ou testes cutâneos de leitura tardia (teste de contato e ou intradérmico de leitura tardia). Os testes de contato com BL são realizados em vaselina petrolada a 5%, mas a concentração para punctura e intradérmico varia entre as medicações. A Tabela 2 sumariza as concentrações não irritantes utilizadas nos testes de punctura e intradérmico com estes fármacos5. O valor preditivo negativo dos testes cutâneos quando se utiliza o PPL e MDM é maior que 93%, e o valor preditivo positivo gira em torno de 50 a 75%2. Indivíduos com testes cutâneos negativos poderão ser submetidos ao teste de provocação após estratificação de risco2.
Os testes in vitro podem ser utilizados na complementação da investigação quando disponíveis. Nas reações imediatas podem ser utilizadas: as dosagens de triptase, de IgE específica e o teste de ativação de basófilos (BAT). A triptase na fase aguda pode indicar se ocorreu desgranulação mastocitária, e, quando elevada, indica que houve reação do tipo anafilática; deve-se avaliar a triptase basal para descartar a possibilidade de aumento por mastocitose sistêmica ou outras desordens não clonais de mastócitos. As dosagens de IgE específicas para os BL apresentam uma baixa sensibilidade e estão disponíveis para alguns fármacos (Penicilina G e V, amoxicilina, ampicilina e cefaclor). A principal utilização da dosagem de IgE específica seria em pacientes de alto risco para reações imediatas graves (anafilaxia) antes da realização dos testes cutâneos e de provocação. O BAT quantifica a expressão de CD63 ou CD203c induzida por drogas através de citometria de fluxo, mas só está disponível apenas em alguns centros especializados, e sua maior indicação seria também em reações imediatas de alto risco previamente à realização do teste de provocação. Nas reações tardias os testes de transformação de linfócitos (TTL) e ELISPOT (enzyme-linked immunosorbent spot assay) podem ser úteis na avaliação destas reações. O TTL mede a proliferação de linfócitos T na presença do fármaco suspeito num período de 5 a 7 dias, e o ELISPOT detecta células produtoras de citocinas antígeno específicas após incubação com polimorfonucleares por 24 horas na presença do fármaco suspeito. O BAT e os ensaios para reações tardias, no nosso meio, ainda são utilizados apenas em nível de pesquisa2,13,15.
ESTRATIFICAÇÃO DE RISCO
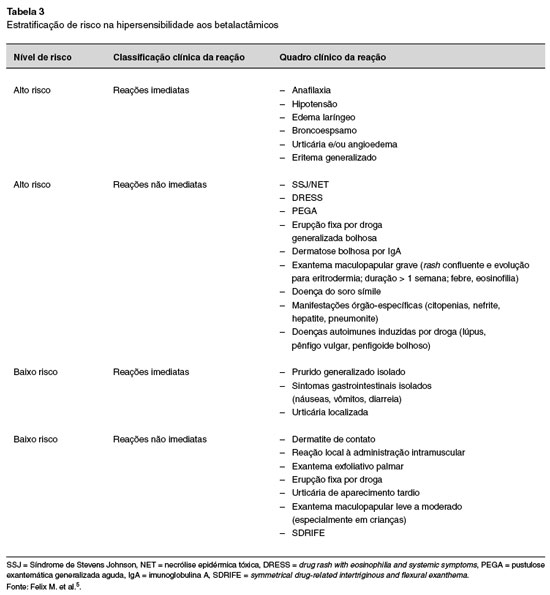
A estratificação de risco deve ser abordada levando em consideração as características das manifestações clínicas iniciais ao fármaco suspeito e a presença de comorbidades do paciente. Pode ser classificada em baixo, moderado e alto risco. A Tabela 3 mostra os principais aspectos clínicos relacionados à estratificação de risco aos BL5,15. Doenças cardiovasculares, renais e respiratórias em atividades; a utilização de fármacos como betabloqueadores, antiarrítmicos, inibidores da ECA (enzima conversora da angiotensina); mastocitose sistêmica e até a presença de gestação constituem situações potenciais de alto risco. No contexto da estratificação de riscos aos BL, os dois cenários práticos mais frequentes também são os mais debatidos na avaliação da hipersensibilidade e da reatividade cruzada entre os BL: paciente com alergia às penicilinas, ou aquele com alergia a alguma cefalosporina16-20.
O conhecimento da estrutura básica dos BL, levando em consideração a semelhança e a identidade existente entre estes fármacos no contexto da reatividade cruzada, torna-se fundamental na escolha de um fármaco alternativo eficaz e seguro durante a investigação, conforme preconizado pelos principais estudos17-21. A Tabela 4 resume os BL disponíveis no mercado brasileiro que possuem cadeias laterais R1 ou R2 similares ou idênticas.
ALÉRGICOS À PENICILINA: REATIVIDADE CRUZADA ÀS AMINOPENICILINAS
Apesar do grande número de pacientes rotulados como alérgicos à penicilina, mais de 95% podem tolerar a penicilina após uma investigação sistematizada. Devido a esta baixa prevalência de alergia verdadeira à penicilina, indivíduos com história de reações à penicilina devem ser avaliados para confirmar ou afastar este diagnóstico, evitando assim a utilização de fármacos alternativos de amplo espectro de outras classes, como vancomicina e quinolonas, que elevam os custos, aumentam a seleção de cepas resistentes como Enterococcus e Staphylococcus aureus resistentes à vancomicina e Clostridium difficile4,21,22.
Estudos relatam uma elevada reatividade cruzada entre benzilpenicilina e penicilinas semissintéticas, mais precisamente as aminopenicilinas (amoxicilina e ampicilina), por compartilharem o grupo amino na cadeia lateral R115,17,19,23.
Por outro lado, estudos com indivíduos alérgicos às aminopenicilinas, que apresentaram reações mediadas por IgE ou mesmo tardias, mostraram testes cutâneos negativos para benzilpencilina (penicilina G) e fenoximetilpenicilina (penicilina V) e tolerância à provocação com estes fármacos. Blanca-Lopez e cols. estudaram 58 indivíduos com reações imediatas à amoxicilina ou amoxicilina/ácido clavulânico. Destes, 7 foram positivos a determinantes da penicilina G, 40 foram positivos à amoxicilina, mas toleraram as penicilinas G e V, e 11 foram positivos apenas ao ácido clavulânico, tolerando penicilina G, V e amoxicilina24. Torres e cols. diagnosticaram hipersensibilidade imediata às penicilinas em 290 pacientes através de testes cutâneos, dosagens de IgE específica ou testes de provocação, sendo a amoxicilina envolvida em 65% dos casos, e a benzilpenicilina em 3%. Naquela casuística: 58% foram considerados reatores seletivos às aminopenicilinas (amoxicilina ou ampicilina) e os outros 42% foram positivos também para os determinantes PPL ou MDM, sendo classificados como respondedores não seletivos25. Com relação às reações tardias às aminopenicilinas, outro estudo mostrou que 72% desses pacientes toleravam a penicilina V26.
ALÉRGICOS À PENICILINA: REATIVIDADE CRUZADA COM CEFALOSPORINAS
Alguns estudos pregressos mostravam dados conflitantes com os estudos atuais em pacientes alérgicos à penicilina e reatividade cruzada às cefalosporinas. Acredita-se que a contaminação das cefalosporinas com traços de penicilina G em seu processamento químico levou a uma superestimativa da prevalência da reatividade cruzada entre estas classes de BL2. Em estudos realizados a partir de 1990 em pacientes comprovadamente com reações mediadas por IgE às penicilinas, o índice de positividade aos testes cutâneos às cefalosporinas variava de 0 a 27%27, contudo, dados mais recentes sugerem que os índices devam realmente variar de acordo com a similaridade da cadeia lateral R1 entre as penicilinas e as cefalosporinas.
Caimmi S. e cols. avaliaram a segurança da cefuroxima em pacientes com hipersensibilidade comprovada a um ou mais BL. Dos 143 indivíduos alérgicos avaliados, a prevalência de sensibilização à cefuroxima nos pacientes alérgicos apenas às penicilinas foi de 4,2%, mostrando ser um fármaco alternativo seguro a ser utilizado após realização de testes nesse grupo de indivíduos28. É importante salientar que a cefuroxima tem cadeia R1 bastante distinta das cadeias R1 das penicilinas.
Em 2018, o grupo do professor Antonino Romano publicou uma grande casuística, na qual estudaram 252 indivíduos com alergia IgE-mediada às penicilinas em relação à reatividade a cefalosporinas. Para tal, utilizaram um algoritmo extenso que incluiu dosagem de IgE para cefaclor, testes cutâneos e provocação com cefalosporinas de estruturas variadas. Foram encontrados 99 (39,3%) pessoas com algum teste positivo para cefalosporinas, mas quase todos eram positivos para cefalosporinas com cadeias R1 idênticas ou similares às das penicilinas. Nenhum paciente reagiu à provocação com cefuroxima e ao ceftriaxone, que não compartilham R1 com as penicilinas. Portanto, concluiu-se que indivíduos com alergia IgE-mediada às penicilinas podem ser submetidos a tratamento com cefalosporinas de cadeia R1 distinta, mas que preferencialmente tenham testes negativos para esses antibióticos antes da administração terapêutica27.
Confirmando estes achados, em uma metanálise recente de 21 estudos, Picard M. e cols. incluíram 1.269 pacientes comprovadamente alérgicos à penicilina (reações mediadas por IgE ou por linfócitos T) e mostraram que o índice de reatividade cruzada varia com o grau de semelhança entre as cadeias laterais R1. Este risco foi de 16,5% para algumas aminocefalosporinas com cadeias laterais idênticas às aminopenicilinas, de 5,6% para cefalosporinas que apresentavam cadeias laterais R1 similares às penicilinas, e de 2,1% para outras cefalosporinas com baixo grau de similaridade química com as aminopenicilinas18.
Como exemplos, trazemos dois casos clínicos de pacientes do arquivo pessoal do autor U.P.M. No primeiro caso, uma paciente com história de urticária imediata após exposição à amoxicilina. Na investigação, apresentou teste cutâneo positivo à penicilina G e amoxicilina-clavulanato, denotando a provável reatividade cruzada pela semelhança das cadeias laterais R1 (Figura 2). A paciente foi submetida à provocação oral supervisionada com cefaclor, que tem cadeia R1 similar, mas não idêntica, e ela apresentou boa tolerância a esse fármaco. Contudo, é necessário salientar que, por ser antibiótico de cadeia semelhante, apenas após a investigação completa até a provocação negativa foi possível liberar o cefaclor. O risco de reação a esse fármaco seria, inicialmente, superior ao de outra cefalosporina de cadeia R1 diferente, com a cefuroxima, por exemplo, que foi o fármaco usado no segundo caso - outra paciente, com história de urticária e angioedema imediatos após exposição à amoxicilina. Foram realizados os testes cutâneos com as penicilinas (Figura 3), e, como alternativa, com a cefuroxima, cuja cadeia lateral R1 é totalmente distinta. O intradérmico com essa cefalosporina foi negativo, e a tolerância foi comprovada na sequência com teste de provocação negativo.
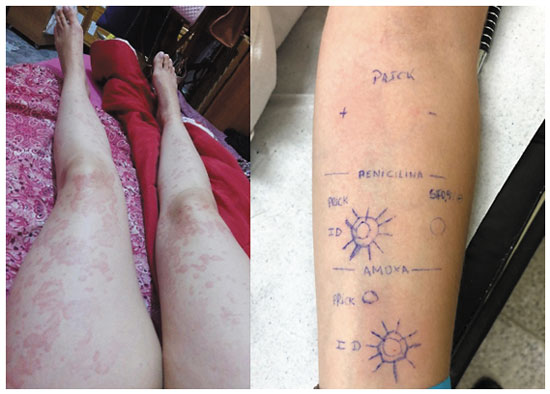
Figura 2
Reação imediata à amoxicilina (urticária) e teste intradérmico de leitura imediata positivo à amoxicilina-clavulanato e penicilina
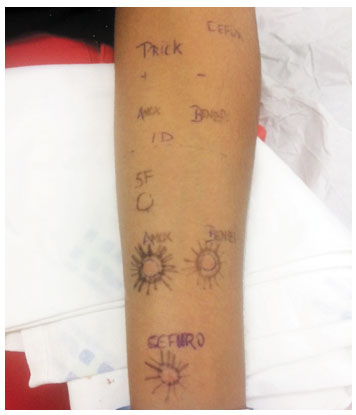
Figura 3
Testes cutâneos intradérmicos positivos com penicilina e amoxicilina-clavulanato e negativo com cefuroxima numa paciente com história de urticária e angioedema imediatos após amoxicilina
Romano A. e cols. estudaram 131 pacientes com reações imediatas (maioria anafilaxia às penicilinas) confirmados com testes cutâneos positivos. Todos foram submetidos aos testes cutâneos com cefazolina e ceftibuten, cefalosporinas que não compartilham a cadeia R1 com as penicilinas, e na sequência foi confirmada a tolerância através da provocação. Apenas um paciente (0,8%) apresentou teste cutâneo positivo à cefazolina e ceftibuten e também a outros reagentes como carbapenêmico e aztreonan, sugerindo que, para esse paciente, o determinante antigênico fosse o próprio anel BL. Os achados confirmam que o epítopo deve, na grande maioria dos casos, ser relacionado à cadeia lateral. Porém, pela possibilidade, embora remota, de sensibilização ao anel BL ou mesmo a de cossensibilização a diferentes BL, os autores mantiveram a recomendação de se realizar testes cutâneos pré-tratamento com estas cefalosporinas em sensibilizados às penicilinas29.
Alguns estudos avaliaram a reatividade cruzada com as cefalosporinas nos pacientes com reações alérgicas tardias a penicilinas e foi descrita uma reatividade cruzada de até 31,2%15, porém, numa investigação mais sistematizada, utilizando um painel de cefalosporinas, Romano e cols. estudaram pacientes com reações mediadas por linfócitos T a penicilinas confirmadas por testes cutâneos tardios, tanto intradérmico de leitura tardia como teste de contato. Os indivíduos eram submetidos a esses mesmos testes cutâneos com as cefalosporinas, e, quando negativos, a testes de provocação. Nesse estudo, a taxa geral de reatividade cruzada entre aminopenicilinas e aminocefalosporinas (cefalexina, cefaclor, cefadroxil) ficou em torno de 20%, mas foi de zero com cefuroxima e ceftriaxone. Vale lembrar que as três aminocefalosporinas estudadas têm cadeia lateral R1 similar ou idêntica às aminopenicilinas. Esses dados corroboram o fato de que, em reações alérgicas tardias, o determinante antigênico é a cadeia lateral30.
ALÉRGICOS ÀS PENICILINAS: REATIVIDADE CRUZADA COM CARBAPENÊMICOS E MONOBACTÂMICOS
Em pacientes com reações confirmadas mediadas por IgE à penicilina, o índice de reatividade cruzada com os carbapenêmicos foi menor que 1% em testes cutâneos realizados para imipenem, meropenem e ertapenem31. Em outro estudo envolvendo 212 pacientes com reações confirmadas por anticorpos IgE às penicilinas, todos apresentaram testes cutâneos negativos ao aztreonan, e 211 foram negativos ao teste de provocação com aztreonam32.
Já em reações não imediatas a penicilinas, dois estudos publicados pelo mesmo grupo, em que foram estudados mais de duzentos pacientes, mostraram 100% de testes cutâneos e de provocação negativos com carbapenêmicos e aztreonam30,33. Esses dados confirmam os achados de que as cadeias laterais devem ser o determinante antigênico de todas as reações tardias aos BL.
CEFALOSPORINAS: REATIVIDADE CRUZADA COM PENICILINAS
As reações de hipersensibilidade às cefalosporinas são relatadas em cerca de 1-3% da população, porém na Europa chega ser responsável por 10 a 40% de todas as reações aos BL e também como importante causa de anafilaxia perioperatória, com destaque para a cefazolina8,20.
Em indivíduos com alergia mediada por IgE às cefalosporinas, poucos estudos avaliaram a reatividade cruzada com outros BL utilizando teste de provocação nos indivíduos com testes cutâneos negativos. Em estudo com 24 pacientes alérgicos a cefalosporinas, apenas 2 pacientes apresentaram testes cutâneos positivos à penicilina G, os 22 pacientes restantes com testes negativos toleraram provocação com penicilina G34. Outro estudo realizado em 40 pacientes com anafilaxia à cefazolina, confirmados por testes cutâneos, sem realização de testes cutâneos para penicilina e submetidos à provocação oral com amoxicilina por 3 dias, não evidenciou nenhuma reação imediata, sendo que apenas 1 paciente apresentou rash benigno tardio após 24 horas de provocação35.
ALÉRGICOS ÀS CEFALOSPORINAS: REATIVIDADE CRUZADA COM CARBAPENÊMICOS E MONOBACTÂMICOS
Poucos estudos estudaram a reatividade cruzada entre cefalosporinas, carbapenêmicos e monobactâmicos. Numa revisão sistemática publicada em 2014, os autores compilaram os dados de 10 estudos e 12 relatos de caso, resultando em mais 850 indivíduos, porém apenas 12 tinham história, e não confirmada, de reações imediatas a cefalosporinas. Nesse grupo, a incidência de reações aos carbapenêmicos foi de 25% (3 pacientes)36.
Em outro estudo do grupo do prof. Romano, 98 pacientes alérgicos às cefalosporinas foram avaliados. A positividade para os testes com esses outros BL foi baixa: 2% para imipenem, 1% para meropenem e 3,1% para o aztreonam, com destaque do último para os pacientes cuja alergia prévia era à ceftazidima, que compartilha cadeia R1 como esse monobactâmico37.
Em resumo, em pacientes alérgicos às cefalosporinas, a reatividade cruzada com os carbapenêmicos é menor que 1%, e praticamente inexistente com os monobactâmicos, exceto em alérgicos à ceftazidima, que apresenta cadeia lateral idêntica ao aztreonam8,16.
ALÉRGICOS À CEFALOSPORINAS: REATIVIDADE CRUZADA COM OUTRAS CEFALOSPORINAS
Na avaliação de pacientes alérgicos às cefalosporinas uma questão importante é saber se eles são capazes de tolerar outras cefalosporinas. Em alérgicos às cefalosporinas a resposta imune IgE mediada é comumente direcionada às cadeias laterais R1 e R2, implicando no fato destes pacientes poderem tolerar outras cefalosporinas de cadeias laterais diferentes. Entretanto, estas evidências ainda são baseadas em poucos estudos de pequenas séries e relatos de casos, além de haver descrição de cossensibilização às cefalosporinas, ou de modo ainda menos frequente pela sensibilidade a um determinante antigênico relacionado ao anel BL. A reatividade cruzada entre as cefalosporinas tem sido demonstrada por similaridade ou identidade principalmente entre as cadeias laterais R1, mas também em relação às R2.
Poucos estudos foram realizados em pacientes alérgicos às cefalosporinas que foram provocados com cefalosporinas alternativas que mostraram testes cutâneos negativos. Num estudo envolvendo 21 pacientes com reações imediatas à cefazolina, sendo 19 com reações anafiláticas, todos apresentaram testes cutâneos negativos à cefalotina e também toleraram a provocação com este fármaco38. E um outro estudo, pacientes com história de reação imediata à cefuroxima, e confirmados com testes cutâneos positivos, foram submetidos a testes cutâneos para ceftazidima. Todos tiveram os resultados negativos e toleraram a provocação com este fármaco, mostrando que uma pequena diferença estrutural entre estes fármacos pode resultar em perda da reatividade cruzada e apresentar tolerância clínica39.
Um outro estudo maior envolveu 102 pacientes com história de reações imediatas às cefalosporinas, tanto anafilaxia como urticária. Todos foram submetidos a testes cutâneos com um painel de 11 cefalosporinas e foram classificados em 4 grupos de acordo com a resposta aos testes40.
- Grupo A: 73 pacientes com testes cutâneos positivos ao ceftriaxone ou outra cefalosporina com cadeia lateral semelhante R1 (cefotaxima, ceftazidima, cefuroxima, cefodizima);
- Grupo B: 13 pacientes com testes positivos às aminocefalosporinas com cadeias laterais R1 idênticas à amoxicilina ou ampicilina (cefalexina, cefaclor e cefadroxila);
- Grupo C: 7 pacientes com cadeias laterais R1 semelhantes (cefazolina, cefoperazone, cefaman-dole);
- Grupo D: 9 pacientes com positividade às cefa-losporinas de mais de um grupo, o que sugeria uma resposta imune direcionada aos anéis BL ou dihidrotiazina, mais do que às cadeias laterais.
A provocação sistematizada foi realizada com cefalosporinas selecionadas, cujos testes cutâneos haviam sido negativos, e não houve nenhuma reação. Nenhum paciente foi provocado com cefalosporina de cadeia lateral R1 semelhante ou com a cefalosporina implicada na reação. As provocações com as cefalosporinas alternativas foram, em geral, bem toleradas, confirmando que a alergia não seria "classe específica", mas sim, na grande maioria das vezes, direcionada às cadeias R1 ou R2. Além disso, os autores concluíram que os testes cutâneos negativos antes das provocações já eram um excelente biomarcador da segurança da provocação, que viria a se confirmar negativa40.
De qualquer forma, é notório que os estudos que avaliaram a reatividade cruzada dentro da classe das cefalosporinas ainda são escassos, e devem crescer exponencialmente nos próximos, até pela crescente importância dessa classe de BL na prática clínica. Naquela que deve ser a maior casuística unicêntrica de pacientes investigados por suspeita de alergia a cefalosporinas, Touati N. e cols. levantaram retrospectivamente os dados de 476 pacientes com história de reações às cefalosporinas. A alergia foi confirmada apenas em 22,3% dos casos, sendo 51,9% através dos testes cutâneos e 48,1% pelos testes de provocações. Apesar de seguros, os testes de provocação desencadearam anafilaxia em 20% dos casos, e mesmo os testes cutâneos acarretaram reações sistêmicas em 9,1% dos indivíduos. Os pacientes foram investigados para confirmar ou excluir o agente causador, e também foram classificados em 4 grupos de acordo com a cadeia lateral R1, mas não houve sistematização da investigação de reatividade cruzada. Mesmo dentro dos grupos de cadeias R1 similares ou idênticas, foi muito baixo o índice de reatividade cruzada41.
Recomendações atuais - EAACI (European Academy of Allergy and Clinicai Immunology)
Considerando os estudos existentes até 2020, a EAACI publicou recentemente diretrizes para facilitar o manejo dos pacientes com alergia a um ou mais BL. Nessa publicação, definiu-se como "muito rara" a sensibilização ao anel BL nas reações IgE-mediadas, sendo as cadeias laterais o epítopo mais frequente. Além disso, foi descrito também que, nas reações por imunidade celular, a sensibilização ao anel BL não ocorre, ou seja, a reatividade cruzada entre todos os BL é inexistente e, portanto, a troca de BL por outro de cadeia lateral distinta é segura15.
Como recomendações em relação às duas classes mais usadas, penicilinas e cefalosporinas, as diretrizes europeias sugerem que, em pacientes que não possam ser submetidos à investigação completa, quando há indicação de uma cefalosporina num indivíduo com antecedente de alergia imediata à penicilina, que ele seja submetido a testes cutâneos com cefalosporinas de cadeias laterais diferentes das penicilinas e, se os resultados forem negativos, sejam submetidos a teste de provocação15. Por outro lado, em reações não imediatas leves a moderadas (exantemas) às penicilinas em pacientes que requerem tratamento com cefalosporinas e não há tempo para realização de testes cutâneos de leitura tardia pré-tratamento, pode ser considerado a administração de dose plena de cefalosporinas com cadeias laterais diferentes das penicilinas sob supervisão médica, sem riscos de reações graves, mas apenas sendo documentado a ocorrência de exantemas15.
Na realidade brasileira, onde a realização de testes cutâneos com medicamentos é de escopo da atuação do médico alergista-imunologista e levando-se em conta que nossa especialidade ainda não conta com profissionais habilitados e disponíveis igualmente distribuídos em todo o país, acreditamos que esse algoritmo possa ser adaptado para nossa realidade, de modo a se tornar mais prático e factível em todo o território nacional.
RECOMENDAÇÕES ATUAIS - DEPARTAMENTO CIENTÍFICO DE ALERGIA A DROGAS DA ASBAI
Inicialmente, numa suspeita de alergia prévia a um BL, deve-se questionar sobre a urgência da investigação. Idealmente, deve-se iniciar a investigação o quanto antes, respeitando-se o intervalo mínimo de quatro semanas após a reação inicial, se possível.
Caso a investigação seja eletiva e ambulatorial, a prioridade deve ser tentar confirmar ou excluir a hipersensibilidade ao BL suspeito. Porém, concomitantemente pode-se lançar mão da investigação de outros membros da mesma classe, em particular nos testes cutâneos, em que se pode fazer vários testes num mesmo momento e avaliar também tolerância a outros antibióticos BL, caso o suspeito se confirme como culpado. Para tal, deve-se respeitar o método de, inicialmente, caracterizar o fenótipo da reação índice e se foi imediata ou não imediata, de modo a se realizar o teste cutâneo adequado: punctura e intradérmico de leitura imediata ou intradérmico de leitura semitardia [Arthus] ou tardia e teste de contato, respectivamente. Além disso, imperativo lembrar que para a realização de intradérmico, devemos usar medicações nas suas apresentações injetáveis (parenterais), estéreis.
Caso os testes cutâneos sejam negativos e não haja contraindicação, baseada na estratificação de risco do paciente, o ideal é realizar a provocação com o suspeito, pois se essa for negativa, toda a classe dos BL estará liberada para uso. Também salientamos que, em caso de reações não imediatas exantemáticas leves, pode-se lançar mão da provocação diretamente, sem a obrigatoriedade dos testes cutâneos. Contudo, caso a alergia ao BL inicial seja confirmada, seja por teste cutâneo ou de provocação, ou se tiver alguma contraindicação (farmacodermia grave, por exemplo), pode-se chegar à liberação de alternativas com o teste de provocação baseado nas cadeias laterais da droga.
Caso se trate de necessidade urgente de uso de BL num paciente ainda não investigado, a investigação sistematizada terá de ser postergada, e a prioridade será a liberação de um BL eficaz e seguro. Nesse caso, a regra é utilizar BL de estrutura diferente do suspeito de ter causado a reação inicial (Tabela 4) e, idealmente, se fazer a primeira administração com incremento de doses, como num teste de provocação. Quando se tratar de reação inicial imediata, em particular se tiver sido anafilática, os testes cutâneos de leitura imediata com o BL alternativo antes da primeira dose terapêutica podem aumentar a segurança dessa provocação. Ao término do tratamento com esse BL, deve ser programada a investigação completa do agente suspeito, para desrotular possíveis pacientes não alérgicos e liberar toda a classe de BL. O algoritmo sugerido de avaliação da tolerância a outros BL num paciente com suspeita de alergia está esquematizado na Figura 4.
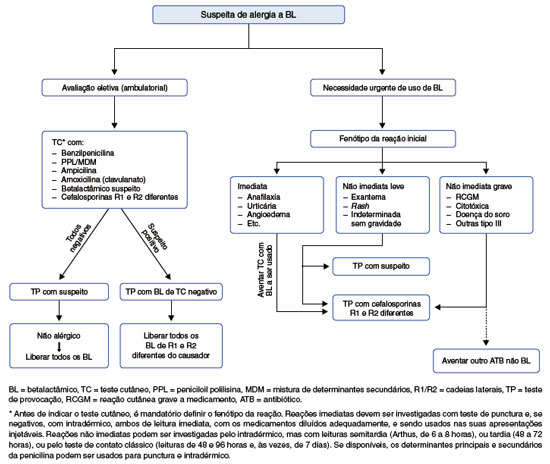
Figura 4
Algoritmo para avaliação do paciente com suspeita de alergia a um betalactâmico, de modo a investigar o suspeito e possível tolerância a outros antibióticos da classe
CONCLUSÕES
Os betalactâmicos são os fármacos que mais causam reações de hipersensibilidade envolvendo um mecanismo imunológico, com destaque para as classes das penicilinas e cefalosporinas. Estudos recentes têm demonstrado que tanto dentro de uma mesma classe como entre betalactâmicos de classes diferentes, a reatividade cruzada é bem menor do que antes se imaginava, e parece estar intimamente relacionada à semelhança estrutural entre as cadeias laterais desses fármacos. Assim, o conhecimento da estrutura química dos betalactâmicos é fundamental nessa avaliação. A abordagem atualizada da reatividade cruzada entre os betalactâmicos deve ser feita através de uma investigação sistematizada, permitindo desrotular os pacientes não verdadeiramente alérgicos, mas ao menos permitir o uso de betalactâmico alternativo de forma segura e eficaz. O desenvolvimento de programas educacionais, com a padronização de algoritmos entre diferentes centros que permitam a médicos especialistas, e não especialistas, colocarem em prática a forma mais adequada de administração dos antimicrobianos em ambientes intra e extra-hospitalares.
REFERÊNCIAS
1. Shenoy ES, Macy E, Rowe T, Blumenthal KG. Evaluation and Management of Penicillin Allergy: A Review. JAMA. 2019;321(2):188-99.
2. Castells M, Khan DA, Phillips EJ. Penicillin Allergy. N England J Med. 2019;381:2338-51.
3. Sacco KA, Bates A, Brigham TJ, Imam JS, Burton MC. Clinical outcomes following in patient penicillin allergy testing: a systematic review and meta-analysis. Allergy. 2017;72(9):1288-96.
4. Huang KG, Cluzet V, Hamilton K, Faduga O. The impact of reported beta-lactam allergy in hospitalized patients with hematologic malignancies requiring antibiotics. Clin Infect Dis. 2018;67(1):27-33.
5. Felix MMR, Aun MV, Menezes UP, Queiroz GRES, Rodrigues AT, D'Onofrio-Silva AC, et al. Allergy to penicillin and betalactam antibiotics. Einstein (São Paulo). 2021;19:1-13.
6. Macy E. Penicillin and Beta-lactam allergy epidemiology and diagnosis. Curr Allergy Asthma Rep. 201414:14:476.
7. Pichler WJ. Imune Pathomechanism and classification of drug hypersensitivity. Allergy. 2019;74(8):1457-71.
8. Khan Da, Banerji A, Bernstein JA, Bilgicer B, Blumenthal K, Castells M, et al. Cephalosporin Allergy: Current understanding and future challenges. J Allergy Clin Immunol Pract. 2019;7:2105-14.
9. Torres MJ, Blanca M. The complex clinical Picture of beta-lactam hypersensitivity: penicillins, cephalosporins, monobactams, carbapenems, and clavams. Med Clin North Am. 2010:94(4):805.
10. Pichichero ME, Zagursky R. Penicillin and cephalosporin allergy. Ann Allergy Asthma Immunol. 2014;112(5):404-12.
11. Zagursky RJ, Pichichero ME. Cross-reactivityin Beta-lactam allergy. J Allergy Clin Immunol Pract. 2018;6(1):72-81.
12. Blanca-Lopez N, Jimenez-Rodriguez TW, Somoza ML, Gomez E, Al-Ahmad M, Perez-Sala D, et al. Allergic reactions to penicillins and cephalosporins: diagnosis assessment of cross-reactivity and management. Exp Rev Clin Immunol. 2019;15(7):707-21.
13. Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, Caubet JC, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy. 2019;74:14-27.
14. Dona I, Romano A, Torres MJ. Algorithm for betalactam allergy diagnosis. Allergy. 2019;74:1817-9.
15. Romano A, Atanaskovic-Markovic M, Barbaud A, Bircher AJ, Brockow K, Caubet JC, et al. Towards a more precise diagnosis of hypersensitivity to beta-lactams: an EAACI position paper. Allergy. 2020;75(6):1300-15.
16. Chiriac AM, Banerji A, Gruchalla RS, Thong BYH, Wickner P, Mertes PM, et al. Controversies in Drug Allergy: Drug Allergy Pathways. J Allergy Clin Immunol Pract. 2019;7(1):46-60.
17. Wurpts G, Aberer W, Dickel H, Brehler R, Jakob T, Kreft B et al. Guideline on diagnostic procedures for suspected hypersensitivity to beta-lactam antibiotics. Allergol Select. 2020;4:11-43.
18. Picard M, Robitaille G, Karam F, Daigle JM, Bédard F, Biron É, et al. Cross-reactivity to cephaslosporins and carbapenems in penicillin-allergic patients: two systematic reviews and meta-analysis. J Allergy Clin Immunol Pract. 2019;7(8):2722-38.
19. Romano A, Gaeta F, Poves MFA, Valluzzi RL. Cross-Reactivity among Beta-lactams. Curr Allergy Asthma Rep. 2016;16:1-12.
20. Chaudhry SB, Veve MP, WagnerJL. Cephalosporins: a focus on side chains and B-lactam cross-reactivity. Pharmacy. 2019;7(3):103:1-16.
21. Rubin R. Overdiagnosis of penicillin allergy leads to costly, inappropriate treatment. JAMA. 2018;320(18):1846-8.
22. Macy E, Contreras R. Health care use and serious infection prevalence associated with penicilillina "allergy"in hospitalized patients: a cohort study. J Allergy Clin Immunol. 2014;133(3):790-6.
23. Caruso C, Valluzzi RL, Colantuono S, Gaeta F, Romano A. B-Lactam Allergy and Cross-Reactivity: A Clinician's Guide to Selecting na Alternative Antibiotic. J Asthma Allergy. 2021;14:31-46.
24. Blanca-Lopez N, Perez-Alzate D, Ruano F, Garcimartin M, delaTorre V, Mayorga C, et al. Selective immediate responders to amoxicillin and clavulanic acid tolerate penicillin derivative administration after confirming the diagnosis. Allergy. 2015;70(8):1013-9.
25. Torres MJ, Romano A, Mayorga C, Moya MC, Guzman AE, Reche M, et al. Diagnostic evaluation of a large group of patients with immediate allergy to penicillins: the role of skin testing. Allergy. 2001;56:850-6.
26. Trcka J, Seitz CS, Brocker EB, Gross GE, Trautmann A. Aminopenicillin-induced exanthema allows treatment with certain cephalosporins or phenoxymethyl penicillin. J Antimicrob Chemother. 2007;60(1):107-11.
27. Romano A, Valluzzi RL, Caruso C, Maggioletti M, Quaratino D, Gaeta F Cross-reactivity and tolerability of cephalosporins in patients with IgE-mediated hypersensitivity to penicillins. J Allergy Clin Immunol Pract. 2018;6(5):1662-72.
28. Caimmi S, Galéra C, Bousquet-Rouanet L, Arnoux B, DemolyP, Bousquet PJ. Safety of cefuroxime as an alternative in patients with a proven hypersensitivity to penicillins: a DAHD cohort survey. Int Arch Allergy Immunol. 2010;153(1):53-60.
29. Romano A, Valluzzi RL, Caruso C, Zaffiro A, Quaratino D, Gaeta F. Tolerability of Cefazolin and Ceftibuten in patients with IgE-Mediated Aminopenicillin allergy. J Allergy Clin Immunol Pract. 2020;9:1989-93.
30. Romano A, Gaeta F, Valluzzi RL, Maggioletti M, Caruso C, Quaratino D. Cross-reactivity and tolerability of aztreonam and cephalosporins in subjects with a T cell-mediated hypersensitivity to penicillins. J Allergy Clin Immunol. 2016;138:179-86.
31. Atanaskovic-Markovic M, Gaeta F, Gavrovic-Jankulovic M,Velickovic TC, Valluzzi RL, Romano A. Tolerability of imipenem in children with IgE-mediated hypersensitivity to penicillins. J Allergy Clin Immunol. 2009;124(1):167-9.
32. Gaeta F, Valluzzi RL, Alonzi C, Maggioletti M, Caruso C, Romano A. Tolerability of aztreonam and carbapenems in patients with IgE-mediated hypersensitivity to pencillins. J Allergy Clin Immunol. 2015;135(4):972-6.
33. Romano A, Gaeta F, Valluzzi RL, Alonzi C, Maggioletti M, Zaffiro A, et al. Absence of cross-reactivity to carbapenems in patients with delayed hypersensitivity to penicillins. Allergy. 2013;68(12):1618-21.
34. Antunez C, Blanca-Lopez N, Torres MJ, Mayorga C, Perez-Inestrosa E, Montanez MI, et al. Immediate allergic reactions to cephalosporins: evaluation of cross-reactivity with a panel of penicillins and cephaslosporins. J Allergy Clin Immunol. 2006;117(2):404-10.
35. Li J, Green SL, Krupowicz BA, Capon MJ, Lindberg A, Hoyle P, et al. Cross-reactivity to penicillins in cephalosporin anaphylaxis. Br J Anaesth. 2019;123(6):e532-e534.
36. Kula B, Djordjevic G, Robinson JL. A systematic review: can one prescribe carbapenems to patients with IgE-mediated allergy to penicillins or cephalosporins? Clin Infect Dis. 2014 Oct 15;59(8):1113-22.
37. Romano A, Gaeta F, Valluzzi RL, Caruso C, Rumi G, Bousquet PJ. IgE-mediated hypersensitivity to cephalosporins: cross-reactivity and tolerability of penicillins, monobactams, and carbapenems. J Allergy Clin Immunol. 2010;126(5):994-9.
38. Sadleir Ph, Clarke RC, Platt PR. Cefalotin as antimicrobial prophylaxis in patients with known intraoperative anaphylaxis to cefazolin. Br J Anaesth. 2016;117(4):464-9.
39. Van Gasse AL, Ebo DG, Faber MA, Elst J, Hagendorens MM, Bridts CH, et al. Cross-reactivity in IgE-mediated allergy to cefuroxime: Focus on the R1 side chain. J Allergy Clin Immunol Pract. 2020;8(3):1094-96.
40. Romano A, Gaeta F, Valluzzi RL, Maggioletti M, Zaffiro A, Caruso C, et al. IgE-mediated hypersensitivity to cephalosporins: Cross-reactivity and tolerability of alternative cephalosporins. J Allergy Clin Immunol. 2015;136(3):685-91.
41. Touati N, Cardoso B, Delpuech M, Bazire R, El Kara N, Ouali D, et al. Cephalosporin Hypersensitivity: Descriptive Analysis, Cross-Reactivity, and Risk Factors. J Allergy Clin Immunol Pract. 2021;9(5):1994-2000.