Número Atual: Outubro-Dezembro 2021 - Volume 5 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Relação entre exercício físico e sistema imunológico
Relationship between exercise and the immune system
Bruna Bonifácio; Mariana Reale Tallavasso Vassovinio; Victoria Clemente Monteleone; Vittória Generoso de Faria; João Paulo de Assis
DOI: 10.5935/2526-5393.20210056
Universidade Nove de Julho, Curso de Medicina - São Paulo, SP, Brasil
Endereço para correspondência:
João Paulo de Assis
E-mail: joaoassis@uni9.pro.br
Submetido em: 07/03/2021
Aceito em: 25/04/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
O corpo humano tende sempre a procurar um estado de homeostase, buscando o equilíbrio entre todos os sistemas. O exercício físico está presente na rotina diária de indivíduos, mesmo com objetivos diferentes, porém a influência no sistema imunológico não é muitas vezes abordada como fator relevante. O sistema imune é responsável por proteger o organismo contra infecções e doenças, podendo ser modulado perante a resposta de exercícios físicos regulares. Tendo em vista que, atualmente, existe uma preocupação maior em tornar e manter a imunidade eficiente, a prática regular e moderada do exercício pode contribuir para uma maior eficácia desse sistema, dessa forma, podendo ser considerada uma proteção ao corpo humano. O objetivo dessa revisão foi sintetizar os dados de estudos presentes na literatura que demonstram a influência do exercício físico na resposta do sistema imunológico, tornando possível compreender as alterações moleculares, fisiológicas, metabólicas e celulares que levam a um tipo específico de resposta do organismo humano.
Descritores: Sistema imunológico, exercício físico, inflamação, leucócitos.
INTRODUÇÃO
Nos dias atuais o sedentarismo tem sido um hábito dentre os seres humanos. O aumento de horas em frente a computadores, videogames e televisão contribuem para o aumento dessa população, que, consequentemente, diminui o tempo da prática de atividade física, gerando inúmeros prejuízos à saúde1. O benefício do exercício físico é evidente há muito tempo. No século V a.C., o médico Hipócrates já afirmava: "Todas as partes do corpo, se usadas com moderação e exercidas nos trabalhos aos quais cada um está acostumado, tornam-se saudáveis e bem desenvolvidas e envelhecem lentamente; mas se não forem usadas e ficarem ociosas, elas se tornam sujeitas a doenças, com defeito de crescimento e envelhecem rapidamente." Infelizmente, no século XXI, a crença no valor dos exercícios para a saúde desvaneceu-se, tanto que a falta de exercícios agora representa um grande problema de saúde pública2. É de suma importância que a população volte a acreditar nos benefícios do exercício físico, pois é um aliado para a melhora da saúde e, inclusive, tem a capacidade de promover respostas imunológicas, beneficiando a saúde do indivíduo como um todo. Segundo a Organização Mundial da Saúde (OMS), para ter os benefícios à saúde, são indicados, para adultos saudáveis, mais de 300 minutos de exercício físico semanal em intensidade moderada, ou 150 minutos de exercício físico semanal em intensidade vigorosa, ou uma combinação de exercícios de intensidade moderada e vigorosa3.
O presente artigo tem como objetivo realizar uma revisão integrativa da literatura relacionando o papel que o exercício físico exerce sobre o sistema imunológico.
SISTEMA IMUNOLÓGICO
O sistema imunológico é composto por diversos órgãos, células e moléculas com a finalidade de defender o organismo, de forma adaptável, contra agentes infecciosos ou não infecciosos, e manter a homeostase corpórea4. Muitos estressores físicos, como cirurgias, traumas, queimaduras, sepse e exercício físico, induzem um padrão de respostas imunológicas semelhantes5. Frente a esses estressores físicos, nosso corpo monta essa resposta imunológica que inclui dois estágios: a imunidade inata e a imunidade adaptativa. O primeiro compreende as barreiras físicas e químicas, além da ação de células como macrófagos, células dendríticas (DCs), células natural killer (NKs) e neutrófilos. Nesse estágio também pode-se citar diversas citocinas e interleucinas (ILs), além do óxido nítrico (NO). O segundo estágio tem como mecanismo de ação os linfócitos T (TCD4+ e TCD8+) e os linfócitos B e seus produtos, como anticorpos e citocinas. Essa resposta, chamada de adaptativa, pode ser subdividida em imunidade celular (mediada por células) e imunidade humoral (mediada por anticorpos)6,7. Para facilitar o entendimento entre o exercício físico e suas influências no sistema imunológico, apresentaremos a seguir as principais células e moléculas solúveis do sistema imunológico inato e adaptativo, influenciadas durante o exercício físico.
NEUTRÓFILOS
Os neutrófilos representam cerca de metade da quantidade total de leucócitos circulantes, tornando-se assim os leucócitos mais abundantes no sangue, e sendo uma das primeiras células a chegar ao local da infecção e ativar o processo inflamatório. Esse conjunto de células faz parte do sistema imunológico inato e é essencial para a defesa do hospedeiro, além de participar de várias condições inflamatórias. Para que essa resposta aconteça, os neutrófilos são atraídos por mediadores químicos até o local da lesão, e essa migração ocorre em quatro etapas: primeiramente os neutrófilos se aproximam do endotélio de forma marginal, depois acontece a rolagem para que os neutrófilos possam aderir o endotélio e alterar a forma, dessa maneira acontece a migração transendotelial, e finalmente os neutrófilos saem de dentro dos vasos e atingem os tecidos inflamados4. Também são importantes na fagocitose, e este processo é estimulado pela ligação dos receptores presentes nos neutrófilos a opsoninas, Fc de IgG, moléculas do complemento como C3b e receptores Toll-like (TLRs)8. Nota-se, então, que diversos elementos estão envolvidos no comportamento destas células, como mediadores neuroendócrinos, liberação de esteroides, produção de citocinas e processos de oxirredução associados com a produção de radicais livres, todos esses fatores são influenciados pelo exercício físico4.
Uma das características mais pronunciadas da atividade física nos parâmetros imunológicos é a neutrofilia prolongada após exercício agudo, de moderada intensidade e longa duração9. Um estudo foi realizado em pessoas do gênero masculino, que foram submetidos a uma aula de ciclismo indoor. Nesta pesquisa foram verificadas variações agudas nos níveis de neutrófilos presentes no sangue, em que, imediatamente após o exercício a contagem de neutrófilos aumentou em 12%, e num período de recuperação de 24 horas o número foi reduzido para 19,8% e 11,3% no período de 48 horas4. Esse aumento dos níveis de neutrófilos está intimamente relacionado ao aumento da expressão das moléculas de adesão celular após o exercício, o que pode contribuir para o extravasamento de neutrófilos para o tecido danificado, incluindo o músculo esquelético (Figura 1)10. Foi relatada uma redução na expressão de L-selectina (CD62L) imediatamente após o exercício, seguida por um aumento durante a recuperação11. A expressão de CD11b também ocorre em resposta ao exercício físico12.
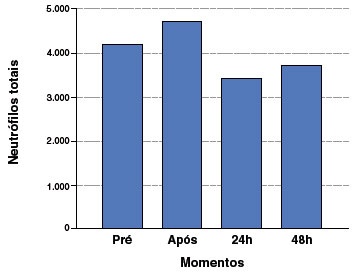
Figura 1
Contagem de neutrófilos totais em momentos pré, imediatamente após, 24h após e 48h após o exercício físico
MACRÓFAGOS E MONÓCITOS
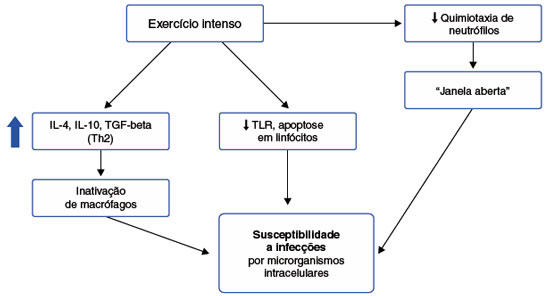
Os macrófagos são células teciduais, que fazem a ponte entre o sistema imunológico inato e o sistema imunológico adaptativo. Agem produzindo citocinas, fagocitando microrganismos, apresentando antígenos via moléculas de MHC e iniciando o processo de reparo tecidual4,6. O estresse do exercício tem um efeito estimulante na maioria das funções dos macrófagos e monócitos13. A ação das catecolaminas liberadas durante o exercício provoca monocitose transitória, porém o exercício exaustivo naqueles indivíduos que portam alguma condição inflamatória adjacente pode diminuir o número de macrófagos recrutados para o sítio inflamatório14. Foi demonstrado que durante e logo após o exercício a quimiotaxia, fagocitose e atividade citotóxica estão aumentadas, possivelmente associadas à secreção aumentada de cortisol, prolactina e tiroxina15,16. Exercícios aeróbicos prolongados e extenuantes diminuem a expressão de receptores do tipo Toll (Toll-like receptor - TLRs) em macrófagos e comprometem a apresentação de antígenos para os linfócitos T, impedindo, sobretudo, a resposta inflamatória Th1. Esse efeito anti-inflamatório impede o dano tecidual causado pelos mediadores inflamatórios e reduz o risco de doenças inflamatórias crônicas, mas aumenta a susceptibilidade de infecções por microrganismos intracelulares17,18.
CÉLULAS DENDRÍTICAS
As células dendríticas têm a capacidade de internalizar antígenos e expressar um grande número de moléculas coestimulatórias, sendo uma importante célula apresentadora de antígenos para as células T, estimulando a sua expansão clonal19. Também são consideradas como ponte entre o sistema imunológico inato e o sistema imunológico adaptativo20, sendo uma das primeiras células a chegar no local da infecção4,6. Chiang e cols. observaram em roedores que, após cinco semanas de treinamento na esteira com incrementos na velocidade e inclinação ao longo das semanas, houve um aumento no número de células dendríticas, em sua expressão de MHC de classe II e produção de IL-12, sugerindo a capacidade de indução de resposta imunológica celular21.
CÉLULAS NATURAL KILLER
As células natural killer (NK) são uma população heterogênea de linfócitos T que expressam marcadores característicos, como o CD16 e o CD5622, e que são responsáveis pelo reconhecimento e lise de células infectadas por vírus, bactérias, protozoários e de células tumorais, além de atuar contra a disseminação do tumor23. A atividade citolítica destas células é aumentada pelo interferon-alfa (IFN-α)24 e interleucina-2 (IL-2), enquanto certas prostaglandinas e complexos imunes regulam negativamente a função das células NK22,25. Esse tipo celular se mostra muito responsivo ao estímulo do exercício físico, exibindo um aumento em até 6 vezes de seus níveis séricos após o esforço físico26. Isso ocorre, principalmente, devido à responsividade destas células ao aumento dos níveis de adrenalina e noradrenalina, que são liberadas durante o exercício. Essa liberação, e por consequência, o aumento sérico das células NK, depende da intensidade e duração do exercício físico27. Em contrapartida foi comprovado que após o exercício intenso e de longa duração, a concentração de células NK e a atividade citolítica NK tendem a diminuir abaixo dos valores pré-exercício. A redução máxima nas concentrações de células NK e, portanto, a menor atividade destas, ocorre 2-4 h após o exercício, provavelmente devido à ação de prostaglandinas28.
CITOCINAS E QUIMIOCINAS
As citocinas são glicoproteínas solúveis que, em geral, apresentam baixo peso molecular (entre 5.000 e 30.000) e desempenham um papel central na mediação e regulação das respostas imunológicas quando lançadas no local da inflamação29-31. As quimiocinas compreendem uma família englobada pelas citocinas, responsáveis por mediar e deslocar leucócitos para as áreas de inflamação4. Essas substâncias têm a capacidade de atuar como mensageiras entre as células do sistema imunológico, hematopoiético e neuroendócrino32. Estas moléculas podem agir como substâncias pró ou anti-inflamatórias. As principais citocinas anti-inflamatórias são IL-10 e TGF-beta (fator de transformação de crescimento β) que podem inibir a produção de citocinas pró-inflamatórias. Dentre as citocinas pró-inflamatórias podemos citar IL-1, IL-2, IL-12, IL-18, IFN-γ e TNF-α. A produção das citocinas anti-inflamatórias, sobretudo IL-10, pode ser regulada por uma variedade de fatores, como por exemplo as catecolaminas, os glicocorticoides e prostaglandina E2 (PGE2), que são produzidas durante o exercício físico33. A IL-6, que atualmente vem sendo denominada miocina, é uma citocina que pode desencadear diversas funções moduladoras em função da alteração de seus níveis fisiológicos, induzindo efeitos pró-inflamatórios, anti-inflamatórios ou até mesmo ambos, de acordo com o organismo e/ou grupo celular em que são sintetizados9,34. A IL-6, durante os exercícios prolongados, é liberada em altas concentrações pelos músculos esqueléticos35-37. A concentração plasmática da quimiocina IL-8 pode aumentar em resposta à inflamação decorrente de uma sessão de exercício físico em que ocorram contrações musculares excêntricas38,39.
LINFÓCITOS
Os linfócitos são divididos entre linfócitos T e B, no qual a célula T é responsável por erradicar infecções ocasionadas por patógenos intracelulares e ativar outras células. Já as células B são responsáveis por secretar anticorpos e criar memória, quando transformados em plasmócitos após sua ativação. Estas células também são responsáveis pela memória antigênica, ou seja, em uma nova exposição ocorre a indução de uma resposta imunológica mais rápida e intensa, que colabora para a eliminação do patógeno de forma mais eficaz4. Durante o exercício físico moderado, a concentração de linfócitos aumenta no leito vascular e, após exercícios extenuantes, diminui para níveis abaixo do período pré-exercício40,41. Essa queda pode ser consequência de um mecanismo de apoptose ou devido à liberação de adrenalina e cortisol, os quais inibem a função linfocitária e são liberados durante exercícios de alta intensidade10. A razão entre os níveis de linfócitos CD4+ e CD8+ diminui à medida que as células TCD8+ aumentam no sangue em relação à TCD442,43.
IMUNOGLOBULINAS
As imunoglobulinas são produtos das células B que são secretadas após o contato com o antígeno específico27. Após exercício de alta e média intensidade, tem sido descrito aumento das imunoglobulinas séricas. Essa informação pode ser explicada pela contração do volume plasmático que ocorre após o exercício13. O afluxo de proteínas do extra para o intravascular, representadas principalmente por linfa rica em imunoglobulinas também poderia explicar o achado13. Porém, a IgA, presente nas mucosas do trato superior respiratório e, portanto, responsável pela proteção desse sistema, pode diminuir expressivamente após exercícios de alta intensidade, o que pode justificar a prevalência de doenças respiratórias que acometem as vias aéreas superiores em atletas (IVAS)27,44.
O EXERCÍCIO FÍSICO
A atividade física é considerada um dos principais componentes de uma vida saudável. Ela pode ser utilizada para a manutenção da saúde e bem-estar, pois é capaz de modular alguns aspectos neurológicos e endocrinológicos nos indivíduos que realizam treinamentos regulares. A prática de exercícios físicos, atualmente, é utilizada como meio de promoção de saúde e tem sido proposta como uma intervenção não medicamentosa que traz diversos benefícios à saúde do indivíduo45. Além das funções relacionadas à prevenção do excesso de peso corporal, inflamação sistêmica e doenças crônicas não transmissíveis, sugere-se um potencial benéfico do exercício físico na redução de doenças transmissíveis, incluindo patologias virais, devido ao estímulo da imunidade celular46,47.
A capacidade de realização de treinamentos depende das respostas metabólicas do corpo humano em converter energia química, proveniente dos tecidos musculares, em forma de trifosfato adenosina (ATP) posteriormente clivada em difosfato adenosina (ADP), em energia mecânica, o que faz com que ocorra a contração muscular48. Buscando compreender a relação entre metabolismo e exercício físico, inúmeros estudos foram realizados, com objetivo de demonstrar quais respostas celulares seriam desencadeadas pelos treinamentos e quais variáveis poderiam interferir nessa resposta celular17. A variável mais encontrada nos artigos pesquisados diz respeito à intensidade do treinamento, classificando o exercício físico quanto ao nível de esforço, podendo ser leve, moderado ou intenso. Essa classificação leva em conta parâmetros fisiológicos do organismo como frequência cardíaca máxima, consumo máximo de oxigênio e índice de percepção ao esforço50.
O exercício físico é capaz de gerar um estresse para o organismo. Fisiologicamente, há perda da homeostase, ou seja, há um desequilíbrio sistêmico devido às alterações de volume sanguíneo, temperatura corporal e consumo máximo de oxigênio51. Antes e durante a prática de exercícios, alguns agentes químicos, neurais e hormonais sofrem ajustes, com o objetivo de proporcionar alterações cardiovasculares com aumento da frequência e força de bombeamento do coração, alterando o fluxo sanguíneo de forma proporcional à intensidade do exercício. Em resposta às alterações, o corpo modifica parâmetros metabólicos e fisiológicos para manter o equilíbrio, com isso as respostas celulares na fase aguda, no curto prazo, são diferentes da fase crônica, no longo prazo49.
Fase aguda
Uma sessão de exercício realizada de forma isolada pode ser caracterizada como uma fase aguda, e nessa fase alguns efeitos fisiológicos já podem acontecer. Esses efeitos podem ser divididos em imediatos e tardios. Os efeitos imediatos acontecem logo após a realização do exercício, e os tardios de 24 a 72 horas após o exercício. Os efeitos agudos imediatos correspondem à sudorese, ao aumento da frequência cardíaca e da ventilação pulmonar, e os efeitos tardios consistem na melhora da sensibilidade à insulina e da secreção de catecolaminas. Em nível sanguíneo podemos encontrar uma leucocitose, e esse aumento de leucócitos acontece em função do aumento das catecolaminas. Essas substâncias induzem o aumento na quantidade de neutrófilos e células natural killer (NK), e alguns estudos experimentais já evidenciaram um aumento no número de macrófagos e diminuição da expressão de MHC II52-55.
Fase crônica
A fase crônica do exercício físico ocorre após inúmeras sessões de treinamento realizadas de forma regular. Nessa fase ocorre uma adaptação, e os estímulos da fase aguda passam a ser mais eficazes. Nessa fase ocorre fortalecimento dos músculos, melhora no condicionamento cardiovascular e no perfil lipídico. Essa prática regular de exercícios, principalmente, de forma moderada, faz com que o indivíduo crie tolerância aos estímulos estressores. Essa tolerância também ocorre no sistema imunológico. Vale ressaltar que estas alterações estão relacionadas ao tipo de exercício, intensidade e carga, ou seja, cada tipo de treinamento resulta na ativação ou na inativação de mecanismos celulares e moleculares, que podem interferir diretamente no sistema imunológico do ser humano13,56.
TIPOS DE TREINAMENTO
Treinamento resistido
O treinamento resistido consiste na realização de exercícios com uso de pesos e máquinas, com objetivo de trabalhar contra a resistência muscular, gerando uma sobrecarga no músculo56, o que favorece a resistência muscular e consequentemente aumento de massa magra e redução de gordura corporal. Com a prática regular do treinamento resistido também gera redução da massa gorda, o que melhora a adaptação física corporal, facilitando atividades cotidianas. A musculação e levantamento de peso são exemplos de treinamento resistido57.
Treinamento aeróbico
O treinamento aeróbico consiste em um maior número de repetições, com uma duração maior e com intensidade moderada. Durante esse tipo de exercício há um maior consumo de oxigênio pelo organismo, sob a forma de ATP para geração de trabalho muscular. Os benefícios para o organismo são a aumento da eficiência cardíaca, redução do peso gordo, melhora da saúde mental, da disposição e do sistema imunológico. Andar de bicicleta, natação e caminhadas são alguns dos exemplos de treinamento aeróbico56-58.
Intensidade
A intensidade do exercício está relacionada com a capacidade respiratória (VO2max) e tem como variáveis o volume do treino, a complexidade dos exercícios, a capacidade do indivíduo e o tempo de duração58. O exercício físico se trata de um estresse metabólico para o organismo, o treinamento intenso gera um estresse ainda maior, pois aumenta a formação intracelular de espécies reativas de oxigênio (ERO) promovendo maior estresse oxidativo21. O exercício físico moderado ou de baixa intensidade auxilia a resposta imunológica saudável e reduz o estresse oxidativo após uma sessão de exercício, dessa forma não sobrecarrega o sistema imunológico, tornando-se mais eficiente e com uma melhora da resposta59.
A intensidade está diretamente relacionada com a imunidade, pois é a principal variável que define como será a resposta imunológica do organismo frente ao tipo de treinamento. Dessa forma, os exercícios de intensidade baixa e moderada trazem maiores benefícios relacionados ao sistema imunológico. A imunossupressão induzida pela alta intensidade do exercício é estudada desde 1994, por Nieman, que propôs a curva em J, que traz a relação da intensidade do exercício com a possibilidade de infecção (Figura 2). Analisando todos os parâmetros e variáveis encontradas dentro da realização de exercício físico, nota-se que a frequência, a intensidade e o volume de treino são os principais fatores capazes de influenciar as adaptações celulares e do metabolismo do indivíduo, o que inclui a resposta imunológica15,52,59.
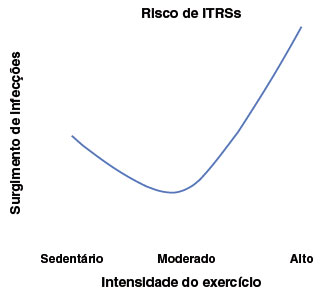
Figura 2
Modelo da curva em "J" da relação entre carga de exercício e surgimento de infecções do trato respiratório superior (ITRSs)
RESPOSTA IMUNOLÓGICA FRENTE AO EXERCÍCIO FÍSICO
O sistema imunológico apresenta uma determinada resposta frente ao tipo de estímulo que o exercício proporciona e, junto com as alterações da função imunológica, são notadas também alterações moleculares, celulares e teciduais. Essa diferença de resposta está relacionada com o nível de estresse que o treinamento gera, a aptidão física do indivíduo e a regularidade dos estímulos60. Tendo em vista que o exercício físico induz inflamação (local e sistêmica), assim como o reparo tecidual após um trauma, adaptações fisiológicas decorrentes do treinamento também podem ser classificadas como agudas e crônicas61.
A resposta aguda tem como objetivo ajustar a homeostasia para o reparo tecidual logo após uma única ou várias sessões de exercício. Além disso, ela pode ser subdividida em imediata ou tardia, como dito no tópico anterior28. As adaptações agudas imediatas são as que ocorrem até alguns minutos após o término do exercício, como por exemplo, elevações da frequência cardíaca, da pressão arterial e da temperatura corporal. Porém, esses valores podem mudar de acordo com o tipo de exercício, estático ou dinâmico, por exemplo62,63. Nos exercícios estáticos a obstrução do fluxo sanguíneo faz com que os metabólitos produzidos durante a contração se acumulem, ativando quimiorreceptores musculares, os quais promovem aumento expressivo da atividade nervosa simpática, ocasionando um aumento da frequência cardíaca, com diminuição do volume sistólico e menor acréscimo do débito cardíaco28. Em contrapartida, a pressão arterial tende ao aumento, pelo aumento da resistência vascular periférica62. Nos exercícios dinâmicos há elevada atividade nervosa simpática, que provoca um aumento do débito cardíaco, da frequência cardíaca e do volume sistólico28. A liberação de metabólitos musculares provoca a vasodilatação na musculatura ativa, o que diminui a resistência vascular periférica62.
Um estudo feito em oito homens saudáveis tentou analisar os efeitos de três tipos diferentes de exercício na contagem de leucócitos sanguíneos durante e após o exercício. Os indivíduos foram expostos aos seguintes experimentos: exercício aeróbico de intensidade equivalente a 90-97% do VO2máx por 5 min, prolongado: duas horas de exercício em cicloergometria (longo) completadas a 60 a 65% do VO2máx, e o de resistência: três séries de 10 repetições a 60 a 70% da força de 1-RM (repetição máxima). Os participantes permaneceram sentados por um período de recuperação de 3 horas após cada tipo de exercício, posteriormente comparados com o grupo controle, que estava sentado por 5 horas. Durante o exercício, as células NK, células T e B foram recrutadas para a corrente sanguínea, além do aumento da quantidade de neutrófilos e monócitos circulantes. Essa leucocitose ocorreu imediatamente após os exercícios e persistiu por 3 horas após o término63.
As contagens de linfócitos TCD3 e TCD4 mostraram aumento semelhante entre o exercício aeróbico e o prolongado. Porém, no período pós-exercício, depois de 3 horas de repouso, as contagens dos linfócitos TCD3 e TCD4 do exercício aeróbico estavam abaixo do normal, caracterizando uma linfocitopenia. As células circulantes CD3 CD16+ CD56+ (natural killer) aumentaram após o exercício aeróbico, um pouco menos no exercício prolongado e menos ainda nos de resistência. No entanto, todos voltaram ao valor basal 3 horas depois. O exercício induziu poucas mudanças na contagem das células B (CD19+), a qual aumentou apenas no pico aeróbico, imediatamente após o exercício, e um aumento após 3 horas nos exercícios de resistência64.
As prováveis justificativas para a linfocitopenia, causada após o término do exercício, podem estar relacionadas à redução dos níveis de adrenalina, seguido de um aumento na concentração de cortisol e hormônio do crescimento, levando a uma redistribuição dos leucócitos e linfócitos, apresentando, desse modo, um efeito imunossupressor27. Já o aumento das células natural killer deve-se à maior secreção de catecolaminas, em especial a epinefrina, e a liberação de alguns fatores do sistema complemento, como os interferons (IFN-1), interleucinas (IL-2) e o hormônio beta-endorfina como coadjuvantes desse processo64. Após 3 horas de exercício, as células NK voltaram aos valores basais, tendo em vista a liberação de prostaglandinas por neutrófilos e macrófagos junto com fatores hormonais como cortisol, o qual possui efeito imunossupressor30. Ao longo das 24 ou 48 horas após uma sessão de exercício, a fase aguda que era imediata, torna-se tardia, em que são observadas reduções nos níveis tensionais e aumento da sensibilidade62.
Já as adaptações crônicas resultam da exposição sistemática e regular das sessões de exercícios, em longo prazo, sendo assim, a fase crônica é a soma do efeito das adaptações agudas no sistema neuro-muscular ao longo de algumas semanas, que geram mudanças morfofuncionais dos sistemas fisiológicos. Como exemplo, bradicardia de repouso, hipertrofia muscular, hipertrofia ventricular esquerda e elevação da potência aeróbica28,63. Além disso, há o aumento do fluxo sanguíneo para os músculos esqueléticos e para o músculo cardíaco, pois o exercício físico propicia a angiogênese62.
Um estudo feito com 28 idosos com duração de seis meses de treinamento moderado mostrou que o número absoluto de linfócitos TCD4+ (CD28+CD4+) aumentou, assim como o das células produtoras de IFN-γ (Th1), enquanto as células T, responsáveis pela produção de IL-4 (Th2), não sofreram alterações significativas63. Alguns outros estudos comprovam estes dados demonstrando que o número total de linfócitos T, de células TCD4+, e a expressão de IL-2R em células T aumentou em pacientes submetidos a exercícios de intensidade moderada combinados de resistência e força, ou programa de treinamento exclusivamente de resistência. Concluiu-se que a expressão aumentada é responsável por favorecer a resposta de Th1, o que previne infecções causadas por microrganismos intracelulares31,62.
O aumento da interleucina-6, IL-6, tem direta relação com a intensidade do exercício31, dado o fato de que se encontra em abundância em tecidos musculares, o que a torna mais sensível aos estímulos e intensidade dos exercícios físicos35. Por outro lado, atividades de alta intensidade geram aumento das concentrações de citocinas anti-inflamatórias (padrão Th2), que pode resultar no aumento da susceptibilidade a infecções, como por exemplo a infecção de vias aéreas superiores (IVAS). Atletas que apresentam baixas concentrações plasmáticas de IL-10 (baixa concentração também na mucosa nasal), IL-1ra e IL-8 em repouso, possuem mais propensão a desenvolver doenças respiratórias65. Estes dados demonstram que a resposta imunológica pode ser modulada frente a estímulos diferentes, ou seja, dependendo da intensidade do exercício físico (Figura 3)62.
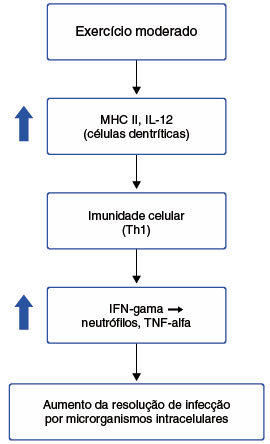
Figura 3
Resumo dos efeitos do exercício físico de intensidade moderada
De maneira resumida, podemos dizer que exercício de intensidade moderada promove proteção contra infecções causadas por microrganismos intracelulares, pois direciona a resposta imunológica para a predominância de células Th1, na qual o tipo de resposta é celular62. Está associado ao aumento da função dos leucócitos, auxilia a quimiotaxia, desgranulação, fagocitose e atividade oxidativa dos neutrófilos uma hora após exercício físico60. Já o exercício de grande intensidade, gera um aumento nos níveis de citocinas anti-inflamatórias (padrão Th2), com o objetivo de reduzir os danos causados no tecido muscular devido ao estresse gerado, tornando o indivíduo mais suscetível a infecções (Figura 4)62. Após a realização de apenas uma sessão de exercício intenso, uma imunossupressão temporária acontece, conhecida como "janela imunológica", e pode durar de 3 a 72 horas60.
CONCLUSÃO
A prática de exercícios físicos de forma regular é essencial para manutenção da saúde, já que permite uma resposta imunológica adequada, leva ao fortalecimento do sistema cardiovascular e respiratório, além de melhorar o perfil lipídico do indivíduo que a pratica. A ciência é rica em estudos com evidências que mostram que o exercício físico é capaz de gerar alterações nas concentrações e nas funções de algumas células do sistema imunológico. Alguns aspectos, como a duração e a intensidade do exercício influenciam em como e qual será a resposta imunológica frente ao estímulo. É necessário um entendimento das adaptações imunológicas provocadas pelo exercício físico para que em uma perspectiva futura possa ser direcionado o melhor tipo de treinamento para cada pessoa, levando em consideração a individualidade do praticante, visando uma melhor e mais eficiente resposta imunológica.
REFERÊNCIAS
1. Enes CC, Betzabeth S. Obesidade na adolescência e seus principais fatores determinantes. Revista Brasileira de Epidemiologia. 2010;13(1):163-71.
2. Febbraio MA, Pedersen BK. Contraction-induced myokine production and release: is skeletal muscle an endocrine organ? Exerc Sport Sci Rev. 2005;33:114-9.
3. Organização Mundial da Saúde (OMS). Diretrizes da OMS para atividade física e comportamento sedentário, 2020 [Internet]. Disponível em: https://apps.who.int/iris/bitstream/handle/10665/ 337001/9789240014886-por.pdf?sequence=102&isAllowed=y#:~:text=Para%20sa%C3%BAde%20e%20bem%2Destar,dia%20 para%20crian%C3%A7as%20e%20adolescentes.
4. de Melo CW, Mesquita-Júnior D, Araújo JAP, Takao-Catelan TT, Souza AWS, Silva NP, et al . Sistema imunitário: Parte I. Fundamentos da imunidade inata com ênfase nos mecanismos moleculares e celulares da resposta inflamatória. Rev Bras Reumatol. 2010.50(4):434-47.
5. Hoffman-Goetz L, Pedersen BK. Exercise and the immune system: a model of the stress response? Immunol Today. 1994;15:382-7.
6. Simpson RJ, Katsanis E. The immunological case for staying active during the COVID-19 pandemic. Brain Behav Immun. 2020;87:6-7.
7. Elenkov IJ, Chrousos GP, Wilder RL. Neuroendocrine regulation of IL-12 and TNF-alpha/IL-10 balance. Clinical implications. Ann NY Acad Sci. 2000;917:94-105.
8. Machado-Filho R, Machado TJ. Efeitos da prática regular de exercícios físicos sobre o sistema imune. EFDeportes.com. 2011 ;16(157). Disponível em: https://www.efdeportes.com/efd157/efeitos-de-exercicios-fisicos-sobre-o-sistema-imune.htm.
9. MCCarthy DA, Dale MM. The leucocytosis of exercise. A review and model. Sports Med. 1988;6:333-63.
10. Baganha RJ, Modesto LV, Pereira AA, Santos GFS, Oliveira JJ, Silva AS, et al. Variações agudas na contagem leucocitária após aula de ciclismo indoor. ConScientiae Saúde. 2017;16(2):234-40.
11. Kurokawa Y, Shinkai S, Torii J, Hino S, Shek PN. Exercise-induced changes in the expression of surface adhesion molecules on circulating granulocytes and lymphocytes subpopulations. Eur J Appl Physiol. 1995;71:245-52.
12. Smith JA, Gray AB, Pyne DB, Baker MS, Telford RD, Weideman MJ. Moderate exercise triggers both priming and activation of neutrophil subpopulations. Am J Physiol Regulatory Integrative Comp Physiol. 1996;270:R838-R845.
13. Costa-Rosa LFPB, Vaisberg MW. Influências do exercício na resposta imune. Rev Bras Med Esporte. 2002;8(4):167-72.
14. Mackinnon, LT. Immunity in athletes. Int J Sports Med. 1997;18:S62-8.
15. Nieman DC, Nehlsen-Cannarella SL. The immune response to exercise. Semin Hematol. 1994;31:166-79.
16. Costa-Rosa LFBP, Safi DA, Curi R. Effect of hypo and hyperthyroidism on macrophages function and metabolism in rats. Cell Biochem Funct. 1995;13:141-7.
17. Mackinnon LT, Chick TW, van As A. Effects of prolonged intense exercise on natural killer cell number and function. Exercise Physiology Current Selected Research. 1988:77-89.
18. Gleeson M, McFarlin B, Flynn M. Exercise and Toll-like receptors. Exerc Immunol Rev. 2006;12:34-5.
19. Banchereau J, Briere F, Caux C, Davoust J, Lebecque S, Liu YJ, et al. Immunobiology of dendritic cells. Annu Rev Immunol. 2000;18:767-811.
20. Elenkov IJ, Chrousos GP, Wilder RL. Neuroendocrine regulation of IL-12 and TNF-alpha/IL-10 balance. Clinical implications. Ann NY Acad Sci. 2000;917:94-105.
21. Chiang LM, ChenYJ, Chiang J, Lai LY, ChenYY, Liao HF. Modulation of Dendritic Cells by Endurance Training. Int J Sports Med. 2007;28:798-803.
22. O'Shea J, Ortaldo JR. The biology of natural killer cells: insights into the molecular basis of function. In: Lewis CE, McGee JO, eds. The Natural Killer Cell. Oxford, UK: Oxford Univ. Press; 1992. p. 1-40.
23. Whiteside TL, Herberman RB. The role of natural killer cells in human disease. Clin Immunol Immunopathol. 1989;53:1-23.
24. Ortaldo JR, MantovanI A, Hobbs D, Rubinstein M, Pestka S, Herberman RB. Effects of several species of human leukocyte interferon on cytotoxic activity of NK cells and monocytes. Int J Cancer. 1983;31:285-9.
25. Brunda MJ, Herberman RB, Holden HT. Inhibition of murine natural killer cell activity by prostaglandins. Immunopharmacology. 1980;124:2682-7.
26. Abbas AK, Lichtman AH, Pillai S. Imunologia celular e molecular. 7a ed. Rio de Janeiro: Elsevier; 2011.
27. Krinski K, Elsangedy HM, Heriberto C, Buzzachera CK, Soares IA, Wagner C, et al. Efeitos do exercício físico no sistema imunológico. Revista brasileira de medicina. 2010;67(7):227-8.
28. Pedersen BK, Thomsen BS, Nielsen H. Inhibition of natural killer cell activity by antigen-antibody complexes. Allergy. 1986;41:568-74.
29. Oliveira CMB, Sakata RK, Issy AM, Gerola LR, Salomão R. Citocinas e dor. Revista Brasileira de Anestesiologia. 2011; 61(2):260-5.
30. Dinarello CA, Mier JW. Interleukins Annu Rev Med. 1986;37:173-8.
31. Peake JM, Suzuki K, Hordern M, Wilson G, Nosaka K, Coombes JS. Plasma cytokine changes in relation to exercise intensity and muscle damage. Eur J Appl Physiol. 2005;95:514-21.
32. Vilcek J, Feldman M. Historical review: cytokines as therapeutic and targets of therapeutics. Trends Pharmacol Sci. 2004;25:201.
33. Elenkov IJ, Chrousos GP, Wilder RL. Neuroendocrine regulation of IL-12 and TNF-alpha/IL-10 balance. Clinical implications. Ann NY Acad Sci. 2000;917:94-105.
34. Prestes J, Donatto FF, Dias R, Frolinni AB, Cavaglieri CR. Papel da Interleucina-6 como um sinalizador em diferentes tecidos durante o exercício físico. Fitness & Performance Journal. 2006;5(6):348-53.
35. Pedersen BK, Febbraio MA. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiol Ver. 2008;88:1379-406.
36. Febbraio MA, Pedersen BK. Contraction-induced myokine production and release: is skeletal muscle an endocrine organ? Exerc Sport Sci Rev. 2005;33:114-9.
37. Dinarello CA, Mier JW. Interleukins Annu Rev Med. 1986;37:173-8.
38. Ostrowski K, RohdeT, Asp S, Schjerling P, Pedersen BK. Chemokines are elevated in plasma after strenuous exercise in humans. Eur J Appl Physiol. 2001;84:244-5.
39. Nieman DC, Davis JM, Henson DA, Walberg-Rankin J, Shute M, Dumke CL, et al. Carbohydrate ingestion influences skeletal muscle cytokine mRNA and plasma cytokine levels after a 3-h run. J Appl Physiol. 2003;94(5):1917-25.
40. OshidaY, Yamanouchi K, Hayamizu S, SatoY. Effect of acute physical exercise on lymphocyte subpopulations in trained and untrained subjects. Int J Sports Med. 1988;9(2):137-40.
41. Hansen JB, Wilsgard L, Osterud B. Biphasic changes in leukocytes induced by strenuous exercise. Europ J Appl Physiol. 1991;62(3):157-61.
42. Pedersen BK, Hoffman-Goetz L. Exercise and the immune system: regulation integration and adaptation. Physiol Rev. 2000;80(3):1055-81.
43. da Silveira MP, da Silva Fagundes KK, Bizuti MR, Starck É, Rossi RC, de Resende e Silva DT. Physical exercise as a tool to help the immune system against COVID-19: an integrative review of the current literature. Clin Exp Med. 2021;21(1):15-28.
44. Mackinnon LT, Chick TW, van As A, Tomasi TB. The Effect of Exercise on Secretory and Natural Immunity. In: Mestecky J, McGhee JR, Bienenstock J., Ogra PL, eds. Recent Advances in Mucosal Immunology. Advances in Experimental Medicine and Biology. Boston, MA: Springer; 1987. vol. 216 A.
45. Buss PM. Promoção da saúde e qualidade de vida. Ciência & Saúde Coletiva. 2000;5(1):163-77.
46. Laddu DR, Lavie CJ, Phillips SA, Arena R. Physical activity for immunity protection: Inoculating populations with healthy living medicine in preparation for the next pandemic. Prog Cardiovasc Dis. 2021;64:102-4.
47. Nieman DC, Wentz LM. The compelling link between physical activity and the body's defense system. J Sport Health Sci. 2019;8(3):201-17.
48. Ferreira FFG, Bressan J, Marins JCB. Efeitos metabólicos e hormonais do exercício físico e sua ação sobre a síndrome metabólica. EFDeportes.com. 2009;13(129).
49. Pancorbo-Sandoval AE. Medicina do esporte: princípios e prática. Porto Alegre: Artmed; 2005.
50. Tiggemann CL, Pinto RS, Kruel LFM. A Percepção de Esforço no Treinamento de Força. Revista Brasileira de Medicina do Esporte. 2010;169(4).
51. Buhrer C, Santos MG. Análise dos efeitos dos exercícios físicos nos níveis de cortisol e no controle do estresse. EFDeportes.com. 2013;17(176).
52. Kura GG, Tourinho-Filho H. Adaptações agudas e crônicas dos exercícios resistidos no sistema cardiovascular. EFDeportes.com. 2011;15(153).
53. Monteiro MF, Sobral Filho, DC. Exercício físico e o controle da pressão arterial. Revista Brasileira de Medicina do Esporte. 2004;10(6):513-6.
54. Miranda Chaves CRMM, Oliveira CQ, Alves de Britto JA, Gaspar Elsas MIC. Exercício aeróbico, treinamento de força muscular e testes de aptidão física para adolescentes com fibrose cística: revisão da literatura. Rev Bras Saúde Matern Infant. 2007;7(3):245-50.
55. Mutti LC, Salles BF, Lemos A, Simão R. Os benefícios dos exercícios resistidos na melhoria da capacidade funcional e saúde dos paraplégicos. Revista Brasileira de Medicina do Esporte. 2010;16(6):465-70.
56. Roschel H, Tricoli V, Ugrinowitsch C. Treinamento físico: considerações práticas e científicas. Revista Brasileira de Educação Física e Esporte. 2011;25:53-65.
57. Kenney WL, Wilmore JH, Costill DL. Fisiologia do Esporte e do Exercício. 5a ed. Manole;2013. p. 614.
58. Ferreira FG, Bressan J, Marins JCB. Efeitos metabólicos e hormonais do exercício físico e sua ação sobre a síndrome metabólica. EFDeportes.com. 2009;13(129).
59. Silva FOC, Macedo DV. Exercício físico, processo inflamatório e adaptação: uma visão geral. Rev Bras Cineantropom Desempenho Hum. 2011;13(4):320-8.
60. Leandro CG, Castro RM, Nascimento E, Pithon-Curi TC, Curi R. Mecanismos adaptativos do sistema imunológico em resposta ao treinamento físico. Revista Brasileira de Medicina do Esporte. 2007;13(5):343-8.
61. Cavalcante ER. Efeitos das adaptações agudas e crônicas do exercício físico relacionadas ao sistema cardiovascular da população idosa. Revista Científica Multidisciplinar Núcleo do Conhecimento. 2019;6(12):21-32.
62. Terra R, Silva SAG, Pinto VS, Dutra PML. Efeito do Exercício no Sistema Imune: Resposta, Adaptação e Sinalização Celular. Rev Bras Med Esporte. 2012;18(3):208-14.
63. Natale VM, Brenner IK, Moldoveanu AI, Vasiliou P, Shek P, Roy JS. Efeitos de três tipos diferentes de exercício na contagem de leucócitos sanguíneos durante e após o exercício. São Paulo Med J. 2003;121(1):9-14.
64. Shimizu K, Kimura F, Akimoto T, Akama T, Tanabe K, Nishijima, et al. Effect of moderate exercise training on T-helper cell subpopulations in elderly people. Exerc Immunol Rew. 2008;14:24-37.
65. Batista ML Jr, Lopes RD, Seelaender MC, Lopes AC. Anti-inflammatory effect of physical training in heart failure: role of TNF-alpha and IL-10. Arq Bras Cardiol. 2009;93(6):692-700.