Número Atual: Outubro-Dezembro 2021 - Volume 5 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Antonio Carlos Pastorino
- Joseane Chiabai
- Débora Carla Chong-Silva
- Fabio Chigres Kuschnir
- Adriana Azoubel-Antunes
- Cristine Secco Rosário
- Marisa Lages Ribeiro
- Carlos Antônio Riedi
- Patrícia Gomes de Matos Bezerra
- Herberto Jose Chong-Neto
- Gustavo Falbo Wandalsen
- Maria de Fátima Pombo Sant'Anna
- Emanuel Sarinho
- Luciana R. Silva
- Norma de Paula M. Rubini
- Dirceu Solé
ARTIGO ESPECIAL
Guia Prático de Atualização no tratamento da exacerbação de asma na criança e no adolescente - Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e Sociedade Brasileira de Pediatria
Practical Update Guide on the treatment of asthma exacerbation in children and adolescents - Joint position of the Brazilian Association of Allergy and Immunology and the Brazilian Society of Pediatrics
Antonio Carlos Pastorino1,2; Joseane Chiabai1; Débora Carla Chong-Silva3; Fabio Chigres Kuschnir4,5; Adriana Azoubel-Antunes4,5; Cristine Secco Rosário1; Marisa Lages Ribeiro1,2; Carlos Antônio Riedi3; Patrícia Gomes de Matos Bezerra3; Herberto Jose Chong-Neto4,5; Gustavo Falbo Wandalsen2,4; Maria de Fátima Pombo Sant'Anna3; Emanuel Sarinho2,5; Luciana R. Silva2; Norma de Paula M. Rubini2,5; Dirceu Solé5
DOI: 10.5935/2526-5393.20210053
1. Associação Brasileira de Alergia e Imunologia, Departamento Científico de Alergia em Pediatria da ASBAI - São Paulo, SP, Brasil
2. Sociedade Brasileira de Pediatria - Rio de Janeiro, RJ, Brasil
3. Sociedade Brasileira de Pediatria, Departamento Científico de Pneumologia Pediátrica da SBP - Rio de Janeiro, RJ, Brasil
4. Sociedade Brasileira de Pediatria, Departamento Científico de Alergia Pediátrica da SBP - Rio de Janeiro, RJ, Brasil
5. Associação Brasileira de Alergia e Imunologia - São Paulo, SP, Brasil
Endereço para correspondência:
Antonio Carlos Pastorino
E-mail: acpastorino@uol.com.br
Submetido em: 28/08/2021
Aceito em: 06/09/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
Exacerbação aguda de asma é uma condição frequente na criança e no adolescente e uma das causas mais comuns de procura aos pronto atendimentos e de internações. Pode ocorrer em pacientes que ainda não foram diagnosticados como asmáticos, e mesmo naqueles cujo controle da doença não se encontre adequado. Reconhecer a exacerbação e iniciar seu tratamento desde o domicílio até o adequado manejo inicial em ambiente hospitalar é fundamental para evitar sua evolução para complicações que coloquem o paciente em risco de vida. O tratamento compreende o reconhecimento e tratamento da hipoxemia, da obstrução e do processo inflamatório, além de fornecer orientações na alta hospitalar e encaminhamentos para continuidade do tratamento.
Descritores: Asma aguda, exacerbação da asma, criança, adolescente, tratamento.
DEFINIÇÃO DE EXACERBAÇÃO
Exacerbação da asma é definida como uma piora aguda ou subaguda dos sintomas da asma e da função pulmonar. Caracteriza-se por aumento progressivo da falta de ar, da tosse, do chiado ou da sensação de aperto torácico, representando uma mudança dos sintomas habituais do paciente, suficiente para exigir a modificação no tratamento1,2. Exacerbações podem ocorrer em pacientes com diagnóstico pré-existente de asma, ou, ocasionalmente, como a primeira apresentação da doença.
O termo acadêmico "exacerbação", no entanto, é mais utilizado na literatura científica e clínica, enquanto estudos hospitalares se referem mais à "asma aguda grave". Durante o atendimento, usar o termo "exacerbação" nem sempre é adequado, pois é difícil para muitos pacientes pronunciarem e lembrarem. O termo "exacerbação de asma" é de mais fácil entendimento, além de transmitir o sentido de que a asma está presente mesmo quando os sintomas não são persistentes. O termo "ataque" é utilizado por muitos pacientes e profissionais de saúde, mas com significados amplamente variados, e pode não ser percebido como um fator de piora gradual. Na literatura pediátrica, o termo "episódio" é comumente utilizado, mas a compreensão deste termo por pais/cuidadores também não é conhecido1.
Nos Estados Unidos, exacerbações da asma levaram a 1,7 milhões de visitas à emergência e 200.000 hospitalizações em 2016. Os cuidados com exacerbações da asma na emergência custam cinco vezes mais do que os cuidados em consultório. Neste contexto, o Governo americano tem estimulado os cuidados da asma, com o objetivo de reduzir as visitas à emergência e as hospitalizações, como medidas chave de saúde2.
A exacerbação da asma pode ser desencadeada por infecção viral, exposição a agentes externos (fumaça, poluentes, alérgenos inalatórios), medicamentos, atividade física, distúrbios psicossociais, má adesão ao tratamento de controle, entre outros1,3. No entanto, um subconjunto de pacientes apresenta exacerbação sem exposição a fatores de risco conhecidos. Além disso, exacerbações graves podem ocorrer em pacientes com sintomas de asma leve ou bem controlada.
A lista de fatores ("gatilhos") mais comuns que aumentam o risco de um paciente apresentar exacerbações, independente do seu nível de controle de sintomas, inclui:
- infecções respiratórias virais;
- exposição a alérgenos como pólen de gramíneas, poeira de feijão ou de soja, esporos fúngicos;
- alergia alimentar com manifestações sistêmicas;
- poluição do ar3;
- mudanças sazonais e/ou retorno ao ambiente escolar;
- adesão pobre ao corticosteroide inalado.
Exacerbações graves que ocorrem de forma epidêmica têm sido relacionadas a tempestades, com altos níveis de polens de gramíneas ou fungos dispersos no ar4.
As epidemias de exacerbações graves de asma podem ocorrer de modo repentino e colocam alta pressão no sistema de saúde local. Tais epidemias foram relatadas em associação a tempestades de primavera com pólen4 de gramínea de centeio ou esporos fúngicos, e com exposição ambiental à poeira de soja.
OBJETIVOS DO TRATAMENTO NA EXACERBAÇÃO DE ASMA
Os principais objetivos do tratamento das exacerbações de asma são a estabilização clínica da criança, com a supressão ou redução dos seus sintomas e a prevenção de complicações, como hospitalização e morte. Durante o tratamento das exacerbações, as seguintes metas devem ser buscadas:1,5
- reverter a obstrução ao fluxo aéreo;
- corrigir a hipoxemia;
- minimizar o risco de recidiva dos sintomas;
- prevenir novas exacerbações.
Pacientes em maior risco de exacerbações graves e até óbito devem ser identificados e tratados de forma precoce, preferencialmente em serviços de emergência. Estes pacientes incluem aqueles com1:
- história de asma quase fatal - necessidade de tratamento em Unidade de terapia intensiva (UTI), intubação com ventilação mecânica;
- hospitalização ou ida a serviço de emergência por exacerbação de asma no último ano;
- uso excessivo de beta-2 agonista de curta duração (SABA), especialmente com consumo maior de um frasco ao mês;
- ausência de uso de corticosteroide inalado;
- adesão ruim ao tratamento de controle e sem plano de ação;
- história de doenças psiquiátricas ou problemas psicológicos;
- alergia alimentar associada à asma;
- má percepção da gravidade;
- comorbidades como pneumonia e cardiopatias.
CLASSIFICAÇÃO DA EXACERBAÇÃO PELA GRAVIDADE - ESCORES
É importante durante a avaliação da exacerbação da asma, a realização de anamnese e exame físico sumários enquanto se providencia tratamento inicial conforme avaliação do quadro, atentando-se para a classificação da gravidade da exacerbação da asma. Isto pode ser realizado observando-se a intensidade da dispneia, frequências respiratória e cardíaca, saturação transcutânea de oxigênio (saturação de O2) e função pulmonar.
A avaliação da gravidade é essencial para a definição de melhor abordagem terapêutica, assim como para avaliação do risco de admissão hospitalar, permanência em serviços de urgência, além de ser útil no acompanhamento do paciente durante o tratamento da exacerbação. Para isto, a utilização de escores de gravidade padronizados contribui para melhor seguimento deste processo.
Os parâmetros utilizados para esta avaliação devem levar em consideração a faixa etária e a capacidade cognitiva da criança e do adolescente. Considera-se como objetivo do tratamento da exacerbação, a manutenção da saturação de O2 acima de 94% em ar ambiente, a presença de sintomas mínimos ou ausentes e função pulmonar próxima da normalidade. Considera-se grave a inabilidade para falar sentenças, a agitação, presença de saturação de O2 abaixo de 90% (abaixo de 92% em menores de 5 anos) em ar ambiente e pico de fluxo expiratório (PFE), abaixo de 50% do previsto para o paciente1.
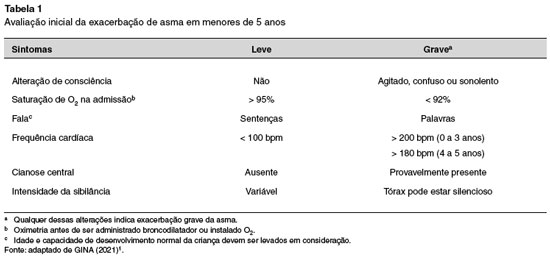
Na Tabela 1 são destacados os aspectos que são levados em consideração para a avaliação da gravidade da exacerbação da asma em menores de 5 anos.
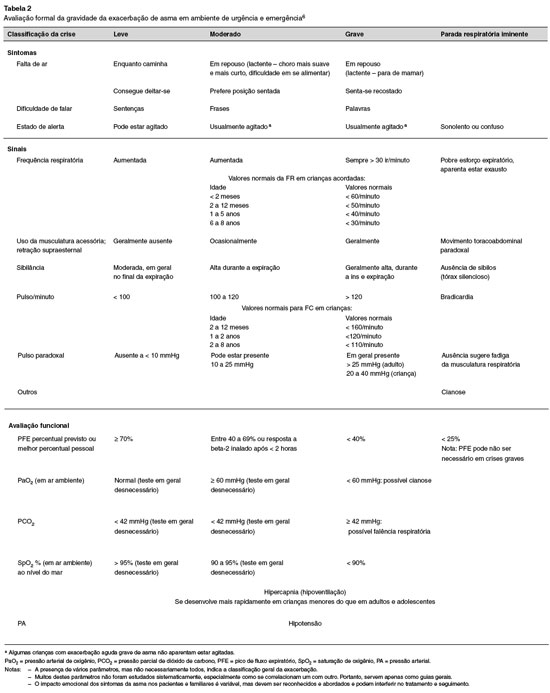
De maneira mais detalhada, a Tabela 2 apresenta os parâmetros de avaliação da gravidade da exacerbação asmática6.
Outros instrumentos podem ser utilizados com a finalidade de avaliar a gravidade da exacerbação, sendo alguns descritos a seguir.
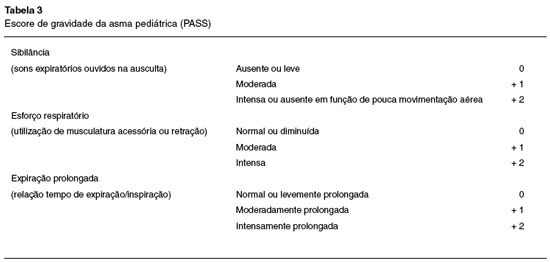
Pediatric Asthma Severity Score - PASS7,8
Destinado a pacientes menores de 18 anos, o PASS é útil para avaliação da possibilidade de admissão hospitalar ou permanência prolongada em emergências (Tabela 3). Leva em consideração a sibilância, o esforço respiratório e a expiração prolongada utilizando a soma de todos os componentes (0 a 6); quanto maior a soma, mais intensa é a exacerbação.
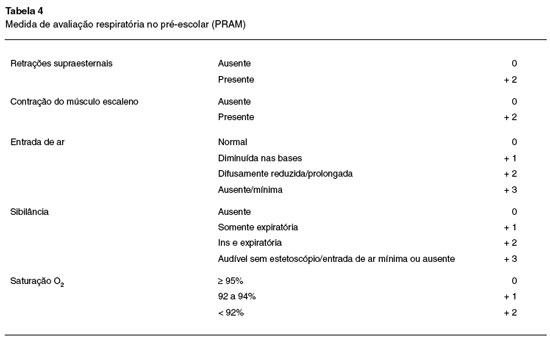
Preschool Respiratory Assessment Measure -PRAM8,9
O PRAM foi desenvolvido por estudo prospectivo de crianças entre 3 e 6 anos de vida, atendidas em pronto atendimento e, após análises de regressão logística, incluiu cinco variáveis: retrações supraesternais, contração do músculo escaleno, entrada de ar, sibilância e saturação de O2 (Tabela 4). A soma de todos os componentes fornece a gravidade e, quanto maior, mais intensa é a exacerbação.
TRATAMENTO DA EXACERBAÇÃO BASEADO NA GRAVIDADE
1. Hipóxia
Crianças, e especialmente lactentes, têm maior risco de insuficiência respiratória durante as exacerbações de asma e desenvolvem hipoxemia mais rapidamente do que os adultos10. Na criança, a saturação de O2 abaixo de 92% é um preditor de internação, e abaixo de 90% sinaliza a necessidade de tratamento mais agressivo1.
A hipoxemia nas exacerbações correlaciona-se com o grau de obstrução nas vias aéreas, e consequentemente com a alteração na relação ventilação-perfusão (V/Q)11. No início do tratamento com broncodilatadores, a vasodilatação pode ser maior que a broncodilatação, resultando em desequilíbrio na relação V/Q, o que pode ocasionar piora da saturação de O2 em 5% ou mais nos primeiros 30 minutos após administração de salbutamol12,13.
A maioria das exacerbações é leve e não requer oferta de oxigênio suplementar. Quando necessário, a oferta deve ser titulada de acordo com a oximetria (se disponível) com objetivo de mantê-la ≥ 94%. A administração de 1 a 3 L/min de O2 costuma ser suficiente, podendo ser por cateter nasal ou máscara facial11. O uso de ventilação não invasiva deve ser considerado nos pacientes em exacerbação grave, quando houver falha nos tratamentos iniciais14. Cânulas nasais que ofertem alto-fluxo (2-2,5 L/kg/min) ainda não demonstraram eficácia e segurança em crianças com exacerbações agudas por asma. A intubação orotraqueal deve ser considerada quando houver rebaixamento do nível de consciência, hipoxemia e acidose respiratória refratárias, além de depressão respiratório ou bradicardia10,16.
2. Broncoespasmo
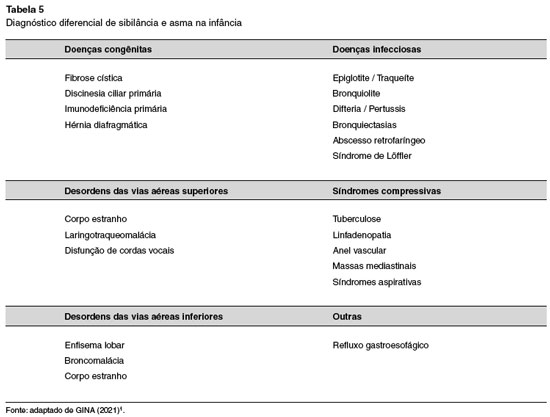
A obstrução do fluxo de ar decorrente da contração do músculo liso brônquico e cuja principal expressão clínica são os sibilos, é considerada evento fisiopatológico central da exacerbação de asma. A avaliação da criança com sibilância aguda compreende a anamnese cuidadosa abrangendo os diferentes diagnósticos diferenciais para cada faixa etária e o exame físico, capaz de determinar o local de origem do sintoma (Tabela 5)1.
Entretanto, estimativas clínicas de gravidade da exacerbação de asma baseadas apenas na presença de sibilância podem resultar em avaliação imprecisa da doença. Por exemplo, sibilos audíveis geralmente são um sinal de asma moderada, enquanto que a ausência deste sintoma pode ser um sinal de obstrução grave do fluxo de ar17.
Assim, além da ausculta pulmonar, diferentes sintomas e sinais clínicos podem ajudar o pediatra a determinar a gravidade da asma aguda. Os sinais de exacerbação grave incluem: o uso de músculos acessórios da respiração, hiperinsuflação do tórax, taquipneia, taquicardia, diaforese, obnubilação, ansiedade, incapacidade de completar frases e dificuldade de se deitar. Estado mental alterado, com ou sem cianose, é um sinal de alerta para atendimento de emergência imediato e hospitalização18 (vide Tabelas 1 a 4).
Medidas objetivas em série da função pulmonar facilitam a quantificação da gravidade da obstrução ao fluxo de ar e a resposta a tratamento. O volume expiratório forçado no primeiro segundo (VEF1) medido por espirometria é mais sensível e menos variável do que a medida da taxa de PFE19. Entretanto, este último método fornece uma avaliação rápida, simples e econômica da obstrução do fluxo de ar. A avaliação de PFE antes e após a administração de um broncodilatador pode indicar o grau de melhora na função pulmonar, que pode ser alcançado pela terapia instituída. Valores de PFE entre 50% a 79% do previsto, ou da melhor marca pessoal, significam a necessidade de tratamento imediato com agente beta-2 agonista de ação curta inalado (SABA). Valores menores de 50% indicam a necessidade de atendimento médico imediato, enquanto os abaixo de 35% estão associados a possível episódio grave com risco de vida20,21.
Quando disponíveis, dados relacionados à eficácia dos tratamentos anteriores são úteis para instituir a terapêutica mais adequada. Uma exacerbação de asma alérgica tem maior probabilidade de responder imediatamente a um SABA e ao ajuste na dose de corticosteroide inalado, ao passo que o paciente com uma exacerbação desencadeada por infecção viral tem maior probabilidade de necessitar de corticosteroide sistêmico. Pacientes em uso excessivo de SABA podem se tornar refratários a beta-2 agonistas inalados e necessitar de corticosteroide sistêmico17.
Principais medicações utilizadas para reversão do broncoespasmo
Beta-2 agonistas de ação curta (SABA)
Os SABA inalados são os medicamentos de primeira linha para o tratamento das exacerbações agudas de asma em crianças1.
Quando administrados por via inalatória, estes agentes broncodilatadores melhoram escores clínicos, diminuem a frequência respiratória, melhoram a função pulmonar e a saturação de O2 e efeitos adversos comparáveis a tratados com placebo22.
O salbutamol, um SABA seletivo disponibilizado gratuitamente pelo Ministério da Saúde do Brasil, pode ser utilizado em crianças de todas as idades. Em geral é administrado na dose variável de 2 a 10 jatos (cada jato contém 100 μg) a cada 20 minutos dentro da primeira hora do tratamento23,24. De acordo com o peso podem ser administrados: 5 a 10 kg - 4 jatos; 10 a 20 kg - 6 jatos; e > 20 kg - 8 jatos.
Em metanálise de 39 estudos que incluiu 1.897 crianças e 729 adultos, o uso de inaladores dosimetrados acoplados a um espaçador (MDI+ESP) foi a opção de preferência para a administração de beta-2 agonistas em crianças em exacerbação de asma leve e moderada. O tratamento com nebulizador pode ser preferido em pacientes que são incapazes de cooperar, utilizando um MDI devido à gravidade da asma aguda ou por agitação25.
Brometo de ipratrópio
O brometo de ipratrópio (BI) é um derivado quaternário do sulfato de atropina disponível como solução para nebulização. Atua por inibição competitiva da acetilcolina no receptor muscarínico colinérgico, relaxando assim o músculo liso nas grandes vias aéreas centrais26. Metanálise incluindo quatro ensaios com 173 crianças concluiu que não é adequado para uso como agente único em crianças com exacerbações da asma, porém a terapia combinada com SABA em exacerbações de asma mais graves em crianças reduziu o risco de internação hospitalar em até 25%27,28.
A dose recomendada de nebulização é 125-250 μg/ dose (em crianças menores de 4 anos de idade, o que corresponde a 10-20 gotas) a 250-500 μg/dose (em crianças com 4 anos ou maiores, o que corresponde a 20-40 gotas), em combinação com o salbutamol. Deve ser administrado até três vezes a cada 20 minutos, na primeira hora, em seguida sua dose deve ser reduzida em 4 a 6 horas ou descontinuada23 (cada gota contém 0,0125 mg ou 12,5 μg).
Sulfato de magnésio
O sulfato de magnésio (MgSO4) é um broncodilatador que pode ser administrado por nebulização ou por via intravenosa. Age por relaxamento direto da musculatura brônquica, porém apresenta discreta propriedade adicional anti-inflamatória relacionada ao bloqueio do influxo de íons de cálcio em células musculares, modulando assim a liberação de histamina de mastócitos e a transmissão neural colinérgica29. Seu uso intravenoso não é recomendado de rotina nas exacerbações de asma, podendo ser indicado em exacerbações graves que não responderam ao tratamento inicial em crianças maiores de 2 anos de idade. Recente metanálise mostrou que sua administração por via intravenosa parece reduzir o tempo e o risco de internação por asma, podendo ser considerado em pacientes que apresentem exacerbações graves com risco de vida, e/ou que permanecem graves após uma hora de tratamento intensivo convencional28.
O uso de sulfato de magnésio isotônico inalatório na dose de 150 mg em três doses na primeira hora em crianças com 2 anos ou mais em exacerbações graves permanece como opção na GINA 2021, por outro lado, até o momento, não existem evidências de algum benefício substancial do MgSO4 nebulizado na asma aguda1,30.
3. Inflamação
Corticosteroides sistêmicos
Os corticosteroides têm sido utilizados para o tratamento da asma há mais de 50 anos, e seus benefícios significativos são documentados por vários estudos31,32. Em revisão Cochrane, cursos curtos de esteroides contribuiram para a melhora na pontuação dos sintomas, menores taxas de recaída, menos hospitalizações e menor necessidade de uso de beta-2 agonista28,32. Além dos broncodilatadores, o corticosteroide sistêmico é essencial para o sucesso da terapia nas exacerbações da asma, pois reduz a inflamação e a produção de muco, bem como aumenta a eficácia dos broncodilatadores33. Embora os corticosteroides sejam administrados rotineiramente por via inalatória para o controle da asma, durante uma exacerbação grave, os sistêmicos são preferidos34. Com relação ao modo de administração, as vias intravenosa ou intramuscular não oferecem vantagens significativas em relação à via oral, sendo esta a preferida se o paciente for capaz de tolerar a ingestão de medicação oral e não houver preocupação com absorção intestinal anormal35. A administração oral é tão eficaz quanto a intravenosa, sendo mais rápida, menos invasiva e menos onerosa1. Nas crianças, a solução oral deverá ser preferida. A via endovenosa poderá ser utilizada nos pacientes com dificuldade de deglutir, apresentando vômitos ou quando a intubação orotraqueal ou ventilação não invasiva se fazem necessárias1.
As diretrizes atuais recomendam a administração precoce dos corticosteroides sistêmicos, de preferência na primeira hora de tratamento1,36, como medida efetiva no controle da exacerbação e prevenção de recidiva para todas as exacerbações moderadas a graves em adultos, adolescentes e crianças entre 6 e 11 anos de idade1. Sua indicação é particularmente importante nos casos em que não houve melhora clínica com a utilização do broncodilatador, quando a exacerbação se acentuou, ou quando o paciente tem histórico de exacerbações com necessidade do uso do corticosteroide para resolução. Essas drogas necessitam de cerca de 4h para impactar na melhora clínica1. A dose preconizada é de 1-2 mg/kg de prednisona ou equivalente em dose única pela manhã, máximo de 40 mg/dia, durante 3 a 5 dias. A dexametasona oral 0,6 mg/kg por 1 ou 2 dias apresenta benefícios semelhantes, com menor risco de intolerância oral, não devendo ser utilizada por mais tempo, por seus efeitos metabólicos. Para os casos ainda sintomáticos, considerar a troca para prednisolona1,33. Os potenciais efeitos colaterais são uma preocupação com o uso de corticosteroides orais. No entanto, cursos curtos de prednisona 1-2 mg/kg por dia, durante 5 dias, mostraram não ter efeito sobre a densidade mineral óssea, estatura e função adrenal 30 dias após a terapia37.
Corticosteroides inalados
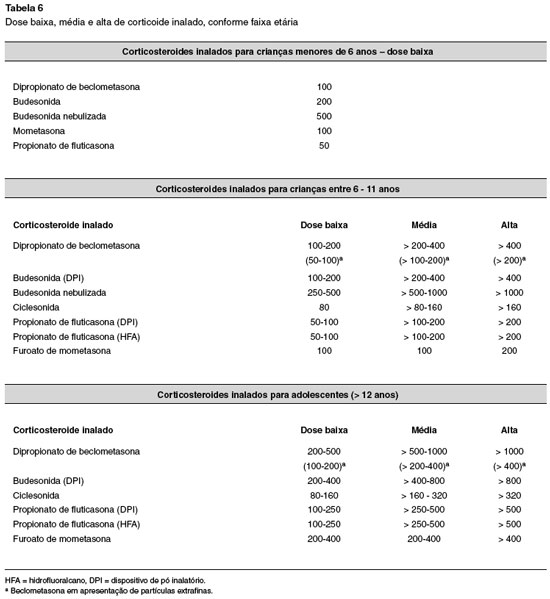
O uso de corticosteroide inalado (ICS) em altas doses reduz as internações hospitalares em pacientes com asma aguda que não são tratados com corticosteoides por via oral ou intravenosa38. Essa foi a conclusão de um estudo que analisou o benefício do ICS para asma tratada na emergência em 32 ensaios clínicos randomizados (RCTs: 21 RCTs avaliaram 1.403 crianças de 6 meses a 18 anos; 13 RCTs compararam ICS versus placebo, e oito RCTs compararam ICS versus corticosteroides sistêmicos). A dose e a frequência de uso dos ICS variaram amplamente; no entanto, em todos os casos, o ICS foi administrado no início do curso do tratamento da exacerbação, geralmente no momento do primeiro tratamento com broncodilatador, e por nebulizador ou MDI com espaçador. Houve redução significativa nas admissões hospitalares (desfecho primário) para as crianças (n = 583) tratadas com ICS quando comparadas com aquelas tratadas com placebo (OR = 0,52, IC95%: 0,33-0,80; p = 0,003; I2 = 59%). Nenhum dado agrupado foi disponibilizado para resultados secundários (por exemplo, função pulmonar ou pontuação clínica) com base exclusivamente em pacientes pediátricos22. Concluindo, a sua utilização em associação ao corticosteroide sistêmico na urgência parece reduzir o número de internações nas crianças (evidência B). Entretanto, seu custo pode ser um fator limitante e sua utilização ainda não é consensual, sobretudo com relação à escolha do fármaco, dose e tempo de tratamento, sendo as evidências mais recentes conflitantes1. Para crianças com 12 anos ou mais, recomenda-se iniciar o ICS antes da alta, se o paciente não utilizava previamente algum ICS. Aqueles que já utilizam ICS devem ter seu tratamento intensificado (até 4 vezes a dose basal) por 2 a 4 semanas, e devem ser lembrados sobre a importância do uso diário, não sendo mais indicada a utilização isolada do broncodilatador1.
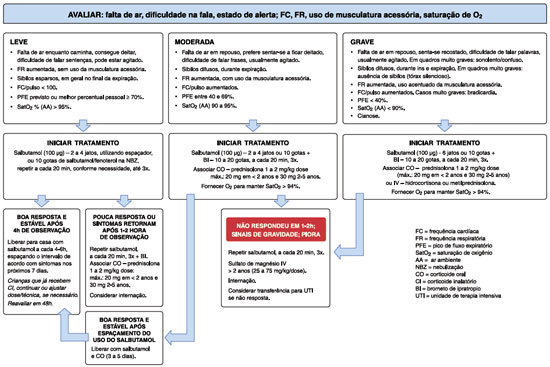
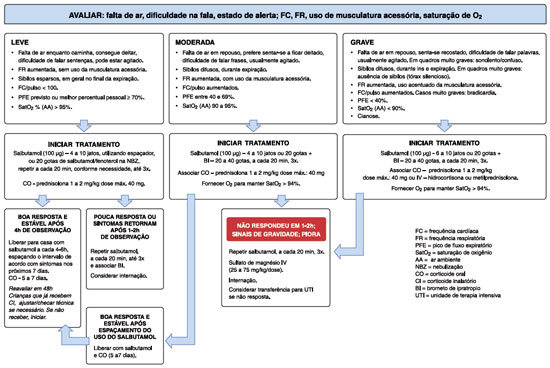
As Figuras 1 e 2 apresentam sugestão de fluxograma de manejo da exacerbação em crianças menores de 6 anos e com 6 anos ou mais.
4. Outras alternativas terapêuticas
Terapia de segunda linha para o tratamento da exacerbação da asma na criança/adolescente
A maioria das crianças apresenta exacerbações leves ou moderadas da asma e tem boa resposta à terapia preconizada como primeira linha. Somente uma minoria apresentará exacerbação grave e não responsiva às medidas convencionais, com necessidade de escalonamento da terapêutica e utilização de medicamentos considerados de segunda linha.
Há uma variabilidade grande nos critérios que definem os fármacos de segunda linha, e a escolha poderá variar conforme o quadro clínico, a idade da criança, mas especialmente, quanto à disponibilidade do produto e experiência do serviço.
Didaticamente podemos agrupar os tratamentos de segunda linha em:28
- tratamento broncodilatador inalatório adicional: beta-2 agonistas inalatórios contínuos, anticolinérgicos inalatórios como o brometo de ipratrópio e sulfato de magnésio nebulizado;
- tratamento broncodilatador parenteral: beta-2 agonistas seletivos, como salbutamol e terbutalina; adrenalina (agonista dos receptores a e P), sulfato de magnésio endovenoso; metilxantinas como teofilina e aminofilina e ketamina;
- outros tratamentos: heliox, antibióticos, anestésicos inalatórios e suporte ventilatório.
Muitos destes fármacos já foram discutidos anteriormente, e os demais serão detalhados a seguir.
Sulfato de magnésio (MgSO4)
Descrito pela primeira vez como adjuvante no tratamento das exacerbações graves de asma em 1994, o mecanismo pelo qual o MgSO4 gera o relaxamento da musculatura lisa dos brônquios e consequente broncodilatação ainda não é totalmente compreendido39. Acredita-se que atue aumentando a captação de cálcio no retículo endoplasmático e/ou bloqueio do influxo de íons de cálcio nas células musculares lisas, agindo com um antagonista.
Além disso, atua como cofator da adenilciclase e ATPase de sódio-potássio, potencializando os efeitos dos fármacos beta-2 agonistas39-41. Mecanismos secundários incluem a inibição da liberação de acetilcolina pelos nervos colinérgicos e a redução da liberação de histamina pelos mastócitos42. O MgSO4 já foi descrito para uso inalatório e parenteral em crianças maiores de 2 anos, sendo que o uso intravenoso, em administração única, em 20 minutos, nas doses que variam de 25 a 75 mg/kg/dose (dose máxima 2-2,5 g/dose) ou em infusões prolongadas por 4 horas, com doses mais elevadas 200 mg/kg/4horas, apresenta evidência mais robusta que o uso inalatório40,41. Estudos concluem que o MgSO4 intravenoso reduz as chances de internações hospitalares, tem boa relação custo-benefício e, que, mesmo no pronto atendimento não está associado a efeitos colaterais ou danos significativos40. Quando se avaliou parâmetros de função pulmonar, houve melhora significativa do VEF1 e da relação VEF1/CVF em crianças com asma leve e moderada, tratadas com MgSO4 intravenoso, sem efeitos adversos registrados39. Evidências sugerem que a administração simultânea de sulfato de magnésio e um agente beta-2 agonista potencializa o efeito broncodilatador por aumentar a resposta do beta-receptor30,41.
Beta-2 agonista inalatório em uso contínuo
Para pacientes com exacerbações graves e que não respondem à administração intermitente de beta-2 agonista de curta ação inalado, pode-se optar pela administração em inalação contínua, neste caso utilizando-se nebulizador, com o objetivo de saturar todos os receptores beta-2 do trato respiratório e atingir broncodilatação máxima42. Metanálise que avaliou duas revisões mostrou evidências fracas e sem superioridade do uso contínuo quando comparado ao intermitente (a cada 15/20 minutos). Não houve diferença no tempo de permanência no pronto atendimento e número de internação em crianças, diferente do observado por estudos em adultos, nos quais a nebulização contínua mostrou-se superior, especialmente em pacientes com obstrução mais grave. Não foram observadas diferenças significativas nos efeitos colaterais das duas formas de administração de broncodilatadores43. Outro fato observado foi entre crianças e adolescentes hospitalizados com asma grave e submetidos a nebulizações contínuas com albuterol armazenados em frascos com cloreto de benzalcônio (conservante). Para estes pacientes a duração da nebulização contínua foi mais longa em comparação aos que receberam nebulização sem o conservante (9 vs. 6 horas; RR: 1,79; IC95%: 1,45-2,22; p < 0,001). Assim, concluiu-se que o cloreto de benzalcônio age como um antagonista funcional do salbutamol, e que as apresentações sem este produto são mais seguras para uso em nebulização contínua44.
Beta-2 agonista intravenoso
A ideia clássica do uso de beta-2 agonistas por via intravenosa em adição ou em substituição aos beta-2 agonistas inalatórios decorre do conceito de que durante uma exacerbação grave, a constrição brônquica intensa pode impedir a entrega do fármaco inalado às vias aéreas distais45. Por outro lado, utilizados de modo sistêmico também apresentam mais efeitos adversos relacionados à interação com receptores beta-1 fora das vias aéreas, principalmente taquicardia e agitação. Desde a década de 1990, busca-se comprovar a eficácia do salbutamol intravenoso em crianças com asma grave refretaria à terapia convencional45. Estudo que o comparou com placebo, mostrou desmame da terapia inalada e alta precoce do departamento de emergência.
Estudo comparativo de terbutalina intravenosa com solução salina + albuterol nebulizado mostrou melhora significante dos escores clínicos, porém quatro indivíduos apresentaram toxicidade cardíaca à terbutalina, sendo um caso de arritmia cardíaca, e três com níveis elevados de troponina46. Revisões da Cochrane em 2001 e 2012, incluindo crianças e adultos, não encontraram benefício significativo da adição de beta-2 agonistas intravenosos aos beta-2 agonistas inalatórios45,47. A via de escolha para administração dos beta-2 agonistas continua a ser a inalatória. Havendo a impossibilidade de uso desta via, a terapia intravenosa deve ser considerada, e, havendo a combinação das terapias, a monitorização dos efeitos adversos deve ser rigoroso45-47.
Adrenalina (epinefrina)
É fármaco com potente ação beta adrenérgica e efeito broncodilatador semelhante ao dos beta-2 agonistas, porém menos seletivo. Historicamente a adrenalina parenteral era considerada a terapia padrão para as exacerbações da asma nos anos 1970 e 1980, porém com a comprovação de eficácia clínica similar e da facilidade do uso dos broncodilatadores inalados, a adrenalina ficou reservada como opção para pacientes gravemente enfermos que não respondem à terapia inalada de primeira linha28,48.
Metilxantinas - teofilina e aminofilina
O efeito broncodilatador destes fármacos se deve à inibição da fosfodiesterase, que acarreta em acúmulo de adenosina monofosfato cíclico (cAMP) nas células musculares lisas, antagonismo da adenosina e liberação de catecolaminas. Com a comprovação da eficácia e segurança dos beta-2 agonistas de curta ação, a ausência de benefício clínico adicional das metilxantinas e, especialmente, pelo risco de efeitos colaterais diante da pequena margem de segurança terapêutica, nas duas últimas décadas, desencorajou-se o uso destes fármacos nas exacerbações agudas de asma de crianças e adultos28.
Revisão sistemática, do início dos anos 2000, avaliou sete estudos (380 crianças com exacerbação de asma grave hospitalizadas) e concluiu que o uso de aminofilina acarretou melhora da função pulmonar, porém sem correspondente melhora clínica. Além disso, não houve redução do tempo de hospitalização e da necessidade de medicação inalatória, ocorrendo mais episódios de vômitos nos grupos que receberam aminofilina49.
Quando comparada ao salbutamol intravenoso, na exacerbação de asma grave em crianças, percebeu-se tendência de maior tempo de uso de O2 (17,8 horas vs. 7,0 horas), bem como aumento significante no tempo de hospitalização no grupo salbutamol (85,4 horas vs. 57,3 horas), apesar de não se encontrar diferenças no escore clínico com duas horas de tratamento50.
Vale lembrar que a aminofilina apresenta margem de segurança estreita e pode ocasionar os efeitos colaterais já descritos. Estudos mostraram ocorrência de náuseas, vômitos, cefaleia, dores abdominais e palpitações49,50. Ao ponderar entre os efeitos adversos e terapêuticos das metilxantinas, quando comparado às outras classes mais seguras, entende-se por que as metilxantinas encontram-se no grupo das não recomendadas na maioria das diretrizes internacionais. Na atualidade, o seu uso só se justifica em ambiente de UTI, onde a capacidade de monitorar de perto os níveis séricos poderia mitigar os potenciais efeitos adversos deste fármaco47.
Ketamina
Fármaco amplamente utilizado em UTI. É um anestésico dissociativo usado também por suas propriedades sedativas e analgésicas51. O efeito de induzir broncodilatação se deve pela ação simpatomimética ou como um efeito direto no músculo liso brônquico. Outros efeitos sugeridos incluem imunomodulação e ação anticolinérgica. Aumento de secreção brônquica e delírio são efeitos adversos comuns com o uso prolongado de ketamina28,51. Para pacientes em ventilação mecânica, a administração de ketamina foi associada ao aumento na complacência dinâmica e redução no pico de pressão inspiratória e na PaCO252. Existem poucos estudos com resultados favoráveis ao uso da ketamina na exacerbação da asma, e outros já mostram pouca diferença na melhora do escore clínico e na evolução, o que a coloca como um fármaco com fraca evidência em comparação com outras terapias ad-juvantes. O racional da indicação da ketamina seria aos pacientes em insuficiência respiratória, intubados, onde em combinação com broncodilatação, aliaria os efeitos de sedação e analgesia28,51,52.
Heliox
É a mistura de hélio-oxigênio, onde o nitrogênio (que representa aproximadamente 79% das moléculas do ar atmosférico) é substituído por hélio. Sendo o hélio um gás sete vezes mais leve do que o nitrogênio, o gás resultante é menos denso e, com isso, melhor administrado em situações de fluxos respiratórios turbulentos (como é o caso da asma) favorecendo uma oferta mais adequada de oxigênio. Ao atingir-se fluxo laminar (quando a respiração ofegante diminuiu) o benefício máximo é alcançado. Alguns estudos apontam que a utilidade do heliox diminui quando a necessidade de FIO2 cai abaixo de 0,553. O heliox apresenta poucos riscos, entretanto, recomenda-se o monitoramento do fornecimento, uma vez que os fluxômetros podem não corresponder à oferta do gás com precisão, e o uso prolongado de heliox pode impedir o fluxo turbulento durante a tosse, dificultando o clearence pulmonar. Apesar da característica física relevante, estudos clínicos são controversos quanto ao benefício real do heliox na exacerbação grave de asma, com uma tendência em mostrar pouca melhora clínica e dos escores de dispneia, e sem incremento nos valores de função pulmonar, apesar da administração do gás ter evitado a intubação em um número pequeno de pacientes53,54. O uso de broncodilatadores conduzidos por heliox foi estudado em crianças e adultos com asma55, e uma revisão sistemática relatou aumento dos fluxos expiratórios e redução das admissões hospitalares, menor tempo de permanência em pronto atendimento e maior benefício em indivíduos mais graves55,56. O uso de heliox pode ser considerado em pacientes que não responderam à terapêutica convencional, uma vez que o custo é baixo e o evento adverso é desprezível, sendo interrompido se não for evidenciada melhora clínica53-56.
Suporte ventilatório não invasivo
O suporte ventilatório não invasivo (VNI) e cânula nasal de alto fluxo (CNAF) têm sido cada vez mais utilizados em quadros de insuficiência respiratória, incluindo asma aguda grave. A pressão positiva reduz o trabalho respiratório por auxiliar os músculos respiratórios e melhorar a oxigenação ao aumentar a pressão média das vias aéreas. Com isso, há o incremento das trocas gasosas. O uso de VNI em crianças e adultos com status asmático foi associado à redução da PaCO2 e da frequência respiratória e aumento de pH e da PaO257,58. A CNAF, diante da característica de oferecer gás aquecido e umidificado através de uma cânula nasal, em fluxo que excede a demanda inspiratória do paciente e baixo nível de pressão positiva, costuma ser melhor tolerada, especialmente pelos pacientes pediátricos.
O uso da CNAF em crianças com exacerbação da asma extrapola o que se observa em doenças pulmonares obstrutivas de adultos, e sugere um bom perfil de segurança, mas estudos que comprovam sua eficácia na asma pediátrica são escassos60. Estudo recente avaliou crianças maiores de 2 anos em exacerbação grave, atendidas em pronto atendimento. A instituição de CNAF não mostrou benefícios clínicos ou diminuição no tempo de internação, quando comparadas ao grupo tratado com oxigenoterapia convencional60.
Os efeitos positivos do CPAP (do inglês Continuos Positive Airway Pressure - Pressão Positiva Contínua nas Vias Aéreas) e BiPAP (do inglês BI-level Positive Airway Pressure - pressão positiva em vias aéreas a dois níveis) em crianças com asma, incluem um efeito broncodilatador direto, melhora do recrutamento alveolar, incremento do fluxo de ar, reexpansão de áreas de colapso, hiperinsuflação e trabalho respiratório reduzidos57. De modo geral, dados científicos sugerem que o VNI é seguro para crianças com exacerbação grave e contribui para a melhora do padrão respiratório. Estudos na população pediátrica, especialmente com uso da CNAF, são necessários.
Antibióticos
Mesmo diante do fato das exacerbações da asma, especialmente nas crianças, serem precipitadas principalmente por desencadeantes ambientais ou infecções virais e menos comumente por infecções bacterianas, com frequência observamos a prescrição de antibióticos para tratamento da exacerbação. Revisão Cochrane em 2001, com ensaios controlados e randomizados, não demonstrou benefício clínico algum com a adição de antibióticos durante exacerbações agudas de asma em crianças ou adultos61.
Os estudos que avaliaram o uso de macrolídeos na asma são principalmente em adultos e voltados para o manejo crônico de asma. Em revisão sistemática, o uso crônico de macrolídeos mostrou ter algum benefício sobre a função pulmonar, mas não foi superior ao placebo na prevenção de internações hospitalares ou na melhoria das medidas de qualidade de vida62. Não há dados que apoiem o uso de macrolídeos nas exacerbações de asma.
Anestésicos inalatórios
Anestésicos inalados, como isofluorano, halotano e sevoflurano são relaxantes poderosos do músculo liso e podem ajudar a aliviar a broncoconstrição63. Isoflurano e sevoflurano são mais comumente usados, uma vez que o halotano pode causar hepatotoxicidade63. Outros efeitos adversos descritos são diminuição da resistência vascular sistêmica, levando à hipotensão e hipertermia maligna. Aplicações bem-sucedidas de anestésicos inalatórios em crianças e adultos jovens, com estado asmático refratário, já foram descritas, com redução da PaCO2 e aumento do pH após algumas horas de administração64. Devido ao alto custo dessa terapia e ao potencial para efeitos adversos, os anestésicos inalados podem ser uma escolha para asmáticos graves, internados em UTI, lembrando que a administração destes fármacos requer equipamento especializado, muitos deles disponíveis somente em salas de cirurgias63,64.
Monitorização da exacerbação
Assim como na avaliação inicial, o monitoramento contínuo da frequência respiratória, frequência cardíaca, saturação de O2, grau de alerta, uso de musculatura acessória e retrações intercostais é crucial para as decisões relativas ao tratamento. A frequência de monitoramento varia, dependendo da gravidade da doença e da resposta à terapia inicial, mas para a maioria dos pacientes é tipicamente a cada 20 a 30 minutos para a primeira hora de tratamento, em todos os pacientes. Importante não utilizar parâmetros de forma isolada2.
A saturação de O2 com oxímetro de pulso deve ser monitorada com frequência (valor < 92% em ar ambiente indica exacerbação grave), especialmente em crianças ≤ 5 anos. Níveis de saturação < 90% em adultos e crianças indicam necessidade de tratamento agressivo para a exacerbação1. A saturação de hemoglobina (SpO2 < 92%), especialmente após o uso de broncodilatador permite identificar os pacientes mais graves e que devem receber tratamento hospitalar65. A oximetria de pulso tem suas limitações devido a artefatos de movimento, dificuldade de leitura com baixa perfusão e não deve ser utilizada de forma isolada como indicador de internação hospitalar66.
Para crianças maiores e adultos, as diretrizes recomendam medidas de PFE (percentual do previsto ou do melhor PFE) e/ou medidas do VEF1. Essa avaliação deve ser realizada, sempre que possível, antes do tratamento, pois há dificuldade de ser realizada em crianças menores e pacientes com exacerbação grave. Valores abaixo de 40% do previsto indicam exacerbação grave2. De acordo com a GINA 2021, o valor de corte para exacerbação grave é ≤ 50% do previsto ou do melhor valor pessoal1. Após o início do tratamento a avaliação sequencial dos valores de PFE e VEF1 podem ser utilizados como critério para indicar a liberação do paciente. Valores de função pulmonar (PEF, VEF1) de 60% a 80% do previsto ou do melhor valor pessoal, associados à melhora dos sintomas, são critérios para liberar o paciente para tratamento em domicílio65.
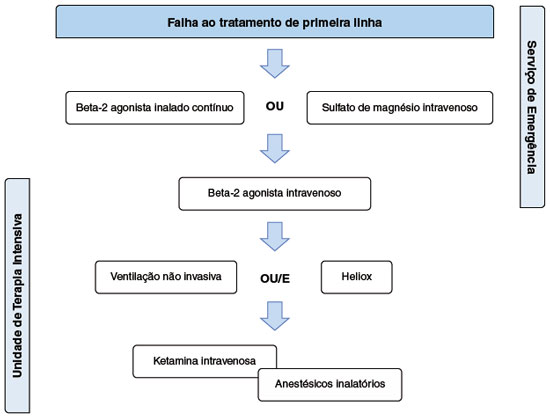
Figura 3
Sugestão de fluxograma de abordagem da exacerbação da asma refratária ao tratamento de primeira linha. Adaptado de Rheder KJ47
A gasometria arterial, em geral, não é utilizada de rotina e deve ser considerada para pacientes com PFE ou VEF1 inferiores a 50% do previsto e/ou maior valor pessoal, ou para os pacientes que não apresentarem boa evolução com o tratamento inicial1, ou nos pacientes com saturação de O2 abaixo de 92%. Níveis normais de PaCO2 ou aumentados são indicativos de evolução de piora da gravidade da asma65.
A radiografia de tórax não dever ser realizada de rotina, pois raramente indica mudança de tratamento. Está indicada quando o paciente não apresenta boa resposta ao tratamento ou quando há sinais sugestivos de complicação, por exemplo, pneumotórax ou achados clínicos de consolidação1,65,67.
Outros exames laboratoriais, assim como os exames de imagem, raramente têm utilidade no tratamento e não estão recomendados na avaliação de rotina2.
Internação hospitalar ou em unidade de terapia intensiva - indicações
Os pacientes que chegam à sala de emergência com exacerbação aguda de asma classificada como leve ou moderada e apresentam piora ou falha na resposta aos broncodilatadores e corticosteroides, após duas horas do atendimento inicial, necessitarão de internação hospitalar. Os pacientes que chegam com exacerbação classificada como grave devem ser internados em unidade de terapia intensiva pediátrica (UTIP)68.
Os critérios absolutos de internação incluem69:
- deterioração clínica observada pela piora da dispneia e/ou aumento do esforço respiratório;
- fadiga respiratória com redução da frequência respiratória, redução da retração esternal e assin-cronia toracoabdominal;
- hipoventilação grave ("tórax silencioso" à ausculta ou incapacidade do paciente em falar);
- necessidade de O2 suplementar por saturação baixa de O2 na oximetria de pulso por uma hora ou mais após o início da terapia inicial;
- história prévia de asma quase fatal, com necessidade de internação em UTIP, com intubação e ventilação mecânica.
Os critérios relativos de internação incluem69:
- história prévia de exacerbação aguda com rápido agravamento e internação;
- adesão inadequada ao tratamento ambulatorial de controle, com utilização frequente de broncodilatadores, sobretudo de curta duração;
- paciente em condição de vulnerabilidade social, e incapacidade do cuidador de prestar assistência necessária ao paciente.
Os critérios absolutos de internação em UTIP incluem70:
- incapacidade de falar, confusão ou sonolência;
- hipoxemia apesar de O2 suplementar;
- hipercapnia moderada a grave.
Indicações de intubação
As indicações absolutas de intubação traqueal incluem71,72:
- maior esforço respiratório grave e persistente, com alteração do estado mental;
- hipoxemia (pO2 < 60 mmHg) em vigência da oferta de altas concentrações de O2 (100%) ou ventilação com pressão positiva não invasiva (VNI);
- hipercapnia progressiva causando acidose respiratória significativa ou alteração do estado mental;
- parada cardiorrespiratória.
Tratamento da exacerbação de asma fora do ambiente hospitalar
A identificação de sintomas ou de outros fatores que são precursores de exacerbação da asma é fundamental para iniciar o tratamento e sua prevenção, precocemente. A combinação do aumento da tosse durante o dia, sibilos e uso de beta-2 agonista durante a noite tem se mostrado como forte preditor de exacerbação iminente da asma, predizendo aproximadamente 70% das exacerbações, com um baixo valor de falso positivo (14%). Em contraste, nenhum sintoma individual foi preditor de exacerbação iminente de asma73.
O tratamento inicial da exacerbação de asma inclui um plano de ação que permita aos membros da família e cuidadores perceber a piora da asma, iniciar o tratamento, reconhecer exacerbações graves, identificar quando for necessário o atendimento de urgência e seguir recomendações de seguimento. O plano de ação deve conter informações específicas sobre as medicações, incluindo doses e modo de utilização1.
Os pais e/ou cuidadores das crianças com asma devem ser orientados a procurar atendimento médico imediatamente se:
- a criança está agudamente dispneica;
- os sintomas não são imediatamente aliviados por broncodilatador inalado;
- o período de alívio após o uso de beta-2 agonista de curta ação (SABA) fica progressivamente menor;
- uma criança menor de um ano necessita de SABA repetidamente1.
O tratamento da exacerbação de asma deve ser iniciado com uso de SABA (doses de salbutamol variáveis de 2 a 10 jatos/dose ou equivalente, dependendo da idade da criança e/ou adolescente), um jato de cada vez, com um espaçador com ou sem máscara. Isso pode ser repetido por duas vezes, com intervalos de 20 minutos, se necessário. A criança deve ser observada. Se houver melhora, manter em repouso por uma hora. Se não houver melhora, ou se mais de 6 jatos de SABA forem necessários para alívio dos sintomas nas duas primeiras horas, deve-se procurar atendimento médico urgente1.
Não há evidências que suportem o tratamento com corticosteroide oral (CO) iniciado pela família/cuidadores no manejo domiciliar da exacerbação de asma74,75. Tratamento episódico preventivo com corticosteroide inalatório nebulizado em altas doses pode reduzir exacerbações em crianças com sibilância intermitente induzida por vírus. No entanto, devido aos efeitos colaterais, principalmente se utilizados inadvertidamente e inadequadamente, essa estratégia deve ser adotada somente se o médico tiver confiança de que o uso será apropriado e de que a criança será monitorada quanto a eventos adversos76.
Em crianças de 2 a 5 anos com sibilância intermitente induzida por vírus, estudo randomizado controlado mostrou que um curso curto de antagonista do receptor de leucotrieno (LTRA) implementado no início da exacerbação reduziu sintomas, utilização de recursos de saúde e absenteísmo no trabalho dos cuidadores77. Os pais devem ser aconselhados sobre o risco de eventos adversos no sono e comportamento com o uso de montelucaste78.
A educação para o automanejo da asma deve incluir um plano de ação por escrito e revisão regular por um profissional de saúde do controle da asma e uso adequado das medicações. Isso reduz dramaticamente a morbidade de asma em adultos e crian-ças1. Em todas as consultas, a técnica do uso dos dispositivos inalatórios deve ser reavaliada, treinada e corrigida. Em crianças pequenas, o foco da educação em asma é nos pais/cuidadores, porém, medidas simples podem ser ensinadas. A educação em asma também é eficaz quando realizada por profissionais da comunidade do paciente, utilizando uma linguagem compreensível e abordagens adequadas79.
Orientações quanto à importância do controle da asma em longo prazo, efeitos colaterais do uso repetido de corticosteroide oral e técnica adequada do uso de dispositivos inalatórios devem ser realizadas sempre que possível, pois melhoram desfechos em longo prazo em pacientes com asma grave80.
Exemplos de plano de ação para crianças menores de 6 anos ou acima dessa idade estão apontadas nas Figuras 4 e 5.
Orientação para alta hospitalar
Crianças que experimentam uma exacerbação de asma são de risco para exacerbações futuras. Estudos demonstram que os cuidadores têm dificuldade em gerenciar as instruções recebidas no momento da alta hospitalar, cometendo erros de dosagem da medicação, além de má adesão à terapêutica e falhas em manter um seguimento ambulatorial adequado81. Desta forma, precisamos de empenho e estratégias claras para modificar estas dificuldades, aproveitando a internação e orientações dadas à alta hospitalar para gerar mais impacto no controle da doença e evitar readmissões por exacerbação82.
Isso envolve não somente o fornecimento da prescrição de medicamentos, mas orientações de educação em asma, reforçando a importância de seguimento regular82,83.
Antes da alta hospitalar, a criança deve estar estável, isto é, tem que se manter fora do leito sem necessidade de O2 suplementar, com capacidade de se alimentar e ingerir líquidos sem dificuldade.
Orientações da alta, segundo recomendações da GINA1, são descritas a seguir.
MEDICAÇÕES
1. Broncodilatador de curta ação - deve ser usado quando necessário, baseado nos sintomas, porém esse requerimento diário da medicação deve ser anotado para avaliação se o uso está diminuindo, ao longo dos dias, para níveis pré-exacerbação.
2. Corticosteroide oral (CO) - completar o tempo de tratamento, que deve ser de 3 a 5 dias em crianças, e de 5 a 7 dias em adolescentes (dose de 1-2 mg/kg de prednisolona, máximo de 40 mg/ dia).
3. Corticosteroide inalado (CI) - iniciar CI antes da alta, se não houver sido prescrito previamente (dose baixa 2 vezes ao dia no primeiro mês após a alta, ajustando-se posteriormente, com o médico assistente, conforme necessário) (vide Tabela 6). Pacientes que já recebiam a medicação devem ter seu tratamento intensificado, por duas a quatro semanas, reforçando-se a importância do uso diário das medicações.
EDUCAÇÃO
1. Identificar fatores de risco e desencadeantes que contribuem para exacerbação.
É importante identificar, antes da alta, os fatores de risco que podem ter contribuído para exacerbação e estabelecer estratégias para modificá-los. As exacerbações graves suficientes para gerarem internação podem ser decorrentes da exposição a alérgenos e irritantes, infecções virais respiratórias, tratamento de manutenção inadequado, problemas com adesão, e/ou falta de um plano de ação para asma, por escrito.
2. Orientar técnica inalatória e plano de ação
Rever técnica inalatória e acertar eventuais erros.
Rever técnica do PFE, se utilizado.
Prover um plano de ação por escrito ou rever o plano de ação já existente (Figuras 4 e 5). Pacientes com plano de ação e que monitoram o controle da doença utilizando medidas de PFE têm melhores resultados no tratamento após a alta.
ENCAMINHAMENTOS
Programar, idealmente, um retorno com o médico assistente em 1 a 2 dias (2 a 7 dias para adolescentes) e outro 1 a 2 meses após a alta, dependendo da clínica, praticidade de agendamento e contexto social. Isso é fundamental para que o tratamento seja continuado, e que os sintomas sejam bem controlados.
REFERÊNCIAS
1. Global Initiative for Asthma - GINA - update 2021 [Internet]. Disponível em: www.ginasthma.org. Acessado em: maio/2021.
2. Hasegawa K, Craig SS, Teach SJ, Camargo Jr. CA. Management of asthma exacerbations in the emergency department. J Allergy Clin Immunol Pract. 2021;9(7):2599-610.
3. Tiotiu AI, Novakova P Nedeva D, Chong-Neto HJ, Novakova S, Steiropoulos P, et al. Impact of air pollution on asthma outcomes. Int J Environ Res Public Health. 2020;17(17):6212.
4. D'Amato G, Chong-Neto HJ, Monge Ortega OP, Vitale C, Ansotegui I, Rosario N, et al. The effects of climate change on respiratory allergy and asthma induced by pollen and mold allergens. Allergy. 2020;75:2219-28.
5. Stenson E, Tchou M, Wheeler D. Management of acute asthma exacerbations. Curr Opin Pediatr. 2017;29:305-10.
6. Scarfone RJ. Acute asthma exacerbations in children younger than 12 years: Emergency department management. UpToDate 2021. Disponível em: https://www.uptodate.com/contents/acute-asthma-exacerbations-in-children-younger-than-12-years-emergency-department-management. Acessado em: 10/06/2021.
7. Gouin S, Robidas I, Gravel J, Guimont C, Chalut D, Amre D. Prospective evaluation of two clinical scores for acute asthma in children 18 months to 7 years of age. Acad Emerg Med. 2010;17(6):598-603.
8. Chalut DS, Ducharme FM, Davis GM. The Preschool Respiratory Assessment Measure (PRAM): a responsive index of acute asthma severity. J Pediatr. 2000;137:762-8.
9. Gorelick MH, Stevens MW, Schultz TR, Scibano PV. Performance of a novel clinical score, the pediatric Asthma Severity Score (PASS), in the evaluation of acute asthma. Acad Emerg Med. 2004;11:10-8.
10. Kline-Krammes S, Patel NH, Robinson S. Childhood asthma: a guide for pediatric emergency medicine providers. Emerg Med Clin North Am. 2013;31(3):705-32.
11. Castro-Rodríguez JA. Tratamiento dela crisis asmática en pediatria Management of acute asthma exacerbations in pediatrics. An Pediatr (Barc). 2007;67(4):390-400.
12. Tal A, Pasterkamp H, Leahy F Arterial oxygen desaturation following salbutamol inhalation in acute asthma. Chest. 1984;86(6):868-9.
13. Shein SL, Speicher RH, Filho JO, Gaston B, Rotta AT. Contemporary treatment of children with critical and near-fatal asthma. Rev Bras Ter Intensiva. 2016;28(2):167-78.
14. Le Conte P, Terzi N, Mortamet G, Abroug F, Carteaux G, Charasse C, Chauvin A et al. Management of severe asthma exacerbation: guidelines from the Société Française de Médecine d'Urgence, the Société de Réanimation de Langue Française and the French Group for Pediatric Intensive Care and Emergencies. Ann Intensive Care. 2019;9(1):115.
15. Chao KY, Chien YH, Mu SC. High-flow nasal cannula in children with asthma exacerbation: A review of current evidence. Paediatr Respir Rev. 2021:S1526-0542(21)00003-8.
16. Lee MO, Sivasankar S, Pokrajac N, Smith C, Lumba-Brown A. Emergency department treatment of asthma in children: A review. J Am Coll Emerg Physicians Open. 2020;1(6):1552-61.
17. Fergeson JE, Patel SS, Lockey RF. Acute asthma, prognosis, and treatment. J Allergy Clin Immunol. 2017;139(2):438-47.
18. Miller EK, Avila PC, Khan YW, Word CT, Pelz BJ, Papadopoulos NG, et al. Wheezing exacerbations in early childhood: evaluation, treatment, and recent advances relevant to the genesis of asthma. J Allergy Clin Immunol Pract. 2014;2(5):537-43.
19. Camargo CA, Rachelefsky G, Schatz M. Managing Asthma Exacerbations in the Emergency Department: Summary of the National Asthma Education and Prevention Program Expert Panel Report 3 Guidelines for the Management of Asthma Exacerbations. Proc Am Thorac Soc. 2009;6(4):357-66.
20. Hasegawa K, Sullivan A, Tsugawa Y, Turner, S. Comparison of US emergency department acute asthma care quality: 1997-2001 and 2011-2012. J Allergy Clin Immunol. 2014;135(1):73-80.
21. Waseem M, Leber M, Wasserman E, Sullivan A, Camargo CA, Hasegawa K. Factors associated with concordance with the non-level-A guideline recommendations for emergency department patients with acute asthma. J Allergy Clin Immunol. 2015;3(4):618-20.
22. Castro-Rodriguez JA, J Rodrigo G, E Rodríguez-Martínez C. Principal findings of systematic reviews of acute asthma treatment in childhood. J Asthma. 2015;52(10):1038-45.
23. Indinnimeo L, Chiappini E, Miraglia Del Giudice M; Italian Panel for the management of acute asthma attackin children Roberto Bernardini. Guideline on management of the acute asthma attack in children by Italian Society of Pediatrics. Ital J Pediatr. 2018;44(1):46.
24. Scarfone RJ, Fuchs SM, Nager AL, Shane SA. Controlled trial of oral prednisone in the emergency department treatment of children with acute asthma. Pediatrics. 1993;92(4):513-8.
25. Cates CJ, Welsh EJ, Rowe BH. Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma. Cochrane database Syst Rev. Cochrane Database Syst Rev. 2013;9:CD000052.
26. Brown JH, Brandl K,Wess J. Agonistas e antagonistas dos receptores muscarínicos. In: Brunton L, Hilal-Dandan R, Knollman B. As bases farmacológicas da terapêutica de Goodman e Gilman. 13a ed. Porto Alegre: AMG; 2019. p. 181-96.
27. Rodrigo GJ, Castro-Rodriguez JA. Anticholinergics in the treatment of children and adults with acute asthma: a systematic review with meta-analysis. Thorax. 2005;60(9):740-6.
28. Craig SS, Dalziel SR, Powell CV, Graudins A, Babl FE, Lunny C. Interventions for escalation of therapy for acute exacerbations of asthma in children: an overview of Cochrane Reviews. Cochrane Database Syst Rev. 2020 Aug 5;8(8):CD012977.
29. Powell C, Dwan K, Milan SJ, Beasley R, Hughes R, Knopp-Sihota JA, et al. Inhaled magnesium sulfate in the treatment of acute asthma. Cochrane Database Syst Rev. 2012 Dec 12;12:CD003898.
30. Knightly R, Milan SJ, Hughes R, Knopp-Sihota JA, Rowe BH, Normansell R, et al. Inhaled magnesium sulfate in the treatment of acute asthma. Cochrane Database Syst Rev. 2017 Nov 28;11(11):CD003898.
31. Pardue Jones B, Fleming GM, Otillio JK, Asokan I, Arnold DH. Pediatric acute asthma exacerbations: Evaluation and management from emergency department to intensive care unit. J Asthma. 2016;53(6):607-17.
32. Rowe BH, Spooner C, Ducharme FM, Bretzlaff JA, Bota GW. Early ED treatment of acute asthma with systemic corticosteroids. Cochrane Database Syst Rev. 2001;1:Cd002178.
33. Keeney GE, Gray MP, Morrison AK, Levas MN, Kessler EA, Hill GD, et al. Dexamethasone for acute asthma exacerbations in children: a meta-analysis. Pediatrics. 2014;133:493-9.
34. Maselli DJ, Peters JI. Medication Regimens for Managing Acute Asthma. Respir Care. 2018;63(6):783-96.
35. Lahn M, Bijur P, Gallagher EJ. Randomized clinical trial of intramuscular vs oral methylprednisolonein the treatment of asthma exacerbations following discharge from an emergency department. Chest. 2004;126(2):362-8.
36. Rowe BH, Spooner CH, Ducharme FM, Bretzlaff JA, Bota GW. Corticosteroids for preventing relapse following acute exacerbations of asthma. Cochrane Database Syst Rev 2007;(3):CD000195.
37. Ducharme FM, Chabot G, Polychronakos C, Glorieux F, Mazer B. Safety profile of frequent short courses of oral glucocorticoids in acute pediatric asthma: impact on bone metabolism, bone density, and adrenal function. Pediatrics. 2003;111:376-83.
38. Edmonds ML, Milan SJ, Camargo CA Jr, Pollack CV, Rowe BH. Early use of inhaled corticosteroids in the emergency department treatment of acute asthma. Cochrane Database Syst Rev. 2012 Dec 12;12(12):CD002308.
39. Õzdemir A, Dogruel D. Efficacy of Magnesium Sulfate Treatment in Children with Acute Asthma. Med Princ Pract. 2020;29:292-8.
40. Irazuzta JE, Chiriboga N. Magnesium sulfate infusion for acute asthma in the emergency department. J Pediatr(Rio J). 2017;93:19-25.
41. Liu X, Yu T, Rower JE, Campbell SC, Sherwin CM, Johnson MD. Optimizing the use ofintravenous magnesium sulfate for acute asthma treatment in children. Pediatr Pulmonol. 2016;51(12):1414-21.
42. Kenyon CC, Fieldston ES, Luan X, Keren R, Zorc JJ. Safety and effectiveness of continuous aerosolized albuterol in the non- intensive care setting. Pediatrics. 2014;134(4):e976-82.
43. Camargo CA, Spooner C, Rowe BH. Continuous versus intermittent p-agonists for acute asthma. Cochrane Database Syst Rev. 2003;(4):CD001115).
44. Pertzborn MC, Prabhakaran S, Abu-Hasan M, Baker D, Wu S, Wu P, et al. Continuous Albuterol with Benzalkonium in Children Hospitalized With Severe Asthma. Pediatrics. 2020;145(4):e20190107.
45. Travers AH, Milan SJ, Jones AP, Camargo CA Jr., Rowe BH. Addition of intravenous beta(2)-agonists to inhaled beta(2)-agonists for acute asthma. Cochrane Database Syst Rev. 2012;12:CD010179.
46. Bogie AL, Towne D, Luckett PM, Abramo TJ, Wiebe RA. Comparison of intravenous terbutaline versus normal saline in pediatric patients on continuous high-dose nebulized albuterol for status asthmaticus. Pediatr Emerg Care. 2007;23(6):355-61.
47. Rehder KJ. Adjunct Therapies for Refractory Status Asthmaticus in Children. Respir Care. 2017;62(6):849-65.
48. Hon KL, Leung AK. Medications and Recent Patents for status asthmaticus in children. Recent Pat Inflamm Allergy Drug Discov. 2017;11(1):12-21.
49. Mitra A, Bassler D, Goodman K, Lasserson TJ, Ducharme FM. Intravenous aminophylline for acute severe asthma in children over two years receiving inhaled bronchodilators. Cochrane Database Syst Rev. 2005;(2):CD001276.
50. Roberts G, Newsom D, Gomez K, Raffles A, Saglani S, Begent J, et al. Intravenous salbutamol bolus compared with an amino- phylline infusion in children with severe asthma: a randomized controlled trial. Thorax. 2003; 58:306-10.
51. Goyal S, Agrawal A. Ketaminein status asthmaticus: a review. Indian J Crit Care Med. 2013;17(3):154-61.
52. Heshmati F, Zeinali MB, Noroozinia H, Abbacivash R, Mahoori A. Use of ketamine in severe status asthmaticus in intensive care unit. Iran J Allergy Asthma Immunol. 2003;2(4):175-80.
53. Hess DR, FinkJB,Venkataraman ST, Kim IK, Myers TR,Tano BD. The history and physics of heliox. Respir Care. 2006;51(6):608-12.
54. Rodrigo G, Pollack C, Rodrigo C, Rowe BH. Heliox for nonintubated acute asthma patients. Cochrane Database Syst Rev. 2003;(4):CD002884.
55. Braun Filho LR, Amantéa SL, Becker A, Vitola L, Marta VF, Krumenauer R. Use of helium-oxygen mixture (Heliox) in the treatment of obstructive lower airway disease in a pediatric emergency department. J Pediatr(Rio J). 2010;86(5):424-8.
56. Rodrigo GJ, Castro-Rodriguez JA. Heliox-driven beta2-agonists nebulization for children and adults with acute asthma: a systematic review with meta-analysis. Ann Allergy Asthma Immunol. 2014;112(1):29-34.
57. Mayordomo-Colunga J, Medina A, Rey C, Concha A, Menendez S, Arcos ML, et al. Non-invasive ventilation in pediatric status asthmaticus: a prospective observational study. Pediatr Pulmonol. 2011;46(10):949-55.
58. Carroll CL, Schramm CM. Noninvasive positive pressure ventilation for the treatment of status asthmaticus in children. Ann Allergy Asthma Immunol. 2006;96(3):454-9.
59. Kelly GS, Simon HK, Sturm JJ. High-flow nasal cannula use in children with respiratory distress in the emergency department: predicting the need for subsequent intubation. Pediatr Emerg Care. 2013;29(8):888-92.
60. Benítez RG, Sanabria LPM, Pavlicich V, Mesquita M. High flow nasal cannula oxygen therapy in patients with asthmatic crisis in the pediatric emergency department. Rev Chil Pediatr. 2019;90(6):642-8.
61. Graham V, Lasserson T, Rowe BH. Antibiotics for acute asthma. Cochrane Database Syst Rev. 2001;(3):CD002741.
62. Kew KM, Undela K, Kotortsi I, Ferrara G. Macrolides for chronic asthma. Cochrane Database Syst Rev. 2015;(9):CD002997.
63. Char DS, Ibsen LM, Ramamoorthy C, Bratton SL.Volatile anesthetic rescue therapy in children with acute asthma: innovative but costly or just costly? Pediatr Crit Care Med. 2013;14(4):343-50.
64. Masuda Y, Tatsumi H, Goto K, Imaizumi H, Yoshida S, Kimijima T, et al. Treatment of life-threatening hypercapnia with isoflurane in an infant with status asthmaticus. J Anesth. 2014;28(4):610-2.
65. BritishThoracic Society, Scottish Intercollegiate Guidelines Network. British guideline on the Management of Asthma: A national clinical guideline. Revised 2016. London: British Thoracic Society, Scottish Intercollegiate Guidelines Network; 2016. 214p.
66. Keahey L, Bulloch B, Becker AB, Pollack CV Jr, Clark S, Camargo CA Jr; Multicenter Asthma Research Collaboration (MARC) Investigators. Initial oxygen saturation as a predictor of admission in children presenting to the emergency department with acute asthma. Ann Emerg Med. 2002;40(3):300-7.
67. Carroll CL, Sala KA. Pediatric status asthmaticus. Crit Care Clin. 2013;29(2):153-66.
68. Powell, Colin VE. Acute severe asthma. J Paediatr Child Health. 2016;52(2):187-91.
69. 2020 Focused Updates to the Asthma Management Guidelines: A Report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. (NIH publication no. 20-HL-8140). Bethesda, MD: National Heart, Lung, and Blood Institute, 2020. Available from: http//www.nhlbi.nih.gov/ health-topics/asthma-management-guidelines-2020-updates.
70. Proença Filho JO, Freddi NA. Estado de mal asmático. In: Hirschheimer MR, Carvalho WB, Matsumoto T, editors. Terapia intensiva pediátrica e neonatal. 4a ed. Rio de Janeiro: Atheneu; 2018. p. 549-86.
71. Koninckx M, Buysse C, de Hoog M. Management of status asthmaticus in children. Paediatr Respir Rev. 2013;14:78.
72. Leatherman, J. Mechanical Ventilation for Severe Asthma. Chest. 2015;147(6):1671-80.
73. Swern AS, Tozzi CA, Knorr B, Bisgaard H. Predicting an asthma exacerbation in children 2 to 5 years of age. Ann Allergy Asthma Immunol. 2008;101:626-30.
74. Grant CC, Duggan AK, DeAngelis C. Independent parental administration of prednisone in acute asthma: a double-blind, placebo-controlled, crossover study. Pediatrics. 1995;96:224-9.
75. Vuillermin P, South M, Robertson C. Parent-initiated oral corticosteroid therapy for intermittent illnessesin children. Cochrane Database Syst Rev. 2006:D005311.
76. Kaiser SV, Huynh T, Bacharier LB, Rosenthal JL, Bakel LA, Parkin PC, et al. Preventing exacerbations in preschoolers with recurrent wheeze: a meta-analysis. Pediatrics. 2016;137(6):e20154496.
77. Robertson CF, Price D, Henry R, Mellis C, Glasgow N, Fitzgerald D, et al. Short-course montelukast for intermittent asthma in children: a randomized controlled trial. Am J Respir Crit Care Med. 2007;175:323-9.
78. FDA requires Boxed Warning about serious mental health side effects for asthma and allergy drug montelukast (Singulair); advises restricting use for allergic rhinitis. FDA, 2020. Disponível em: http://www.fda.gov/drugs/drug-safety-and-availability/fda-requires-boxed-warning-about-serious-mental-health-side-effects-asthma-and-allergy-drug. Acessado em: 21/06/2021.
79. Chan M, Gray M, Burns C, Owens L, Woolfenden S, Lingam R, et al. Community-based interventions for childhood asthma using comprehensive approaches: a systematic review and meta-analysis. Allergy Asthma Clin Immunol. 2021;17(1):19.
80. Song W-J, Won H-K, Lee SY, Park H-K, Cho YS, Chung KF, et al. Patients' experiences of asthma exacerbation and management: a qualitative study of severe asthma. ERJ Open Res.
2021;7(2):00528-2020.
81. Glick AF, Farkas JS, Nicholson J, Dreyer BP, Fears M, Bandera C, et al. Parental Management of Discharge Instructions: A Systematic Review. Pediatrics. 2017;140(2):e20164165.
82. Krupp NL, Fiscus C, Webb R, Webber EC, Stanley T, Pettit R, et al. Multifaceted quality improvement initiative to decrease pediatric asthma readmissions. J Asthma. 2017;54(9):911-8.
83. Parikh K, Hall M, Kenyon CC, Teufel RJ 2nd, Mussman GM, Montalbano A, et al. Impact of Discharge Components on Readmission Rates for Children Hospitalized with Asthma. J Pediatr. 2018;195:175-81.