Número Atual: Abril-Junho 2021 - Volume 5 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Síndrome de enterocolite induzida por proteína alimentar como diagnóstico diferencial das alergias alimentares: relato de caso
Food protein-induced enterocolitis syndrome as a differential diagnosis for food allergies: a case report
Haroldo Teófilo de-Carvalho1; Daniela Mitsue Suzuki2; Patrícia Golgato Aguiar2; Paula Ravanelli Rossi3; Cristiane Felipe Toniolo3; Deborah Carvalho Cavalcanti3
DOI: 10.5935/2526-5393.20210030
1. Universidade Federal de São Carlos - UFSCar, Área de Saúde da Criança e do Adolescente - Departamento de Medicina - São Carlos, SP, Brasil
2. Santa Casa de São Carlos, Residência Médica em Pediatria - São Carlos, SP, Brasil
3. Hospital Universitário Prof. Dr. Horácio Carlos Panepucci HU-UFSCar, Linha de Cuidado da Criança e do Adolescente - São Carlos, SP, Brasil
Endereço para correspondência:
Haroldo Teófilo de-Carvalho
E-mail: haroldoteofilo@gmail.com
Submetido em: 15/02/2021
Aceito em: 30/03/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A síndrome da enteropatia induzida por proteína alimentar, aguda ou crônica, é um tipo de alergia alimentar não mediada por IgE, que surge entre os 5 e 9 meses de idade, e é caracterizada por episódios de vômitos que começam aproximadamente 1 a 4 horas após a ingestão do alérgeno, algumas vezes acompanhados de letargia, palidez cutânea e diarreia com sangue, resultando em instabilidade hemodinâmica e choque em 15% dos casos. Sua epidemiologia em larga escala é desconhecida, assim como o mecanismo imunopatológico, no entanto, sugere-se um papel importante das células T no processo inflamatório.As manifestações e a gravidade dependem da frequência e da dose do alimento desencadeante, bem como do fenótipo e da idade de cada paciente. A suspeita se dá com base principalmente na história clínica e nos sintomas característicos da doença, que tendem a melhorar após a retirada do alimento suspeito. O teste de provocação oral é o padrão ouro para o diagnóstico, mas deve ser reservado para os casos em que a história é confusa e a hipótese incerta. A abordagem de primeira linha no tratamento visa corrigir a desidratação ou estabilizar o choque quando presente, e interromper imediatamente a oferta de alimentos com potencial indutor de reação alérgica. Relatamos o caso de uma lactente de 2 meses de idade com diagnóstico da síndrome, cujo objetivo é atentar o leitor quanto as suas particularidades, auxiliando-o no diagnóstico precoce e adequado a fim de evitar a depleção progressiva e a evolução para sua forma potencialmente grave.
Descritores: Hipersensibilidade alimentar, enterocolite, desidratação, pediatria.
INTRODUÇÃO
A alergia alimentar pode ser definida como uma doença resultante de uma resposta imunológica desorganizada que ocorre após a ingestão ou contato com determinados alimentos potencialmente alergênicos, resultando em manifestações clínicas variáveis, de sintomas pouco expressivos até disfunções orgânicas graves e óbito. Dentre as formas graves de alergia alimentar destaca-se a síndrome da enteropatia induzida por proteína alimentar (FPIES), uma alergia não mediada por IgE que se apresenta na infância, com incidência maior em lactentes entre os 5 e 9 meses de idade, marcada por episódios de vômitos que começam aproximadamente 1 a 4 horas após a ingestão de alimentos, algumas vezes acompanhados de letargia, palidez cutânea e diarreia com sangue, culminado em instabilidade hemodinâmica em pelo menos 15% dos casos1-4.
A epidemiologia em larga escala e o mecanismo imunológico da síndrome ainda são desconhecidos. Os poucos dados disponíveis estimam uma frequência de 3 para cada 1.000, e sugerem um papel importante das células T na tempestade de citocinas, que ocasiona danos à barreira epitelial e aumento da permeabilidade intestinal, características histológicas que permitem diferenciar a FPIES de outros tipos de alergias alimentares não mediadas por IgE5,6.
Apresentamos a seguir um caso de síndrome da enteropatia induzida por proteína alimentar e as características que permitem diferenciá-la das demais alergias alimentares. Nosso objetivo é atentar o leitor quanto as suas particularidades, auxiliando-o no diagnóstico precoce e adequado a fim de evitar a depleção progressiva causada pela doença e a evolução para sua forma grave e potencialmente fatal.
O responsável pelo paciente autorizou o uso de dados do prontuário para a confecção desse relato, diante da assinatura do Termo de Consentimento Livre e Esclarecido, e após a aprovação do Comitê de Ética em Pesquisa (Parecer n° 4.373.857).
RELATO DE CASO
Lactente do sexo feminino, de 2 meses de idade, em aleitamento materno exclusivo, apresentava há 20 dias diarreia volumosa, com grande quantidade de muco e sangue, associado a vômitos, duas a três horas após a alimentação, resultando em hiporexia e perda de peso (300 gramas nesse período). Em consulta anterior no pronto atendimento a mãe havia informado que consumia grandes quantidades de proteína animal e derivados lácteos, sendo então aventada a hipótese diagnóstica de alergia à proteína do leite de vaca (APLV) e encaminhada ao serviço de gastroenterologia, entretanto, a persistência do quadro fez com que a mãe procurasse novamente o serviço de urgência e que a criança fosse internada para elucidação diagnóstica. No momento da internação a lactente estava irritada, com os olhos fundos, a fontanela deprimida, a boca seca, e com dificuldade de pega ao seio materno. Ao exame físico seus pulsos eram finos e o tempo de enchimento capilar maior que 4 segundos.
Quando avaliado o turgor da pele, o sinal da prega desaparecia muito lentamente (mais de 2 segundos) e sua pele era descorada. A criança estava taquicardica (frequência cardíaca de 183 batimentos por minuto), eupneica (frequência respiratória de 36 incursões por minuto) e afebril (temperatura axilar 36,3 °C).
A Tabela 1 traz os resultados dos exames laboratoriais colhidos na admissão hospitalar.

Foi encaminhada imediatamente à sala de emergência, monitorizada, puncionado acesso venoso na mão direita, realizada sondagem vesical de demora (sem diurese na bolsa) e teste de glicemia capilar (93 mg/dL). Infundido 3 alíquotas de 20 mL/Kg de cristaloides, obtendo melhora do estado hemodinâmico, da desidratação, e débito urinário com urina turva.
O exame radiológico do abdome não evidenciou áreas lucentes que representassem sinais de pneumoperitônio ou pneumatose intestinal, mas as alças eram marcadas pelo edema e pela intensa distensão gasosa, correspondendo com os sinais semiológicos de distensão abdominal e dor à palpação apresentados durante o exame físico.
A paciente foi internada, o aleitamento materno exclusivo foi mantido, e a mãe submetida a regime alimentar isento de alimentos com proteína do leite de vaca (recebia chá, café, pão e bolacha de água e sal e maisena no dejejum e nos lanches, e arroz, feijão, uma proteína e uma guarnição nas refeições principais). Devido ao número de perdas decorrentes dos vômitos, da diarreia e a baixa aceitação do leite materno, complementamos a oferta hídrica com soro isotônico e glicose para infusão em 24 horas.
Apesar das medidas iniciais e da restrição alimentar instituída para a mãe, após 3 dias de internação a criança mantinha-se em regular estado geral, alternado sonolência com irritabilidade. Havia persistência dos vômitos sempre 2 a 3 horas após as mamadas e da diarreia com rajas de sangue, demandando administração de ondansentrona a cada 8 horas. Diariamente as perdas eram repostas com soro de reparação. Solicitado cultura de fezes, cultura para rotavírus e clostridium, cujos resultados foram normais.
Fazendo uma avaliação retrospectiva do quadro clínico e dos exames laboratoriais, a hipótese diagnóstica de síndrome de enterocolite induzida por proteína alimentar foi aventada. Após consenso entre as equipes de Gastroenterologia Pediátrica e Nutrição, no quarto dia de internação, optou-se por suspender totalmente o aleitamento materno e iniciar fórmula infantil extensamente hidrolisada, no entanto, os sintomas persistiram, levando à substituição por fórmula à base de aminoácidos após 96 horas da sua introdução (9° dia de internação).
Os vômitos persistiram nos três primeiros dias após a mudança da fórmula infantil, assim como a diarreia, que apesar de presente, diminuiu o número de episódios, o muco e o sangue. Os sintoma cessaram totalmente com cinco dias de uso da fórmula de aminoácidos (14° dia de internação), refletindo na melhora do estado geral da criança e na recuperação nutricional. Ela então recebeu alta após os exames se normalizarem, e é acompanhada no serviço de Pediatria, pela Gastroenterologia e Alergologia Pediátrica, com ganho de peso adequado e ausência de alterações gastrintestinais.
DISCUSSÃO
Os primeiros relatos da FPIES datam da década de 70, quando Powell descreve uma série de casos de enterocolite em crianças que consumiam leite de vaca ou fórmula à base de soja. Posteriormente, a identificação dos sinais e sintomas relacionados com a síndrome, e sua evolução temporal possibilitaram a classificação em duas formas de apresentação: aguda e crônica. A forma aguda é caracterizada por episódios de vômitos e/ou diarreia recorrentes aproximadamente 1 a 4 horas após a ingestão de um alimento alergênico. O vômito geralmente é prolongado e intenso, resultando em desidratação, letargia, palidez e choque nas formas graves. Já a forma crônica geralmente é encontrada em lactentes com menos de 4 meses de idade, e é resultado da exposição prolongada a alimentos alergênicos, principalmente o leite de vaca, a proteína de soja e alguns grãos, entretanto, também pode acometer crianças em aleitamento materno exclusivo. Cerca de 63% dos pacientes são reativos a um único alimento, enquanto 35% a dois ou mais alimentos indutores7-10.
Em condições normais, quando os alérgenos alimentares chegam ao lúmen intestinal, os macrófagos do epitélio intestinal capturam tais alérgenos e os apresentam às células dendríticas CD103+, que por sua vez, processam esses alérgenos e os drenam para os linfonodos regionais, apresentando-os como peptídeos para as células T CD4+ virgens. Durante esse processo, as citocinas liberadas ajudam a transformar as células virgens em células T-reg, e fazem as células B produzirem IgA específica ao invés de IgE3,11.
Já no epitélio intestinal danificado, grande parte dos alérgenos passam entre as células epiteliais e não são capturados pelos macrófagos. Quando encontram as células dendríticas, expressam OX-40L e drenam para os linfonodos regionais, para as células T CD4+ que expressam CD40. Durante esse processo, as citocinas IL-4, IL-5 e IL-13 ativam uma resposta imune mediada por TH2 e fazem com que as células B produzam IgE específica ao invés de IgA3,11.
As manifestações e a gravidade da FPIES dependem da frequência e da dose do alimento desencadeante, bem como do fenótipo e da idade de cada paciente. A Tabela 2 mostra os exames comumente solicitados na investigação, no entanto, vale ressaltar que o diagnóstico se baseia na exclusão de outras causas potenciais e, principalmente, na história clínica e nos sinais e sintomas característicos que melhoram após a retirada do alimento suspeito2,11.

O teste de provocação oral é o padrão ouro para o diagnóstico da FPIES e de outras alergias alimentares, sobretudo quando a história não é clara, além de auxiliar na avaliação da aquisição de tolerância e da reatividade clínica. A dosagem de IgE sérica específica pode ser útil para o diagnóstico diferencial, já que na síndrome seus resultados costumam ser negativos, visto que sua fisiopatologia é presumivelmente mediada por células T. Quando há a detecção de IgE específica para proteína do leite de vaca em uma pequena parte dos pacientes nessa situação, alguns autores sugerem uma forma da síndrome denominada de atípica, a qual constitui um fator de risco para persistência dos sintomas além dos 3 anos de idade12-14.
Os exames radiológicos não são necessários para elucidação diagnóstica, entretanto, na avaliação inicial das crianças hemodinamicamente instáveis, quando não é possível estabelecer a causa do choque, as radiografias de abdome agudo (radiografia de tórax ortostático, abdome ortostático e decúbito dorsal) podem ser úteis na exclusão de processos obstrutivos, inflamatórios e perfurativos. Quando solicitadas, os achados radiológicos mais frequentes na FPIES são a presença de edema de alça intestinal, níveis hidroaéreos, estreitamento inespecífico do reto e sigmoide e espessamento das plicas circulares no duodeno e jejuno com excesso de líquido intraluminal15.
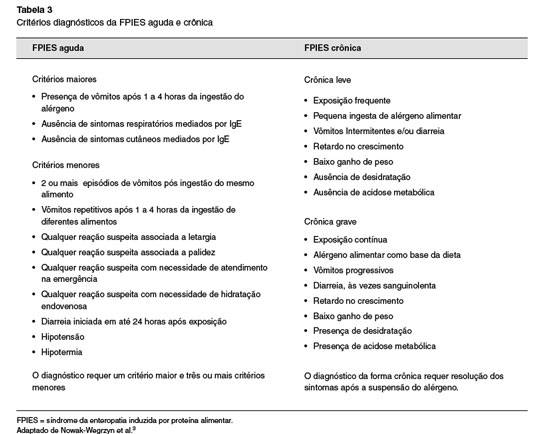
Alguns fatores podem dificultar o estabelecimento do diagnóstico, em especial a presença de sintomas comuns a diversas doenças. Os episódios iniciais podem ser diagnosticados erroneamente como gastroenterite, anafilaxia, estenose hipertrófica de piloro, doença do refluxo gastroesofágico, intolerância à lactose, doença celíaca, doença de Hirschsprung, intussuscepção e sepse. Nowak-Wegrzyn e cols. propuseram critérios diagnósticos para pacientes em investigação de FPIES aguda ou crônica3,12-16 (Tabela 3).
A abordagem de primeira linha no tratamento é interromper imediatamente a oferta de alimentos com potencial indutor de reação alérgica. O leite materno parece exercer um efeito protetor contra a FPIES, fazendo com que a maioria das crianças não reajam aos alérgenos alimentares presentes nele, o que não exclui a possibilidade de acometimento daqueles em aleitamento materno exclusivo, uma vez que os elementos desencadeadores, especialmente as proteínas do leite de vaca, também podem ser transmitidas na aleitação. Nesse caso, a restrição alimentar materna, apesar de não encontrar consenso na literatura, deve ser instituída se houver persistência dos sintomas alérgicos, e o aleitamento materno descontinuado caso a medida anterior isoladamente não seja eficaz na resolução do problema. Quanto à recomendação de fórmulas infantis hipoalergênicas, deve-se optar, inicialmente, pelas fórmulas extensamente hidrolisadas, reservando as fórmulas de aminoácidos para os não respondedores1,3,17-18.
A desidratação ocasionada pelo extravasamento de líquido resultante da intensa permeabilidade intestinal pode causar instabilidade hemodinâmica e choque, simulando um quadro de sepse ou choque séptico de foco abdominal. Quanto à fluidoterapia, devemos nos atentar ao tipo de solução e o tempo de infusão, sobretudo nas situações em que não há serviço de terapia intensiva pediátrica disponível na unidade de atendimento. Deve-se utilizar cristaloides balanceados ao invés de coloides, no volume de 10 a 20 mL/Kg, avaliando frequentemente os sinais de sobrecarga cardíaca. Não se recomenda o uso de amidos e gelatinas. O uso de epinefrina deve ser considerado caso haja hipotensão após reposição volêmica adequada19.
Não há consenso quanto ao uso de corticoides no tratamento da FPIES. Acredita-se que o efeito benéfico esteja amparado na hipótese fisiopatológica de lesão intestinal mediada por células inflamatórias. Assim, a metilprednisolona (1 mg/kg) em dose única por via intravenosa tem sido recomendada2,3,15.
Optamos pela administração de ondansentrona no paciente relatado por ser o único antiemético disponível para uso intravenoso em nosso hospital, e não observamos efeitos colaterais relacionados ao tratamento com essa droga. Trata-se de um antagonista altamente seletivo dos receptores 5-HT3 da serotonina, capaz de bloquear estímulos neuroendócrinos induzidos pelo processo inflamatório intestinal e assim inibir os vômitos causados pela FPIES, todavia, sua eficácia e segurança em lactentes nessa idade ainda não está bem estabelecida, sendo usada na maioria das vezes de forma off label, contudo, sua administração por via intravenosa ou intramuscular é segura em crianças acima de 1 ano de idade20-22.
O prognóstico da FPIES é bom, e a maioria dos casos tem resolução entre os 3 e 5 anos, sem sequelas, desde que feitas orientações dietéticas adequadas, otimização dos nutrientes, uso de fórmulas infantis apropriadas e suplementação vitamínica quando necessária3,4,13,23,24.
REFERÊNCIAS
1. Solé D, Silva LR, Cocco RR, Ferreira CT, Sarni RO, Oliveira LC, et al. Consenso Brasileiro sobre Alergia Alimentar: 2018 - Parte 1 - Etiopatogenia, clínica e diagnóstico. Documento conjunto elaborado pela Sociedade Brasileira de Pediatria e Associação Brasileira de Alergia e Imunologia. Arq Asma Alerg Imunol. 2018;2(1):7-38.
2. Feuille E, Nowak-Wegrzyn A. Definition, etiology, and diagnosis of food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2014;14(3):222-8.
3. Nowak-Wegrzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017;139(4):1111-26.
4. Katz Y, Goldberg MR, Rajuan N, Cohen A, Leshno M. The prevalence and natural course of food protein-induced enterocolitis syndrome to cow's milk: a large- scale, prospective population-based study. J Allergy Clin Immunol. 2011;127:647-53.
5. Özdemir Ö. Immuno pathogenesis of food protein induced enterocolitis syndrome (FPIES). MOJ Immunol. 2018;6(3):86-8.
6. Vila Sexto L. Latest insights on food protein-induced enterocolitis syndrome: An emerging medical condition. J Investig Allergol Clin Immunol. 2018;28(1):13-23.
7. Powell GK. Milk and soy induced enterocolitis of infancy. J Pediatr. 1978;93:553-60.
8. Ruffner MA, Ruymann K, Barni S, Cianferoni A, Brown-Whitehorn T, Spergel JM. Food protein induced enterocolitis syndrome: insights from review of a large referral population. J Allergy Clin Immunol Pract. 2013;1:343-9.
9. Mehr S, Kakakios A, Frith K, Kemp AS. Food protein induced enterocolitis syndrome: 16-year experience. Pediatrics. 2009;123:e459-e64.
10. Hwang JB, Sohn SM, Kim AS. Prospective follow-up oral food challenge in food protein-induced enterocolitis syndrome. Arch Dis Child. 2009;94:425-8.
11. Yu W, Freeland DMH, Nadeau KC. Food allergy: immune mechanisms, diagnosis and immunotherapy. Nat Rev Immunol. 2016;16(12):751-65.
12. Nowak-Wegrzyn A, Berin MC, Mehr S. Food Protein- Induced Enterocolitis Syndrome. J Allergy Clin Immunol Pract. 2020;8(1):24-35.
13. Caubet JC, Ford LS, Sickles L, Järvinen KM, Sicherer SH, Sampson HA, et al. Clinical features and resolution of food protein-induced enterocolitis syndrome: 10-year experience. J Allergy Clin Immunol. 2014;134(2):382-9.
14. Leonard SA, Nowak-Wegrzyn A. Food protein-induced enterocolitis syndrome: na update on natural history and review of management. Ann Allergy Asthma Immunol. 2011;107:95-101.
15. Nowak-Wegrzyn A, Muraro A. Food protein-induced enterocolitis syndrome. Curr Opin Allergy Clin Immunol. 2009;9:371-7.
16. Costa YHM, Gutheil-Gonçalves L, Tiemi-Miyakawa D, Rosário CS, Chong-Silva DC, Riedi CA, et al. Síndrome de Enterocolite Induzida por Proteína Alimentar (FPIES): um novo diagnóstico diferencial para alergia alimentar. Arq Asma Alerg Imunol. 2019;3(3):259-68.
17. Agyemang A, Nowak-Wegrzyn A. Food protein induced enterocolitis syndrome: a comprehensive review. Clinic Rev Allerg Immunol. 2019;57:261-71.
18. Baldo F, Bevacqua M, Corrado C, Nisticò D, Cesca L, Declich V, et al. FPIES in exclusively breastfed infants: two case reports and review of the literature. Ital J Pediatr. 2020;46:144.
19. Weiss SL, Peters MJ, Alhazzani W, Agus MSD, Fiori HR, Inwald DP, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis associated organ dysfunction in children. Intensiv Care Med. 2020;46(1):10-67.
20. Sopo SM, Battista A, Monaco SGM. Ondansetron for food protein-induced enterocolitis syndrome. Int Arch Allergy Immunol. 2014;164:137-9.
21. Freedman SB, Adler M, Seshadri R, Powell EC. Oral ondansetron for gastroenteritis in a pediatric emergency department. N Engl J Med. 2006;354:1698-705.
22. Roslund G, Hepps TS, McQuillen KK. The role of oral ondansetron in children with vomiting as a result of acute gastritis/gastroenteritis who have failed oral rehydration therapy: A randomized controlled trial. Ann Emerg Med. 2008;52:22-9.
23. Meyer R, De Koker C, Dziubak R, Godwin H, Dominguez-Ortega G, Chebar Lozinsky A, et al. The impact of the elimination diet on growth and nutrient intake in children with food protein induced gastrointestinal allergies. Clin Trans Allergy. 2016;6(1):25.
24. Kimura M, Shimomura M, Morishita H, Meguro T. Prognosis of infantile food protein-induced enterocolitis syndrome in Japan. Pediatr Intern. 2017;59(8):855-60.