Número Atual: Abril-Junho 2021 - Volume 5 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Reações cutâneas graves em crianças: como se comportam?
Severe cutaneous adverse reactions in children: how do they behave?
Débora Mutti de Almeida Monteiro1; Dina Larissa Capelasso da-Costa1; Chayanne Andrade de Araujo2; Maria Elisa Bertocco Andrade1; Fátima Rodrigues Fernandes1,2
DOI: 10.5935/2526-5393.20210024
1. Hospital do Servidor Público Estadual de São Paulo, Alergia e Imunologia - São Paulo, SP, Brasil
2. Hospital Infantil Sabará / Instituto de Pesquisa e Ensino - Pensi, Pediatria - São Paulo, SP, Brasil
Endereço para correspondência:
Débora Mutti de Almeida Monteiro
E-mail: dmutti@outlook.com.br
Submetido em: 25/03/2021
Aceito em: 09/05/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: As reações cutâneas graves a medicamentos (RCGM) compreendem um grupo de doenças caracterizadas por hipersensibilidade tardia a um ou vários tipos de fármacos. Por ser uma doença potencialmente fatal, o diagnóstico precoce, bem como o início do tratamento, são de suma importância.
OBJETIVO: Analisar a evolução das RCGM em pacientes pediátricos acompanhados em dois hospitais da cidade de São Paulo, SP.
MÉTODO: Trata-se de um estudo retrospectivo baseado na análise de prontuários de pacientes atendidos no período de 2002 a 2018 em dois hospitais da capital paulista.
RESULTADOS: Não houve diferença entre os sexos, prevaleceu a faixa etária dos adolescentes, e os medicamentos mais implicados com o desenvolvimento das lesões cutâneas foram os anticonvulsivantes, sendo os principais a carbamazepina e fenitoína, sem diferença entre eles, seguidos dos antibióticos betalactâmicos. No tratamento, todos os pacientes fizeram uso de corticoides sistêmicos e anti-histamínicos, sendo que oito pacientes também receberam imunoglobulina intravenosa e um recebeu ciclosporina. A taxa de mortalidade foi baixa e, em relação às complicações e sequelas, a autoimunidade foi a mais encontrada.
CONCLUSÃO: Os casos de RCGM são eventos raros na faixa etária pediátrica, todavia de alta morbimortalidade e risco de sequelas. O diagnóstico e tratamento precoces contribuem para um melhor prognóstico, sendo de suma importância a identificação da medicação associada, bem como a retirada da mesma.
Descritores: Síndrome de Stevens-Johnson, síndrome de hipersensibilidade a medicamentos, pustulose exantematosa aguda generalizada.
INTRODUÇÃO
As reações cutâneas graves a medicamentos (RCGM) compreendem um grupo de doenças caracterizadas por hipersensibilidade sistêmica a um ou vários tipos de fármacos. A incidência é de 1:1.000.000 da população e se caracterizam como importantes causas de hospitalizações. Estudos mostram que 6,5% dos pacientes internados apresentam quadros de reações cutâneas a drogas, podendo resultar em óbito1-3.
O grupo de RCGM inclui a reação à droga com eosinofilia e sintomas sistêmicos (DRESS), síndrome de Stevens Johnson (SSJ), necrólise epidérmica tóxica (NET) e pustulose exantemática generalizada aguda (PEGA). A maior dificuldade no diagnóstico destas doenças é a diferenciação na fase inicial entre erupções maculopapulares ou morbiliformes e erupções virais que são observadas com muita frequência nessa faixa etária3,4. A síndrome DRESS é uma reação adversa rara a medicamentos com características sistêmicas de erupção cutânea, anormalidades hematológicas como eosinofilia, linfadenopatia e envolvimento de órgãos como fígado, rins e pulmão1; o SSJ/NET são farmacodermias bolhosas com destacamento cutâneo (< 10% = SSJ; entre 10 e 30% sobreposição e > 30% NET)5; e a PEGA é uma doença com pústulas estéreis, acompanhados por febre e leucocitose6.
O diagnóstico precoce, bem como o início rápido do tratamento, é de suma importância, por serem doenças potencialmente fatais. Fatores de risco, comorbidades e diagnóstico diferencial dependem da idade do indivíduo afetado. Por exemplo, infecções virais e bacterianas com exantemas, importantes diagnósticos diferenciais para hipersensibilidade a medicamentos, são muito mais comuns em crianças pequenas.Tradicionalmente, os mesmos algoritmos e técnicas de diagnóstico são utilizados para crianças e adultos, assumindo que os princípios gerais aplicados a adultos também sejam aplicáveis em crianças7.
Um dos principais pontos do tratamento consiste em retirar o medicamento suspeito e indicar a terapêutica específica, que varia de acordo com o tipo de reação e sua gravidade8. Todavia, em crianças, pelo fato de a escolha de medicamentos alternativos ser mais limitada, devido às restrições de prescrição, a retirada do medicamento causador da reação cutânea pode trazer consequências de considerável gravidade7.
As opções terapêuticas incluem anti-histamínicos, corticosteroides sistêmicos, imunoglobulina intravenosa, plasmaferese e agentes imunossupressores, bem como cuidados adequados com a pele e as mucosas, juntamente com o suporte à vida, e em alguns casos, é necessária a transferência para a unidade de terapia intensiva pediátrica9.
OBJETIVO
Analisar as características das RCGM quanto ao diagnóstico, complicações, sequelas e mortalidade em pacientes pediátricos, acompanhados em dois hospitais da cidade de São Paulo, SP.
Casuística e métodos
Foi realizado um estudo observacional, descritivo, retrospectivo, por meio de análise de prontuários eletrônicos e banco de dados dos pacientes. Foram incluídos no estudo pacientes de 0 a 18 anos incompletos, com diagnóstico definido de RCGM, atendidos no período entre 2002 a 2018 em dois hospitais da cidade de São Paulo/SP, sendo eles o Hospital do Servidor Público Estadual de São Paulo - Francisco Morato de Oliveira, e o Hospital Infantil Sabará/ Instituto de Pesquisa e Ensino - Pensi.
Os dados foram analisados por meio de estatística descritiva, sendo apresentadas as frequências absoluta e relativa de cada variável coletada, e os casos foram classificados de acordo com os critérios para classificação das RCGM. As variáveis coletadas foram o tipo de reação cutânea grave a medicamento, a droga implicada e/ou etiologia, a idade acometida, o tempo de acompanhamento, as comorbidades, o tratamento utilizado, as complicações/sequelas, e a possível evolução para óbito.
Este trabalho foi submetido à avaliação do Comitê Ética em Pesquisa do Hospital do Servidor Público Estadual, SP, segundo protocolo número 25599419.8.1001.5463, tendo sido aprovado de acordo com o parecer consubstanciado número 3.773.584 de 16 de dezembro de 2019. Como os dados para confecção da pesquisa foram obtidos de prontuários, e o anonimato dos participantes foi preservado, não foi necessária assinatura de Termo de Consentimento Livre e Esclarecido.
RESULTADOS
Nesta série de casos, avaliamos 16 pacientes com RCGM de 0 a 18 anos incompletos e não encontramos diferença estatisticamente significante entre os sexos. O pequeno tamanho da amostra e a reduzida frequência das ocorrências impediu a realização de testes comparativos. A faixa etária que abrangeu a maioria dos casos foi a dos adolescentes, com 6 (37,5%) dos casos, seguida de 5 lactentes (31,3%), 3 escolares (18,8%) e 2 pré-escolares (12,5%), apresentando mediana de idade 5 e com desvio padrão 6,47 (Figura 1).
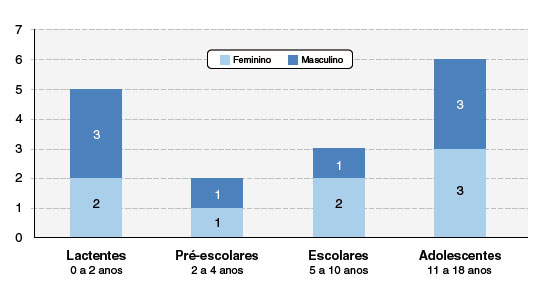
Figura 1
Distribuição dos pacientes de acordo com sexo e faixa etária
Fonte: dados coletados pelos autores.
Classificando as RCGM, foram encontradas 9 com diagnóstico de SSJ (56,2%), 4 de NET (25%), 2 de DRESS (12,5%) e 1 de PEGA (6,3%) (Figura 2).
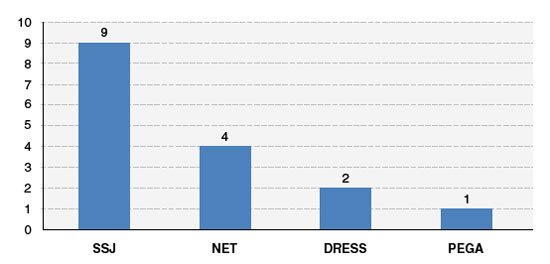
Figura 2
Diagnósticos de reações cutâneas graves a medicamentos (RCGM)
SSJ = síndrome de Stevens Johnson, NET = necrólise epidérmica tóxica, DRESS = reação à droga com eosinofilia e sintomas sistêmicos, PEGA = pustulose exantemática generalizada aguda.
Fonte: dados coletados pelos autores.
Em relação aos fármacos mais implicados foram identificados os anticonvulsivantes (6 casos), antibióticos associados a anti-inflamatório (4 casos), antibióticos isoladamente (3 casos), e dipirona (1 caso). Dos anticonvulsivantes, os mais frequentes foram carbamazepina e fenitoína, sem diferença entre os mesmos, e dos antibióticos foram os betalactâmicos. Em 2 casos a etiologia da síndrome foi associada à infecção por Mycoplasma pneumoniae (Figura 3).
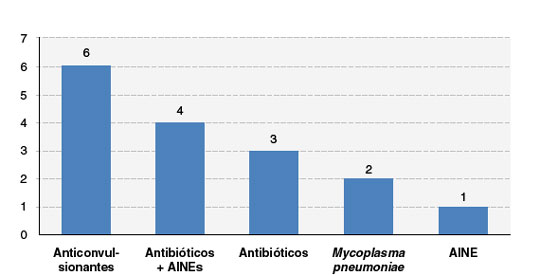
Figura 3
Medicamentos implicados na etiologia das reações graves
AINE = anti-inflamatório não esteroide.
Fonte: dados coletados pelos autores.
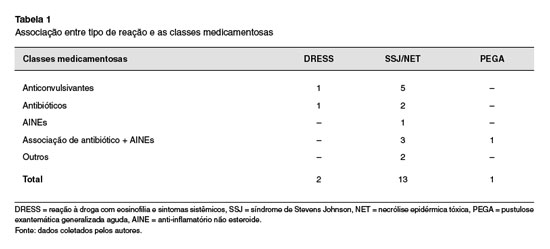
Sobre a associação entre o tipo de reação e as classes medicamentosas, observamos que no diagnóstico de SSJ/NET, a principal classe medicamentosa envolvida foi a dos anticonvulsivantes (Tabela 1).
Adolescentes
Nos prontuários analisados, as comorbidades encontradas foram: 7 pacientes apresentavam crises convulsivas, 4 com infecções de vias aéreas superiores, 3 com pneumonias, 1 com amigdalite e 1 com abscesso. Estes pacientes tinham como doença de base: síndrome de Down, síndrome de West, autismo associado à epilepsia e frutosemia, um paciente para cada doença apresentada.
O tempo médio de permanência hospitalar na fase aguda da reação foi de 16 dias. Quanto ao tratamento, todos fizeram uso corticoides sistêmicos e anti-histamínicos, 8 (50%) fizeram uso de imunoglobulina intravenosa (IGIV), e 1 (6,5%) de ciclosporina (Figura 4). Os pacientes foram orientados a excluir os medicamentos implicados na reação e, no seguimento ambulatorial após a alta, não observamos recidiva do quadro ou outras reações a medicamentos.
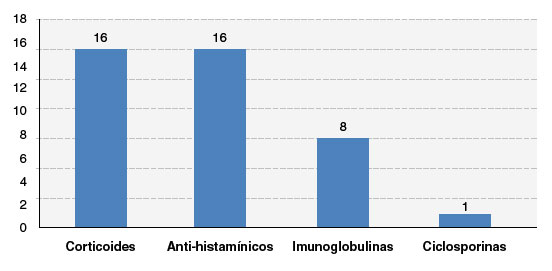
Figura 4
Distribuição dos pacientes de acordo com o tratamento utilizado nas reações graves
Fonte: dados coletados pelos autores.
Dos pacientes incluídos nesta série de casos, 2 (12,5%) foram a óbito, sendo 1 na fase aguda da NET e outro em consequências da doença de base (tumor cerebral). Quanto às complicações e sequelas observadas na evolução dos pacientes, encontramos 2 casos (12,5%) de autoimunidade (vitiligo e doença de Behçet), 1 (6,3%) de triquíase, 1 (6,3%) de hepatite C pós-transfusional, e 1 (6,3%) de imunossupressão (associado a ciclosporina) (Figura 5).
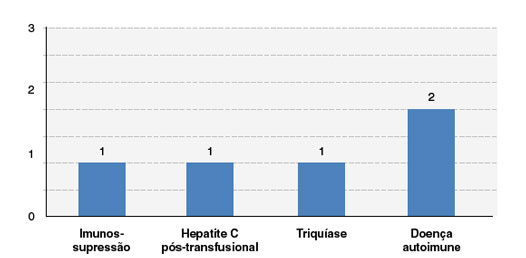
Figura 5
Complicações e sequelas observadas na evolução dos casos de reações cutâneas graves a medicamentos (RCGM)
Fonte: dados coletados pelos autores.
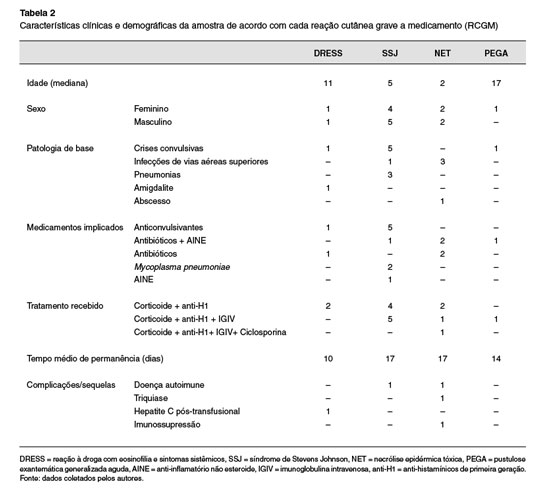
As características clínicas e demográficas encontradas neste trabalho de acordo com cada RCGM estão descritas na Tabela 2.
DISCUSSÃO
No presente estudo, a maior parte dos casos de RCGM ocorreu em adolescentes, sem distinção entre os sexos masculino e feminino. Este resultado pode ser explicado pelas observações realizadas por Lewis e cols.10, que em um estudo realizado com 3.182 adolescentes em idade escolar, observaram que o uso indevido de medicamentos nessa faixa etária é mais difundido do que se imagina, com um nível notavelmente alto especialmente entre os adolescentes mais familiarizados com os medicamentos, o que per se pode aumentar o número de casos de reações adversas. A despeito do fato de que as reações identificadas em nosso trabalho tenham se originado após o uso de medicamentos sob prescrição médica, vale ressaltar o fato de que este uso é bastante difundido entre os adolescentes,
Características clínicas e demográficas da amostra de acordo com cada reação cutânea grave a medicamento (RCGM) justificando a elevada ocorrência de RCGM nessa faixa etária, em nossa amostra. Porém, sabe-se que existem alguns grupos de indivíduos que apresentam maior chance de desenvolver RCGM, como pacientes epilépticos11. Quanto às crianças, vale ressaltar que, quando questionados, cerca de 10% dos pais relatam suspeita de hipersensibilidade a pelo menos um medicamento em seus filhos. No entanto, apenas algumas dessas reações podem ser confirmadas como alérgicas após uma análise diagnóstica, sugerindo que ainda falta conhecimento sobre a epidemiologia de hipersensibilidade a medicamentos, espectro clínico e métodos de diagnóstico apropriados, particularmente em crianças7.
Observamos que a SSJ foi a RCGM mais frequente, atingindo mais da metade da amostra avaliada. Segundo Hsu e cols.12, que avaliaram a incidência de SSJ no período de 2009 a 2012 nos EUA, erupções bolhosas complexas, características da SSJ são reações adversas graves a medicamentos. Sua incidência atinge algo entre 4,3 a 5,8 crianças em 1 milhão, representando um ônus substancial para os serviços de saúde.
Em nossa amostra, as crises convulsivas se constituíram na comorbidade mais comumente identificada, e os fármacos que mais se associaram aos episódios de RCGM foram os anticonvulsivantes, coincidindo com o estudo de Darjani e cols.13, que avaliaram os efeitos das drogas anticonvulsivantes no desenvolvimento de reações cutâneas adversas graves, por meio de um estudo longitudinal envolvendo 440 pacientes admitidos em um Serviço de Dermatologia e encontraram os anticonvulsivantes como causa mais comum de RCGM. Este grupo medicamentoso esteve associado ao desenvolvimento de SSJ e também da necrólise epidérmica tóxica (NET) e reação medicamentosa com eosinofilia de acometimento sistêmico (DRESS)13.
Notou-se nesta pesquisa que o tempo médio de duração da fase aguda da doença foi em torno de duas semanas. Para Dibek e cols.14, o tempo médio de manutenção dos sintomas após o uso do medicamento foi de aproximadamente 22 dias, embora este período varie bastante de acordo com o agente etiológico. Ainda para os autores, que relataram em seu estudo um tempo médio de duração da fase aguda de 11 dias, muito semelhante ao que foi observado por nós, os sintomas podem ocorrer mais rapidamente, e podem ser mais graves em exposições subsequentes14.
O rápido reconhecimento dos quadros de reações a medicamentos tem especial importância na evolução dos pacientes. Brockow e Pfützner15 recomendam que é necessário adotar medidas aprimoradas que busquem diagnosticar com assertividade especialmente as reações adversas cutâneas graves, identificando o medicamento agressor e detectando indivíduos em risco.
Todos os pacientes receberam corticoides sistêmicos e anti-histamínicos como terapia de base na fase aguda, sendo que a metade da nossa amostra recebeu imunoglobulina endovenosa associada. Ensina e cols.2 afirmam que para o tratamento das reações medicamentosas graves deve ser preconizada a suspensão do medicamento suspeito e realizado o uso de corticosteroides sistêmicos, anti-histamínicos, e dependendo dos casos de modo ainda controverso, o uso de imunossupressores e imunoglobulina intravenosa.
Segundo Dibek e cols.14, embora não exista consenso entre os pesquisadores, a principal estratégia de tratamento nos casos de RCGM é a descontinuação imediata do medicamento suspeito, seguido da administração de corticoides sistêmicos16.
Outras modalidades de tratamento, como a imunoglobulina intravenosa, plasmaferese, o uso de ciclofosfamida e ciclosporina também são sugeridas como eficazes no tratamento das reações adversas graves. Ressalta-se que a estratégia de tratamento deve ser modulada de acordo com a gravidade do comprometimento sistêmico observada em cada paciente14. Dentre as alternativas terapêuticas para estas síndromes, destaque deve ser dado ao uso da imunoglobulina intravenosa (IVIg), além de outros imunossupressores, como a ciclosporina17. No entanto, embora o uso da IVIg tenha reduzido a taxa de mortalidade dos pacientes, não foram observados efeitos mensuráveis na progressão do descolamento ou na velocidade de reconstituição da epiderme. Ainda, não se apoia o uso rotineiro do tratamento com IVIg para pacientes com SSJ ou NET, principalmente em casos de insuficiência renal18.
Nos casos indicados, ressalta-se que o uso da IVIg deve ser precoce19, a fim de evitar o destacamento cutâneo, e que o SCORe of Toxic Epidermal Necrosis (SCORTEN) deve ser utilizado para parametrizar os resultados20. Quanto ao mecanismo de ação da imunoglobulina, sabe-se que esta atua por meio de um bloqueio FAS-FASligante21, evitando assim a apoptose de queratinócitos.
Neste estudo, apenas um paciente (6,3%) veio a óbito por complicações ocorridas na fase aguda da doença, classificada como NET. Este resultado é semelhante ao observado por Dibek e cols.14, que também computaram apenas uma morte em seu estudo longitudinal, todavia incluindo uma amostra bem maior do que a observado em nosso estudo. A despeito da reduzida mortalidade observada em nosso estudo, taxas entre 10% e 34% já foram reportadas22. Os preditores de mortalidade incluem idade avançada, doenças crônicas associadas, quadros de infecção (especialmente septicemia, pneumonia e tuberculose), malignidade hematológica (com destaque para linfomas não-Hodgkin e leucemia), e insuficiência renal22. Quanto à taxa de mortalidade no Brasil, não existem estudos epidemiológicos controlados que permitam estimá-la, mas apenas relatos de casos isolados. Nesse sentido, novos estudos são necessários para que se possa conhecer a mortalidade associada às RGCM em nosso país.
Deve-se sempre considerar que, embora os casos de reações cutâneas graves a medicamento em crianças não sejam tão comuns, eles são potencialmente graves. Dessa forma, chama-se a atenção mais uma vez para a necessidade de um diagnóstico precoce e tratamento adequado visando reduzir a incidência de morbidade e mortalidade.
Dentre as complicações e sequelas, o vitiligo e doença de Behçet foram as mais incidentes, embora tendo atingido apenas pouco mais de 10% da amostra. A literatura reporta associação entre as reações cutâneas graves a medicamentos e algumas doenças autoimunes, como por exemplo, o lúpus eritematoso sistêmico23, o vitiligo24 e a doença de Behçet25. É fato conhecido que erupções cutâneas medicamentosas são mediadas por mecanismos imunológicos, sugerindo existir uma memória imunológica específica envolvida neste fenômeno, ao invés de toxicidade direta causada pela própria droga. A maioria das erupções medicamentosas parece resultar de hipersensibilidade tardia mediada por células T, e a ativação secundária de diferentes cascatas de citocinas pode contribuir para a heterogeneidade das apresentações clínicas26.
CONCLUSÃO
Neste estudo, verificou-se que não houve diferença entre os sexos, prevaleceu a faixa etária dos adolescentes, e os medicamentos mais implicados com o desenvolvimento das lesões cutâneas foram os anticonvulsivantes, sendo os principais a carbamazepina e fenitoína, sem diferença entre eles, seguidos dos antibióticos betalactâmicos.
No tratamento, todos os pacientes fizeram uso de corticoides sistêmicos e anti-histamínicos, sendo associados à imunoglobulina endovenosa em oito, e à ciclosporina em um paciente. A taxa de mortalidade foi baixa, e em relação às complicações e sequelas, a autoimunidade foi a mais incidente. Os pacientes mantiveram seguimento ambulatorial após a alta, e não observamos recidiva do quadro ou outras reações a medicamentos.
Por ser tratar de uma doença grave, com quadro clínico inicial muitas vezes semelhantes às doenças exantemáticas virais da infância, este estudo tem como importância ressaltar as principais características clínicas encontradas nos pacientes pediátricos com diagnósticos de RCGM, suas principais drogas implicadas, bem como o tratamento e sua evolução visando aumentar o conhecimento sobre este assunto nessa faixa etária, uma vez que artigos nessa população são escassos. Em relação às limitações deste estudo, destaca-se o reduzido tamanho da amostra. Entretanto, pode-se afirmar que os casos de RCGM são eventos raros na faixa etária pediátrica, todavia de alta morbimortalidade e risco de sequelas. O diagnóstico e tratamento precoces contribuem para um melhor prognóstico, sendo de suma importância a identificação da medicação associada, bem como a retirada da mesma.
REFERÊNCIAS
1. Cacoub P, Musette P, Descamps V, Meyer O, Speirs C, Finzi L, et al. The DRESS Syndrome: A literature review. Am J Med. 2011;124(7):588-97.
2. Ensina LF, Fernandes FR, Malaman MF, Chavarria ML, Bernd LAG. Reações de hipersensibilidade a medicamentos. Rev bras alerg imunopatol. 2009;32(2):42-7.
3. Schnyder B. Approach to the Patient with Drug Allergy. Immunol Allergy Clin North Am. 2009;29(3):405-18.
4. Fernandes FR, Taguchi MR, Cabral JEB, Ayres SS, Pimentel D, Sá LC, et al. Toxic epidermal necrolysis in newborn period: case report. Allergol Immunopathol (Madr). 2011;39(4):240-1.
5. Hsu DY, Brieva J, Silverberg NB, Paller AS, Silverberg JI. Pediatric Stevens-Johnson syndrome and toxic epidermal necrolysis in the United States. J Am Acad Dermatol. 2017;76(5):811-817.e4.
6. Halevy S. Acute Generalized Exanthematous Pustulosis. In: Shear NH, Dodiuk-Gad RP, orgs. Advances in Diagnosis and Management of Cutaneous Adverse Drug Reactions: Current and Future Trends [Internet]. Singapore: Springer; 2019 [citado 2 de janeiro de 2020]. p. 105-22. Disponível em: https://doi.org/10.1007/978-981-13-1489- 6_8
7. Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca-Lopez N, et al. Drug hypersensitivity in children: report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016;71(2):149-61.
8. Noguera-Morel L, Hernández-Martín Á, Torrelo A. Cutaneous Drug Reactions in the Pediatric Population. Pediatr Clin. 2014;61(2):403-26.
9. Sassolas B, Haddad C, Mockenhaupt M, Dunant A, Liss Y, Bork K, et al. ALDEN, an Algorithm for Assessment of Drug Causality in Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: Comparison With Case-Control Analysis. Clin Pharmacol Ther. 2010;88(1):60-8.
10. Lewis AL, Klintworth EM, Hinton JO, Gray KM. Adolescent Medication Misuse: Results from the MUSC Inventory of Medication Experiences (MIME). Adolesc Psychiatry Hilversum Neth. 2013;3(2):184-9.
11. Man CB, Kwan P, Baum L, Yu E, Lau KM, Cheng AS, et al. Association between HLA-B* 1502 allele and antiepileptic drug-induced cutaneous reactions in Han Chinese. Epilepsia. 2007;48(5):1015-8.
12. Hsu AP, Fleisher TA, Niemela JE. Mutation analysis in primary immunodeficiency diseases: case studies. Curr Opin Allergy Clin Immunol. 2009;9(6):517-24.
13. Darjani A, Alizadeh N, Abdi H, Hosseini M, Zaresharifi S. Anticonvulsant Drugs and Severe Adverse Cutaneous Drug Reactions: A Longitudinal Observational Study. Casp J Neurol Sci. 2019;5(3):127-32.
14. Dibek Misirlioglu E, Guvenir H, Bahceci S, Haktanir Abul M, Can D, Usta Guc BE, et al. Severe Cutaneous Adverse Drug Reactions in Pediatric Patients: A Multicenter Study. J Allergy Clin Immunol Pract. 2017;5(3):757-63.
15. Brockow K, Pfützner W. Cutaneous drug hypersensitivity: developments and controversies. Curr Opin Allergy Clin Immunol. 2019;19(4):308.
16. Zimmermann S, Sekula P, Venhoff M, Motschall E, Knaus J, Schumacher M, et al. Systemic immunomodulating therapies for Stevens-Johnson syndrome and toxic epidermal necrolysis: a systematic review and meta-analysis. JAMA Dermatol. 2017;153(6):514-22.
17. Marulli AHCGCM, Carrozzo M, Chimenti MS. High-dose Intravenous lmmunoglobulin for Severe Drug Reactions: Efficacy in Toxic Epidermal Necrolysis. Acta Derm Venereol. 2003;83:430-2.
18. Bachot N, Revuz J, Roujeau J-C. Intravenous immunoglobulin treatment for Stevens-Johnson syndrome and toxic epidermal necrolysis: a prospective noncomparative study showing no benefit on mortality or progression. Arch Dermatol. 2003;139(1):33-6.
19. Marcus N, Smuel K, Almog M, Prais D, Straussberg R, Landau D, et al. Successful intravenous immunoglobulin treatment in pediatric severe DRESS syndrome. J Allergy Clin Immunol Pract. 2018;6(4):1238-42.
20. Sorrell J, Anthony L, Rademaker A, Belknap SM, Callahan S, West DP, et al. Score of toxic epidermal necrosis predicts the outcomes of pediatric epidermal necrolysis. Pediatr Dermatol. 2017;34(4):433-7.
21. Wang R, Zhong S, Tu P, Li R, Wang M. Rapid remission of Stevens- Johnson syndrome by combination therapy using etanercept and intravenous immunoglobulin and a review of the literature. Dermatol Ther. 2019;e12832.
22. Hsu DY, Brieva J, Silverberg NB, Silverberg JI. Morbidity and Mortality of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis in United States Adults. J Invest Dermatol. 2016;136(7):1387-97.
23. Clement K, Nalini N. Case Report on a Rare Adverse Drug Reaction of Cefotaxime Induced Subacute Cutaneous Lupus Erythematosus. J Young Pharm. 2019;11(1):108.
24. Lian BS, Busmanis I, Lee HY. Relapsing Course of Sulfasalazine- Induced Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS) Complicated by Alopecia Universalis and Vitiligo. Ann Acad Med Singapore. 2018;47(11):492-3.
25. Lee CH, Jang SJ, Oh SR, Kim HJ, Lee MS. A Case of Fatal DRESS Syndrome Caused by Dapsone in a Patient with Behcet's Syndrome. J Korean Rheum Assoc. 2009;16(3):253-7. 26. Roujeau J-C. Immune Mechanisms in Drug Allergy. Allergol Int. 2006;55(1):27-33.