Número Atual: Abril-Junho 2021 - Volume 5 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Esofagite eosinofílica: uma revisão narrativa
Eosinophilic esophagitis: a narrative review
Letícia Dall'Agnol1; Phelipe dos Santos Souza2; Claudia Bernhardt2; Fangio Ferrari3
DOI: 10.5935/2526-5393.20210023
1. Universidade do Vale do Itajaí, Medicina - Itajaí, SC, Brasil
2 Universidade do Vale do Itajaí, Alergia e Imunologia - Itajaí, SC, Brasil
3. Universidade do Vale do Itajaí, Gastroenterologia - Itajaí, SC, Brasil
Endereço para correspondência:
Letícia Dall'Agnol
E-mail: leticiadallagnol2@gmail.com
Submetido em: 10/03/2021
Aceito em: 30/03/2021
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A esofagite eosinofílica (EoE) é uma doença inflamatória, crônica e recidivante do esôfago, caracterizada por inflamação com predomínio de eosinófilos e sintomas de disfunção esofágica. A doença, que representa a principal causa de disfagia crônica em crianças, jovens e adultos, compartilha intrínseca correlação com alergias, tanto em sua fisiopatologia, quanto em dados epidemiológicos e, recentemente, foi considerada uma manifestação tardia da marcha atópica em alguns indivíduos. O presente trabalho objetiva ampliar o conhecimento acerca da doença, visto que a EoE é uma patologia relativamente nova na história da medicina, e seu diagnóstico depende de elevada suspeição clínica. Além disso, por ser uma entidade com elevado potencial de causar impacto na qualidade de vida e repercussões fisiológicas, psicológicas e sociais para os pacientes, a suspeição e reconhecimento precoce da doença é essencial para que se institua a terapêutica adequada e obtenha-se controle sobre a progressão da doença.
Descritores: Esofagite eosinofílica, gastroenterologia, hipersensibilidade.
INTRODUÇÃO
A esofagite eosinofílica (EoE), que constitui a principal causa de disfagia crônica em jovens e adultos1, é uma doença inflamatória do esôfago, desencadeada devido a resposta imunológica anômala frente ao contato com antígenos em indivíduos geneticamente predispostos2. A doença apresenta importante associação com alergias, sendo recentemente reconhecida como manifestação tardia da marcha atópica3.
No manejo da EoE, existem funções importantes para diversos profissionais de saúde, que incluem médicos generalistas, alergistas, gastroenterologistas, patologistas, nutricionistas, psicólogos e outros. A possibilidade de gestão compartilhada da EoE justifica-se devido ao órgão acometido, fisiopatologia da doença e repercussão psicossocial e fisiológica nos pacientes4.
Epidemiologia
A EoE tem distribuição global, sendo mais comum em regiões frias, áridas e em zonas rurais5. A doença acomete predominantemente homens (3:1), na faixa etária de 30 a 40 anos e, embora tenha sido observada em diferentes etnias, é mais prevalente na raça branca6.
A prevalência da EoE, segundo estudos com base populacional adulta e pediátrica, varia de 10 a 57/100.000 pessoas, e sua incidência, que se encontra em ascensão, é atualmente estimada em 10/100.000 casos por ano7. Estudos revelam um aumento na incidência da doença de 40% entre os anos de 2000 a 20038, e embora seja tentador atribuir esse aumento à ampliação do conhecimento sobre a EoE e desenvolvimento de métodos diagnósticos, esta não é a única explicação. Estudos comprovam que a incidência de EoE supera o aumento modesto das taxas de biópsias9.
Manifestações clínicas
As manifestações clínicas da EoE variam de acordo com a idade do paciente. Na população pediátrica, a recusa alimentar, dor abdominal, náuseas e vômitos são sintomas frequentes, estando, por vezes, associados à má progressão pôndero-estatural. No adulto, os sintomas predominantes são a disfagia, sensação de impacto alimentar e pirose10.
Fisiopatologia
A EoE, assim como outras doenças alérgicas, inicia com a ingestão ou inalação de antígenos, que em contato com descontinuidades do epitélio esofágico, devido a defeitos em desmossomos e junções intracelulares, são apresentados para células T, iniciando o processo fisiopatológico da doença11.
Após o contato com antígenos, as células T, transformam-se em células TH-2, que secretam citocinas como IL-4, IL-5 e IL-13, além de eotaxina-3 e anticorpos do tipo IgE. Estes produtos promovem a perpetuação do processo inflamatório, uma vez que não só contribuem para a descontinuidade da barreira epitelial e subsequente entrada de antígenos, como também atuam no recrutamento, maturação e ativação de células efetoras como os eosinófilos12.
Os eosinófilos recrutados para o local da inflamação liberam um fator de crescimento denominado TGF-B, que apresenta papel central na fisiopatologia da doença, uma vez que ativa a produção de colágeno, contribuindo para fibrose e sintomas de dismotilidade esofágica13.
Antígenos alimentares e aeroalérgenos
Quanto à prevalência dos antígenos alimentares na fisiopatologia da doença, parece haver correlação com a região geográfica e a idade dos pacientes, dado que nos Estados Unidos, leite, ovo e trigo são os antígenos mais comuns em crianças, enquanto nos adultos predominam apenas o leite e o trigo. Já a soja é um antígeno mais frequente na Espanha do que nos Estados Unidos. Todavia, como consenso, pesquisas destacam o leite como o alérgeno mais comum, em cerca de 2/3 dos pacientes, seguido de ovos e trigo em 1/4 dos pacientes, porém a doença também pode ser causada por muitos outros alimentos. Trinta a cinquenta por cento dos pacientes apresentam apenas 1 alimento causador da doença, 30% apresentam 2 alimentos, e os 30% restantes apresentam 3 ou mais alimentos envolvidos na etiologia da EoE11.
Tem sido sugerida a participação de aeroalérgenos na doença, dado que o diagnóstico de EoE parece aumentar durante a primavera e verão, que são temporadas de pólen11. Testes em animais foram os primeiros a documentar a relação imunológica entre vias aéreas e o esôfago com o início experimental de EoE após a inalação de antígenos provenientes de ácaros, Aspergillus fumigatus e baratas. A inalação de antígenos alimentares, como amendoim, também pode levar à eosinofilia esofágica13.Tal processo parece correlacionar-se com a proximidade existente entre as cadeias de linfonodos da traqueia e do esôfago14,15.
Genética e EoE
A genética funciona ao menos como parte do processo fisiopatológico da doença, posto que 10% dos pais dos pacientes com EoE apresentam estenose esofágica e 8% evidências histológicas da doença8. Além disso, a concordância em gêmeos monozigóticos chega a 58%16.
Diversos genes parecem favorecer o desenvolvimento da doença, e dentre eles encontra-se o CCL26, que codifica a eotaxina-3, uma proteína quimiotática de eosinófilos cuja expressão encontra-se aumentada nos doentes com EoE, ampliando o recrutamento local de eosinófilos17.
Alergias e EoE
Indivíduos atópicos apresentam maior predisposição para desenvolver a EoE, visto que 40-80% dos pacientes apresentam história pessoal, e 60% história familiar de atopia18.
Ainda, com base nas taxas de resolução clínica e histológica da doença em pacientes tratados com orientações dietéticas (90% com uso de fórmula de aminoácidos e cerca de 80% com dietas empíricas ou guiada por testes alérgicos), percebe-se que a maior parte dos casos ocorre devido à sensibilização a alérgenos alimentares19.
Evidenciando a intima correlação entre atopias e EoE, uma revisão sistemática com 53.592 pacientes adultos e pediátricos mostra que a rinite alérgica foi consideravelmente mais frequente entre os pacientes com EoE comparado ao grupo controle (OR 5,58; IC 95% 3,27-9,53), assim como asma (OR 3,06; IC 95% 2,01 a 4,66) e eczema (OR 2,86; IC 95% 1,88-4,36)20.
A marcha atópica é a história natural de manifestações alérgicas que se desenvolvem a partir da infância e, classicamente, inicia com dermatite atópica, progredindo para alergia alimentar mediada por IgE, asma e rinite alérgica21.
Algumas das evidências que sugerem que a EoE seja membro da marcha atópica são: fisiopatologia caracterizada por inflamação alérgica22, maior prevalência em indivíduos atópicos23, compartilhamento de genes de susceptibilidade com todos os outros membros da marcha atópica24 e associações feitas entre antígenos alimentares e aeroalérgenos com a exacerbação da EoE25.
Segundo um estudo realizado por Hill e cols., na presença de dermatite atópica, alergia alimentar IgE-mediada e asma, a taxa de diagnóstico de EoE foi aumentada, sendo a alergia alimentar a manifestação com efeito mais evidente. Além disso, o estudo demonstrou que o diagnóstico de EoE foi maior em indivíduos com mais de uma reação alérgica, evidenciando um efeito cumulativo de múltiplas condições alérgicas no diagnóstico de EoE26.
Como a presença de uma ou mais manifestações da marcha atópica mostrou-se cumulativamente associada com o subsequente desenvolvimento de EoE, a doença passou a ser considerada uma manifestação tardia da marcha atópica em alguns indivíduos2.
Diagnóstico
Os critérios diagnósticos para EoE sofreram diversas modificações nos últimos anos. Conforme consta no guideline publicado em 2020 pela Associação Americana de Gastroenterologia, em conjunto com equipe de Força-tarefa em Alergia e Imunologia27, bem como o consenso de atualização dos critérios diagnósticos publicado em 201828, tanto a triagem inicial com IBPs, quanto o conceito de eosinofilia esofágica responsiva ao IBP como uma entidade distinta da EoE foram excluídos dos critérios diagnósticos da doença.
Atualmente os critérios diagnósticos para EoE são: sintomas de disfunção esofágica, presença de 15 ou mais eosinófilos intraepiteliais por campo de grande aumento (CGA) e exclusão de outras causas de eosinofilia esofágica, como a doença do refluxo gastroesofágico, acalasia, infecções, doenças do tecido conjuntivo, hipersensibilidade a drogas e síndrome hipereosinofílica4.
Avaliação endoscópica da EoE
A endoscopia digestiva alta (EDA) é importante para o diagnóstico e acompanhamento dos pacientes com EoE, pois permite não só a visualização de alterações macroscópicas compatíveis com a doença, como também a obtenção de biópsias destinadas a análise histológica. A fim de aumentar a acurácia diagnóstica, recomenda-se a coleta de ao menos 4 fragmentos de biópsias do esôfago médio-proximal e distal29.
Os achados endoscópicos comumente encontrados na doença, classificados pela Escala de Referência Endoscópica para a EoE (EREFS), são: edema, friabilidade da mucosa (mucosa tipo "papel crepom"), estrias esbranquiçadas longitudinais, pontos de exsudato, anéis circulares fixos ou transitórios que conferem ao esôfago o aspecto de traquealização, e estenose esofágica. Todavia, vale ressaltar que 17 a 30% dos pacientes apresentam EDA sem alterações30.
Ainda, por meio da avaliação endoscópica pode-se classificar a EoE em dois fenótipos distintos (inflamatório ou fibroestenótico), conforme demonstrado na Tabela 1.
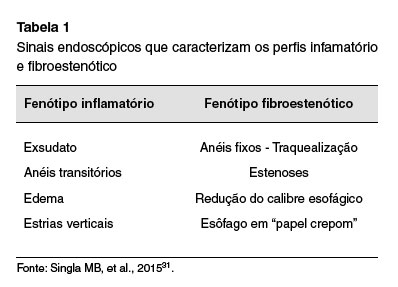
Um trabalho que analisou a prevalência dos dois fenótipos ao longo dos anos demonstrou que antes dos anos 2000, toda a amostra analisada tinha o diagnóstico de EoE fibroestenótica. Após as diretrizes de 2007, o perfil inflamatório tornou-se o predominante e apenas um terço dos pacientes passaram a apresentar o perfil fibroestenótico ao diagnóstico. O diâmetro esofágico médio antes e após as primeiras diretrizes também apresentou modificação, passando de 10 mm para 14 mm. Essas informações refletem os resultados da campanha para diagnóstico e terapêutica precoces da doença, visando interromper as sequelas crônicas de fibrose32.
Avaliação histológica da EoE
Os achados histológicos presentes na maioria dos pacientes com EoE, embora não sejam patognomônicos e exclusivos da doença, são: densidade de eosinófilos ≥ 15 eosinófilos intraepiteliais por campo de grande aumento (CGA), distribuição intraepitelial difusa de eosinófilos, microabscessos eosinofílicos, hiperplasia da membrana basal, degranulação de eosinófilos e fibrose da lâmina própria33.
O achado considerado diagnóstico para EoE é a contagem de eosinófilos por CGA ≥ 15 em uma ou mais amostras, sendo recomendada a coleta de fragmentos do esôfago proximal, médio e distal para aumentar a acurácia diagnóstica. Além disso, pelo menos uma avaliação das mucosas de estômago e duodeno deve ser realizada para afastar a doença eosinofílica gastroduodenal29.
Aplicabilidade de outros exames
A eficácia dos testes de alergias na identificação de gatilhos para a EoE é controversa e permanece em estudo, pois, embora sejam úteis na identificação de reações de hipersensibilidade, não refletem fidedignamente a correlação com a EoE. Existem três principais testes utilizados atualmente: o teste cutâneo por punctura, teste de contato e dosagem de IgE. Todavia, nenhuma das modalidades foi adotada como escolha no contexto da EoE34.
Os testes cutâneos por punctura (TCP) com leitura imediata avaliam a resposta mediada por IgE e são os testes que apresentam a maior sensibilidade na identificação dos antígenos possivelmente envolvidos na etiologia da doença. Os alimentos que aparentemente desenvolvem uma reação IgE-mediada são: leite de vaca, ovo, soja, amendoim, trigo, arroz, peixe, marisco, tomate, ervilha, feijão, carne bovina e carne de frango.Vale ressaltar que a sensibilização a aeroalérgenos também deve ser avaliada pelo TCP, dado que pode estar implicado na exacerbação ou até mesmo na patogênese da EoE. Contudo, o teste apresenta limitações, uma vez que a EoE parece ser mediada não exclusivamente por IgE, além de estar relacionada com a hipersensibilidade tardia35.
O teste de contato, realizado por meio de adesivos com antígenos postos em contato com a pele do paciente, analisa melhor o mecanismo da EoE em comparação ao teste cutâneo por punctura, uma vez que analisa a hipersensibilidade tardia. Contudo, o teste não é validado para a doença, nem seus extratos são padronizados36.
A combinação do teste cutâneo por punctura com o teste de contato aumentou o valor preditivo negativo de 90% para 93% na detecção das substâncias potencialmente alergênicas, e parece ser útil na avaliação clínica do paciente ao se excluir determinadas substâncias alergênicas34.
Embora a avaliação laboratorial não tenha valor diagnóstico, existem dois parâmetros que podem ser informativos de inflamação eosinofílica associada a à sensibilização alérgica. A eosinofilia periférica é um desses parâmetros e surge em até 50% dos doentes; já elevação de IgE total, que é o outro parâmetro, está presente em até 78% dos doentes com EoE. No entanto, não existem dados que fundamentem a utilização desses parâmetros como indicadores da doença10.
A dosagem de IgG4 constitui uma abordagem alternativa para avaliar a atividade da doença. Estudos revelam que o nível de IgG4 é elevado no esôfago de pacientes com EoE ativa, quando comparado com aqueles com EoE controlada37, já o nível sérico de IgG4 é cerca de 100 vezes maior nos pacientes com EoE do que naqueles do grupo controle38.
Tratamento
As três principais opções terapêuticas para EoE, que visam a eliminação do estímulo alergênico, obtenção de controle sintomático e remissão da atividade da doença, são dieta alimentar, fármacos e dilatação endoscópica. A dilatação endoscópica é uma modalidade reservada apenas para casos de impacto alimentar e estenose grave, devido ao elevado risco de dor, hemorragia e perfuração39.
Diante de pacientes assintomáticos com EoE confirmada por meio de biópsia, especialistas aconselham a intervenção terapêutica, dado ao risco de remodelação, fibrose e estenose esofágica em longo prazo40.
Tratamento dietético
Existem três opções disponíveis para o tratamento da EoE com dietas alimentares: dieta de evicção de alimentos conhecidos como alergênicos, que se constitui na restrição de leite, ovos, peixe/marisco, frutos secos, amendoim, soja e trigo, (eficácia de 74%); dieta de evicção guiada por resultados da avaliação de alergia (eficácia de 76%), e a dieta com base em uma fórmula de aminoácidos (eficácia de 88 a 100%)41.
A dieta de evicção de alimentos reconhecidos como alergênicos e a dieta orientada por avaliação de alergia são as mais práticas42. No entanto, a primeira apresenta caráter extremamente restritivo e por vezes desnecessária, podendo condicionar deficiências nutricionais. Além disso, a eficácia parece ser ligeiramente superior na dieta orientada por estudo de alergia, sendo essa de mais fácil aceitação43.
Tratamento farmacológico
Dentre as opções farmacológicas estão os corticoides tópicos, que devem ser colocados na boca e depois deglutidos via inalador pressurizado. Nos 30 minutos após a administração do fármaco, o paciente deverá permanecer sem a ingestão de alimentos e bebidas10. O medicamento mais utilizado é a fluticasona, que apresenta eficácia de 50 a 95%, dependendo da dose utilizada e tempo de duração do tratamento, que varia de 4 a 12 semanas41. Usualmente, o tratamento com fluticasona é feito com 2-3 jatos, 2 vezes ao dia, por 6 semanas. Apesar de eficaz e bem tolerado, após interrupção do tratamento, surgem recidivas em até 50% dos pacientes, obrigando-os a reiniciar a terapia medicamentosa. A incidência de efeitos secundários a essa terapêutica é desconhecida, embora a candidíase tenha sido reportada44.
A corticoterapia sistêmica, com prednisolona na dose de 1 a 2 mg/kg/dia, no máximo 60 mg/dia, só deve ser empregada a curto prazo em casos de disfagia grave e estenose esofágica importante sem indicação de dilatação endoscópica.Trata-se de uma terapêutica que, apesar de eficaz, relaciona-se com muitos efeitos adversos, não sendo uma boa opção de tratamento em longo prazo41.
Antagonistas de receptores de leucotrieno também podem ser utilizados. Porém, apesar do uso de montelucaste 20-40 mg/dia trazer controle sintomático da doença, não demonstrou progresso em nível histológico45.
Os anticorpos monoclonais, como o anti-IL5, reduzem a inflamação, apresentando remissão clínica e histológica da doença, contudo mais estudos são necessários para que se aprove o uso destes medicamentos na prática clínica46.
Inicialmente, os IBPs eram recomendados para distinguir EoE de DRGE, tendo em vista que a última condição clínica traz achados semelhantes à EoE. A premissa subjacente a essa recomendação era de que o único efeito importante dos IBPs seria inibição da secreção ácida. Contudo, após o reconhecimento de seus efeitos anti-inflamatórios, perfil de segurança a longo prazo e comodidade posológica, os IBPs passaram a ser considerados referência no tratamento da EoE47.
Os mecanismos envolvidos nas propriedades antiinflamatórias dos IBPs relacionam-se com a redução de citocinas pró-inflamatórias e inibição da expressão de moléculas de adesão reconhecidas por ligantes de eosinófilos, além do bloqueio da expressão de eotaxina-339.
Estudos revelam melhora clínica (71,6%), histológica (56,6%) e endoscópica (61,8%) em pacientes com EoE tratados com IBP por 8 semanas (omeprazol, 20 mg duas vezes ao dia)48.
Após compreender-se que a resposta ao uso de IBPs não deve ser interpretada como DRGE, nem impedir o diagnóstico de EoE, a dose recomendada para adultos é de 20-40 mg ao dia, por 8 a 12 semanas, não sendo especificado o tipo de IBP. Já para crianças, recomenda-se 1 mg/kg de IBP, duas vezes ao dia27.
Avaliação da resposta ao tratamento
Para a avaliação da resposta terapêutica, consideram-se os sintomas clínicos, achados endoscópicos e histológicos após 8-12 semanas de tratamento. Não há diretrizes definidas sobre o acompanhamento em longo prazo desses pacientes após a resposta inicial ao tratamento. Deve-se ter em mente a possibilidade de manutenção da terapêutica causando menor impacto possível na qualidade de vida do paciente, porém mantendo a remissão dos sintomas. O seguimento desses pacientes torna-se difícil, uma vez que é discutível a realização de novas endoscopias com biópsias após o ressurgimento dos sintomas49.
História natural da doença
A doença apresenta um caráter crônico e recidivante, sendo o ritmo de atividade variável e individualizado para cada paciente. A demora entre o início dos sintomas e o diagnóstico da doença é de cerca de 4,3 anos, podendo variar entre 1 e 13 anos50.
Embora não esteja, até o momento, associada a uma limitação da expectativa de vida, do ponto de vista sintomatológico, a perspectiva não é tão animadora. Noventa e sete por cento dos doentes apresentam persistência dos sintomas da doença, como a disfagia42.
Estudos de follow-up demonstram unanimidade na identificação de remodelação, anéis e estenoses esofágicas como complicações estruturais e funcionais ao órgão, além da síndrome de Boerhaave, que, embora rara, já tem sido reportada51. Recentemente, ainda não houve associação da doença com neoplasias malignas42.
CONCLUSÕES
A EoE é uma doença inflamatória crônica do esôfago com intrínseca correlação com fenômenos alérgicos e incidência crescente, com necessidade de novos estudos para que medidas terapêuticas e de seguimento tornem-se mais estabelecidas.
Além disso, nota-se que a doença cursa com importante repercussão na qualidade de vida dos pacientes pois, com a progressão da doença, não só o funcionamento esofágico estará comprometido, mas também as relações interpessoais e com o meio no qual o paciente encontra-se inserido, visto que alimentar-se não constitui unicamente uma necessidade fisiológica, mas um momento de prazer e socialização.
É importante suspeitar de EoE para que se faça o diagnóstico, e a suspeição clínica da doença só é possível com o conhecimento acerca do tema. Posto que a doença é de responsabilidade de múltiplas áreas da saúde, esperamos ter contribuído com a ampliação do conhecimento por meio de nosso trabalho.
REFERÊNCIAS
1. Arias A, Pérez-Martínez I, Tenías JM, Lucendo AJ. Systematic review with meta-analysis: The incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther. 2016;43:3-15.
2. Gómez-Aldana A, Jaramillo-Santos M, Delgado A, Jaramillo C, Lúquez-Mindiola A. Eosinophilic esophagitis: Current concepts in diagnosis and treatment. World J Gastroenterol. 2019;25:4598-613.
3. Hill DA, Grundmeier RW, Ramos M, Spergel JM. Eosinophilic Esophagitis is a late manifestation of the allergic march. J Allergy Clin Immunol Pract. 2018;6:1528-33.
4. Reed CC, Dellon ES. Eosinophilic esophagitis. Med Clin N Am. 2019;103:29-42.
5. Jensen ET, Hoffman K, Shaheen NJ, Genta RM, Dellon ES. Esophageal eosinophilia is increased in rural areas with low population density: Results from a national pathology database. Am J Gastroenterol. 2014;109:668-75.
6. Chehade M, Sampson HA. Epidemiology and etiology of eosinophilic esophagitis. Gastrointest Endoscopy Clin N Am. 2008;18:33-44.
7. Moawad FJ. Eosinophilic esophagitis: incidence and prevalence. Gastrointest Endoscopy Clin N Am. 2018;28:15-25.
8. Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med. 2004;351:940-1.
9. Dellon ES, Hirano I. Epidemiology and natural history of Eosinophilic Esophagitis. Gastroenterology. 2018;154:319-32.
10. Furuta GT, Liacouras CA, Collins MH, Gupta SK, Justinich C, Putnam PE, et al. Eosinophilic Esophagitis in Children and Adults: A Systematic Review and Consensus Recommendations for Diagnosis and Treatment. Sponsored by the American Gastroenterological Association (AGA) Institute and North American Society of Pediatric Gastroenterology, Hepatology, and Nutrition. Gastroenterology. 2007;133:1342-63.
11. Clayton F, Peterson K. Eosinophilic esophagitis: pathophysiology and definition. Gastrointest Endoscopy Clin N Am. 2018;28:1-14.
12. Spergel J, Aceves SS. Allergic components of eosinophilic esophagitis. Journal of Allergy and Clinical Immunology. 2018;142:1-8.
13. Rothenberg ME. Biology and treatment of eosinophilic esophagitis. Gastroenterology. 2009;137:1238-49.
14. Mishra A, Niranjan R, Rayapudi M, Mishra A, Dutt P, Dynda S. Pathogenesis of allergen-induced eosinophilic esophagitis is independent of interleukin (IL)-13. Immunol Cell Biol. 2013;91:408-15.
15. Rajavelu P, Rayapudi M, Moffitt M, Mishra A, Mishra A. Significance of para-esophageal lymph nodes in food or aeroallergen-induced iNKT cell-mediated experimental eosinophilic esophagitis. Am J Physiol -Gastrointest Liver Physiol. 2012; 302:645-54.
16. Alexander ES, Martin LJ, Collins MH, Kottyan LC, Sucharew H, He H, et al. Twin and family studies reveal strong environmental and weaker genetic cues explaining heritability of eosinophilic esophagitis. J Allergy Clin Immunol. 2014;134:1084-92.
17. Blanchard C, Wang N, Stringer KF, Mishra A, Fulkerson PC, Abonia JP, et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis. J Clin Invest. 2006;116:536-47.
18. Swoger JM, Weiler CR, Arora AS. Eosinophilic Esophagitis: Is It All Allergies? Mayo Clinic Proceedings. 2007;82:1541-9.
19. Markowitz JE, Spergel JM, Ruchelli E, Liacouras CA. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents. Am J Gastroenterol. 2003;98:777-82.
20. González-Cervera J, Arias Á, Redondo-González O, Cano-Mollinedo MM, Terreehorst I, Lucendo AJ. Association between atopic manifestations and eosinophilic esophagitis: A systematic review and meta-analysis. Ann Allergy, Asthma Immunol. 2017;118:582-90.
21. Wahn U, Nickel R, Grüber C, Lau S, Illi S. The atopic march. Asthma Prevention. 2005. 313-31.
22. Hill DA, Spergel JM. The Immunologic Mechanisms of Eosinophilic Esophagitis. Current Allergy and Asthma Reports. 2016;16:1-15.
23. Mohammad AA, Wu SZ, Ibrahim O, Bena J, Rizk M, Piliang M, et al. Prevalence of atopic comorbidities in eosinophilic esophagitis: A case-control study of 449 patients. J Am Acad Dermatol. 2017;76:559-60.
24. Marenholz I, Esparza-Gordillo J, Rüschendorf F, Bauerfeind A, Strachan DP, Spycher BD, et al. Meta-analysis identifies seven susceptibility loci involved in the atopic march. Nat Commun. 20156;6:8804.
25. Ram G, Lee J, Ott M, Brown-Whitehorn TF, Cianferoni A, Shuker M, et al. Seasonal exacerbation of esophageal eosinophilia in children with eosinophilic esophagitis and allergic rhinitis. Ann Allergy, Asthma Immunol. 2015;115:224-8.
26. Hill DA, Dudley JW, Spergel JM. The Prevalence of Eosinophilic Esophagitis in Pediatric Patients with IgE-Mediated Food Allergy. J Allergy Clin Immunol Pract. 2017;5:369-75.
27. Hirano I, Chan ES, Rank MA, Sharaf RN, Stollman NH, Stukus DR, et al. AGA institute and the joint task force on allergy-immunology practice parameters clinical guidelines for the management of eosinophilic esophagitis. Ann Allergy, Asthma Immunol. 2020;124:416-23.
28. Dellon ES, Liacouras CA, Molina-Infante J, Furuta GT, Spergel JM, Zevit N, et al. Updated International Consensus Diagnostic Criteria for Eosinophilic Esophagitis: Proceedings of the AGREE Conference. Gastroenterology. 2018;155(4):1022-1033.e10.
29. Collins MH, Martin LJ, Alexander ES, Todd Boyd J, Sheridan R, He H, et al. Newly developed and validated eosinophilic esophagitis histology scoring system and evidence that it outperforms peak eosinophil count for disease diagnosis and monitoring. Dis Esophagus. 2017;30(3):1-8.
30. Hirano I, Moy N, Heckman MG, Thomas CS, Gonsalves N, Achem SR. Endoscopic assessment of the oesophageal features of eosinophilic oesophagitis: Validation of a novel classification and grading system. Gut. 2013;62:489-95.
31. Singla MB, Chehade M, Brizuela D, Maydonovitch CL, Chen Y-J, Riffle ME, et al. Early Comparison of Inflammatory vs. Fibrostenotic Phenotype in Eosinophilic Esophagitis in a Multicenter Longitudinal Study. Clin Transl Gastroenterol. 2015;6(12):e132.
32. Lipka S, Boyce HW, Kumar A, Richter JE. The Changing Faces of Eosinophilic Esophagitis: The Impact of Consensus Guidelines at the University of South Florida. Dig Dis Sci. 2015;60:1572-8.
33. Rodrigo S, Abboud G, Oh D, DeMeester SR, Hagen J, Lipham J, et al. High intraepithelial eosinophil counts in esophageal squamous epithelium are not specific for eosinophilic esophagitis in adults. Am J Gastroenterol. 2008;103:435-42.
34. Aceves SS. Allergy testing in patients with eosinophilic esophagitis. Gastroenterology and Hepatology. 2016;12:516-8.
35. Spergel JM, Beausoleil JL, Mascarenhas M, Liacouras CA. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis. J Allergy Clin Immunol. 2002;109:363-8.
36. Anyane-Yeboa A, Wang W, Kavitt RT. The Role of Allergy Testing in Eosinophilic Esophagitis. Gastroenterol Hepatol (NY). 2018;14(8):463-9.
37. Wright BL, Kulis M, Guo R, Orgel KA, Wolf WA, Burks AW, et al. Food-specific IgG4 is associated with eosinophilic esophagitis. J Allergy Clin Immunol. 2016;138:1190-2.
38. Wilson JM, Schuyler AJ, Tripathi A, Erwin EA, Commins SP, Platts- Mills TAE. IgG4 Component Allergens Are Preferentially Increased in Eosinophilic Esophagitis As Compared to Patients with Milk Anaphylaxis or Galactose-Alpha-1,3-Galactose Allergy. J Allergy Clin Immunol. 2016;137(2).
39. Franciosi JP, Liacouras CA. Eosinophilic Esophagitis. Immunol Allergy Clin North Am. 2009;29:19-27.
40. Liacouras CA, Bonis P, Putnam PE, Straumann A, Ruchelli E, Gupta SK, et al. Summary of the first international gastrointestinal eosinophil research symposium. J Pediatr Gastroenterol Nutr. 2007;45(3):370-91.
41. Piedade S, Gaspar Â. Esofagite eosinofílica. Rev Port Imunoalergologia. 2009;17:215-24.
42. Lieberman JA, Chehade M. Eosinophilic Esophagitis: Diagnosis and Management. Immunol Allergy Clin North Am. 2012;32:67-81.
43. Spergel JM, Andrews T, Brown-Whitehorn TF, Beausoleil JL, Liacouras CA. Treatment of eosinophilic esophagitis with specific food elimination diet directed by a combination of skin prick and patch tests. Ann Allergy, Asthma Immunol. 2005;95:336-43.
44. Schaefer ET, Fitzgerald JF, Molleston JP, Croffie JM, Pfefferkorn MD, Corkins MR, et al. Comparison of Oral Prednisone and Topical Fluticasone in the Treatment of Eosinophilic Esophagitis: A Randomized Trial in Children. Clin Gastroenterol Hepatol. 2008;6:165-73.
45. Attwood SEA, Lewis CJ, Bronder CS, Morris CD, Armstrong GR, Whittam J. Eosinophilic oesophagitis: A novel treatment using Montelukast. Gut. 2003;52:181-5. 46. Stein ML, Collins MH, Villanueva JM, Kushner JP, Putnam PE, Buckmeier BK, et al. Anti-IL-5 (mepolizumab) therapy for eosinophilic esophagitis. J Allergy Clin Immunol. 2006;118:1312-9.
47. Cheng E. Proton pump inhibitors for eosinophilic oesophagitis. Current Opinion in Gastroenterology. 2013; 29:416-20.
48. Vazquez-Elizondo G, Ngamruengphong S, Khrisna M, Devault KR, Talley NJ, Achem SR. The outcome of patients with oesophageal eosinophilic infiltration after an eight-week trial of a proton pump inhibitor. Aliment Pharmacol Ther. 2013;38:1312-9.
49. Morais MB, Cruz AS, Sadvsky ADI, Brandt KG, Duarte MA, Epifanio M, et al. Esofagite Eosinofílica. Documento do Departamento Científico de Gastroenterologia da Sociedade Brasileira de Pediatria [Internet]. 2018. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/20035g-GPA_-_Esofagite_Eosinofilica_final-marco.pdf.
50. Sousa F, Costa AC, Barbosa M. Esofagite eosinofílica e alergia. GE J Port Gastrenterologia. 2013;20:10-5.
51. Straumann A. The Natural History and Complications of Eosinophilic Esophagitis. Gastrointest Endosc Clin N Am. 2008;18:99-118.



