Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Urticárias crônicas induzidas: atualização do tema
Chronic inducible urticaria: topic update
Sérgio Duarte Dortas Junior; Guilherme Gomes Azizi; Ana Carolina Miranda Sousa; Omar Lupi; Alfeu Tavares França; Solange Oliveira Rodrigues Valle
DOI: 10.5935/2526-5393.20200047
Hospital Clementino Fraga Filho- Universidade Federal do Rio de Janeiro (HUCFF/UFRJ), Serviço de Imunologia - Rio de Janeiro, RJ, Brasil
Endereço para correspondência:
Guilherme Gomes Azizi
E-mail: gazizi247@gmail.com
Submetido em: 10/06/2020
Aceito em: 18/08/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A urticária é uma doença comum, determinada pela ativação de mastócitos que se apresenta por urticas, angioedema, ou ambos. Convencionou-se classificar a urticária, quanto a sua duração, em duas formas: aguda (UA) e crônica (UC). A urticária é definida como crônica quando persiste por 6 semanas ou mais. A urticária crônica compreende urticária crônica espontânea (UCE) e urticárias crônicas induzidas (UCInd), que incluem as urticárias físicas e não físicas.Estudos sugerem que a presença de UCInd associada a UCE está ligada a um pior prognóstico e duração da doença. Essa revisão tem por objetivo atualizar as informações disponíveis sobre a prevalência, quadros clínicos, métodos diagnósticos e tratamentos das UCInd por estímulos físicos ou não.
Descritores: Angioedema, urticária crônica, dermografismo, urticárias crônicas induzidas, urticárias físicas, urticária, urticária por pressão tardia, urticária ao frio.
INTRODUÇÃO
A urticária é uma doença comum, determinada pela ativação de mastócitos que se apresenta por urticas, angioedema ou ambos1. É uma enfermidade heterogênea, sendo facilmente reconhecida pelos pacientes e médicos. Entretanto, é altamente complexa ao considerarmos a etiologia e as terapias. Convencionou-se definir a urticária, quanto a sua duração, em duas formas: aguda (UA) e crônica (UC). A urticária é definida como crônica quando persiste por 6 semanas ou mais1. A urticária crônica compreende urticária crônica espontânea (UCE) e urticárias crônicas induzidas (UCInd), que incluem as urticárias físicas e não físicas2.
A prevalência de urticárias físicas (UF) em adultos varia de 20 a 30% entre os casos de urticária, e 6,2 a 25,5% em crianças. Estima-se que as UF estejam presentes em até 5% da população geral. Em 10 a 50% dos pacientes com UC, uma UF (mais comumente o dermografismo sintomático e urticária por pressão tardia) está presente3. Na verdade, é importante reconhecer que associações de UF e UCE são muitas vezes observadas, enquanto um paciente pode mostrar simultaneamente duas ou mais formas induzidas de urticária. Pacientes com UCE com um componente de UF têm pior prognóstico, com maior duração da doença4,5. Por exemplo, em um estudo realizado por Kozel e cols., a taxa de remissão após 1 ano, em pacientes com associação UCE e UF, foi de 21%, em comparação com 47% em pacientes com UCE isolada6.
As UCInds podem ser diagnosticadas por meio da história clínica, exame físico e da reprodução das lesões através dos testes de provocação.
Nosso objetivo é atualizar as informações disponíveis sobre a prevalência, manifestações clínicas, métodos diagnósticos e tratamentos das UCInd7.
Para realizar a atualização foram consideradas publicações que abordassem o tema "urticárias crônicas induzidas" por meio de revisão em bases de dados MEDLINE (PubMed), Cochrane, Scientific Electronic Library Online (SciELO), além de considerarmos os consensos e diretrizes recentemente publicados. Foram utilizadas as seguintes palavras-chaves: urticária, angioedema, urticárias crônicas induzidas, dermografismo, urticária por pressão tardia, urticária solar, urticária ao calor, urticária ao frio, urticária vibratória e urticária colinérgica.
DERMOGRAFISMO
Este tipo de urticária física caracteriza-se pela ocorrência de urticas após uma pressão ou força de corte aplicada sobre a pele, o que pode ser causado durante a fricção, o ato de coçar ou esfregar, desenvolvendo lesões pruriginosas, raramente acompanhadas de angioedema8-10.
É a forma mais comum de UCInd, presente em 2 a 5% da população geral, alcançando de 30 a 50% dos casos2,11, além de ser uma das urticárias crônicas induzidas mais comumente presente em pacientes com UCE4. O dermografismo pode ser assintomático ou sintomático11.
O dermografismo pode ser confirmado por meio de uma pressão exercida sobre a pele com um objeto sem corte, de maneira suave, como uma espátula ou uma tampa de caneta romba. O teste é considerado positivo se uma pápula pruriginosa, estiver presente em até 10 minutos da provocação.
Pode ser avaliado também pelo uso do dermografômetro, que é um instrumento de ponta de aço lisa, de 2,3 mm de diâmetro, que pode ser calibrado para exercer a pressão desejada. As configurações de escala de 0 a 15 são equivalentes a pressões que variam entre 20 e 160 g/mm2 (196-1569 kPa).
Três linhas paralelas (10 cm) devem ser feitas utilizando-se o dermografômetro (Figura 1B) e uma régua apropriada, com as marcações 0 (20 g/ mm2), 2 (36 g/mm2) e 5 (60 g/mm2) na região dorsal superior.O surgimento de uma pápula pruriginosa para a pressão aplicada é considerado diagnóstico de dermografismo.
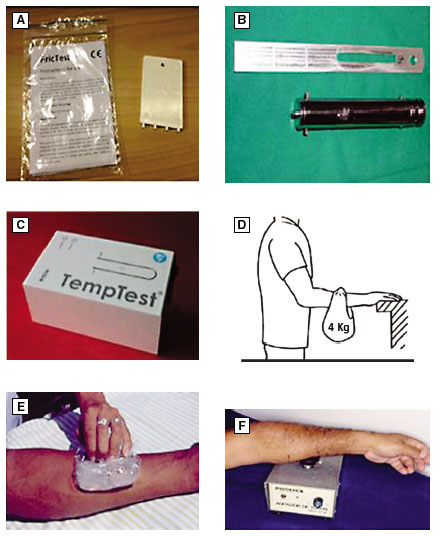
Figura 1
Testes de provocação para urticárias crônicas induzidas. A = FricTest 4.0,B= Dermografômetro, C = TempTest, D= Teste de Warin, E = Teste do cubo de gelo, F = Vórtex
O Fric Test® (Moxie, Berlim, Alemanha), é outra ferramenta utilizada na confirmação do diagnóstico, sendo um dispositivo de plástico com quatro dentes (3.0, 3.5, 4.0 e 4.5 mm de comprimento, respectivamente) que deve-se aplicar sobre a pele, exercendo uma força similar pelo examinador, determinando o limite para a reação. O instrumento é colocado verticalmente, realizando uma fricção em uma única passagem sobre a região anterior do antebraço a uma distância de aproximadamente 60 mm da fossa cubital. O teste é considerado positivo no caso do surgimento de uma pápula de ≥ 3 mm de largura, dentro de 10 minutos, no local da provocação13 (Figura 1A).
A terapia de primeira linha é o anti-histamínico H1 de segunda geração. Caso não haja controle com a dose usual, pode-se até quadruplicar a dose da mesma medicação9,14,15.
Outra opção de tratamento inclui o omalizumabe em casos selecionados9,16,17. Uma análise retrospectiva mostrou que 86% dos pacientes ficaram assintomáticos e 14% tiveram uma melhoria significativa com o uso de omalizumabe18. Recentemente, observamos em 10 pacientes com UCE associada a dermografismo boa resposta ao omalizumabe, com redução dos sintomas e ausência de positividade aos testes de provocação (Fric Test® e Dermografômetro)19.
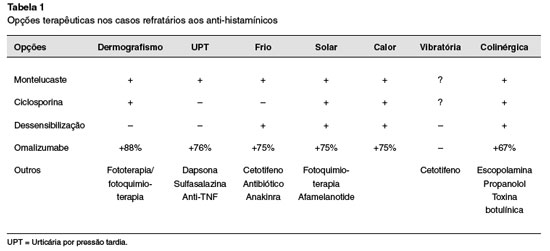
O uso de ciclosporina também se mostrou eficaz em casos refratários aos anti-histamínicos19. Fototerapia e fotoquimioterapia também foram relatados como eficazes21-24 (Tabela 1).
URTICÁRIA POR PRESSÃO TARDIA (UPT)
Pacientes com UPT desenvolvem urtica e/ou angioedema a partir de 4 a 6 horas de exposição da pele após um estímulo de pressão sustentado. As lesões podem surgir em até 12-24 h, as quais podem durar até 72 horas25-28. Como em outras urticárias físicas, a UPT pode ocorrer concomitante a diferentes urticárias crônicas, espontânea e/ou induzidas, podendo acometer 37% a 62% dos pacientes com UCE29-31.
Os testes de provocação possuem como objetivo simular pressão suficiente, durante um tempo indicado e sustentado sobre a pele, para que a reação ocorra e possa ser analisada em tempos estipulados. Os métodos de teste incluem o apoio de alças com pesos sobre o ombro, aplicação de hastes com peso posicionadas verticalmente sobre a pele e sobre anteparo em região dorsal, coxa ou antebraço, ou o uso do dermografômetro (Figura 1B).
Logo, a UPT pode ser confirmada por meio de um teste, realizado através do posicionamento de 7 kg em uma alça de 3 cm apoiada sobre o ombro do paciente por 10 a 15 minutos. O resultado é considerado positivo quando há o desenvolvimento de urticária e/ou angioedema no local de pressão após 4-5 horas2. Outra opção para o diagnóstico da UPT é o teste de Warin, o qual consiste na aplicação, durante 5 minutos, de uma bolsa, pesando 4 kg, e uma esfera de 1,5 cm de diâmetro sob a alça de 3 cm de largura para exercer pressão localizada, no 1/3 médio do antebraço. A leitura imediata é realizada com 30 minutos e a tardia entre 4-6 horas. A positividade do teste é definida pelo surgimento de reação cutânea com edema e eritema, associada à queimação32,33 (Figura 1D).
A provocação pode ser realizada com o dermografômetro (Figura 1B), o qual é aplicado perpendicularmente com 100 g/mm2 (981 kPa), durante 70 segundos, sobre a pele da região inferior da borda da escápula. A leitura deve ser feita entre 2-6 horas e 24 horas após o teste, sendo considerado positivo quando ocorre o surgimento tardio de edema palpável com eritema com, no mínimo, 3 mm de diâmetro, aproximadamente 6 h após a provocação, podendo surgir até 24 h. A reação geralmente não está associada com prurido, mas pode ser acompanhada por uma sensação de dor e/ou queimação. A UPT deve ser diferenciada do dermografismo sintomático que possui característica imediata e pode estar associado a alguns casos de UPT9,25,34,35.
Para o controle deve-se aconselhar e buscar a compreensão do paciente sobre a UPT, evitando pressões estáticas, como por exemplo, calçados e roupas apertadas.
Os regimes de tratamento recomendados incluem anti-histamínicos H1 não sedantes. O uso de doses superiores à padrão é muitas vezes necessária e recomendada. Outras opções de tratamento incluem a combinação de anti-histamínicos e montelucaste36-38.
Um dos principais relatos do uso de omalizumabe em UPT é o caso de um paciente com 10 anos de doença, que utilizava 540 mg/dia de fexofenadina e 100 mg/dia de azatioprina, com alívio parcial dos sintomas. Após a administração de 150 mg de omalizumabe concomitante a fexofenadina, o paciente apresentou controle total dos sintomas após 2 dias da injeção. Outros casos semelhantes, de pacientes com UPT isolada ou associada a UCE, em uso de anti-histamínicos H1 de segunda geração, foram relatados com boa resposta ao omalizumabe após a primeira dose19,37,39-42.
Uma das maiores análises do uso do omalizumabe na UPT demonstrou que de 8 pacientes tratados,7 (88%) alcançaram o controle completo dos sintomas, enquanto um (12%) teve melhora significativa18.
A dapsona43, sulfassalazina44,45, anti-TNF46 e teofilina também já foram utilizadas para o controle dos sintomas da UPT47 (Tabela 1). Grundamann e cols. utilizaram a dapsona como alternativa em 31 pacientes, demonstrando eficácia na redução dos sintomas em 74% da amostra43.
URTICÁRIA AO FRIO
Urticária ao frio é definida pelo surgimento de urticas após exposição ao frio, seja por objetos sólidos, ar ou líquidos frios. As lesões são causadas pela liberação de histamina, leucotrienos e outros mediadores pró-inflamatórios dos mastócitos2,4,6,48.
A urticária ao frio é a segunda forma mais comum de urticária induzida física. Sua incidência anual estimada é de 0,05%. Sua frequência varia entre 5,233,8%, predominando no sexo feminino (2:1), sendo a faixa etária mais acometida entre 20-30 anos2,49,50.
As lesões geralmente são limitadas ao local de contato com o frio (urticas e angioedema), porém podem ser generalizadas e acompanhadas por manifestações sistêmicas, inclusive com evolução para insuficiência respiratória aguda e anafilaxia. Estas ocorrem principalmente em situações como carregar objetos refrigerados, nadar em água gelada, permanecer ou entrar em ambiente refrigerado33,51.
A urticária ao frio pode ser adquirida ou familiar. A forma adquirida divide-se em primária (idiopática) e secundária, sendo a idiopática a mais comum2,4.
A urticária ao frio familiar é uma forma muito rara. As lesões aparecem 30 minutos após a exposição ao frio. É acompanhada de calafrios e febre, durando 4-6 horas. Pode ser dividida em duas síndromes: urticária ao frio tardia e síndrome autoinflamatória familiar associada ao frio (FCAS). Esta última associada à mutação de CIAS1, levando à ativação de IL-1β33,49,52.
O tipo adquirido secundário pode ser decorrente de infecções bacterianas ou virais, incluindo borreliose, sífilis, comprometimento respiratório pelo Mycoplasma pneumoniae, hepatites, mononucleose infecciosa e infecção pelo HIV. Outras anormalidades são crioglobulinemia, criofibrinogenemia, medicamentos e hemoglobinúria paroxística ao frio4,54,57.
Os métodos de provocação para urticária ao frio incluem o clássico "teste do cubo do gelo" e o TempTest®2,4.
O "teste do cubo de gelo" é realizado com a aplicação de um cubo de gelo envolto em plástico no antebraço do paciente durante 5 minutos. A leitura é realizada após 10 minutos, onde se observa, no local da aplicação do gelo, o surgimento de uma urtica2 (Figura 1E).
O TempTest® é um novo método baseado no efeito Peltier, validado para o diagnóstico de pacientes com urticária ao frio e urticária ao calor, para medir seus limiares de temperatura e atividade da doença2,33 (Figura 1C).
A principal característica do TempTest® 4.0, a versão mais recente deste instrumento, é que ele tem um único elemento de temperatura (elemento Peltier), que fornece um gradiente contínuo de temperatura variando de 4 °C a 44 °C2.
Os testes de provocação de temperatura são realizados colocando o antebraço do paciente no elemento de temperatura do TempTest® durante 5 minutos. Uma resposta positiva é definida pelo surgimento de uma pápula de 2 mm de largura (a largura do elemento da temperatura TempTest®) 10 min após a provocação (Figura 1C).
O comprimento das pápulas em pacientes com urticária ao frio corresponde aos seus limites de temperatura e atividade da doença. É muito fácil e rápido para determinar os limiares de temperatura, o que é muito relevante para os pacientes e para os médicos também2.
Em nosso serviço avaliamos quatro pacientes, utilizando o TempTest®, e identificamos positividade para temperaturas iguais ou inferiores a 27 °C58.
O manejo da urticária ao frio inclui4,19,55,56 (Tabela 1):
- evitar exposição ao frio, bebidas ou alimentos frios;
- anti-histamínicos não sedantes nas doses recomendadas ou até quadruplicadas;
- indução de tolerância pela imersão gradual na água fria, em intervalos regulares;
- nos casos graves, com anafilaxia ao frio, um plano emergencial deve ser instituído, inclusive com a prescrição de autoinjetores de adrenalina;
- em casos selecionados o uso de omalizumabe; antibióticos: doxiciclina, penicilina; Anakinra e Etanercept mostraram benefício.
URTICÁRIA AO CALOR
A urticária ao calor é uma forma rara de urticária induzida caracterizada por eritema pruriginoso e urticas que surgem logo após a exposição ao calor. A maioria dos casos ocorre em mulheres (82%). A idade do início da urticária de calor é, em média, de 34,4±19,5 anos, variando de 4 a 78 anos57.
Pode-se apresentar sob duas formas: localizada e generalizada, na dependência da limitação da reação na área da pele diretamente exposta ou acometimento de áreas distantes, respectivamente54.
As urticas surgem 2-15 minutos após a exposição e podem persistir até por aproximadamente 1-3 horas. Pode ocorrer sensação de queimação no local das lesões. Alguns pacientes podem apresentar manifestações sistêmicas como síncope, fadiga, náuseas, vômitos, dor abdominal, febre e dispneia. Este quadro ocorre, particularmente, se as áreas acometidas forem extensas57.
O diagnóstico é confirmado por meio da aplicação de um estímulo quente na pele da superfície volar do antebraço (por exemplo, com um cilindro de metal/vidro cheio de água quente ou banhos de água quente até 44 °C, durante 5 minutos, com um período de observação de 10 minutos)2,4,57.
O equipamento TempTest® pode ser usado como alternativa ao teste descrito anteriormente, com a vantagem de permitir a determinação dos limiares de temperatura (Figura 1C).
Em nosso serviço avaliamos três pacientes utilizando o TempTest®, e identificamos positividade para temperaturas iguais ou superiores a 38 °C58.
A urticária ao calor geralmente é tratada com anti-histamínicos não sedantes nas doses recomendadas ou até quadruplicadas. Há relatos do uso de omalizumabe em casos refratários de pacientes apenas com urticária ao calor ou associada a UCE, com controle dos sintomas4,19,56,57 (Tabela 1).
URTICÁRIA SOLAR
Pacientes com urticária solar desenvolvem urticas rapidamente após a exposição da pele à luz solar (UVA, 320-400 nm; ou comprimentos de onda visíveis, 400-600 nm). Com menor frequência, as lesões são induzidas por UVB, 280-320 nm, ou radiação infravermelha > 600 nm. A urticária solar representa 7% de todas as fotodermatoses59,60.
É classificada em dois tipos: o tipo I ocorre em pacientes com precursores no soro, plasma ou fluido de tecido cutâneo que se torna fotoalergênico e, uma vez ativado pelo comprimento de onda apropriado, se liga à autoanticorpos IgE ligados aos receptores de IgE, resultando em desgranulação de mastócitos e liberação de histamina e outros mediadores inflamatórios. O tipo II também é mediado por IgE, porém os precursores são encontrados tanto em indivíduos saudáveis, quanto em pacientes com urticária solar4,33,59.
Na maioria dos casos é benigna, mas em alguns pacientes pode haver sintomas sistêmicos associados, como dor de cabeça, náuseas, envolvimento mucoso e até mesmo anafilaxia60.
O diagnóstico de urticária solar é feito testando o indivíduo para vários comprimentos de luz para simular a provocação da urticária2,4.
Dentre os testes de provocação estão: lâmpada de projetor de slides (para luz visível), luz negra fluorescente (comprimentos de onda UVB e UVA), luz solar fluorescente (comprimentos de onda UVB e UVA), ou lâmpada infravermelha (comprimentos de onda infravermelhos). A dose eritematosa mínima (DEM) de urticária pode ser determinada expondo uma área de 1 cm2 de pele a uma distância de 10 cm da fonte de luz2.
Diferentes modalidades terapêuticas foram descritas, de acordo com a intensidade dos sintomas: protetores solares, anti-histamínicos orais, ciclosporina, dessensibilização com diferentes tipos de fototerapia, omalizumabe, plasmaférese, imunoglobulina intravenosa (IgIV), afamelanotide, entre outros. Embora tenham sido propostas recomendações terapêuticas no contexto das urticarias crônicas, não há diretrizes baseadas em consenso e baseadas em evidências que definam a abordagem específica para urticária solar4,56,59,61 (Tabela 1).
URTICÁRIA/ANGIOEDEMA VIBRATÓRIO
Pacientes com urticária/angioedema vibratório apresentam prurido e urticas minutos após a pele expor-se a estímulos vibratórios, por exemplo, pilotar motocicletas, cavalgar ou praticar mountain bike; uso de britadeira, cortador de grama e tocar instrumentos musicais como guitarra. Este subtipo de urticária pode ser familiar, com herança autossômica dominante2,62.
Pode ser diagnosticado por exposição da pele a um vórtice misturador, apoiando o antebraço do paciente sob o punho e o cotovelo, de modo que a pele do antebraço, mão ou dedo repouse no copo de borracha do vórtice. Então, o misturador vibra em uma velocidade constante entre 780 e 1380 rpm durante pelo menos 1 min e até 5 min2,4,62 (Figura 1F).
O tratamento da urticária vibratória consiste em evitar os estímulos provocativos, anti-H1 não sedativos, e exposição progressiva a estímulos vibratórios para induzir tolerância. Há apenas descrição de um relato de caso do uso de omalizumabe em urticária/ angioedema vibratório, porém sem melhora dos sintomas4,63,64 (Tabela 1).
URTICÁRIA AQUAGÊNICA
A urticária aquagênica é uma condição rara, desencadeada pelo contato com água, independentemente da sua temperatura65-67. Aproximadamente 30 minutos após o contato com a água, os pacientes desenvolvem urticas com 1-2 mm. Em sua maioria são casos isolados, entretanto, foram relatados casos familiares65,68.
Sua fisiopatogenia não é bem compreendida, todavia, existe evidência de que a água atuaria como transportador de um antígeno epidérmico, capaz de ativar mastócito69,70.
Antes de buscar o teste para urticária aquagênica deve-se excluir demais possibilidade dentre as urticárias induzidas, tanto através da história clínica quanto por testes de provocação. O diagnóstico é confirmado através da aplicação de uma compressa embebida em água a 35-37 °C ou soro fisiológico colocado no tronco do paciente. Retira-se a compressa ou a toalha após 40 minutos ou mais precocemente, caso o paciente relate prurido ou se houver surgimento de pápulas no local do teste. O teste é positivo se as lesões se desenvolverem na área de contato dentro de 10 min após a retirada da toalha2.
Anti-histamínicos H1 e terapia com UV são empregados para o tratamento desta doença com resposta variável71-74 (Tabela 1).
URTICÁRIA COLINÉRGICA
A primeira descrição da urticária colinérgica foi feita por Duke em 192410, sendo caracterizada pelo surgimento de lesões micropapulares, relacionadas à elevação da temperatura corporal a partir de exercício físico ou aplicação local de calor, além do estresse emocional, comidas picantes ou bebidas quentes. As lesões possuem, aproximadamente, entre 1 e 3 mm, localizando-se em tronco e membros superiores75-80. Um dos mecanismos fisiopatológicos sugeridos depende da presença de um autoanticorpo para um antígeno do suor, visto que há descrição do surgimento de pápulas semelhantes após o teste do soro autólogo. Outros exemplos de possíveis mecanismos incluem a oclusão de poros e anidrose81-83. Diferente de outros tipos de urticária, muitos pacientes com urticária colinérgica queixam-se de "formigamento", o que tem grande impacto na qualidade de vida destes pacientes84.
As lesões tendem a durar 15 a 60 minutos e podem estar associadas ao angioedema local. Na suspeita de urticária colinérgica é importante diferenciá-la da anafilaxia induzida pelo exercício, urticária aquagênica, urticária adrenérgica e urticária colinérgica induzida pelo frio85-88.
O teste de provocação para confirmar urticária colinérgica também possui como objetivo descartar a anafilaxia induzida pelo exercício. Deve-se ter cautela ao realizar o teste em indivíduos cardiopatas, e analisar pacientes com outras apresentações de lesões cutâneas. É consenso que um aumento na temperatura corporal acima 1 °C da linha de base, conforme indicado por um teste de aquecimento passivo sentado por ≤ 15 min em um banho com água a 42 °C confirma o diagnóstico de urticária colinérgica.
Um protocolo padronizado para diagnosticar e medir os limiares de urticária colinérgica, usando a ergometria com controle da frequência cardíaca, tem sido proposto86. O teste é realizado por ergometria com controle da frequência cardíaca. O paciente se posiciona na bicicleta ergométrica e inicia as pedaladas, sendo instruído de maneira que a pulsação se eleve em 15 batimentos por minuto a cada 5 minutos, alcançando 90 batimentos por minuto acima do nível basal após 30 minutos. O tempo para o surgimento da urticária é inversamente proporcional à intensidade da doença, ou seja, quanto menor o tempo para o surgimento das lesões, mais grave é considerada a urticária colinérgica89.
Recentemente, relatamos um caso no qual foi realizado teste para urticária colinérgica utilizando um lance de escada (13 degraus) e parâmetros similares a protocolo padronizado, anteriormente descrito. Foi utilizado um frequencímetro (Polar F11®) para aferição e controle da frequência cardíaca (FC). O paciente foi instruído a realizar subidas e descidas de modo a elevar sua FC em 15 bpm por 5 minutos, sendo intensificadas, buscando 90 bpm a mais, do que o valor basal, após 30 min. Após 15 min e 45 bpm do valor basal, surgiram micropápulas e eritema em face, tórax e membros, sendo o teste positivo em exercício leve (57% da FC Máx)62.
A terapia de primeira escolha é composta por anti-histamínicos não sedativos90,91. Entretanto, existem alternativas para casos refratários, como o omalizumabe92,93, inclusive com relatos de casos nos quais os pacientes com apenas uma dose de omalizumabe tiveram reduções drásticas nos sintomas relacionados à urticária colinérgica, ao serem avaliados através dos DLQI e Chronic Urticaria Quality of Life Questionnaire94. Brometo de escopolamina95, combinações de propranolol, anti-histamínicos e montelucaste96, e injeção de toxina botulínica, têm sido sugeridos97. Protocolos de dessensibilização envolvendo exercício físico regular ou tratamento com suor autólogo já foram descritos em alguns pacientes98. Há relato de efetividade com altas doses de danazol (600 mg por dia), porém com importantes efeitos colaterais99-101 (Tabela 1).
A Tabela 2 resume os principais testes de provocação para o diagnóstico e acompanhamento de pacientes com urticárias induzidas.
CONCLUSÃO
As urticárias crônicas induzidas podem ser debilitantes devido a uma série de limitações impostas à vida do paciente. Podem estar associadas à UCE, e mais de uma forma de UCInd podem ser observadas em um mesmo paciente. As UCInd estão associadas a um pior prognóstico e duração da doença, comprometendo a qualidade de vida do indivíduo acometido.
Os subtipos mais frequentes de UCInd são dermografismo, urticária ao frio e urticária de pressão tardia.
Nossos dados corroboram os achados de outros estudos epidemiológicos, com uma maior prevalência de UC no sexo feminino, faixa etária (20-30 anos), associação UCE e UCInd, além do tipo mais frequente de UCInd (dermografismo). Por outro lado, diferente dos achados de estudos europeus, encontramos maior duração da doença no grupo estudado (10,2 anos versus 3-5 anos).
O diagnóstico dos diferentes subtipos é estabelecido através de testes de provocação específicos (pressão, frio, calor, luz solar, vibração), e a conduta terapêutica é semelhante à indicada para outras formas de urticária crônica, englobando medidas de afastamento do agente causal, terapia farmacológica com anti-histamínicos não sedantes e medicamentos alternativos, dentre eles os imunobiológicos, nos casos refratários (Tabela 1).
REFERÊNCIAS
1. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer- Weber B, et al. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018 Jul;73(7):1393-414.
2. Magerl M, Altrichter S, Borzova E, Giménez-Arnau A, Grattan CE, Lawlor F, et al. The definition, diagnostic testing, and management of chronic inducible urticarias - TheEAACI/GA(2) LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016 Jun;71(6):780-2.
3. Weller K, Altrichter S, Ardelean E, Krause K, Magerl M, Metz M, et al. Chronic urticaria. Prevalence, course, prognostic factors and impact. Hautarzt. 2010;61:750-7.
4. Sánchez-Borges M, González-Aveledo L, Caballero-Fonseca F, Capriles-Hulett A. Review of physical urticarias and testing methods. Curr Allergy Asthma Rep. 2017;17(8):51.
5. Kozel MM, Mekkes JR, Bossuyt PM, Bos JD. Natural course of physical and chronic urticaria and angioedema in 220 patients. J Am Acad Dermatol. 2001;45:387-91.
6. Kaplan AP, Gray L, Shaff RE, Horakova Z, Beaven MA. In vivo studies of mediator release in cold urticaria and cholinergic urticaria. J Allergy ClinImmunol. 1975;55(6):394-402.
7. Maurer M, Metz M, Bindslev-Jensen C, Bousquet J, Canonica GW, Church MK, et al. Definition, aims, and implementation of GA²LEN urticaria centers of reference and excellence. Allergy. 2016:71;1210-8.
8. Breathnach SM, Allen R, Ward AM, Greaves MW. Symptomatic dermographism: natural history, clinical features laboratory investigations and response to therapy. Clin Exp Dermatol. 1983;8:463-76.
9. Dice JP. Physical urticaria. Immunol Allergy Clin North Am. 2004;24:225-46.
10. Duke WW. Urticaria caused specifically by the action of physical agents: (light, cold,heat, freezing, burns, mechanical irritation, and physical and mental exertion). J Am Med Assoc. 1924;83:3-9.
11. Abajian M, Schoepke N, Altrichter S, Zuberbier T, Maurer M. Physical urticarias and cholinergic urticaria. Immunol Allergy Clin North Am. 2014;34:73-88.
12. Soter NA, Wasserman SI. Physical urticaria/angioedema: an experimental model of mast cell activation in humans. J Allergy Clin Immunol. 1980;66:358-65.
13. Schoepke N, Abajian M, Church MK, Magerl M. Validation of a simplified provocation instrument for diagnosis and threshold testing of symptomatic dermographism. Clin Exp Dermatol. 2015;40:399-403.
14. Magerl M, Schmolke J, Metz M, ZuberbierT, Siebenhaar F, Maurer M. Prevention of signs and symptoms of dermographic urticaria by single-dose ebastine 20 mg. Clin Exp Dermatol. 2009;34:e137-e140.
15. Sharpe GR, Shuster S. The effect of cetirizine on symptoms and wealing in dermographic urticaria. Br J Dermatol. 1993;129:580-3.
16. Krause K, Ardelean E, Kessler B, Magerl M, Metz M, Siebenhaar F, et al. Antihistamine-resistant urticaria factitia successfully treated with anti-immunoglobulin E therapy. Allergy. 2010;65:1494-5.
17. Metz M, Altrichter S, Ardelean E, Kessler B, Krause K, Magerl M, et al. Anti-immunoglobulin E treatment of patients with recalcitrant physical urticaria. Int Arch Allergy Immunol. 2011;154:177-80.
18. Metz M, Ohanyan T, Church MK, Maurer M. Omalizumab is an effective and rapidly acting therapy in difficult-to-treat chronic urticaria: a retrospective clinical analysis. J Dermatol Sci. 2014;73:57-62.
19. Valle SOR, Azizi GG, Dortas Junior SD. Chronic spontaneous urticária (CSU) associated with chronic inducible urticaria (CIndU): Efficacy of omalizumab. Volume 74, Issue S106. Special Issue: Abstracts from the European Academy of Allergy and Clinical Immunology Congress, 01-05 June 2019, Lisbon, Portugal.
20. Toda S, Takahagi S, Mihara S, Hide M. Six cases of antihistamineresistant dermographic urticaria treated with oral ciclosporin. Allergol Int. 2011;60:547-50.
21. Borzova E, Rutherford A, KonstantinouGN, Leslie KS, Grattan CE. Narrowb and ultraviolet B phototherapy is beneficial in antihistamineresistant symptomatic dermographism: a pilot study. J Am Acad Dermatol. 2008;59:752-7.
22. Adamski H, Viguier M. Solar urticaria. Ann Dermatol Venereol. 2012;139:324-8.
23. Hannuksela M, Kokkonen EL. Ultraviolet light therapy in chronic urticaria. Acta Derm Venereol. 1985;65:449-50.
24. Johnsson M, Falk ES, Volden G. UVB treatment of factitious urticaria. Photodermatol.1987;4:302-4.
25. Lawlor F, Black AK. Delayed pressure urticaria. Immunol Allergy Clin North Am. 2004;24:247-58.
26. Lawlor F, Black AK, Ward AM, Morris R, Greaves MW. Delayed pressure urticaria, objective evaluation of a variable disease using a dermographometer and assessment of treatment using colchicine. Br J Dermatol. 1989;120:403-8.
27. Ryan TJ, Shim-Young N, Turk JL. Delayed pressure urticaria. Br J Dermatol.1968;80:485-90.
28. Barlow RJ, Ross EL, MacDonald D, Black AK, Greaves MW. Adhesion molecule expression and the inflammatory cell infiltrate in delayed pressure urticaria. Br J Dermatol. 1994;131:341-7.
29. Dover JS, Black AK, Ward AM, Greaves MW. Delayed pressure urticaria. Clinical features, laboratory investigations, and response to therapy of 44 patients. J Am Acad Dermatol. 1988;18(6):1289-98.
30. Barlow RJ, Warburton F, Watson K, Black AK, Greaves MW. Diagnosis and incidence of delayed pressure urticaria in patients with chronic urticaria. J Am Acad Dermatol. 1993;29:954-8.
31. Sanchez J, Amaya E, Acevedo A, Celis A, Caraballo D, Cardona R. Prevalence of inducible urticaria in patients with chronic spontaneous urticaria: associated risk factors. J Allergy Clin Immunol Pract. 2017;5:464-70.
32. Warin RP. A simple out-patient test for delayed pressure urticaria. Br J Dermatol. 1987;116(5):742-3.
33. França AT, Valle SOR. Urticária e angioedema: diagnóstico e tratamento. 3ª ed. Rio de Janeiro: Revinter; 2014.
34. Lawlor F. Cellular, molecular and therapeutic aspects of the physical urticarias. MD theses (Dublin); 1990.
35. Black AK, Lawlor F, Greaves MW. Consensus meeting on the definition of physical urticarias and urticarial vasculitis. Clin Exp Dermatol. 1996;21(6):424-6.
36. Nettis E, Colanardi MC, Soccio AL, Ferrannini A, Vacca A. Desloratadine in combination with montelukast suppresses the dermographometer challenge test papule, and is effective in the treatment of delayed pressure urticaria: a randomized, doubleblind, placebo-controlled study. Br J Dermatol. 2006;155:1279-82.
37. Nettis E, Pannofino A, Cavallo E, Ferrannini A, Tursi A. Efficacy of montelukast, in combination with loratadine, in the treatment of delayed pressure urticaria. J Allergy Clin Immunol. 2003;112:212-3.
38. Berkun Y, Shalit M. Successful treatment of delayed pressure urticaria with montelukast. Allergy. 2000;55:203-4.
39. Metz M, Altrichter S, Ardelean E, Kessler B, Krause K, Magerl M, et al. Anti-immunoglobulin E treatment of patients with recalcitrant physical urticaria. Int Arch Allergy Immunol. 2011;154:177-80.
40. Bindslev-Jensen C, Skov PS. Efficacy of omalizumab in delayed pressure urticaria: a case report. Allergy. 2010;65:138-9.
41. Rodriguez-Rodriguez M, Antolin-Amerigo D, Barbarroja-Escudero J, Sanchez-Gonzalez MJ, Alvarez-Mon M. Successful treatment of severe delayed pressure angiooedema with omalizumab. Allergol Immunopathol (Madr). 2014;42:78-80.
42. Ghazanfar MN, Sand C, Thomsen SF. Effectiveness and safety of omalizumab in chronic spontaneous or inducible urticaria: evaluation of 154 patients. Br J Dermatol. 2016;175:404-6.
43. Grundmann SA, Kiefer S, Luger TA, Brehler R. Delayed pressure urticaria - dapsone heading for first-line therapy? J Dtsch Dermatol Ges. 2011;9:908-12.
44. Engler RJ, Squire E, Benson P. Chronic sulfasalazine therapy in the treatment of delayed pressure urticaria and angioedema. Ann Allergy Asthma Immunol. 1995;74:155-9.
45. Swerlick RA, Puhar N. Delayed pressure urticaria: response to treatment with sul-fasalazine in a case series of seventeen patients. Dermatol Ther. 2015;28:318-22.
46. Magerl M, Philipp S, Manasterski M, Friedrich M, Maurer M. Successful treatment of delayed pressure urticaria with anti-TNFalpha. J Allergy Clin Immunol. 2007;119:752-4.
47. Kalogeromitros D, Kempuraj D, Katsarou-Katsari A, Gregoriou S, Makris M, Boucher W, et al. Theophylline as "add-on" therapy in patients with delayed pressure urticaria: a prospective self-controlled study. Int J Immunopathol Pharmacol. 2005;18:595-602.
48. Magerl M, Pisarevskaja D, Staubach P, Martus P, Church MK, Maurer M. Critical temperature threshold measurement for cold urticaria: a randomized controlled trial of H(1) -antihistamine dose escalation. Br J Dermatol. 2012;166(5):1095-9.
49. Siebenhaar F, Weller K, Mlynek A, Magerl M, Altrichter S, Vieira Dos Santos R, et al. Acquired cold urticaria: clinical picture and update on diagnosis and treatment. Clin Exp Dermatol. 2007;32(3):241-5.
50. Koeppel MC, Bertrand S, Abitan R, Signoret R, Sayag J. Urticaria caused by cold. 104 cases. Ann Dermatol Venereol. 1996;123(10):627-32. 51. Sánchez JM, Ramírez RH, Tamayo LM, Chinchilla CF, Cardona R. Cold urticaria: case series and literature review. Biomedica. 2011 Jun;31(2):168-77. 52. Wanderer AA, Hoffman HM. The spectrum of acquired and familial cold-induced urticaria/urticaria-like syndromes. Immunol Allergy Clin North Am. 2004 May;24(2):259-86, vii. 53. Lemanske RF Jr, Bush RK. Cold urticaria in infectious mononucleosis. JAMA. 1982;247(11):1604. 54. Doeglas HM, Rijnten WJ, Schröder FP, Schirm J. Cold urticaria and virus infections: a clinical and serological study in 39 patients. Br J Dermatol. 1986;114(3):311-8. 55. Metz M, Schütz A, Weller K, Gorczyza M, Zimmer S, Staubach P, et al. Omalizumab is effective in cold urticaria-results of a randomized placebo-controlled trial. J Allergy Clin Immunol. 2017 Sep;140(3):864-7.e5. 56. Maurer M, Metz M, Brehler R, Hillen U, Jakob T, Mahler V, et al. Omalizumab treatment in patients with chronic inducible urticaria: A systematic review of published evidence. J Allergy Clin Immunol. 2018;141(2):638-49. 57. Pezzolo E, Peroni A, Gisondi P, Girolomoni G. Heat urticaria: a revision of published cases with an update on classification and management. Br J Dermatol. 2016;175(3):473-8. 58. Azizi GG, Dortas Junior SD, Zylbersztejn SRS, Rosa M, Tavares JVV, Valle SOR. TempTest: uma ferramenta de precisão na urticária física. Arq Asma Alerg Imunol. 2019;3(Supl 1):S208. 59. Pérez-Ferriols A, Barnadas M, Gardeazábal J, de Argila D, Carrascosa JM, Aguilera P, et al. Solar urticaria: Epidemiology and clinical phenotypes in a Spanish series of 224 patients. Actas Dermosifiliogr. 2017;108(2):132-9. 60. Jong CT, Finlay AY, Pearse AD, Kerr AC, Ferguson J, Benton EC, et al. The quality of life of 790 patients with photodermatoses. Br J Dermatol. 2008;159:192-7. 61. Snast I, Kremer N, Lapidoth M, Enk CD, Tal Y, Rosman Y, et al. Omalizumab for the treatment of solar urticaria: case series and systematic review of the literature. J Allergy Clin Immunol Pract. 2018 Mar. pii: S2213-2198(18)30132-6. 62. Azizi GG, Ontiveros CM, Zylbersztejn SRS, Dortas Junior SD, Valle SOR. Teste de urticária colinérgica modificado e teste de urticária vibratória em hospital universitário. Arq Asma Alerg Imunol. 2019;3(Supl 1):S209. 63. Ting S, Reimann BE, Rauls DO, Mansfield LE. Nonfamilial, vibration-induced angioedema. J Allergy Clin Immunol. 1983 Jun;71(6):546-51. 64. Pressler A, Grosber M, Halle M, Ring J, Brockow K. Failure of omalizumab and successful control with ketotifen in a patient with vibratory angio-oedema. Clin Exp Dermatol. 2013;38:151-3. 65. Seize MB, Ianhez M, de Souza PK, Rotta O, Cestari CS. Familial aquagenic urticaria: report of two cases and literatura review. An Bras Dermatol. 2009;84:530-3. 66. Shelley WB, Rawnsley HM. Aquagenic urticaria. Contact sensitivity reaction to water. JAMA. 1964;189:895-8. 67. Radonjic-Hoesli S, Hofmeier KS, Micaletto S, Schmid-Grendelmeier P, Bircher A, Simon D. Urticaria and angioedema: an update on classification and pathogenesis. Clin Rev Allergy Immunol. 2018;54(1):88-101. 68. Pitarch G, Torrijos A, Martinez-Menchon T, Sanchez-Carazo JL, Fortea JM. Familial aquagenic urticaria and Bernard-Soulier syndrome. Dermatology. 2006;212:96-7. 69. Czarnetzki BM, Breetholt KH, TraupeH. Evidence that water acts as a carrier for an epidermal antigen in aquagenic urticaria. J Am Acad Dermatol. 1986;15:623-7.
70. Sibbald RG, Black AK, Eady RA, James M, Greaves MW. Aquagenic urticaria: evidence of cholinergic and histaminergic basis. Br J Dermatol. 1981;105(3):297-302.
71. Parker RK, Crowe MJ, Guin JD. Aquagenic urticaria. Cutis. 1992;50:283-4.
72. Martinez-Escribano JA, Quecedo E, DelaCuadra J, Frias J,Sanchez- Pedreno P, Aliaga A. Treatment of aquagenic urticaria with PUVA and astemizole. J Am Acad Dermatol. 1997;36:118-9.
73. Yavuz ST, Sahiner UM, Tuncer A, Sackesen C. Aquagenic urticaria in 2 adolescents. J Investig Allergol Clin Immunol. 2010;20:624-5.
74. Park H, Kim HS, Yoo DS, Kim JW, Kim CW, Kim SS, et al. Aquagenic urticaria: areport of two cases. Ann Dermatol. 2011;23(Suppl. 3):S371-S374.
75. Czarnetzki BM. Ketotifen in cholinergic urticaria. J Allergy Clin Immunol. 1990;86:138-9.
76. Illig L. On the pathogenesis of cholinergic urticaria. I. Clinical observations and histological studies. Arch Klin Exp Dermatol. 1967;229:231-7.
77. Illig L, Heinicke A. On the pathogenesis of cholinergic urticaria. II. Studies on the relationships of cholinergic urticaria to sweat secretions with the help of various cholinomimetics. Arch Klin Exp Dermatol. 1967;229:285-99.
78. Illig L, Heinicke A. On the pathogenesis of cholinergic urticaria. 3. The influence of sweat secretion inhibition on cholinergic urticaria. Arch Klin Exp Dermatol. 1967;229:345-59.
79. Illig L, Heinicke A. On the pathogenesis of cholinergic urticaria. IV. On the problem of a true antigen-antibody reaction. Arch Klin Exp Dermatol. 1967;229:360-71.
80. Illig L, Heinicke A. Pathogenesis of cholinergic urticaria. V. The pharmacologic reactivity of the Prausnitz-Kustner reaction and the origin of the antigen. Arch Klin Exp Dermatol. 1967;230:34-47.
81. Moore-Robinson M, Warin RP. Some clinical aspects of cholinergic urticaria. Br J Dermatol. 1968;80(12):794-9.
82. Fukunaga A, Bito T, Tsuru K, Oohashi A, Yu X, Ichihashi M, et al. Responsiveness to autologous sweat and serum in cholinergic urticaria classifies its clinical subtypes. J Allergy Clin Immunol. 2005;116:397-402.
83. Nakazato Y, Tamura N, Ohkuma A, Yoshimaru K, Shimazu K. Idiopathic pure sudomotor failure: anhidrosis due to deficits in cholinergic transmission. Neurology. 2004;63(8):1476-80.
84. Hatakeyama M, Fukunaga A, Washio K, Ogura K, Yamada Y, Horikawa T, et al. Addition of lafutidine canimprove disease activity and lead to better quality oflife in refractory cholinergic urticaria unresponsive to histamine H1 antagonists. J Dermatol Sci. 2016;82(2):137-9.
85. Oda Y, Fukunaga A, Tsujimoto M, Hatakeyama M, Washio K, Nishigori C. Combined cholinergic urticaria and cold-induced cholinergic urticaria with acquired idiopathic generalized anhidrosis. Allergol Int. 2015;64(2):214-5.
86. Fukunaga A, Washio K, Hatakeyama M, Oda Y, Ogura K, Horikawa T, et al. Cholinergic urticaria: epidemiology, physiopathology, new categorization, and management. Clin Auton Res. 2018;28(1):103-13.
87. Kawakami Y, Gokita M, Fukunaga A, Nishigori C. Refractory case of adrenergic urticaria successfully treated with clotiazepam. J Dermatol. 2015;42(6):635-7.
88. Montgomery SL. Cholinergic urticaria and exercise-induced anaphylaxis. Curr Sports Med Rep. 2015;14:61-3.
89. Altrichter S, Salow J, Ardelean E, Church MK, Werner A, Maurer M. Development of a standardized pulse controlled ergometry test for diagnosing and investigating cholinergic urticaria. J Dermatol Sci. 2014;75(2):88-93.
90. Zuberbier T, Aberer W, Burtin B, Rihoux JP, Czarnetzki BM. Efficacy of cetirizine incholinergic urticaria. Acta Derm Venereol. 1995;75:147-9.
91. Zuberbier T, Munzberger C, HausteinU, Trippas E, Burtin B, Mariz SD, et al. Double-blind crossover study of high-dose cetirizine in cholinergic urticaria. Dermatology. 1996;193:324-7.
92. Metz M, Bergmann P, Zuberbier T, Maurer M. Successful treatment of cholinergic urticaria with anti-immunoglobulin E therapy. Allergy. 2008;63:247-9.
93. Kutlu A, Tanoglu A, Ozturk S. Healingeffects of omalizumab in a patient with cholinergic urticaria associated severe dyspeptic complaints. Chin Med J (Engl). 2015;128:1559-60.
94. Otto HF, Calabria CW. A case of severe refractory chronic urticaria: a novel method for evaluation and treatment. Allergy Asthma Proc. 2009;30(3):333-7.
95. Ujiie H, Shimizu T, Natsuga K, Arita K, Tomizawa K, Shimizu H. Severe cholinergic urticaria successfully treated with scopolamine butylbromide in addition to antihistamines. Clin Exp Dermatol. 2006;31:588-9.
96. Feinberg JH, Toner CB. Successful treatment of disabling cholinergic urticaria. Mil Med. 2008;173:217-20.
97. Sheraz A, Halpern S. Cholinergic urticaria responding to botulinum toxin injection for axillary hyperhidrosis. Br J Dermatol. 2013;168:1369-70.
98. Kozaru T, Fukunaga A, Taguchi K, OguraK, Nagano T, Oka M, et al. Rapid desensitization with autologous sweat in cholinergic urticaria. Allergol Int. 2011;60:277-81.
99. Berth-Jones J, Graham-Brown RA. Cholinergic pruritus, erythema and urticaria: adisease spectrum responding to danazol. Br J Dermatol. 1989;121:235-7.
100. La Shell MS, England RW. Severe refractory cholinergic urticaria treated with dana-zol. J Drugs Dermatol. 2006;5:664-7.
101. Wong E, Eftekhari N, Greaves MW, Ward AM. Beneficial effects of danazol on symptoms and laboratory changes in cholinergic urticaria. Br J Dermatol.1987;116:553-6.




