Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
ARTIGO ESPECIAL
Guia prático do tratamento com omalizumabe para urticária crônica espontânea
Practical guide to omalizumab treatment for chronic spontaneous urticaria
Janaina Michelle Lima Melo1; Leila Vieira Borges2; Alfeu Tavares França3; Gabriela Andrade Dias4; Luis Felipe Chiaverini Ensina5; Rosana Câmara Agondi6; Solange Oliveira Rodrigues Valle3; Régis de Albuquerque Campos2
DOI: 10.5935/2526-5393.20200045
1. Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, Serviço de Alergia e Imunologia Clínica - Ribeirão Preto, SP, Brasil
2. Complexo Hospital Universitário Prof. Edgar Santos da Universidade Federal da Bahia, Ambulatório de Urticária - Salvador, BA, Brasil
3. Universidade Federal do Rio de Janeiro, Serviço de Imunologia do Hospital Universitário Clementino Fraga Filho - Rio de Janeiro, RJ, Brasil
4. Universidade do Estado do Rio de Janeiro, Serviço de Alergia e Imunologia - Rio de Janeiro, RJ, Brasil
5. Universidade Federal de São Paulo, Alergia, Imunologia Clínica e Reumatologia - São Paulo, SP, Brasil
6. Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, Serviço de Imunologia Clínica e Alergia - São Paulo, SP, Brasil
Endereço para correspondência:
Janaina Michelle Lima Melo
E-mail: janaina.doctor@gmail.com
Submetido em: 20/08/2020
Aceito em: 27/08/2020
Conflito de interesses: Melo JML declara ser speaker da Novartis, Sanofi, Astrazeneca, Chiesi. Ensina LFC declara ser speaker, advisory board e participante de pesquisa clínica da Novartis, speaker da Takeda e Mantecorp, speaker e advisory board da Sanofi e Abbvie. Agondi RC e Dias GA declaram ser speakers da Novartis. Valle SOR e Campos RA declaram ser speakers e participantes de pesquisa clínica da Novartis. Borges LV e França AT declaram não ter conflitos de interesses.
RESUMO
A urticária crônica é uma doença com grande impacto socioeconômico e na qualidade de vida do indivíduo. O adequado conhecimento de formas de tratamento eficazes e com perfil de segurança satisfatório, assim como dos mecanismos preditores de resposta ao tratamento, são essenciais para que se alcance um controle adequado da doença. O omalizumabe é um anticorpo monoclonal anti-IgE com eficácia reconhecida e bom perfil de segurança no tratamento da urticária crônica. Objetivamos elucidar questões envolvidas no manejo desta medicação, através da revisão em literatura de estudos atuais e com relevância clínica. Foi realizado levantamento de questões importantes e pouco elucidadas, buscando respostas baseadas nestes estudos. Com isso, foram abordados aspectos práticos do tratamento com o omalizumabe, esclarecendo desde os fenótipos dos pacientes e conduta adequada para estas diferentes situações, trazendo possíveis fatores preditores de resposta ao tratamento e contemplando também um novo anticorpo monoclonal anti-IgE no manejo destes pacientes.
Descritores: Urticária crônica espontânea, omalizumabe, ligelizumabe, tratamento.
INTRODUÇÃO
A urticária é uma condição clínica onde há desenvolvimento de urticas, angioedema ou ambos. É importante diferenciá-la de um grupo de doenças que cursam com desenvolvimento de lesões urticariformes, que não devem ser considerados como subtipos de urticária, e devem fazer parte do seu diagnóstico diferencial, como a urticária vasculite, a mastocitose cutânea maculopapular (urticária pigmentosa), as síndromes autoinflamatórias (síndromes periódicas associadas à criopirina, síndrome de Schnitzler, etc.), angioedema não histaminérgico (ex. mediado por bradicinina), dentre outros1.
A urticária crônica é caracterizada pela ocorrência de lesões diariamente ou quase diariamente, por período superior a 6 semanas1. Pode ser classificada em urticária crônica espontânea (UCE), quando não existe um desencadeante específico, e urticária crônica induzida (UCInd), em que os sintomas podem ser induzidos por estímulos específicos como frio, calor, pressão, aumento da temperatura corporal (colinérgica), fricção (dermografismo sintomático), luz solar, entre outros menos frequentes1.
O diagnóstico da UCE é essencialmente clínico, sendo recomendada uma investigação complementar que inclui somente o hemograma completo e VHS e/ou PCR, sendo os demais exames solicitados conforme a história, exame físico do paciente e necessidades previstas em algumas fases de tratamento (ex. uso de ciclosporina)1.
A avaliação da atividade da doença, do impacto na qualidade de vida e do controle da urticária, devem ser feitos através da aplicação de questionários validados para a doença - exemplo: Escore de atividade da urticária (UAS), Teste de controle de urticária (UCT), e Questionário de qualidade de vida para urticária crônica (CU-Q2oL)1-11.
O tratamento da UCE deve ser iniciado com antihistamínicos H1 (anti-H1) de segunda geração em doses licenciadas, podendo ser utilizado até quatro vezes a dose recomendada em bula, quando necessário. Naqueles pacientes considerados refratários ao tratamento com os anti-histamínicos em altas doses, é indicado o omalizumabe1,12-15.
Neste artigo, buscamos elucidar questões identificadas no seguimento dos pacientes com UCE, assim como aquelas inerentes ao tratamento, em forma de perguntas e respostas baseadas em evidências científicas.
METODOLOGIA
Seis centros de referência e excelência em urticária (UCARE) realizaram um levantamento das principais questões comumente envolvidas no cuidado e tratamento dos pacientes com UCE. Foram selecionados artigos de revisão e artigos originais, através de busca no PubMed com palavras-chaves como urticária, UCE, tratamento e anti-IgE, referente aos últimos 15 anos, que fornecessem as informações necessárias para responder às perguntas em questão.
PERGUNTAS E RESPOSTAS
1. De forma geral, qual o tratamento preconizado para a urticária crônica espontânea?
O tratamento farmacológico de primeira linha é o anti-H1 de segunda geração em doses licenciadas. Não está indicado o uso de anti-H1 de primeira geração em decorrência dos seus efeitos colaterais, que são bem conhecidos. Se após 2 a 4 semanas do início do anti-H1 de 2ª geração, o paciente se mantiver sintomático, ou antes disso, se os sintomas forem intoleráveis, deve-se dobrar ou até quadruplicar a dose, conforme necessidade de controle clínico. Se após 2 a 4 semanas da dose quadruplicada o paciente se mantiver sem controle adequado da urticária (UAS7 > 6 ou UCT < 12), é indicado o omalizumabe1.
O omalizumabe é um anticorpo monoclonal humanizado recombinante, licenciado para o tratamento da UCE a partir de 12 anos de idade. Se após 6 aplicações do omalizumabe não se identifica melhora clínica, é considerado falha terapêutica, e poderá ser orientado uso de medicações com ação imunossupressora (a exemplo da ciclosporina)1.
2. Quando devem ser utilizados os corticoides no tratamento da urticária crônica?
Não se recomenda uso prolongado de corticoide sistêmico devido aos seus efeitos colaterais. Cursos curtos de corticoide sistêmico, em doses habituais, podem ser ponderados nas exacerbações que não controlam com as medicações de uso habitual, e este não deve ultrapassar 10 dias1,16. O uso de corticoides tópicos não é recomendado por ausência de evidências que indiquem eficácia.
3. Na etapa de tratamento com omalizumabe, qual a dose aplicada e intervalo?
O omalizumabe está disponível na apresentação em frasco ampola com 150 mg da medicação. É preconizada a aplicação via subcutânea da dose de 300 mg, a cada 4 semanas1,12,13,17.
4. Omalizumabe é eficaz para qual tipo de urticária crônica?
A eficácia do omalizumabe foi bem definida para tratamento de pacientes com UCE. No entanto, existem evidências crescentes mostrando a eficácia do tratamento com omalizumabe em pacientes com UCE e UCInd associadas1,15,18-20. Apesar do omalizumabe não ser licenciado para uso em pacientes com UCInd isoladamente, existem evidências que comprovam sua eficácia em pacientes com urticária dermográfica21,22, ao frio23-25 e solar26, que não responderam a doses quadruplicadas do anti-H1.
5. Qual é a eficácia do omalizumabe de acordo com os estudos clínicos e de vida real?
O tratamento com o omalizumabe demonstrou um bom perfil de eficácia em estudo clínicos e estudos de vida real12-14,17,27-30. Segundo o estudo ASTERIA I, que foi um estudo global de fase III, multicêntrico, randomizado, duplo-cego, placebo controlado, na dose de 300 mg/mês, em pacientes refratários a doses licenciadas de anti-H1, houve redução no escore do prurido (analisado através do ISS semanal) em 5,81 pontos (IC 95%: -7,49 a -4,10; p < 0,0001), assim como porcentagens mais altas de pacientes com sintomas controlados (UAS7≤6: 51,9% vs. 11,3%; p < 0,0001) ou com remissão total dos sintomas (UAS7 = 0: 35,8% vs. 8,8%; p < 0,0001) em comparação ao placebo12. No estudo ASTERIA II, que tinha um desenho semelhante, mas com observação por período mais curto, 44% dos pacientes que usaram o omalizumabe na dose de 300 mg/mês, após 12 semanas de tratamento, tiveram UAS7 de zero, ao passo que no grupo placebo somente 5% dos pacientes alcançaram este UAS7. E por fim, no estudo GLACIAL, em que pacientes refratários a doses quadruplicadas de anti-H1 foram tratados com omalizumabe, 34% dos casos ficaram assintomáticos após 12 semanas de tratamento com o omalizumabe, contra 5% do placebo13,17. Estudos de vida real em pacientes refratários ao tratamento com anti-H1 em doses quadruplicadas demonstraram uma eficácia superior à descrita nos ensaios clínicos, de modo que uma recente metanálise descreveu que 72,2% dos pacientes apresentaram controle completo dos sintomas, e 17,8% do controle parcial com o omalizumabe31. Dados nacionais indicam que até 85% dos pacientes refratários aos anti-H1 tratados com omalizumabe apresentam resposta29.
6. É necessário solicitar algum tipo de exame antes de indicar e iniciar o omalizumabe?
Não há indicação formal em literatura de realização de exames antes de iniciar a aplicação do omalizumabe1. No entanto alguns estudos sugerem que os níveis totais de IgE se relacionam como preditores de resposta ao tratamento com o omalizumabe. Diante do exposto, se possível é recomendável realizar este exame antes do tratamento com omalizumabe nos pacientes com UCE15,32-38.
7. O omalizumabe pode ser utilizado em gestantes e lactantes?
Por razões éticas não são realizados estudos clínicos em pacientes gestantes ou que amamentam, porém não foram observadas evidências de teratogenicidade ou embriotoxicidade em estudos pré-clínicos. No entanto, o omalizumabe parece atravessar a placenta e ser excretado em pequenas quantidades no leite materno. O registro EXPECT, que foi um estudo observacional pós-marketing em pacientes com asma que estavam em uso de omalizumabe, não evidenciou eventos adversos em mulheres grávidas expostas ao omalizumabe no período de 8 semanas antes da concepção ou durante a gravidez39. Em estudos de vida real, também não foram observados eventos adversos relacionados ao feto ou ao lactente40. O uso do omalizumabe em gestantes é categoria B de risco conforme definido pelo Food and Drug Administration (FDA)15.
8. O omalizumabe poderia ser utilizado em crianças menores de 12 anos?
Existem apenas alguns relatos de caso sobre eficácia e segurança do omalizumabe em crianças menores de 12 anos com UCE refratária ao tratamento com antiH141. Na asma, o omalizumabe é indicado a partir dos 6 anos de idade. Caso seja proposto o uso do omalizumabe nesta faixa etária, é importante que o paciente (quando possível) e o representante legal, entendam que se trata de uso off-label1,15.
9. Após iniciar o omalizumabe devem ser mantidos os anti-histamínicos?
A indicação até o presente momento é de que o omalizumabe seja uma terapia complementar aos anti-H1 na UCE1. No entanto, o omalizumabe tem se mostrado eficaz sem a necessidade de manter terapia concomitante com anti-H1 em até 60% dos casos42. Estudo retrospectivo, multicêntrico que avaliou o uso de anti-histamínico nos pacientes com UCE tratados e controlados com omalizumabe evidenciou que não havia associação significativa da gravidade com o uso dos anti-H1, assim como entre respondedores precoces ou tardios43. Türk e cols. recomendam que se o paciente não apresentou nenhum benefício com o uso do anti-H1 antes de iniciar o omalizumabe no momento que este último é iniciado, o anti-H1 pode ser suspenso desde que esta decisão seja de forma conjunta com o paciente. Enquanto naqueles pacientes que se beneficiam de alguma forma do uso do anti-H1 ele deverá ser mantido até que se atinja uma resposta adequada com o omalizumabe, quando então o antiH1 poderia ser reduzido15.
10. Quais são os possíveis efeitos colaterais do omalizumabe e qual a frequência com que ocorrem?
O omalizumabe é um medicamento com baixa frequência de efeitos colaterais, de forma que somente 4% dos pacientes necessitam interromper a medicação por algum evento adverso30,31,44,45. Os pacientes podem relatar cefaleia, astenia, fadiga e até exacerbação da urticária, porém em geral estes sintomas são leves e tendem a reduzir após a segunda aplicação da medicação15,44. Eventos adversos graves que resultem em interrupção da medicação são raros, e compreendem trombocitopenia, hipertensão, abscesso pélvico, infecção retroperitoneal e anafilaxia46-49.
11. O omalizumabe é seguro e eficaz em pacientes oncológicos com UCE?
Existem poucos estudos que abordem esta correlação. Os estudos com maior tempo de uso de tratamento são para pacientes com asma, e não foi observado até o momento maior risco de câncer ou piora nestes pacientes50-52.
12. Como proceder com o paciente que está em uso prévio de ciclosporina?
Como nas versões anteriores do consenso internacional, o uso da ciclosporina era indicado na mesma etapa de tratamento do omalizumabe53, podemos encontrar alguns pacientes que após a dose quadruplicada de anti-H1 progrediram para ciclosporina ao invés de omalizumabe. Portanto, podem existir três perfis de pacientes15:
1 -Paciente com resposta completa da UCE em uso de ciclosporina - avaliar retirada deste medicamento e checar se o paciente já evoluiu para remissão. Se na retirada lenta ocorrer recidiva das lesões, deve-se substituir para omalizumabe pelo risco/benefício;
2 -Paciente sem resposta à ciclosporina - suspender e iniciar o omalizumabe;
3 -Paciente com resposta parcial à ciclosporina - iniciar o omalizumabe mantendo a ciclosporina na dose eficaz mais baixa. Quando o controle completo com omalizumabe for alcançado, a ciclosporina deve ser interrompida.
13. Como avaliar a resposta ao tratamento com omalizumabe? Como considero um paciente controlado?
A avaliação da resposta ao tratamento com omalizumabe pode ser feita através de ferramentas clínicas validadas que são respondidas pelo próprio paciente, como o UAS7 ou UCT2-4.
O UAS7 é uma ferramenta prospectiva, que avalia os sintomas da urticária por 7 dias consecutivos (número de urticas e intensidade do prurido). O mínimo da pontuação é zero, e o máximo 42. Para considerar o paciente controlado, o UAS7 deve estar menor ou igual a 62,3.
O UCT é uma ferramenta retrospectiva, já validada em português11, que pode ser aplicada no dia da consulta informando sobre 4 questões sobre o controle da urticária no último mês. Os valores variam de 0 a 16, e considera valores maiores do que 12 como doença controlada5,6.
Outro questionário útil é o CU-Q2oL, que demonstra a qualidade de vida do paciente, avaliando quanto os fatores relacionados com a urticária atrapalham o seu cotidiano, já validado em português10. Apresenta valores entre 23 a 115, onde 23 é considerado excelente qualidade de vida, e 115 pior qualidade de vida7,8,10.
Assim como o UAS, o Escore de Atividade do Angioedema (AAS) é uma ferramenta validada de avaliação prospectiva, sendo composta de 5 perguntas com avaliação apenas do angioedema. Deve ser preenchida diariamente, durante as 4 semanas consecutivas anteriores à consulta, e sua pontuação semanal varia de 0 a 105 pontos. Dentre as suas limitações, além de ser particularmente útil apenas nos pacientes com angioedema sem urtica e se tratar de uma ferramenta prospectiva, estão a dificuldade de adesão e não ter sido avaliada para uso em crianças3,4,54.
O questionário validado que aborda o impacto do angioedema na qualidade de vida do paciente (AE-QoL) pode ser aplicado no máximo a cada 6 meses, referente ao período das 4 semanas anteriores à consulta. Os valores vão de 17 a 85, onde 17 é uma excelente qualidade de vida, e 85 uma pior qualidade de vida. Uma importante limitação desta ferramenta é o fato de não ter um ponto de corte para classificar sua gravidade3,4,55.
14. Quais são os tipos de resposta ao tratamento com omalizumabe?
Podemos considerar três tipos de respondedores56,57:
- Respondedores rápidos: correspondem a 61% dos pacientes, são aqueles que apresentam controle da UCE no primeiro mês da aplicação do omalizumabe (UAS7 ≤ 6 ou UCT ≥ 12), sendo que 28% respondem no primeiro dia do tratamento;
- Respondedores tardios (lentos): correspondem a 27% dos pacientes, são aqueles que apresentam controle da UCE entre o primeiro e sexto mês de tratamento;
- Não respondedores: correspondem a 12% dos pacientes, são aqueles que não respondem após o sexto mês de tratamento. Dentre os respondedores, podemos classificá-los em respondedores parciais e respondedores completos. Os respondedores completos são aqueles que melhoraram totalmente da UCE, mantendo escores de UAS7 ≤ 6 ou UCT 1659-50. Os respondedores parciais são frequentemente definidos por uma redução do UAS7 em pelo menos 30%, mas em menos de 90% ou por pacientes que mostrem um UAS7> 6, mas com uma melhora no UAS7 em comparação com o valor basal. Em relação ao UCT, os respondedores parciais apresentam valores de 11 e 1258.
15. Qual o tempo mínimo que devo manter o omalizumabe para avaliar eficácia ou falha de resposta?
O tempo mínimo para avaliar eficácia do omalizumabe é seis meses ou antes, se o paciente apresentar piora dos sintomas. Os estudos pivotais mostraram que a frequência de respondedores ao omalizumabe aumenta ao longo do tratamento nos seis primeiros meses15,44,56.
16. Se o paciente tiver boa resposta ao omalizumabe, por quanto tempo devo manter o tratamento?
O consenso internacional recomenda tratar a UCE até que a doença desapareça, ou seja, até o completo controle dos sintomas e estabilização da doença sem tratamento. Assim, não é possível predizer por quanto tempo o omalizumabe deverá ser utilizado visto que não é um tratamento modificador ou curativo, apenas controla eficazmente os sintomas1.
17. Como fazer a retirada do omalizumabe se o paciente estiver controlado?
Atualmente não existem biomarcadores que indiquem quando descontinuar o tratamento. Portanto, como a UCE é autolimitada, deve-se retirar o omalizumabe após o controle completo dos sintomas, para que se avalie a possibilidade de remissão da doença. Um dos esquemas mais utilizados é a retirada gradual, mantendo a dose de 300 mg via subcutânea, e aumentando os intervalos entre cada dose. Quando o paciente apresentar UAS7 igual a zero, por no mínimo 6 meses, pode-se aumentar o intervalo entre as doses para cada 6 semanas, em dois momentos. Se permanecer com os parâmetros de controle anteriores, espaçar para 8 semanas por mais dois momentos, e em seguida suspender o omalizumabe15 (Figura 1).
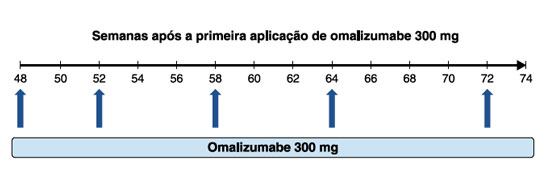
Figura 1
Esquema de retirada gradual do omalizumabe após controle completo da urticária crônica espontânea (UCE)
Outro esquema de retirada descrito na literatura envolve o espaçamento gradual por semana até chegar ao intervalo de 8 semanas e ser descontinuado. Este método foi descrito na Holanda, analisando 132 pacientes com UCE após 6 meses de uso contínuo de omalizumabe, com bom controle em 92%. Neste estudo, 73% dos pacientes foram capazes de estender o intervalo entre as doses para mais que 6 semanas, 57% para mais que 8 semanas, e somente 18% não conseguiram espaçar o intervalo para mais que 4 semanas. Foi observado neste estudo que os pacientes respondedores rápidos foram estatisticamente significante mais propensos ao êxito no espaçamento entre doses do que os pacientes respondedores tardios59. Alguns pacientes podem ficar controlados com doses de omalizumabe em intervalos de até 12 semanas, apresentando piora em períodos superiores a este (observação não publicada).
18. Como manejar pacientes que melhoram com omalizumabe, mas que a redução do UAS7 não foi suficiente para ser considerado como controle (UAS7 menor ou igual a 6)?
Alguns pacientes apresentam piora dos sintomas nos dias que antecedem a aplicação do omalizumabe dentro dos intervalos regulares de 4 semanas. Nestes casos, sugere-se encurtar o intervalo para 3 semanas15,60,61.
Naqueles pacientes sem resposta adequada ao omalizumabe 300 mg em intervalos de 4 semanas, pode-se aumentar a dose total mensal para 450 mg ou 600 mg (em dose única, ou fracionada em intervalos de 15 dias). O aumento da dose de omalizumabe para 450 ou 600 mg é eficaz para controlar a UCE em até 75% dos pacientes62.
19. Como manejar os pacientes que não apresentam resposta ao omalizumabe após os 6 meses?
Caso o paciente não apresente controle dos sintomas (UAS > 6 ou UCT < 12) após 6 meses de tratamento com omalizumabe, prosseguir avançando no algoritmo de tratamento e iniciar ciclosporina na dose de 3 mg/kg/dia1,15.
20. Após suspensão do omalizumabe, qual a taxa de recorrência?
Nos ensaios clínicos e nos estudos de vida real, as taxas de recidiva após a interrupção do omalizumabe são altas, na maioria dos estudos acima de 40%15,63-65. Se ocorrer recidiva após o término do tratamento, deve-se reiniciar o algoritmo do seu início, com anti-H1 em doses licenciadas e depois duplicadas ou quadruplicadas. Em caso de ausência de resposta aos anti-H1 novamente, ou em casos moderados a graves, não retardar o reinício do tratamento com omalizumabe. Os estudos mostram que o retratamento com omalizumabe é eficaz na maioria dos pacientes que eram previamente respondedores63,64,66-68.
21. Existe algum perfil de paciente que pode recidivar antes dos outros?
Ferrer e cols. mostraram que a chance de recidiva está relacionada à gravidade da doença (UAS7 inicial) e também ao tempo de resposta ao omalizumabe69.
- UAS7 inicial GRAVE e
Resposta RÁPIDA ao omalizumabe: maior chance de ter recidiva LEVE após retirada.
Resposta LENTA ao omalizumabe: maior chance de ter recidiva GRAVE após retirada.
- UAS7 inicial MODERADO e
Resposta RÁPIDA ao omalizumabe: maior chance de NÃO ter recidiva.
22. Existe algum biomarcador que indique melhor ou pior resposta ao omalizumabe?
Recentes estudos têm ajudado na compreensão da resposta ao tratamento com omalizumabe na UCE (respondedores completos, parciais e não respondedores) e dos diferentes perfis de respondedores (rápidos e lentos) através de descobertas sobre mecanismos relevantes e biomarcadores que podem funcionar como preditores de resposta32,33,37,45,70-73.
Um possível biomarcador é a dosagem da IgE total antes e durante o tratamento. Artigos recentes têm postulado que pacientes respondedores parciais ou não respondedores tinham baixos níveis de IgE total basal, ou seja, considerando assim dosagem menor que 40 UI/mL um possível preditor de má resposta ao omalizumabe32,35,74. Ertas e cols. identificaram que os não respondedores apresentavam não somente IgE total basal mais baixa, mas também um aumento menor nos níveis totais de IgE na quarta semana de tratamento. Assim, uma proporção inferior a 2 entre os valores de IgE após a semana 4 e os valores basais podem estar associados a um risco maior de não resposta33.
Outros biomarcadores que são citados como associados a baixa resposta ao omalizumabe e alta atividade da doença são os níveis elevados de D-dímeros36-38,75, basopenia76,77, eosinopenia70 e teste de soro autólogo positivo57. No entanto, mais dados são necessários para considerarmos estes parâmetros como úteis para o uso na prática clínica.
23. Quais informações no laudo técnico do médico são importantes para obter acesso ao omalizumabe?
O acesso ao omalizumabe ainda é um desafio para muitos pacientes em diferentes regiões do Brasil. No sentido de minimizar o tempo e aumentar a chance de sucesso no acesso, independente da via, na Tabela 1 são descritos os itens mais importantes para a elaboração de um laudo que será encaminhado para a rede pública ou privada.
24. Além do omalizumabe, existe alguma perspectiva de outra estratégia para inibir a ação da IgE no tratamento da UCE?
Sim. O ligelizumabe é um novo anticorpo monoclonal humanizado de alta afinidade anti-IgE, que vem sendo estudado comparativamente ao omalizumabe, evidenciando em ensaios clínicos, uma afinidade de 40 a 50 vezes maior para IgE in vitro e uma potência nove vezes maior em comparação ao omalizumabe78. Esta superioridade do ligelizumabe com relação ao omalizumabe parece estar relacionado a diferenças dos epítopos de ligação. Além do ligelizumabe se ligar ao receptor FcεRI da IgE com afinidade significativamente maior do que o omalizumabe e mostrar uma inibição aumentada da ligação de IgE a FcεRI e ativação de basófilos, ele interage através do dímero IgE-Fc e favorece o reconhecimento de IgE em uma conformação aberta diferente de suas conformações ligadas a FcεRII ou CD2379.
Em estudo multicêntrico, randomizado, duplocego, placebo controlado, de fase 2b, foi avaliada a eficácia e segurança do ligelizumabe em pacientes com urticária moderada/grave (UAS7 ≥ 16), refratários ao tratamento com anti-H1 isolado ou associado a antileucotrienos ou anti-histamínicos H280. Os participantes foram randomizados em grupos distintos que receberam doses subcutâneas do ligelizumabe de 24, 72 e 240 mg, omalizumabe 300 mg ou placebo, todos em intervalos de 4 semanas, assim como dose única de 120 mg do ligelizumabe seguida de placebo. Avaliados após 12 semanas, foi observado que a dose de 72 mg foi associada com melhor desfecho, onde 44% dos pacientes tratados com ligelizumabe apresentaram controle completo dos sintomas, versus 26% dos tratados com omalizumabe, e nenhum com placebo. Com relação ao perfil de segurança, foi similar a porcentagem de pacientes que referiram pelo menos um evento ad-verso entre os grupos que receberam ligelizumabe, omalizumabe e placebo. Foram observadas reações leves a moderadas no sítio de aplicação em 4% dos pacientes tratados com a dose de 72 mg e 7% dos que receberam 240 mg, assim como eritema leve no local de aplicação em 2% e 6% respectivamente. Eventos adversos graves foram observados em 7%, 2% e 2% dos pacientes tratados com as doses de 24, 72 e 240 mg, respectivamente, contra 4% dos tratados com omalizumabe e 9% dos que receberam placebo. Os eventos adversos mais frequentemente relatados foram infecção viral do trato respiratório superior (20%), outras infecções do trato respiratório superior (13%) e cefaleia (11%). Não houve óbitos e nem quadro de anafilaxia em nenhum dos grupos neste ensaio clínico80.
Diante disso, o ligelizumabe parece ser efetivo no tratamento da urticária crônica espontânea, parecendo ser mais efetivo que o omalizumabe nas doses ≥ 72 mg80. Estudos de fase III estão em andamento e irão fornecer mais informações quanto ao melhor momento de usar o ligelizumabe, e em que perfil de paciente.
CONCLUSÃO
O uso do omalizumabe, anticorpo monoclonal anti-IgE, indicado nos casos de urticária crônica espontânea refratários a dose quadruplicada de antiH1 é uma opção segura e eficaz. Deve ser usado por tempo mínimo de seis meses para avaliação da eficácia, na dose de 300 mg via subcutânea em intervalos de administração a cada quatro semanas.
Estudos recentes têm demonstrado segurança a longo prazo, inclusive em gestantes e lactantes. Existem novas evidências que essa recomendação possa ser modificada dependendo da resposta ao tratamento, com a possibilidade de aumentar a dose do omalizumabe para 450 ou 600 mg, ou diminuir o intervalo de administração para quinzenal, objetivando o controle total dos sintomas. O uso de questionários para avaliação da atividade (UAS7) e controle da urticaria (UCT) é fundamental para a avaliação da resposta ao tratamento e também guiando a retirada gradual do omalizumabe. Caso o paciente apresente recidiva após a retirada, existe possibilidade de retratamento com boa eficácia, existindo perfis de pacientes com maior chance para recidiva, como os pacientes com UAS7 inicial grave e resposta tardia a anti-IgE. O papel de biomarcadores da resposta ao tratamento do omalizumabe ainda é limitado, sendo os níveis de IgE total o principal indicador. Por fim, para os casos de UCE que não respondem ao omalizumabe, existe uma nova perspectiva de terapia ainda não aprovada no Brasil, o ligelizumabe, que consiste num anticorpo anti-IgE com maior afinidade de ligação pelo receptor, e maior potência, comparado ao omalizumabe.
REFERÊNCIAS
1. Zuberbier T, Aberer W, Asero R, Abdul Latiff AH, Baker D, Ballmer- Weber B, et al. The EAACI/GA(2)LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018;73(7):1393-414.
2. Hawro T, Ohanyan T, Schoepke N, Metz M, Peveling-Oberhag A, Staubach P, et al. The Urticaria Activity Score-Validity, Reliability, and Responsiveness. J Allergy Clin Immunol Pract. 2018;6(4):1185-90.e1.
3. Weller K, Siebenhaar F, Hawro T, Altrichter S, Schoepke N, Maurer M. Clinical Measures of Chronic Urticaria. Immunol Allergy Clin North Am. 2017;37(1):35-49.
4. Moestrup K, Ghazanfar MN, Thomsen SF. Patient-reported outcomes (PROs) in chronic urticaria. Int J Dermatol. 2017;56(12):1342-8.
5. Weller K, Groffik A, Church MK, Hawro T, Krause K, Metz M, et al. Development and validation of the Urticaria Control Test: a patientreported outcome instrument for assessing urticaria control. J Allergy Clin Immunol. 2014;133(5):1365-72.
6. Ohanyan T, Schoepke N, Bolukbasi B, Metz M, Hawro T, Zuberbier T, et al. Responsiveness and minimal important difference of the urticaria control test. J Allergy Clin Immunol. 2017;140(6):1710-3.
7. Baiardini I, Braido F, Bindslev-Jensen C, Bousquet PJ, Brzoza Z, Canonica GW, et al. Recommendations for assessing patientreported outcomes and health-related quality of life in patients with urticaria: a GA(2) LEN taskforce position paper. Allergy. 2011;66(7):840-4.
8. Baiardini I, Fasola S, Maurer M, Weller K, Canonica GW, Braido F. Minimal important difference of the Chronic Urticaria Quality of Life Questionnaire (CU-Q2oL). Allergy. 2019;74(12):2542-4.
9. Baiardini I, Pasquali M, Braido F, Fumagalli F, Guerra L, Compalati E, et al. A new tool to evaluate the impact of chronic urticaria on quality of life: chronic urticaria quality of life questionnaire (CU-QoL). Allergy. 2005;60(8):1073-8.
10. Dias GA, Pires GV, Valle SO, Franca AT, Papi JA, Dortas Jr. SD, et al. Cross-cultural adaptation of the Brazilian-Portuguese version of the chronic urticaria quality-of-life questionnaire - CU-Q2oL. Allergy. 2011;66(11):1487-93.
11. Dortas Junior S, Valle S, Weller K, Lupi O, Maurer M. Adaptação transcultural do questionário "Urticaria Control Test" para o português brasileiro. InterScience Place. 2017;12:165-75.
12. Saini SS, Bindslev-Jensen C, Maurer M, Grob JJ, Bülbül Baskan E, Bradley MS, et al. Efficacy and safety of omalizumab in patients with chronic idiopathic/spontaneous urticaria who remain symptomatic on h1 antihistamines: a randomized, placebo-controlled study. J Invest Dermatol. 2015;135(3):925.
13. Maurer M, Rosén K, Hsieh HJ, Saini S, Grattan C, Gimenéz-Arnau A, et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med. 2013;368(10):924-35.
14. Saini S, Rosen KE, Hsieh HJ, Wong DA, Conner E, Kaplan A, et al. A randomized, placebo-controlled, dose-ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticaria. J Allergy Clin Immunol. 2011;128(3):567-73.
15. Türk M, Carneiro-Leao L, Kolkhir P, Bonnekoh H, Buttgereit T, Maurer M. How to treat patients with chronic spontaneous urticaria with omalizumab: questions and answers. J Allergy Clin Immunol Pract. 2020;8(1):113-24.
16. Asero R, Tedeschi A. Usefulness of a short course of oral prednisone in antihistamine-resistant chronic urticaria: a retrospective analysis. J Investig Allergol Clin Immunol. 2010;20(5):386-90.
17. Kaplan A, Ledford D, Ashby M, Canvin J, Zazzali JL, Conner E, et al. Omalizumab in patients with symptomatic chronic idiopathic/ spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol. 2013;132(1):101-9.
18. Gastaminza G, Azofra J, Nunez-Cordoba JM, Baeza ML, Echechipia S, Gaig P, et al. Efficacy and Safety of Omalizumab (Xolair) for Cholinergic Urticaria in Patients Unresponsive to a Double Dose of Antihistamines: A Randomized Mixed Double-Blind and Open- Label Placebo-Controlled Clinical Trial. J Allergy Clin Immunol Pract. 2019;7(5):1599-609.
19. Maurer M, Metz M, Brehler R, Hillen U, Jakob T, Mahler V, et al. Omalizumab treatment in patients with chronic inducible urticaria: A systematic review of published evidence. J Allergy Clin Immunol. 2018;141(2):638-49.
20. Dressler C, Werner RN, Eisert L, Zuberbier T, Nast A, Maurer M. Chronic inducible urticaria: a systematic review of treatment options. J Allergy Clin Immunol. 2018;141(5):1726-34.
21. Krause K, Ardelean E, Kessler B, Magerl M, Metz M, Siebenhaar F, et al. Antihistamine-resistant urticaria factitia successfully treated with anti-immunoglobulin E therapy. Allergy. 2010;65(11):1494-5.
22. Maurer M, Schütz A, Weller K, Schoepke N, Peveling-Oberhag A, Staubach P, et al. Omalizumab is effective in symptomatic dermographism-results of a randomized placebo-controlled trial. J Allergy Clin Immunol. 2017;140(3):870-3.
23. Metz M, Schütz A, Weller K, Gorczyza M, Zimmer S, Staubach P, et al. Omalizumab is effective in cold urticaria-results of a randomized placebo-controlled trial. J Allergy Clin Immunol. 2017;140(3):864-7.
24. Krause K, Zuberbier T, Maurer M. Modern approaches to the diagnosis and treatment of cold contact urticaria. Curr Allergy Asthma Rep. 2010;10(4):243-9.
25. Boyce JA. Successful treatment of cold-induced urticaria/anaphylaxis with anti-IgE. J Allergy Clin Immunol. 2006;117(6):1415-8.
26. Güzelbey O, Ardelean E, Magerl M, Zuberbier T, Maurer M, Metz M. Successful treatment of solar urticaria with anti-immunoglobulin E therapy. Allergy. 2008;63(11):1563-5.
27. Zhao ZT, Ji CM, Yu WJ, Meng L, Hawro T, Wei JF, et al. Omalizumab for the treatment of chronic spontaneous urticaria: A metaanalysis of randomized clinical trials. J Allergy Clin Immunol. 2016;137(6):1742-50.
28. Maurer M, Altrichter S, Bieber T, Biedermann T, Bräutigam M, Seyfried S, et al. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Immunol. 2011;128(1):202-9.
29. Ensina LF, Valle SO, Juliani AP, Galeane M, Vieira dos Santos R, Arruda LK, et al. Omalizumab in Chronic Spontaneous Urticaria: A Brazilian Real-Life Experience. Int Arch Allergy Immunol. 2016;169(2):121-4.
30. Rubini NPM, Ensina LFC, Silva EMK, Sano F, Sole D. Effectiveness and safety of Omalizumab in the treatment of chronic spontaneous urticaria: Systematic review and meta-analysis. Allergol Immunopathol (Madr). 2019;47(6):515-22.
31. Tharp MD, Bernstein JA, Kavati A, Ortiz B, MacDonald K, Denhaerynck K, et al. Benefits and Harms of Omalizumab Treatment in Adolescent and Adult Patients With Chronic Idiopathic (Spontaneous) Urticaria: A Meta-analysis of "Real-world" Evidence. JAMA Dermatol. 2019;155(1):29-38.
32. Weller K, Ohanyan T, Hawro T, Ellrich A, Sussman G, Koplowitz J, et al. Total IgE levels are linked to the response of chronic spontaneous urticaria patients to omalizumab. Allergy. 2018;73(12):2406-8.
33. Ertas R, Ozyurt K, Atasoy M, Hawro T, Maurer M. The clinical response to omalizumab in chronic spontaneous urticaria patients is linked to and predicted by IgE levels and their change. Allergy. 2018;73(3):705-12.
34. Deza G, Ricketti PA, Gimenez-Arnau AM, Casale TB. Emerging Biomarkers and Therapeutic Pipelines for Chronic Spontaneous Urticaria. J Allergy Clin Immunol Pract. 2018;6(4):1108-17.
35. Ertas R, Ozyurt K, Ozlu E, Ulas Y, Avci A, Atasoy M, et al. Increased IgE levels are linked to faster relapse in patients with omalizumabdiscontinued chronic spontaneous urticaria. J Allergy Clin Immunol. 2017;140(6):1749-51.
36. Asero R, Marzano AV, Ferrucci S, Genovese G, Cugno M. Baseline D-dimer plasma levels correlate with disease activity but not with the response to omalizumab in chronic spontaneous urticaria. Allergy. 2019;74(12):2538.
37. Ghazanfar MN, Thomsen SF. D-dimer as a potential blood biomarker for disease activity and treatment response in chronic urticaria: a focused review. Eur J Dermatol. 2018;28(6):731-5.
38. Cugno M, Genovese G, Ferrucci S, Casazza G, Asero R, Marzano AV. IgE and D-dimer baseline levels are higher in responders than nonresponders to omalizumab in chronic spontaneous urticaria. Br J Dermatol. 2018;179(3):776-7.
39. Namazy J, Cabana MD, Scheuerle AE, Thorp JM, Chen H, Carrigan G, et al. The Xolair Pregnancy Registry (EXPECT): the safety of omalizumab use during pregnancy. J Allergy Clin Immunol. 2015;135(2):407-12.
40. Ensina LF, Cusato-Ensina AP, Camelo-Nunes IC, Solé D. Omalizumab as Third-Line Therapy for Urticaria During Pregnancy. J Investig Allergol Clin Immunol. 2017;27(5):326-7
41. Ben-Shoshan M, Grattan CE. Management of Pediatric Urticaria with Review of the Literature on Chronic Spontaneous Urticaria in Children. J Allergy Clin Immunol Pract. 2018;6(4):1152-61.
42. Bernstein JA, Kavati A, Tharp MD, Ortiz B, MacDonald K, Denhaerynck K, et al. Effectiveness of omalizumab in adolescent and adult patients with chronic idiopathic/spontaneous urticaria: a systematic review of 'real-world' evidence. Expert Opin Biol Ther. 2018;18(4):425-48.
43. Ensina LF, Arruda LK, Campos RA, Criado RF, Rodrigues Valle S, Melo JM, et al. H1-Antihistamines May No Longer Be Necessary for Patients With Refractory Chronic Spontaneous Urticaria After Initiation of Omalizumab. J Investig Allergol Clin Immunol. 2020;30(2):145-7.
44. Casale TB, Bernstein JA, Maurer M, Saini SS, Trzaskoma B, Chen H, et al. Similar Efficacy with Omalizumab in Chronic Idiopathic/ Spontaneous Urticaria Despite Different Background Therapy. J Allergy Clin Immunol Pract. 2015;3(5):743-50.
45. Nettis E, Cegolon L, Di Leo E, Lodi Rizzini F, Detoraki A, Canonica GW. Omalizumab in chronic spontaneous urticaria: Efficacy, safety, predictors of treatment outcome, and time to response. Ann Allergy Asthma Immunol. 2018;121(4):474-8.
46. Casale TB, Murphy TR, Holden M, Rajput Y, Yoo B, Bernstein JA. Impact of omalizumab on patient-reported outcomes in chronic idiopathic urticaria: Results from a randomized study (XTEND-CIU). J Allergy Clin Immunol Pract. 2019;7(7):2487-90.
47. Larenas-Linnemann DES, Parisi CAS, Ritchie C, Cardona-Villa R, Cherrez-Ojeda I, Cherrez A, et al. Update on Omalizumab for Urticaria: What's New in the Literature from Mechanisms to Clinic. Curr Allergy Asthma Rep. 2018;18(5):33.
48. Hide M, Igarashi A, Yagami A, Chinuki Y, Inomata N, Fukunaga A, et al. Efficacy and safety of omalizumab for the treatment of refractory chronic spontaneous urticaria in Japanese patients: Subgroup analysis of the phase 3 POLARIS study. Allergol Int. 2018;67(2):243-52.
49. Mandel VD, Guanti MB, Liberati S, Demonte A, Pellacani G, Pepe P. Omalizumab in Chronic Spontaneous Urticaria Refractory to Conventional Therapy: An Italian Retrospective Clinical Analysis with Suggestions for Long-Term Maintenance Strategies. Dermatol Ther (Heidelb). 2018;8(2):291-301.
50. Navarro-Trivino FJ, Merida-Fernandez C, Linares-Gonzalez L, Ruiz-Villaverde R. Is omalizumab safe and effective in oncological patients? Dermatol Ther. 2019:e13115.
51. Long A, Rahmaoui A, Rothman KJ, Guinan E, Eisner M, Bradley MS, et al. Incidence of malignancy in patients with moderate-tosevere asthma treated with or without omalizumab. J Allergy Clin Immunol. 2014;134(3):560-7.
52. Busse W, Buhl R, Fernandez Vidaurre C, Blogg M, Zhu J, Eisner MD, et al. Omalizumab and the risk of malignancy: results from a pooled analysis. J Allergy Clin Immunol. 2012;129(4):983-9.
53. Zuberbier T, Aberer W, Asero R, Bindslev-Jensen C, Brzoza Z, Canonica GW, et al. The EAACI/GA(2) LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria: the 2013 revision and update. Allergy. 2014;69(7):868-87.
54. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development, validation, and initial results of the Angioedema Activity Score. Allergy. 2013;68(9):1185-92.
55. Weller K, Groffik A, Magerl M, Tohme N, Martus P, Krause K, et al. Development and construct validation of the angioedema quality of life questionnaire. Allergy. 2012;67(10):1289-98.
56. Kaplan A, Ferrer M, Bernstein JA, Antonova E, Trzaskoma B, Raimundo K, et al. Timing and duration of omalizumab response in patients with chronic idiopathic/spontaneous urticaria. J Allergy Clin Immunol. 2016;137(2):474-81.
57. Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, et al. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2017;139(3):1059-61.
58. Metz M, Vadasz Z, Kocatürk E, Giménez-Arnau AM. Omalizumab Updosing in Chronic Spontaneous Urticaria: an Overview of Real- World Evidence. Clin Rev Allergy Immunol. 2020;59(1):38-45.
59. Aghdam MA, Pieterse RH, Kentie Manp PA, Rijken F, Knulst AC, Röckmann H. Effective omalizumab interval prolongation in the treatment of chronic urticaria. J Allergy Clin Immunol Pract. 2020.
60. Turk M, Kocaturk E, Cure K, Yilmaz I. Two-week intervals during omalizumab treatment may provide better symptom control in selected patients with chronic urticaria. J Allergy Clin Immunol Pract. 2018;6(4):1389-90.
61. Niemeyer-van der Kolk T, van Maaren MS, van Doorn MBA. Personalized omalizumab treatment improves clinical benefit in patients with chronic spontaneous urticaria. J Allergy Clin Immunol. 2018;142(6):1992-4.
62. Curto-Barredo L, Spertino J, Figueras-Nart I, Exposito-Serrano V, Guilabert A, Mele-Ninot G, et al. Omalizumab updosing allows disease activity control in patients with refractory chronic spontaneous urticaria. Br J Dermatol. 2018;179(1):210-2.
63. Maurer M, Kaplan A, Rosen K, Holden M, Iqbal A, Trzaskoma BL, et al. The XTEND-CIU study: Long-term use of omalizumab in chronic idiopathic urticaria. J Allergy Clin Immunol. 2018;141(3):1138-9.
64. Türk M, Yılmaz İ, Bahçecioğlu SN. Treatment and retreatment with omalizumab in chronic spontaneous urticaria: Real life experience with twenty-five patients. Allergol Int. 2018;67(1):85-9.
65. Ensina LF, de Lacerda AE, Machado LM, Camelo-Nunes I, Sole D. Long-term omalizumab therapy for refractory chronic spontaneous urticaria: a real-life experience. Ann Allergy Asthma Immunol. 2015;115(6):536.
66. Nettis E, Di Leo E, Foti C, Cegolon L, Vacca A. Efficacy and rapid activity of omalizumab retreatment in chronic spontaneous urticaria. J Am Acad Dermatol. 2018;78(6):1211-3. 67. Metz M, Ohanyan T, Church MK, Maurer M. Retreatment with omalizumab results in rapid remission in chronic spontaneous and inducible urticaria. JAMA Dermatol. 2014;150(3):288-90.
68. Har D, Patel S, Khan DA. Outcomes of using omalizumab for more than 1 year in refractory chronic urticaria. Ann Allergy Asthma Immunol. 2015;115(2):126-9.
69. Ferrer M, Gimenez-Arnau A, Saldana D, Janssens N, Balp MM, Khalil S, et al. Predicting Chronic Spontaneous Urticaria Symptom Return After Omalizumab Treatment Discontinuation: Exploratory Analysis. J Allergy Clin Immunol Pract. 2018;6(4):1191-7.
70. Kolkhir P, Church MK, Altrichter S, Skov PS, Hawro T, Frischbutter S, et al. Eosinopenia, in chronic spontaneous urticaria, is associated with high disease activity, autoimmunity, and poor response to treatment. J Allergy Clin Immunol Pract. 2020 Jan;8(1):318-25.
71. Marzano AV, Genovese G, Casazza G, Fierro MT, Dapavo P, Crimi N, et al. Predictors of response to omalizumab and relapse in chronic spontaneous urticaria: a study of 470 patients. J Eur Acad Dermatol Venereol. 2019;33(5):918-24.
72. Schoepke N, Asero R, Ellrich A, Ferrer M, Gimenez-Arnau A, C EHG, et al. Biomarkers and clinical characteristics of autoimmune chronic spontaneous urticaria: Results of the PURIST Study. Allergy. 2019;74(12):2427-36.
73. Sanchez-Borges M, Capriles-Hulett A, Caballero-Fonseca F, Gonzalez-Aveledo L. Biomarkers of treatment efficacy in patients with chronic spontaneous urticaria. Eur Ann Allergy Clin Immunol. 2018;50(1):5-9.
74. Straesser MD, Oliver E, Palacios T, Kyin T, Patrie J, Borish L, et al. Serum IgE as an immunological marker to predict response to omalizumab treatment in symptomatic chronic urticaria. J Allergy Clin Immunol Pract. 2018;6(4):1386-8.
75. Asero R, Marzano AV, Ferrucci S, Cugno M. Elevated baseline D-dimer plasma levels are associated with a prompt response to omalizumab in patients with severe CSU. J Allergy Clin Immunol Pract. 2017;5(6):1740-2.
76. Stitt JM, Dzieciatkowska M, Edwards MG, Hansen K, Hedlund G, Dreskin SC. The basophil proteome in chronic spontaneous urticaria distinguishes responders to omalizumab from non-responders. Clin Exp Allergy. 2018;48(7):898-901.
77. Deza G, Bertolín-Colilla M, Pujol RM, Curto-Barredo L, Soto D, García M, et al. Basophil FcεRI Expression in Chronic Spontaneous Urticaria: A Potential Immunological Predictor of Response to Omalizumab Therapy. Acta Derm Venereol. 2017;97(6):698-704.
78. Wedi B. Ligelizumab for the treatment of chronic spontaneous urticaria. Expert Opin Biol Ther. 2020;20(8):853-61.
79. Gasser P, Tarchevskaya SS, Guntern P, Brigger D, Ruppli R, Zbären N, et al. The mechanistic and functional profile of the therapeutic anti-IgE antibody ligelizumab differs from omalizumab. Nat Commun. 2020;11(1):165.
80. Maurer M, Gimenez-Arnau AM, Sussman G, Metz M, Baker DR, Bauer A, et al. Ligelizumab for Chronic Spontaneous Urticaria. N Engl J Med. 2019;381(14):1321-32.




