Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores- Dirceu Solé
- Maria Anita C. Spindola
- Marcelo Vivolo Aun
- Liana Araujo Azi
- Luiz Antonio G. Bernd
- Daniela Bianchi
- Albertina V. Capelo
- Débora Cumino
- Alex E. Lacerda
- Luciana C. Lima
- Edelton Morato
- Rogean R. Nunes
- Norma de Paula M. Rubini
- Jane Silva
- Maria Angela Tardelli
- Alexandra S. Watanabe
- Erick F. Curi
- Flávio Sano
ARTIGO ESPECIAL
Abordagem das reações de hipersensibilidade perioperatória: Orientações da Sociedade Brasileira de Anestesiologia e da Associação Brasileira de Alergia e Imunologia - Parte II: etiologia e diagnóstico
Approach to perioperative hypersensitivity reactions: Guidelines from the Brazilian Society of Anesthesiology and the Brazilian Association of Allergy and Immunology - Part II: etiology and diagnosis
Dirceu Solé1; Maria Anita C. Spindola2; Marcelo Vivolo Aun1; Liana Araujo Azi2; Luiz Antonio G. Bernd1; Daniela Bianchi2; Albertina V. Capelo1; Débora Cumino2; Alex E. Lacerda1; Luciana C. Lima2; Edelton Morato3; Rogean R. Nunes2; Norma de Paula M. Rubini1; Jane Silva1; Maria Angela Tardelli2; Alexandra S. Watanabe1; Erick F. Curi2; Flávio Sano1
DOI: 10.5935/2526-5393.20200041
1. Associação Brasileira de Alergia e Imunologia - ASBAI
2. Sociedade Brasileira de Anestesiologia - SBA
3. Universidade Federal de Santa Catarina - UFSC
Endereço para correspondência:
Dirceu Solé
E-mail: dirceu.sole@unifesp.br
Submetido em: 02/07/2020
Aceito em: 09/07/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
A anafilaxia perioperatória é manifestação importante no contexto de eventos adversos relacionados à cirurgia. Embora frequentemente relacionada à indução anestésica, pode ocorrer por outros agentes administrados por outras vias. A anafilaxia pode se apresentar como colapso cardiovascular, obstrução da via aérea e/ou insuficiência respiratória com ou sem manifestação cutânea, com consequências fatais em muito casos.Apesar de considerada inevitável em alguns casos, a sua incidência poderia (e deveria) ser reduzida através da busca por fármacos mais seguros. A avaliação abrangente de um episódio é um dos elementos primordiais para tornar a exposição subsequente mais segura, com orientações derivadas dessa investigação. Entretanto, representa um desafio estatístico por ser reação rara, randômica e muitas vezes independente de exposições sucessivas dos pacientes a procedimentos de baixo risco. Neste documento são revisados os mecanismos fisiopatológicos, agentes desencadeantes (adultos e crianças), assim como a abordagem diagnóstica durante a crise e após o episódio. Uma avaliação abrangente, a identificação das medicações, antissépticos e outras substâncias usadas em cada região, registros detalhados e nomenclatura padronizada são pontos fundamentais para a obtenção de dados epidemiológicos mais fidedignos sobre a anafilaxia perioperatória.
Descritores: Anafilaxia, hipersensibilidade a medicamentos, adrenalina, bloqueadores neuromusculares, testes cutâneos, anestesia, anafilaxia perioperatória, triptase.
INTRODUÇÃO
A anafilaxia perioperatória é mais comum em adultos e existe associação com idade, presença de doenças cardiovasculares e reações prévias a medicamentos. É mais frequente que as manifestações iniciem antes ou durante a fase de indução1. Os desencadeantes principais de anafilaxia operatória identificados em todos os levantamentos são: bloqueadores neuromusculares, antibióticos, látex, opiáceos, analgésicos, anti-inflamatórios não-esteroidais, clorexidina, contrastes, corantes, óxido de etileno. Existe variação entre os agentes precipitantes observados em locais diferentes. Tem se verificado aumento do número de reações por antibióticos e diminuição das reações provocadas por látex2.
MECANISMOS DA ANAFILAXIA
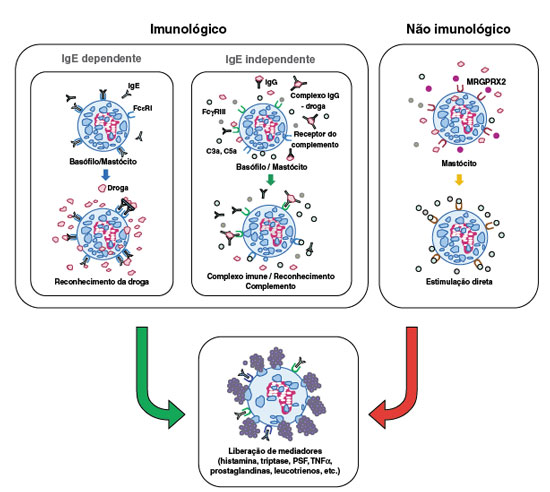
Os mecanismos envolvidos na anafilaxia por drogas podem ser classificados como imunológicos e não imunológicos. Os mecanismos imunológicos incluem a via dependente de IgE e vias IgE-independentes, enquanto que os mecanismos não imunológicos são mediados por ativação direta do mastócito (Figura 1)3,4. Independentemente do mecanismo subjacente, os sinais e sintomas alérgicos são similares e causados pela degranulação de mastócitos e basófilos resultando na liberação de mediadores tais como histamina, triptase, fator ativador de plaquetas (PAF), leucotrienos cisteínicos e outros. O mastócito é a célula principal na anafilaxia mediada por IgE. Estudos recentes indicam a participação de macrófagos e neutrófilos na anafilaxia imunológica não dependente de IgE. Os basófilos estão implicados nas reações IgE-dependentes e IgE-independentes1.
Os principais sinais e sintomas da anafilaxia são mediados pela histamina, incluindo flushing, prurido, urticária/angioedema, rinorreia, espirros, estridor, tosse, sibilos, dispneia, hipóxia, náuseas, vômitos, dor abdominal, diarreia, taquicardia, hipotensão, aumento da permeabilidade vascular e síncope. A triptase ativa várias vias, incluindo a cascata do complemento, da coagulação e o sistema cinina-calicreína, contribuindo para o desenvolvimento de hipotensão arterial e angioedema. Os leucotrienos cisteínicos e o PAF potencializam o aumento da permeabilidade vascular e o desenvolvimento de hipotensão4,5.
É importante ressaltar que um mesmo agente etiológico pode desencadear reações anafiláticas por mais de um mecanismo; por exemplo, os meios de contraste radiológicos podem desencadear anafilaxia por mecanismo imunológico IgE-dependente, mecanismo imunológico IgE-independente e também por ativação direta dos mastócitos3,4.
ANAFILAXIA IMUNOLÓGICA
Reações IgE-dependentes
O mecanismo mais frequente nas reações anafiláticas é o mecanismo IgE-dependente, ou via clássica. Este mecanismo envolve processo de sensibilização ao alérgeno, ativação de linfócitos Th2 e produção de IgE específica contra o alérgeno. A IgE liga-se ao receptor de alta afinidade - FceRI - presente em mastócitos e basófilos e, em contato subsequente com o alérgeno, a ligação cruzada de dois ou mais destes receptores com o alérgeno (ou hapteno ligado a carreador) desencadeia uma complexa cascata de sinalização intracelular que leva à degranulação e liberação de mediadores pré-formados, tais como histamina e triptase. Em seguida, ocorre a liberação de mediadores recém-formados a partir do metabolismo do ácido araquidônico de fosfolípides da membrana (leucotrienos cisteínicos e prostaglandinas) e ativação de outras células inflamatórias que amplificam e potencializam a reação alérgica3-5. A penicilina e os bloqueadores neuromusculares são considerados os principais agentes das reações anafiláticas IgE-mediadas por drogas4.
Reações IgE-independentes
Os mecanismos IgE-independentes podem ser mediados por anticorpos da classe IgG ou pelo sistema do complemento. Estudos em modelos murinos têm demonstrado reações anafiláticas mediadas pela interação de drogas com IgG específica ligada ao receptor FcgRIII em basófilos, macrófagos e neutrófilos, resultando na liberação de PAF6. Embora este modelo ainda não tenha sido comprovado em humanos, estudos com agentes biológicos (infliximabe, adalimumabe) documentaram a ocorrência de reações anafiláticas sem a presença de IgE específica e com a detecção de altos níveis de IgG específica para o agente etiológico7,8.
A ativação do sistema do complemento pode ser induzida pela presença de complexos imunes IgGalérgeno e também com drogas solubilizadas em lipossomas terapêuticos, bem como em excipientes lipídicos. Este mecanismo leva à liberação de C3a, C5a e C5-b-9, que disparam a ativação de mastócitos, basófilos e outras células, acarretando degranulação e liberação de mediadores. Dentre as causas mais comuns de reações anafiláticas IgE-independentes incluem-se os meios de contrate radiológicos, dextran e heparina contaminada com sulfato de condroitina supersulfatado3,4.
Anafilaxia não imunológica
Este tipo de anafilaxia não envolve a ativação do sistema imunológico e está relacionado à estimulação direta de mastócitos, levando à degranulação e liberação de mediadores. Vários fármacos estão relacionados a este mecanismo, incluindo contrastes radiológicos, opioides, bloqueadores neuromusculares, dextran e vancomicina. Recentemente, foi descrito que a degranulação direta de mastócitos relacionada aos opioides, bloqueadores neuromusculares e quinolonas pode ser mediada pelo MAS-related G protein-coupled receptor-X2 (MRGPRX2)9. A interação destes fármacos com o receptor MRGPRX2 pode induzir a liberação de histamina, ß-hexosamidase, TNF-a, prostaglandina e outros mediadores, desencadeando anafilaxia4,10.
FATORES DE RISCO
Os cofatores e fatores potencializadores podem explicar porque um alérgeno pode ser tolerado ou desencadear uma reação leve ou anafilaxia grave em um mesmo paciente em diferentes momentos. Na presença de cofatores, as reações podem tornar-se mais graves e/ou ocorrerem com quantidades menores do agente causal. Segundo estudos internacionais, os cofatores estão presentes em 30% dos casos de anafilaxia1,2,11-22.
Foram postuladas três categorias de fatores de risco: (1) fatores potencializadores, que influenciam no mecanismo imunológico, tais como exercício físico, infecções agudas, drogas (anti-inflamatórios nãoesteroidais, inibidores de bomba de próton), álcool e período menstrual; (2) doenças concomitantes, que estão associadas a reações mais graves e aumento da mortalidade, tais como asma, mastocitose e doença cardiovascular; (3) cofatores, que não têm influência sobre os mecanismos imunológicos, como os betabloqueadores, inibidores da enzima conversora da angiotensina (ECA) e estresse emocional10,23. Entretanto, a classificação dos fatores de risco nem sempre é fácil, pois o conhecimento sobre os mecanismos envolvidos não está suficientemente esclarecido para todos os fatores identificados.
Estudos epidemiológicos indicam maior frequência de reações anafiláticas no sexo feminino, contudo esta diferença só ocorre nos anos relacionados ao período reprodutivo feminino, sugerindo uma relação com os hormônios sexuais. Além disso, episódios recorrentes de anafilaxia no período menstrual estão descritos e apontam para os estrógenos ou progesterona como fatores potencializadores10,23. A suscetibilidade do sexo feminino observada em estudos clínicos foi também demonstrada em modelo murino24.
Os betabloqueadores e inibidores da ECA foram descritos como cofatores na anafilaxia em vários estudos. A razão de chance de anafilaxia para os betabloqueadores e inibidores da ECA foi estimada em 6,8 e 13, respectivamente. Contudo, outros estudos concluíram que o risco de desenvolvimento de anafilaxia com betabloqueadores e inibidores da ECA só é significativo quando as duas drogas são utilizadas simultaneamente. São necessários estudos epidemiológicos para determinar o real impacto destes fármacos como fatores de risco para a anafilaxia10,23.
As estatinas podem ser consideradas um fator de risco para anafilaxia, uma vez que baixos níveis plasmáticos de LDL podem aumentar o risco de anafilaxia grave ou fatal. Esta classe de drogas aumenta a concentração plasmática de PAF por reduzir a atividade da enzima acetil-hidrolase do PAF (PAF-HA), que a atua na degradação do PAF20,25.
Os anti-inflamatórios não-hormonais constituem um fator potencializador de reações anafiláticas bem estabelecido, em especial nas anafilaxias alimentares. Contudo, os mecanismos envolvidos não estão suficientemente esclarecidos10,23.
Estudo recente sobre anafilaxia fatal destacou aumento na incidência na anafilaxia causada por drogas, enquanto que a taxa de anafilaxia por alimentos e venenos permanece estável. Comorbidades cardiovasculares e idade maior que 50 anos foram apontados como fatores de risco para anafilaxias fatais, sendo as drogas mais implicadas nesses casos os antibióticos betalactâmicos, bloqueadores neuromusculares e meios de contraste26.
AGENTES CAUSAIS
As diferenças de nomenclatura, de métodos empregados, da disponibilidade e preferência regional por determinados medicamentos tornam o estudo sobre a incidência das reações de hipersensibilidade perioperatória (RHP) um árduo desafio.
A ampla variabilidade geográfica pode se refletir em inúmeros fatores, tais como prática anestésica, preparo para diagnóstico de reações de hipersensibilidade, existência de centros de investigação, além da interação gene-ambiente27.
Serão apresentados abaixo os diversos agentes implicados em reações de hipersensibilidade perioperatória sem ordem de frequência, visto não termos no Brasil, ainda, estudos dessa natureza.
Bloqueadores neuromusculares e sugamadex
Os bloqueadores neuromusculares (BNM) são a causa mais comum de reações de hipersensibilidade perioperatória na França, Noruega e Bélgica, a segunda no Reino Unido, porém menos comum nos Estados Unidos, Suécia e Dinamarca28. No Brasil, embora sem posterior confirmação diagnóstica por testes cutâneos ou in vitro, em resposta a um questionário elaborado por alergologistas sobre anafilaxia perioperatória, os bloqueadores neuromusculares foram apontados em 37,6% como os culpados pela reação observada pelos anestesiologistas, ocupando o primeiro lugar dentre os agentes destacados30. As reações aos BNM podem ocorrer por mecanismos IgE mediados ou não. Estudos de relação estrutura-atividade têm estabelecido que o local de reconhecimento da IgE, para os bloqueadores neuromusculares, envolve grupos de amônio terciário e quaternário e moléculas adjacentes30. Os grupos substituídos de amônio terciário e quaternário, também presentes em cosméticos, desinfetantes e alimentos poderiam explicar a sensibilização em pacientes que não referem exposição prévia aos bloqueadores neuromusculares31. A hipótese da folcodina, um antitussígeno que contém epítopos alergênicos que fariam reação cruzada com os BNM32, poderia explicar a reação à primeira exposição aos BNM33.
Estudo prospectivo, do tipo caso-controle, iniciado na França em 2015 e previsto para durar 4 anos, (ALlergie aux curares et exposition à la PHOlcodine - ALPHO) poderá elucidar muitas questões27. Os BNM também podem ativar os mastócitos, independentemente da presença de IgE, pela ativação do receptor de membrana MRGPRX234. A ocupação desse receptor MRGPRX2 por vários BNM poderia ser uma explicação alternativa para a sensibilidade cruzada entre os diferentes BNM9.
Pelo descrito acima, tanto pela relação de estrutura-atividade, como pela descoberta desse receptor, está fundamentada a necessidade de investigação sistemática de reatividade cruzada entre os BNM disponíveis, com o objetivo de oferecer uma alternativa segura em uma futura anestesia aos pacientes que sofreram reação de hipersensibilidade perioperatória35.
É necessário ressaltar que, mesmo quando um agente (BNM) culpado é claramente identificado e outros BNM têm testes cutâneos negativos, estes são considerados opções habitualmente seguras, porém não é possível descartar totalmente uma nova reação36.
Testes cutâneos de hipersensibilidade imediata negativos aos BNM, seguidos por exposição sem reação de hipersensibilidade, devem ser registrados no prontuário37.
O sugamadex, uma ciclodextrina modificada para, seletivamente, ligar-se aos bloqueadores neuromusculares esteroidais, foi sugerida como possível tratamento para anafilaxia ao rocurônio. Estudos experimentais demonstraram, por meio da expressão do CD63, um marcador da ativação de basófilos, que a ativação não poderia ser bloqueada pelo sugamadex após ter sido iniciada38. Outro estudo, utilizando um modelo cutâneo, também concluiu ser improvável a modificação da resposta clínica de uma reação alérgica já estabelecida39. A análise retrospectiva de 13 casos de anafilaxia (por rocurônio e antibióticos) não demonstrou modificação do curso clínico pelo próprio sugamadex40. Alie-se a esses estudos os casos de hipersensibilidade ao sugamadex41. Até o momento a recomendação é que o sugamadex não tem papel no tratamento de anafilaxia42.
Látex
A diminuição das reações ao látex de borracha natural da Hevea brasiliensis vem sendo observada como resultado de várias ações, como identificação dos grupos de risco e uso de medidas preventivas, rotulação correta dos dispositivos médicos quanto a presença de látex43, e uso de luvas sem pó44.
Em grupos especiais de crianças submetidas a múltiplas cirurgias (com diagnósticos de espinha bífida, mielomeningocele, problemas urológicos), o látex ocupou o primeiro lugar como causa de anafilaxia perioperatória45. Para esse grupo de pacientes de alto risco, é proposta a prevenção primária, ou seja, deve-se evitar a sensibilização precoce ao látex. Estão indicados, desde o nascimento, o uso de materiais/ dispositivos médicos sem látex, e a realização de cirurgias em ambientes seguros quanto à presença de látex46,47, sendo essas cirurgias realizadas como as primeiras do dia48,49.
Apesar da importância do tema, a busca sobre medidas de prevenção primária traduzidas em modificação de rotinas no centro cirúrgico, pela Sociedade Brasileira de Pediatria (SBP, www.sbp.com.br) e o seu Departamento de Neonatologia, pela Associação Brasileira de Alergia e Imunologia (ASBAI, www.asbai. org.br) e pela Sociedade Brasileira de Anestesiologia (SBA, www.sbahq.org) são inexistentes. A referência nacional encontrada sobre profilaxia primária foi a de Soares, com exclusão do látex desde o momento do nascimento50.
No Brasil, foi emitida pela Agência Nacional de Vigilância Sanitária -ANVISA, a Resolução da Diretoria Colegiada, RDC 37/2015, que trata da informação sobre o conteúdo de látex em produtos médicos51.
Reações ao látex tendem a ocorrer mais tardiamente na cirurgia, após significativo contato com mucosas53,49. A avaliação de sensibilização ao látex, previamente à cirurgia, por alergologista está indicada para pacientes com história suspeita de reação de hipersensibilidade em anestesia anterior não investigada e pacientes com52:
- manifestações de hipersensibilidade ao látex, independentemente das circunstâncias;
- pacientes pediátricos multioperados, principalmente aqueles com espinha bífida, mielomenigocele, em virtude da alta frequência de alergia ao látex;
- pacientes com história de manifestações clínicas à ingestão de abacate, banana, kiwi e outros, pela elevada frequência de reações cruzadas com látex52.
Opioides
Os opioides naturais (morfina e codeína) e os semi-sintéticos (folcodina, hidromorfona e diamorfina) são potentes liberadores de histamina por via direta, causando principalmente manifestações cutâneas, incluindo urticária, prurido e rubor53. Altas doses de morfina usadas durante cirurgia cardíaca não causam broncoespasmo ou angioedema54.
As reações com liberação direta de histamina são muito mais prevalentes que as IgE mediadas, sendo que as primeiras provavelmente resultam da ocupação dos receptores MRGPRX29 do mastócito do que da ligação ao receptor µ55.
Os opioides semissintéticos da classe dos fenilpiperidenos (alfentanil, fentanil, remifentanil) não são liberadores de histamina, e também não parece haver sensibilidade cruzada entre eles e os derivados da morfina, difenilheptanos e fenantrênicos56. A confirmação diagnóstica de reação a opioides é complexa devido às incertezas nos testes cutâneos, pelo potencial liberador de histamina por alguns desses agentes57, e pela indisponibilidade de ensaios IgE específicos validados e confiáveis58. Ainda assim, reações a esses agentes são excepcionalmente raras, considerando sua extensa utilização em anestesia27.
Hipnóticos
As reações aos hipnóticos eram mais frequentes com o tiopental (cujo uso atualmente está em declínio) e com o propofol, quando este tinha em sua formulação o solubilizante Cremophor EL60.
O propofol tem dois grupos isopropila, que atuam como determinantes antigênicos, além de apresentar, em sua formulação atual, solução lipídica com óleo de soja e lecitina de ovo60. A lecitina da formulação do propofol é derivada da gema de ovo e altamente purificada, e os pacientes alérgicos ao ovo tendem a mostrar sensibilização e reagir à proteína da clara54. O óleo de soja usado para a solução de propofol é refinado, sendo as proteínas alergênicas retiradas ao final do processo60.
Para pacientes pediátricos, a referência de alerta sempre citada é a do caso de uma criança com anafilaxia ao ovo e que apresentou reação de urticária generalizada após uso de propofol, com teste cutâneo de hipersensibilidade imediata positivo61. Estudo retrospectivo observacional de crianças com esofagite eosinofílica, fenótipo distinto não IgE mediado, não encontrou diferença da taxa de complicações relacionadas ao uso de propofol62.
A Academia Americana de Alergia, Asma e Imunologia recentemente deliberou que pacientes alérgicos ao ovo podem receber, com segurança, anestesia sem qualquer precaução, sendo essa orientação repetida em revisão recente46. Etomidato, cetamina e os benzodiazepínicos raramente estão implicados; dentre os últimos, o midazolam é o agente mais frequente11.
Anestésicos locais
Os anestésicos locais, apesar de largamente utilizados, raramente são causa de reações anafiláticas por qualquer mecanismo63-65. Apesar da raridade, podem ocorrer até como a substância não suspeita66.
Diversas reações consideradas como de hipersensibilidade podem ter outra origem, tais como: reação vasovagal, sobredose acidental em via intravascular, sintomas pelo uso de vasopressores e reação a outras substâncias administradas concomitantemente (látex, antibióticos, anti-inflamatórios não hormonais, clorexidina, aditivos e preservativos)67.
Segundo Kvisselgaard e cols.65, conhecimentos adicionais de como reconhecer anafilaxia são necessários aos profissionais de saúde. Os autores chamam a atenção para o uso de adrenalina em casos de reação vasovagal. Estes espisódios, muitas vezes são rotulados como anafilaxia, sem o ser65.
A avaliação das reações suspeitas de hipersensibilidade aos anestésicos locais é realizada com testes cutâneos de leitura imediata (puntura e intradérmico), seguidos de testes de provocação por via subcutânea65,67,68. Testar o agente suspeito é importante para estabelecer um diagnóstico definitivo69 e, pelo menos uma alternativa37,67 com o objetivo de oferecer uma opção para uso futuro67.
Os testes cutâneos e intradérmicos devem ser realizados com preparações sem vasoconstritores devido à grande possibilidade de resultado falso-negativo37. A reatividade cruzada é mais comum entre os ésteres, e menos comum entre amidas ou amida-éster68,69.
A anestesia obstétrica é uma situação especial para se testar a história de hipersensibilidade a anestésicos locais. Nessa circunstância deve-se realizar o teste no dia do parto, no centro obstétrico. O alergista realiza os testes cutâneos e, caso sejam negativos, o anestesista administra anestesia local com o anestésico a ser injetado via espinhal. Caso ocorra alguma reação, a equipe obstétrica estará pronta para realizar os procedimentos necessários68.
O grupo de anestésicos locais do tipo éster (cloroprocaína, procaína, tetracaína) é considerado mais antigênico que o grupo amida (lidocaína, bupivacaína, ropivacaína, levobupivacaína). Considera-se que o ácido paraminobenzoico, resultante do metabolismo dos ésteres, seja o responsável pela maior antigenicidade deste grupo20.
Antissépticos, desinfetantes e agentes esterilizantes
a) Clorexidina
A clorexidina é um antisséptico amplamente utilizado no ambiente cirúrgico, desde o uso cutâneo, até como componente de gel de anestésicos locais, lubrificantes, compressas para curativos, soluções oftálmicas ou cateteres para inserção venosa central, previamente impregnados com a substância. Está presente no ambiente extra-hospitalar em enxaguantes bucais, dentifrícios, demaquilantes, curativos e soluções antissépticas de uso doméstico43. O paciente pode ter feito uso desses produtos previamente, sem apresentar qualquer reação. No perioperatório as reações podem ocorrer abruptamente, como à inserção de cateter venoso central70 ou em até 20-40 minutos após o início do procedimento71. A exposição é aumentada pela absorção através da superfície mucosa ou pele incisada. Os testes cutâneos têm se mostrado preditivos da sensibilidade alérgica e correlacionados com a dosagem da IgE específica72.
A clorexidina pode estar oculta em diversos produtos de uso perioperatório, e deve fazer parte da investigação dos casos de anafilaxia, inclusive naqueles em que não se dispõem de informes sobre os agentes utilizados37,71.
b) Povidona
Presente também em sabonetes, soluções antissépticas oftálmicas, são raros os casos atribuídos a essa substância, mas casos documentados com testes cutâneos associados à dosagem de triptase foram publicados73. Vale ressaltar que o antígeno principal identificado é a povidona, e não o iodo74, e não há reação cruzada com meios de contraste iodados49.Testes cutâneos são recomendados para o diagnóstico, e as diluições estão padronizadas28,37.
c) Óxido de etileno
É um gás usado para esterilização de uma ampla gama de dispositivos médicos. É uma causa rara de anafilaxia perioperatória75, restrito principalmente a grupos de alto risco, como pacientes submetidos à diálise, aqueles com mielomeningocele e shunts ventriculoperitoniais76-78. Citado por ser um agente praticamente impossível de ser eliminado por completo,28 porém recomenda-se medidas para minimizar a exposição79.
O diagnóstico é feito apenas com IgE específica77 e o pré-tratamento com omalizumabe tem sido relatado como efetivo80,81.
d) Glutaraldeído e ortoftaldeído
Glutaraldeído e ortoftaldeído (OPA) são desinfetantes utilizados para reprocessamento de artigos odonto-médico-hospitalares sensíveis ao calor. Ao glutaraldeído têm sido atribuídas reações de hipersensibilidade tardia (dermatite de contato). Com o ortoftaldeído, reações de hipersensibilidade imediata durante cistoscopia e laringoscopia82-84.
A empresa fabricante do OPA, em virtude de inúmeras queixas de reações recebidas, contraindicou seu uso em pacientes com câncer, submetidos a cistoscopias de repetição85.
Coloides
Coloides, ou expansores plasmáticos, normalmente são administrados a pacientes com hipotensão, dificultando o diagnóstico correto de reação de hipersensibilidade. Os sinais podem aparecer em até 20-30 minutos após o início da infusão86.
As gelatinas são responsáveis pela maioria das reações, seguidas pelas dextranas49. Devido ao alto risco de reações ao hidroxietilamido, o mesmo foi retirado de outros mercados e não tem sido incluído nos estudos citados em publicações mais recentes27, embora ainda seja comercializado no Brasil. As reações às dextranas são IgG-mediadas devido à ativação do complemento87.
Embora as gelatinas possam induzir reações por liberação inespecífica de histamina, as reações IgE-dependentes são conhecidas. As gelatinas podem desencadear reações também como agentes "ocultos" em produtos hemostáticos, derivados de gelatina bovina ou porcina, em crianças88. Além da alergia à gelatina do composto proteico ósseo presente nas soluções para expansão plasmática ou nos agentes tópicos hemostáticos89,90, há a alergia a alfa-gal (síndrome alfa-gal). É reconhecida como uma alergia IgE-mediada à carne vermelha, mais especificamente envolvendo um oligossacarídeo presente em muitos alimentos de origem animal (mamíferos), como carne e gelatinas91,92. Em re-sumo, pacientes com síndrome alfa-gal não devem receber coloides à base de gelatina, a não ser que apresentem testes cutâneos negativos47.
Sangue e derivados
Reações de hipersensibilidade podem ocorrer a um grupo heterogêneo de componentes do sangue, com variados graus de risco. A grande dificuldade em diagnosticar reações perioperatórias ao sangue e hemocomponentes é a ausência de testes cutâneos confirmatórios27.
Reações urticariformes ocorrem em 0,5% de todas as transfusões de plasma fresco congelado. Como em todos os hemocomponentes, há sempre uma pequena porção de plasma, reações podem ocorrer também com hemácias e plaquetas41.
A divisão das reações em relacionadas ao receptor e ao doador pode contribuir para um melhor entendimento. Das reações relacionadas ao receptor, o melhor exemplo é a de pacientes (receptores) com deficiência de IgA, cujos anticorpos anti-IgA reagem ao antígeno do doador. A avaliação de níveis de IgA de pacientes (receptores) deve fazer parte da investigação de reações de hipersensibilidade em pacientes transfundidos93.
Quando sangue e hemocomponentes foram administrados antes da reação de hipersensibilidade perioperatória, o banco de sangue deve ser notificado. A possibilidade de obtenção de provas positivas ao sangue e/ou hemocomponentes é limitada, e assim o paciente deve ser encaminhado para avaliação alergológica, sendo a reação ao sangue ou seus produtos, um diagnóstico de exclusão com testes alérgicos negativos76.
Além de incompatibilidade ABO e hipovolemia, outras causas, como contaminação bacteriana do sangue e acúmulo de bradicinina, podem explicar choque durante a transfusão94.
Com relação aos testes, esses devem incluir também a pesquisa por alérgenos ocultos, ou seja, substâncias administradas junto ao sangue, como azul de metileno ou agentes hemostáticos78.
A discussão dos casos com alergologistas deve ser buscada para adequada investigação95.
Contrastes radiológicos
Os diversos meios de contrastes iodados têm uma estrutura comum, um anel benzênico aromático sobre o qual são fixados os átomos de iodo, cuja sequência alergênica ainda não foi identificada, porém o iodo não está implicado74,96.
O iodo é um bioelemento indispensável à vida, e não se constitui em uma "sequência antigênica". Não corresponde a nenhuma entidade clínica documentada; portanto a expressão "alérgico a iodo" deve ser abandonada96,97.
Para os peixes, a sequência alergênica identificada é a parvalbumina, proteína do tecido muscular, bem como as enolases e aldolases, enzimas da glicólise98. A tropomiosina é considerado o maior pan-alérgeno para crustáceos, moluscos e artrópodes (por exemplo, o ácaro)99,100.
Essas considerações são necessárias para afastar o conceito errôneo de reatividade cruzada entre contrastes iodados e peixes/frutos do mar47,74,97,101,102. Raciocínio similar aplica-se à iodopovidona, onde o determinante alergênico é a povidona; e não há reatividade cruzada com frutos do mar47,97.
Os contrastes iodados podem desencadear tanto reações IgE dependentes103, quanto reações de hipersensibilidade tardia104. A reatividade cruzada parece ser baixa, apesar da estrutura molecular semelhante. Realizam-se testes cutâneos após uma reação de hipersensibilidade para confirmar o agente suspeito e oferecer uma alternativa segura. Contrastes que resultem em testes cutâneos negativos têm sido usados com segurança em pacientes com reações prévias ao contraste105.
A questão da pré-medicação permanece controversa. Embora seja recomendada em protocolos de alguns países, como os EUA, não o é na Europa. Reserva-se para pacientes que sofreram reações prévias graves, não mediadas por IgE, mastocitose106. Outros preconizam-na de forma restrita aos pacientes com mastocitose e com urticária crônica, que precisem utilizar os contrastes cujos testes cutâneos tenham sido negativos103. Em síntese, a pré-medicação não previne reações IgE mediadas, e sua eficácia para prevenir reações moderadas a graves, imediatas ou tardias, não foi comprovada. O que se faz fundamental é o conhecimento em reconhecer e tratar adequadamente uma anafilaxia por todos aqueles que administram contrastes105-107.
a) Contrastes paramagnéticos
Os contrastes usados em ressonância magnética, ou paramagnéticos, são em sua grande maioria complexos ou quelantes com gadolíneo. Os sintomas descritos para as reações imediatas são muito semelhantes aos descritos para reações de contraste iodado. Até o momento não são conhecidos relatos de reações tardias, embora as mesmas não possam ser descartadas108.
Os mecanismos fisiopatológicos não são bem estabelecidos. Sugere-se o envolvimento de IgE específica em alguns casos, baseados em testes cutâneos positivos, realizados em pacientes com anafilaxia a esses meios de contraste109,110.
b) Corantes
Os corantes têm se tornado agentes frequentemente descritos como causa de reações de hipersensibilidade. Em estudo recente aparecem como quarta causa identificada no Reino Unido, atrás apenas de antibióticos, bloqueadores neuromusculares e clorexidina64.
São três os corantes azuis comumente utilizados: azul patente V, isosulfan blue (estruturalmente relacionados) e o azul de metileno, cuja estrutura não é semelhante. Seu emprego é na pesquisa e mapeamento da drenagem linfática e identificação do nódulo sentinela, em cirurgias oncológicas de mama e melanomas27.
Anafilaxia aos corantes manifesta-se mais tardiamente, em relação aos antígenos perioperatórios injetados intravenosamente, em função da lenta absorção pelos tecidos subcutâneo e linfático111. Faz-se necessário destacar a interferência prolongada com a oximetria de pulso, causando uma falsa queda na leitura da oximetria27 que pode ser aferida pela saturação arterial verificada com a realização de gasometria arterial112,113.
A fluoresceína é um corante utilizado para angiografia de retina114 e em outros procedimentos, também com relatos de reações de hipersensibilidade115.
Outros agentes
a) Aprotinina
É um derivado bovino, inibidor de proteases séricas, com atividade anti-fibrinolítica. É usado por via intravenosa ou como componente de agentes hemostáticos tópicos para reduzir sangramento em cirurgias ortopédicas e cardíacas116. A prevalência de reações por aprotinina em pacientes com exposição prévia é maior, razão pela qual a reexposição com intervalo inferior a 6 meses é considerada contraindicação relativa117.
No Brasil, o registro da aprotinina intravenosa venceu em 2016, e não foi renovado, até a publicação deste. Porém, a aprotinina faz parte de produtos como agentes hemostáticos tópicos e colas biológicas comercializados no Brasil.
b) Protamina
O sulfato de protamina é um polipeptídeo extremamente alcalino, utilizado na reversão dos efeitos anticoagulantes da heparina.Também é parte de um complexo com insulina, para retardar sua absorção e prolongar seu efeito farmacológico (NPH ou Neutra Protamina Hagedorn). Reações de hipersensibilidade, mediadas por IgG, IgE, ativação do complemento e liberação não específica de histamina têm sido relatadas118.
A protamina é produzida por tecnologia recombinante, embora inicialmente tenha sido isolada a partir do esperma de peixe, motivo pelo qual se supunha haver reatividade cruzada nos pacientes alérgicos a peixe. Não foram encontradas evidências para justificar essa hipótese119.
Também a exposição prévia à insulina NPH era considerado fator de risco para o uso de protamina. Embora a incidência de reações seja maior em pacientes diabéticos em uso de insulina NPH, a evidência de alergia IgE-mediada é muito baixa120.
Três casos de alergia à protamina foram objeto de relato recente121. Entretanto, dois desses pacientes, recebendo insulina NPH, foram reexpostos à protamina sem intercorrências, evidenciando que outros mecanismos não-IgE podem estar envolvidos122.
Não há evidências, portanto, até o momento, para evitar o uso de protamina em pacientes com alergia a peixe e naqueles em uso de insulina NPH47.
c) Ácido tranexâmico
É um antifibrinolítico ainda recomendado123, porém raramente são descritas reações de hipersensibilidade, tanto para crianças e adolescentes124, como para adultos. Proposta para testes cutâneos e de provocação são sugeridos125.
d) Hialuronidase
É uma enzima, bovina ou ovina, que degrada o ácido hialurônico e pode ser usada como adjuvante em anestésicos locais para facilitar a penetração nos tecidos. Reações imediatas à hialuronidase têm sido descritas126. Até mesmo reações tardias, com edema e compressão de estruturas nobres, podem ter consequências desastrosas como, por exemplo, em cirurgia oftalmológica127,128. O diagnóstico diferencial com celulite orbital precoce deve ser feito nos casos de edema e hiperemia, sob pena de que compressão compartimental e perda visual ocorram, por retardo na elucidação129.
Antecedentes como alergia à picada de vespas e abelhas (este por possível reação cruzada pela presença de hialuronidase no veneno das mesmas), e uso prévio de preenchimentos cosméticos com ácido hialurônico devem ser pesquisados, antes da decisão do uso de hialuronidase na realização de bloqueios regionais oculares130.
Antígenos ocultos
Alguns agentes não fazem parte do rol de medicamentos, substâncias e dispositivos listados na ficha de anestesia ou descrição cirúrgica. Assim, passam despercebidos e são omitidos quando da investigação pós-crise. Um exemplo são os polietilenoglicóis (PEGs). Os PEGs e seus derivados são polímeros não iônicos do óxido de etileno, disponíveis comercialmente em ampla variação de pesos moleculares, sendo extenso também o seu emprego em produtos médicos farmacêuticos comuns, em medicamentos para câncer, gota e imunoterapias, cosméticos e alimentares131. A falta de padronização da nomenclatura e o baixo índice de alerta para hipersensibilidade de adjuvantes e excipientes podem torná-los ainda mais secretos, dificultando a investigação131,132.
Alguns exemplos são listados a seguir, e alguns alertas são oferecidos no artigo de referência78.
- Óxido de etileno (gás esterilizante), relacionado a reações em cirurgias de shunts ventrículoperitoniais;
- Antibióticos em cimento ósseo e colírios;
- Manitol como adjuvante de alguns medicamentos intravenosos;
- Metilcelulose em lágrimas artificiais;
- Polietilenoglicol em gel, spray de anestésicos locais, em cimentos ósseos78.
A cooperação entre alergologistas, anestesistas e todos os membros da equipe cirúrgica é essencial para pesquisar outras substâncias nem sempre evidenciadas em uma primeira análise.
Anti-inflamatórios não esteroidais
Os anti-inflamatórios não esteroidais (AINEs) são muito utilizados também nos procedimentos cirúrgicos (pré, intra e pós-operatório). Estimativas europeias, por exemplo, apontam que a quase totalidade dos anestesiologistas (99,1%) emprega essa classe de medicamento em algum momento perioperatório134.
Na grande maioria dos casos de hipersensibilidade aos AINEs, incluindo as anafilaxias, o mecanismo responsável pelo quadro clínico não envolve participação imunológica. Nessas situações, o próprio mecanismo de ação do AINEs sobre a enzima ciclooxigenase (COX) - suas isoformas COX1, COX2 e COX3 - com consequente desvio do metabolismo do ácido aracdônico para a via da lipo-oxigenase, ocasionando maior produção de leucotrienos e lipoxinas. Os leucotrienos são potentes vasodilatadores, aumentam a permeabilidade vascular, induzindo edema na mucosa nasal e brônquica, aumentam a secreção mucosa glandular e têm ação broncoconstritora, atuando na constrição da musculatura lisa brônquica. Além disso, ocorre também redução da síntese de prostaglandina (PG) E2. A PGE2 é vasodilatadora, broncodilatadora e estabiliza os mastócitos135,136. Reações que envolvem esse mecanismo são consideradas não seletivas, uma vez que não são específicas para determinada estrutura molecular, mas sim relacionadas à potência com a qual o AINE inibe a COX-1. Dessa forma, o indivíduo reage a diversos AINEs (estruturalmente distintos), e quanto maior for a potência da droga em inibir a COX-1, maior será o risco e a gravidade da reação.
Já, nas situações em que existe envolvimento imunológico, as reações de caráter imediato, como a anafilaxia, têm na sua gênese o mecanismo de hipersensibilidade tipo I com a produção de IgE específica contra um único AINE ou contra AINEs de estrutura química semelhante. Estas reações são consideradas seletivas, já que o indivíduo tolera antiinflamatórios de estrutura química diferente. Cerca de 24% das reações de hipersensibilidade a AINEs são seletivas137. Derivados da pirazolona (dipirona, metamizol), diclofenaco e derivados do ácido propiônico (ibuprofeno,cetoprofeno, naproxeno) têm sido os mais implicados nessas reações138, pela história clínica, confirmação in vivo: testes cutâneos de hipersensibilidade imediata positivos (TCHI) e testes in vitro: teste de ativação de basófilos.
Embora os AINEs sejam a principal causa de anafilaxia provocada por drogas em nosso meio, tanto entre adultos, quanto entre crianças,139,140 são considerados causa rara de anafilaxia perioperatória27.
Na Espanha, estudo com duração de cinco anos evidenciou presença de IgE específica para dipirona (TCHI positivo) em 2 casos, ambos a reação ocorreu no tempo de recuperação anestésica141. Na Alemanha, investigação com testes cutâneos em 53 pacientes evidenciou 5 reações com mediação pelo IgE a metamizol, e 2 a fenilbutazona142. Dados do 6th National Audit Project (NAP6) realizado em 356 hospitais da Inglaterra, País de Gales e Irlanda do Norte143 apontaram 1 caso de anafilaxia por ibuprofeno144.
Na França, no período perioperatório, apenas 3 casos de hipersensibilidade a AINEs imunologicamente mediados foram identificados, em um estudo de abrangência nacional em um período de 8 anos22.
Apesar da pouca frequência das reações perioperatórias aos AINEs, nos casos de reação perioperatória prévia não investigada, sugere-se o uso de paracetamol e inibidores seletivos de COX-252, compostos sabidamente pouco envolvidos nas reações de hipersensibilidade a AINEs, tanto por mecanismos imunológicos, quanto por não imunológicos.
Em pediatria, revisão de artigos originais que atendessem aos critérios uso de dipirona para dor e crianças até 17 anos de idade, identificou dois, de quatro estudos, cujo principal objetivo foi identificar efeitos colaterais ou reações adversas graves com o uso de dipirona145. Além de prurido, edema, exantema e vômito, nenhum evento adverso grave foi mencionado. Concluiu-se que a probabilidade de reações adversas graves à dipirona (reações hemodinâmicas, anafiláticas ou respiratórias) é menor que 0,3%146,147.
São de relevância as recomendações sumarizadas de publicações e recomendações de opiniões de especialistas148:
- prevalência aumentada de reações de hipersensibilidade a AINEs (nas crianças) do que previamente relatado;
- a história natural dessas reações nas crianças ainda é desconhecida, requerendo reavaliações periódicas;
- o teste de provocação é o padrão-ouro; e - os inibidores da COX2, embora ainda não aprovados, têm se mostrado úteis como alteranativas148.
Antibióticos
Antibióticos são utilizados em todos os períodos perioperatórios, seja para profilaxia ou tratamento de infecções. Estima-se que cerca de 15% de todos os antibióticos utilizados em hospitais são prescritos para profilaxia cirúrgica149,150.
Causa bem conhecida e comum de anafilaxia perioperatória, reações a esta classe de medicamento aumentaram marcadamente em muitos países nas últimas décadas. É certo que os compostos antimicrobianos implicados nas anafilaxias perioperatórias variam na dependência do local de uso151. Contudo, as evidências apontam predomínio nítido do envolvimento dos betalactâmicos, particularmente das penicilinas e das cefalosporinas141. Nessas situações, existe participação do mecanismo de hipersensibilidade tipo I de Gell e Coombs com produção de IgE específica e consequente sensibilização ao anel betalactâmico ou às cadeias laterais do betalactâmico. Vale ressaltar que a sensibilização ao anel determina risco de reação a qualquer antibiótico do grupo, uma vez que todos betalactâmicos compartilham dessa estrutura. Já a sensibilização às cadeias laterais torna possível a ocorrência de reações por reatividade cruzada entre betalactâmicos com cadeias laterais semelhantes (p. ex. amoxicilina vs. cefadroxila)152. Nesse contexto, sabe-se, por exemplo, que a cefazolina - cefalosporina muito utilizada como profilaxia cirúrgica - possui cadeias laterais distintas de todos os demais betalactâmicos, de forma que pacientes com reação a este composto toleram os demais compostos do grupo153.
As evidências demonstram, ainda, que podem existir diferenças no padrão de sensibilização a depender do grupo populacional analisado. Sabe-se, por exemplo, que a maioria dos pacientes com alergia a betalactâmicos nos EUA e na Europa são sensibilizados, respectivamente, ao anel betalactâmico e às cadeias laterais141,154-157.
A rotulação espúria de alergia aos betalactâmicos, notadamente à penicilina, é uma questão que merece ser comentada.
Alergia à penicilina é relatada em aproximadamente 10% da população, e em 20% dos pacientes internados. Porém, em pelo menos 90% deles, esse rótulo poderia ser retirado, por história detalhada ou por avaliação em clínica de alergia158.
Em crianças, alergia a antibióticos é relatada em 5 a 10% dos casos, porém, verifica-se que destas, aproximadamente 90% receberam um rótulo inadequado159.
As implicações desse diagnóstico incorreto são o uso de antibióticos alternativos, ocasionando altas taxas de infecção no sítio operatório, resistência bacteriana, infecção hospitalar, prolongamento da internaçãoo hospitalar e altos custos158,160-162. Evidencia-se a premente necessidade por estudos com o objetivo de remover essa rotulação inadequada, minimizando as consequências daí advindas158,163,164.
Existem também relatos de reações perioperatórias à vancomicina e às quinolonas, porém a confirmação de seu papel como agente etiológico - mediante testes cutâneos para pesquisa de IgE específica - é bastante prejudicada, uma vez que tais compostos, degranuladores diretos dos mastócitos, podem liberar histamina, independentemente da produção de IgE específica165.
COMO INVESTIGAR?
No centro cirúrgico
Depois de estabelecido o diagnóstico clínico e tomadas as medidas terapêuticas, sem aguardar resultados de exames laboratoriais, que serão úteis para confirmar o diagnóstico de hipersensibilidade imediata.
As mais recentes recomendações sugerem a obtenção da primeira amostra em até 1 hora após o início da reação, como também a coleta de uma segunda amostra entre 2-4 horas após a primeira42. Caso não seja possível obter as duas amostras, uma única amostra obtida dentro de 1-4 horas é adequado28,52,64. A amostra de base para comparação deverá ser coletada 24 horas após a reação, ou mais tardiamente, no momento da realização dos testes cutâneos28,52,64.
Para a interpretação dos resultados foi recentemente validado o algoritmo que, além de ser de consenso internacional, é também o mais efetivo. Em seus cálculos, os níveis da triptase, após a reação, devem ser maiores que [(1,2 x triptase basal) + 2] µg.L-1, podendo assim discriminar, no cenário perioperatório, entre evento anafilático e não anafilático166,167.
Amostras post-mortem podem ser utilizadas decorrente da alta estabilidade da triptase168.
Vale ressaltar que a dosagem de triptase é, no momento, o único exame a ser coletado durante a crise, para posterior quantificação. A histamina tem meia-vida fugaz, declinando rapidamente a valores normais, não fazendo parte da rotina. Sua utilização é restrita a poucos centros especializados52.
No consultório do Alergologista
A investigação de uma reação perioperatória tem como objetivos: identificar o agente causal, fornecer alternativas seguras e garantir anestesia futura segura, mesmo quando nenhum culpado for identificado. Essa investigação requer abordagem sistemática e idealmente deve ser um esforço de equipe, combinando a perícia de alergologistas/imunologistas em conjunto com anestesiologistas com experiência em investigação de alergia anestésica. O anestesiologista entende o cenário perioperatório e os diversos diagnósticos diferenciais, tem maior facilidade para interpretar a ficha anestésica e pode ajudar a identificar possíveis culpados, mesmo os não documentados na ficha. Já o alergologista/ imunologista tem o conhecimento dos testes disponíveis e de suas limitações28. Idealmente todos os pacientes que apresentam reações imediatas deveriam ser referenciados a alergistas ambulatorialmente para investigação, tanto as reações exclusivamente cutâneas (Grau I), quanto as mais graves (Graus II a IV)28,42,169.
No Brasil, é incomum pacientes procurarem o alergologista espontaneamente, sem terem sido referenciados, o que pode acarretar dificuldade na abordagem e maior demora na obtenção do diagnóstico.
Para o alergologista, a anamnese minuciosa sobre o evento é ferramenta fundamental. Todas as exposições, até 2 horas antes do início da reação28, podem ser relevantes, e a documentação completa, incluindo cronogramas, é essencial. Essa documentação deve incluir a ficha anestésica, todos os prontuários (pré-operatório, sala cirúrgica e recuperação pós-anestésica), anotações do anestesista, detalhes de qualquer exposição cirúrgica ou outras exposições perioperatórias (desinfetantes, spray/géis anestésicos locais, corantes, cimentos) e detalhes de todos os procedimentos (cateteres venosos e urinários, stents). Não é recomendado planejar investigações com base em informações apenas em uma carta de referência28.
No elenco dos produtos que devem ser investigados estão látex e antissépticos (principalmente a clorexidina), porém frequentemente não estão registrados nos prontuários. Outras substâncias menos comumente associadas a reações são os anestésicos locais e óxido de etileno, devendo também serem incluídos na lista para investigação. Ressalte-se que para o óxido de etileno a IgE específica é o diagnóstico atualmente disponível77.
Dessa forma, todos os agentes presentes no pré, intra e pós-operatório imediato devem ser investigados27,28,49.
Por outro lado, não há indicação de testar agentes cujos grupos farmacológicos não foram usados (exemplo: não se deve testar etomidato em pacientes sedados com propofol e/ou midazolam)28.
Outro dado relevante é verificar o uso subsequente das substâncias utilizadas no perioperatório. Medicações usadas na ocasião da reação índice, e que em nova exposição não acarretaram nova reação, não necessitam ser testadas. Porém, vale salientar que substâncias que foram mantidas ou reutilizadas pouco tempo após a recuperação da reação ainda devem ser consideradas para investigação, pois o paciente pode estar em período refratário ou sob efeito de medicações que mascarem uma nova reação, como anti-histamínicos ou corticosteroides28.
Nos casos de pacientes que não conseguem acesso ao prontuário/ficha anestésica, em geral por reações prévias muito remotas (acima de 10 anos), recomenda-se a investigação de látex, clorexidine, óxido de etileno, propofol, fentanil, remifentanil e um BNM para uso seguro em futura anestesia28,52. Sugere-se também investigar cefazolina, midazolam e incluir a succinilcolina como opção de BNM. A cefazolina é o antibiótico mais usado no período perioperatório, e, embora pareça não apresentar reatividade cruzada com outras cefalosporinas e betalactâmicos, ainda não se permite liberá-la para uso seguro sem investigação completa negativa (testes cutâneos seguidos de provocação)170. O midazolam, embora descrito como causa muito rara de reações perioperatórias27,28,52, é causa frequente de testes cutâneos positivos em uma casuística brasileira11, o que pode sugerir perfil diferente de sensibilização para essa população.
Por fim, a succinilcolina ou suxametônio é o BNM mais frequentemente encontrado em kits de emergência para sequência rápida de intubação orotraqueal nos hospitais públicos e privados do país e, portanto, o conhecimento de sua tolerância permite uso futuro em maior segurança.
Definidos os agentes a serem investigados na primeira consulta com o alergista, devem ser programados os testes cutâneos em ambiente hospitalar, e exames laboratoriais iniciais podem ajudar a elucidar o agente e até a evitar testes in vivo desnecessários. Uma questão ainda controversa é dos tempos ideal e limite para a investigação. Embora a positividade dos testes in vitro e cutâneos tenha a tendência de reduzir com o tempo, não há um tempo máximo limite para a solicitação, uma vez que um resultado positivo deve ser valorizado27,28,37,49,169. Já o "tempo ideal" não é conhecido. Sugere-se aguardar um mínimo de 4 a 6 semanas após o evento, mas evitando mais do que 4 meses de intervalo. Por outro lado, as diretrizes britânicas sugerem a possibilidade de se investigar logo após o evento, embora não se possa excluir a possibilidade de algum resultado falso-negativo nesse período37,52,169,171,172.
Para a realização dos testes cutâneos, idealmente anti-histamínicos devem ser suspensos no mínimo 5 dias antes do procedimento. Altas doses de corticoide sistêmico e drogas com ação anti-histamínica (antidepressivos e antipsicóticos) podem influenciar nos resultados37, mas só devem ser suspensos se os médicos prescritores considerarem seguro. Até o momento não há evidência de benefício de se suspender inibidores da enzima conversora de angiotensina ou betabloqueadores que pode aumentar o risco cardiovascular. Portanto não devem ser suspensos como rotina28.
Dessa forma, ao fazer o agendamento dos testes cutâneos, o médico já deve ajustar as medicações de uso oral de acordo com o dia do procedimento e solicitar as provas in vitro, de modo que possam ser checadas antes das provas in vivo agendadas.
a) Provas in vitro
Os testes in vitro incluem principalmente as dosagens séricas de triptase, de IgE específica (sIgE), e o teste de ativação de basófilos (BAT).
Os testes in vitro podem acrescentar acurácia aliada à segurança, na investigação de reações de hipersensibilidade. Porém, não são realizados isoladamente, fazem parte de um algoritmo diagnóstico, sendo avaliados de acordo com outros testes adicionais. Embora existam vários testes in vitro, em sua maioria estão disponíveis apenas em centros de pesquisa, e não na rotina clínica173.
Triptase sérica
A triptase sérica é o melhor biomarcador que comprova a desgranulação dos mastócitos, tanto por mecanismo IgE, como não-IgE mediado. Como é disponível apenas em poucos centros, raramente se tem o resultado imediato da amostra colhido na fase aguda de uma reação perioperatória. Idealmente, recomenda-se coletar duas amostras na fase aguda e, após 24 horas da reação, amostra para o valor basal28. Recentemente publicado, estudo nacional britânico NAP6 mostrou que a coleta imediatamente após a estabilização do paciente aumenta a acurácia da detecção de aumento significativo2. Considera-se aumento significativo a elevação da triptase quando acima de 2 µg/L + 1,2x triptase basal (em µg/L)166,167.
Mesmo quando não se obtém a amostra da fase aguda, a dosagem isolada da triptase basal é útil como triagem para casos de doenças de ativação mastocitária, como a mastocitose28.
IgE sérica específica (sIgE)
A dosagem sIgE é medida complementar importante para documentar uma reação de hipersensibilidade imediata, aliada a outros testes, e não isoladamente.
O resultado positivo de IgE específica a determinado agente confirma a sensibilização àquele agente, mas não necessariamente "alergia". A disponibilidade desse exame é restrita a poucos agentes, e seu valor preditivo não é absoluto. Para muitos agentes, os ensaios não foram ainda adequadamente validados, por número inadequado de pacientes acuradamente fenotipados e expostos, ou indivíduos controle provocados174.
Estão disponíveis ensaios de sIgE principalmente para bloqueadores neuromusculares, antibióticos betalactâmicos, látex, clorexidina e óxido de etileno, nem todos presentes no mercado brasileiro.
Nos casos de necessidade de reintervenção precoce (cirurgias em menos de 4 semanas após o episódio suspeito), a positividade do teste alertará para o agente culpado. Entretanto, em caso negativo, o exame deverá ser repetido após 1-2 meses175.
Teste de ativação de basófilos (BAT)
O BAT fundamenta-se na análise, por citometria de fluxo, de marcadores de ativação e desgranulação presentes na superfície da membrana de basófilos175. Tem sido comparado a testes in vivo, demonstrando alta acurácia diagnóstica para os casos de reações de hipersensibilidade perioperatórias176.
O BAT potencialmente pode ser realizado com qualquer droga, entre as quais BNM, antibióticos, látex, opioides e opiáceos175.
Para a validação do BAT, para diagnóstico das reações de perioperatórias suspeitas de hipersensibilidade, ainda são necessários grandes estudos, com controles padronizados e harmonização dos diagnósticos entre Estados Unidos, Europa e demais regiões do mundo173. No Brasil, a exemplo de muitos países, o BAT ainda não está presente na rotina clínica.
b) Provas in vivo
Os testes in vivo com medicamentos incluem os testes cutâneos e de provocação. Os testes cutâneos permitem confirmar o mecanismo IgE-mediado, e os testes de provocação são considerados o padrão-ouro no diagnóstico das reações de hipersensibilidade a medicamentos177,178. Contudo, no contexto das reações perioperatórias, as indicações e contraindicações dessas provas são peculiares e devem ser ponderadas cautelosamente.
Testes cutâneos
Os testes cutâneos realizados na investigação das reações imediatas perioperatórias são os testes de punctura ou prick test (SPT) e os testes intradérmicos (ID), ambos de leitura imediata (15 a 20 min), para documentar mecanismo IgE-mediado. Recomenda-se que os testes sejam realizados por alergistas experientes nesse procedimento35,52,177.
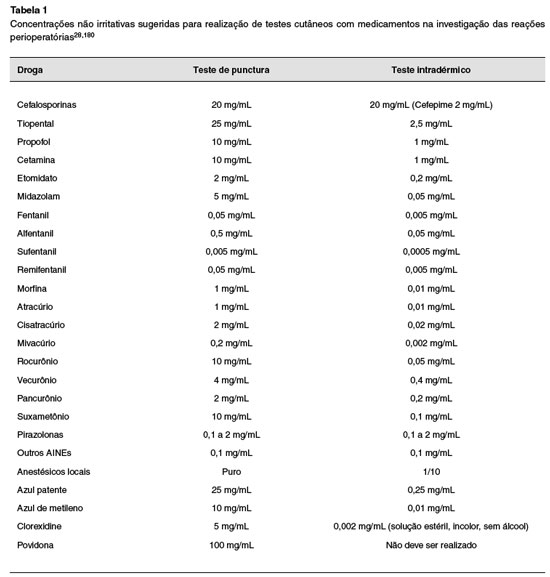
Apesar dos esforços para padronizar as concentrações usadas para o teste cutâneo, as concentrações não irritativas de alguns medicamentos, por exemplo, como opioides e BNM, ainda são motivo de debate. Até o momento, utilizamos as diluições sugeridas pela academia europeia, que estão resumidas na Tabela 1178.
Os SPT sempre devem ser realizados primeiro, geralmente na superfície volar do antebraço, com controles negativo (salina ou diluente) e positivo (histamina). Os resultados são lidos após 15 a 20 minutos, e uma pápula ≥ 3 mm em relação ao controle negativo é considerada positiva. Quando o SPT é negativo ou inconclusivo, o ID é realizado, preferencialmente também no antebraço.
A técnica e interpretação do ID de leitura imediata (15 a 20 min) também ainda é assunto de debate. As diretrizes internacionais de 2011 sugeriam a administração de um volume entre 0,02 e 0,05 mL, atingindo uma pápula inicial de até 4 mm de diâmetro, a ser demarcada com caneta de ponta fina. Deveria ser considerado ID positivo quando a pápula final tivesse no mínimo o dobro da pápula inicial52. Porém, segundo as diretrizes europeias publicadas mais recentemente, deve-se aplicar a injeção de um volume fixo de 0,02 mL, atingindo uma pápula inicial de 3 a 5 mm, e ocorrendo um acréscimo de ≥ 3 mm em comparação com a pápula inicial, o teste é considerado positivo. Controle negativo, com salina, também está indicado. Os resultados devem ser lidos após 20 minutos, e se ocorrer um aumento no diâmetro da pápula de ≥ 3 mm em comparação com a inicial, o teste é considerado positivo28. As diretrizes espanholas de 2018 também sugerem um acréscimo ≥ 3 mm em comparação com a pápula inicial para considerar-se um ID positivo, ou seja, não seria necessário dobrar a pápula inicial. Contudo, esse manuscrito não deixa claro qual diâmetro máximo inicial seria aceitável49. O teste intradérmico também é, preferencialmente, realizado na superfície volar do antebraço, assim como os de punctura. São utilizadas obrigatoriamente substâncias líquidas estéreis, que são injetadas na pele em volumes de 0,02 a 0,03 mL, de modo a formar uma pápula inicial de 3 a 5 mm de diâmetro. Deve ser considerado positivo o teste em que a pápula fina tenha, no mínimo, 3 mm a mais do que a inicial. Em casos de dúvida, o teste pode ser repetido no membro contralateral35.
É importante salientar que existe um risco, embora muito baixo, de reação sistêmica, até anafilática, com a realização de teste ID. Assim, aliado ao fato de que apenas medicações na sua apresentação parenteral podem ser utilizadas, recomendamos a realização apenas em ambiente hospitalar, sob supervisão de alergista experiente no procedimento e no manejo de reações graves177.
Quanto aos agentes a serem escolhidos para testes cutâneos, além daqueles presentes na ocasião da reação, em casos de o teste cutâneo ser positivo com um BNM, é indicado incluir todos os BNM disponíveis para investigação de reatividade cruzada28,37,49. Situação semelhante ocorre quando a investigação é positiva para cefazolina. Sugere-se realizar investigação de outros betalactâmicos pelo potencial teórico de reatividade cruzada (penicilina ou ampicilina e outra cefalosporina intravenosa).
Quanto ao látex, agente muito importante de sensibilização no Brasil, o teste cutâneo deve ser restrito ao SPT, sem realização do ID, mas quando disponível deve ser realizado com extrato comercial e na forma "prick-to-prick" com luva de látex. Se SPT for negativo, em ambiente controlado, é possível se realizar o teste do uso (use test), que embora seja um teste de contato de leitura imediata, acaba por ser uma provocação com látex179.
Testes de provocação com drogas (TPD)
Os TPD são considerados o padrão-ouro na investigação das reações de hipersensibilidade imediata a drogas178,181,182. Contudo, nas reações anafiláticas perioperatórias, o uso é limitado pelos fortes efeitos farmacológicos de drogas perioperatórias, por exemplo, depressão respiratória, paralisia e anestesia28. A princípio, as indicações e contra-indicações para a realização dos TPD em pacientes com hipersensibilidade a medicamento, em geral, podem ser seguidas, ou seja, podem ser realizados quando os testes cutâneos são duvidosos ou negativos, para excluir a sensibilização ao medicamento culpado ou testar uma alternativa segura78,181,182. Além disso, drogas cuja maioria das reações costumam não ser IgE-mediadas, como AINEs e opioides, o TPD pode ser o único teste confiável28.
A anafilaxia é uma contraindicação relativa à realização dos TPD, que acabam sendo mais utilizados para encontro de alternativa terapêutica segura, e não para confirmação diagnóstica183. Isso ocorre pela maior possibilidade de o TPD induzir nova anafilaxia. Assim, o TPD nas anafilaxias intraoperatórias se mostra um procedimento de alto risco e, portanto, só deve ser realizado em centros estruturados e com alergistas bastante experientes nesses procedimentos. Além disso, o TPD em dose total não pode ser realizado devido às ações farmacológicas potentes de muitos dos medicamentos, notadamente BNM e hipnóticos51,184. Em alguns países da Europa, os TPD com anestésicos gerais, como BNM, opioides fortes e sedativos vêm sendo realizados em ambientes controlados, com anestesistas presentes, como centro cirúrgico, sala de recuperação anestésica e unidades de terapia intensiva49,185,186.
No Brasil, até o momento, não há relatos de TPD com tais drogas, uma vez que não são realizados por questões de segurança e pela não disponibilidade, na grande maioria dos centros, de ambientes tão bem controlados. Portanto, até o momento, sugere-se que os TPD nas reações perioperatórias fique restrito ao látex (use test ou teste do uso), anestésicos locais, antibióticos, AINEs e outros (antieméticos, inibidores de bomba de prótons, morfina e opioides fracos, etc.).
Em relação aos betalactâmicos, faz-se necessário ressaltar a questão da cefazolina, o antibiótico mais utilizado em nosso meio para profilaxia de sítio cirúrgico em cirurgias limpas. Além disso, dados recentes sugerem que essa medicação tenha pouca ou nenhuma reatividade cruzada com outros antibióticos da mesma classe170. Assim, em casos de anafilaxia intraoperatória, em que os testes cutâneos não permitiram uma confirmação do agente causador, a investigação com provocação com betalactâmicos se faz necessária. Contudo, a opção entre provocar com a própria cefazolina ou com outra cefalosporina deve ser realizada após ponderação adequada da relação risco-benefício. O TPD com a droga suspeita (cefazolina), se negativo, permite o uso seguro futuro de toda a classe. Caso o TPD seja positivo, numa outra ocasião deve-se fazer outra provocação com cefalosporina alternativa a fim de evitar exclusão desnecessária de toda a classe. Por outro lado, se a equipe optar por não fazer provocação com a cefazolina, mas diretamente com alternativa, o TPD negativo indicará tolerância às demais cefalosporinas, mas no relatório final, a cefazolina deve permanecer descrita como suspeita ou investigação inconclusiva e o uso futuro não poderá ser considerado seguro. Por outro lado, caso a investigação com testes cutâneos de todos os agentes tenha sido conclusiva (exemplo: positivo para rocurônio, mas já com opções seguras de BNM) e o ID com cefazolina 20 mg/mL tenha sido negativo, a provocação com a própria cefazolina é provavelmente mais segura (agente provável foi o rocurônio) e assertiva.
Avaliação pré-operatória - indicações
Não há fundamentação científica para submeter a população em geral a testes diagnósticos aos medicamentos e substâncias a serem utilizados em anestesia (testes de screening)28,37,187. Tais testes, com o objetivo de prevenir reações de hipersensibilidade, constituem-se em medida improvável para reduzir a incidência desses episódios169,188.
Para a ocorrência de anafilaxia, além das substâncias desencadeantes, outros elementos também contribuem (como cofatores amplificadores)189, e nem todos esses fatores poderão estar presentes nos testes prévios, o que poderia explicar as discrepâncias. Além disso, o conhecimento ainda é insuficiente sobre os valores preditivos, positivos e negativos, dos testes para a população em geral52.
No entanto, existem situações em que avaliação pode ser necessária e está indicada:53
a. pacientes que sofreram reações de hipersensibilidade em cirurgia prévia;
b. pacientes que sofreram reação a medicamentos que podem ser utilizados na cirurgia;
c. pacientes com história de alergia ao látex;
d. pacientes com história de reação a alimentos que têm reação cruzada com látex, como banana, abacate, kiwi, mandioca, etc.;
e. pacientes pediátricos submetidos a numerosas cirurgias, principalmente aqueles com espinha bífida ou mielomeningocele, em virtude da alta frequência de alergia ao látex.
Nos últimos três itens (c, d, e), a investigação é conduzida unicamente para o látex48.
A avaliação correta nas situações indicadas pode aumentar a segurança em cirurgias subsequentes. Em estudo norteamericano no periodo de 10 anos (2003-2012), 73 pacientes que soferam reação anafilática foram encaminhados para avaliação alergológica.Treze pacientes tiveram confirmado mecanismo mediado por IgE, 43 dos 73 pacientes tiveram que ser submetidos a nova cirurgia. Em 45 destes, o procedimento ocorreu sem incidentes, seguindo-se a orientação baseada na avaliação. Dois pacientes que apresentaram recorrência de reação sofriam de doença mastocitária190.
Em outro estudo retrospectivo britânico191 (70 pacientes, avaliados entre 2002-2015), 67 deles foram submetidos novamente a anestesia sem intercorrências. Dos três que apresentaram novos episódios, em dois a causa apontada foi a omissão de dados referentes às substâncias utilizadas. Essas não eram anestésicos, e sim desinfetante e solução coloidal, e o terceiro paciente foi diagnosticado com mastocitose sistêmica, posteriormente confirmada por biópsia192.
Enfatize-se a relevância de uma adequada avaliação dos pacientes com condições pré-existentes, tais como mastocitose, angioedema por bradicinina, entre outras43.
SITUAÇÕES ESPECIAIS
Angioedema por bradicinina
Além do angioedema mediado por histamina, desencadeado, frequentemente por antibióticos, bloqueadores neuromusculares, opioides, látex e agentes de radiocontraste, existem as reações por ação da bradicinina. Embora as reações por bradicinina sejam mais raras, elas também se manifestam por angioedema, geralmente localizado, particularmente, em extremidades, face e vias aéreas, podendo evoluir para insuficiência respiratória, semelhante aos quadros de anafilaxia, mas que não respondem à adrenalina.
O edema bradicinérgico pode ocorrer por deficiência ou alteração funcional do inibidor de C1 esterase, de causa tanto hereditária (AEH), quanto adquirida (AEA), além dos inibidores da enzima de conversão da angiotensina (IECA) e bloqueadores do receptor da angiotensina. O angioedema pode comprometer as vias aéreas durante o período perioperatório, afetando até dois terços dos pacientes com AEH e AEA, podendo levar à morte entre 15% e 33% dos casos193,194.
A profilaxia, neste caso, considerada de curto prazo, é sempre indicada nos procedimentos cirúrgicos ou anestésicos, particularmente os que envolvam a região cervicofacial, como amigdalectomia, extração dentária, cirurgia facial, ou que necessitem intubação traqueal. Além disso, procedimentos como endoscopia e broncoscopia devem ser realizados em centro cirúrgico, e também necessitam profilaxia de curto prazo195.
Até o momento, não existem estudos controlados de avaliação da eficácia dos diferentes medicamentos utilizados na profilaxia de curto prazo no AEH e AEA. Portanto, as recomendações atuais são baseadas na opinião de especialistas e em estudos pequenos não controlados196.
Os agentes mais indicados na profilaxia de curto prazo são os concentrados do Inibidor de C1 esterase, de uso IV, devendo ser usado 1 a 6 horas antes do procedimento. Atualmente, no Brasil o único inibidor de C1 esterase liberado pela ANVISA é o Berinert®, utilizado na dose de 20 U/kg197. Além disso, pode ser necessário repetir a dose no caso de cirurgias mais complexas e duradouras, e no caso de grande perda sanguínea. Também, deve-se considerar a administração de plasma fresco congelado, cerca de 1 a 6 horas antes do procedimento, na dose de 10 mL/kg (2-4 unidades para um adulto), quando não estiver disponível o inibidor de C1 esterase198. Porém, em alguns casos pode ocorrer piora do quadro do angioedema, uma vez que o plasma oferece substrato do complemento.
Além disso, uma alternativa é a utilização do danazol, na dose de 10 mg/kg/dia (máximo 600 mg/ dia, dividido em 200 mg 3x ao dia) por 5-7 dias antes do procedimento, devendo-se manter por mais 3-5 dias após o procedimento, e podendo ser usado concomitante ao inibidor de C1 esterase199. De eficácia menos documentada em relação aos três agentes anteriores, os antifribinolíticos, como o ácido tranexâmico, só devem ser utilizados se os medicamentos anteriores não estiverem disponíveis. O ácido tranexâmico deve ser usado na dose de 25 mg/kg/dia (máximo 3-6 g/dia), dividida em 2 a 3 vezes ao dia, 5 dias antes e mantido por 2-5 dias após o procedimento197. Em situações em que o risco é considerado mínimo, e houver acesso ao Icatibanto (inibidor do receptor de bradicinina) ou inibidor de C1 esterase, medicamentos indicados na crise, pode-se omitir a profilaxia de curto prazo.
No caso do angioedema adquirido tipo I e II, a prevenção e tratamento são baseados no angioedema hereditário200. Porém, pacientes com angioedema adquirido podem ser resistentes aos andrógenos atenuados, e se beneficiarem dos agentes antifibronolíticos. Da mesma forma, na crise aguda, parece haver maior resistência ao tratamento com inibidor do C1 esterase e melhor resposta ao inibidor do receptor de bradicinina no angioedema adquirido201.
Os pacientes deverão permanecer sob observação por 36 horas, e devem ter fácil acesso à medicação, em caso de crise202.
Mastocitose
A mastocitose é uma doença clonal caracterizada pela proliferação e acúmulo de mastócitos em diferentes tecidos, preferencialmente na pele e medula óssea203. O excesso de mastócitos acumulados, bem como a maior capacidade de degranulação, pode levar a aumento da frequência e gravidade de reações de hipersensibilidade imediata, podendo ocorrer anafilaxia em 22% a 49% dos adultos com mastocitose204. A literatura sobre anestesia em pacientes com mastocitose é muito limitada, não havendo estudos observando a incidência de reações durante a anestesia geral nesses pacientes205. Têm sido descritos casos de anafilaxia fatal, particularmente após picadas de himenópteros, porém ocasionalmente podem ocorrer após ingestão de drogas como anti-inflamatórios não esteroidais, opioides e drogas no perioperatório206.
No entanto, não há evidências, até o momento, de maior prevalência de reações IgE ou não IgE mediadas a drogas em pacientes com mastocitose que na população em geral205,207.
No caso de anestesia, vários outros fatores que fazem parte dos cuidados gerais do paciente, tais como posicionamento adequado na mesa cirúrgica (evitando pressão indevida), temperatura da sala (perigo de hipotermia), controle da ansiedade, devem ser valorizados e não apenas a escolha das drogas, papel que parece ser superestimado em algumas situações43,207.
Mantém-se a recomendaçãoo de cautela, não obstante, aos BNM do grupo dos benzilisoquinolínicos, pela sua capacidade de histaminoliberação43. Sugere-se também a substituição de morfina, pela mesma razão, por fentanil e similares208.
Em relação ao pré-tratamento, embora não haja uma avaliação para essa medida,209 muitos centros recomendam o uso de anti-histamínicos e corticosteroides sistêmicos antes de procedimentos e/ou cirurgias,205,207 visto não haver recomendações em contrário43. Portanto, indica-se no dia da cirurgia pré-tratamento com anti-histamínico intramuscular, 1 hora antes da cirurgia, prednisona 50 mg, 13h, 7h e 1h antes da cirurgia, além de benzodiazepínicos para reduzir ansiedade e sintomas psicológicos208.
As medicações para estabilização dos mastócitos também deverão ser mantidas até a cirurgia43,207. Em caso de reação perioperatória suspeita de hipersensibilidade, a escala modificada de Ring e Messner para caracterização do quadro é igualmente utilizada, e o tratamento realizado de acordo com a clínica e os protocolos existentes207. O documento ENDA/EAACI205 conclui sobre a ausência de evidências de maior risco de anafilaxia por betalactâmicos nos pacientes com mastocitose. Além disso, sugere, também, que pacientes que toleram anti-inflamatórios não esteroidais (AINES) não precisam descontinuar o seu uso, por não existir estudos que comprovem risco de anafilaxia aumentada por AINEs nesses pacientes205. Parturientes e crianças estão presentes em séries que relatam procedimentos sem intercorrências em pacientes com mastocitose211,212.
Deficiência de IgA
Pacientes com deficiência de IgA correm risco de reações anafiláticas após serem transfundidos com sangue, plasma ou receberem imunoglobulina IV, uma vez que podem desenvolver anticorpos anti-IgA, e, portanto, desenvolverem reação quando receberem produtos com IgA. Recentemente, estudo que avaliou 229 reações alérgicas ou anafiláticas graves relatadas na hemovigilância dos EUA e Canadá entre 2003 e 2012, mostrou que apenas três (1,3%) dos pacientes com deficiência de IgA, apresentavam anti-IgA. Mesmo sendo raras as reações anafiláticas associadas aos anticorpos anti-IgA, há a possibilidade dessas reações ocorrerem após transfusões com produtos derivados do sangue, devendo-se, portanto, tentar identificar a presença desses anticorpos previamente à administração de hemoderivados212.
CONSIDERAÇÕES FINAIS
Das recomendações advindas do NAP664, é importante destacar a que aponta a presença de um anestesista responsável por anafilaxia perioperatória em cada departamento de anestesia, e a este pro-fissional devem ser oferecidas horas e condições para a realização do trabalho.
É recomendável um canal de comunicação adequado entre esse profissional e a clínica local de alergologia, com a troca de e-mails e telefone de contato.
Deve-se tentar estabelecer redes locais, regionais, nacionais e internacionais de centros para investigação de anafilaxia perioperatória, com a proposta de aumentar a capacidade de conduzir grandes estudos, compartilhar experiências e oferecer um atendimento de melhor qualidade a esses pacientes complexos28.
Por fim, é desejável que haja em cada regional da Sociedade Brasileira de Anestesiologia e da Associação Brasileira de Alergia e Imunologia um especialista responsável pelo tema anafilaxia perioperatória.
A combinação dos efeitos dos anestésicos, o procedimento cirúrgico a diagnósticos diferenciais dificultam a avaliação dos eventos perioperatórios. É imprescindível a interação multidisciplinar para prosseguir na investigação diagnóstica e descoberta do agente causador da reação, orientação do paciente para que sejam evitados o banimento inadequado de agentes úteis, bem como a exposição a agentes nocivos não identificados.
Esse trabalho conjunto traduz-se na segurança do pacientes em futuros procedimentos.
REFERÊNCIAS
1. Moneret-Vautrin DA, Mertes PM.Anaphylaxis to general anesthetics. Chem Immunol Allergy. 2010;95:180-9.
2. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project (NAP6).Br J Anaesth. 2018;121(1):159-71.
3. Simons FE. Anaphylaxis. J Allergy Clin Immunol. 2010;125:S161-81.
4. Montañez MI, Mayorga C, Bogas G, Barrionuevo E, Fernandez-Santamaria R, Martin-Serrano A, et al.Epidemiology, mechanisms, and diagnosis of Drug-induced anaphylaxis. Front Immunol. 2017;8:614.
5. Reber LL, Hernandez JD, Galli SJ. The pathophysiology of anaphylaxis. J Allergy Clin Immunol. 2017;140:335-48.
6. Finkelman FD, Rothenberg ME, Brandt EB, Morris SC, Strait RT. Molecular mechanisms of anaphylaxis: Lessons from studies with murine models. J Allergy Clin Immunol. 2005; 115:409-57.
7. Steenholdt C, Svenson M, Bendtzen K, Thomsen OØ, Brynskov J, Ainsworth MA. Acute and delayed hypersensitivity reactions to infliximab and adalimumab in a patient with Crohn's disease. J Crohns Colitis. 2012;6:108-11.
8. Cheifetz A, Smedley M, Martin S, Reiter M, Leone G, Mayer L, et al. The incidence and management of infusion reactions to infliximab: a large center experience. Am J Gastroenterol. 2003;98:1315-24.
9.Navines-Ferrer A, Serrano-Candelas E, Lafuente A, Munoz-Cano R, Martin M, Gastaminza G.MRGPRX2-mediated mast cell response to drugs used in perioperative procedures and anaesthesia. Sci Report. 2018;8:11628.
10. Munõz-Cano R, Pascal M, Araujo G, Goikoetxea MJ, Valero AL, Picado C, et al. Mechanisms, cofactors, and augmenting factors involved in anaphylaxis. Front Immunol. 2017;8:1193.
11. Galvão VR,Giavina-BianchiP,Castells M.Perioperative anaphylaxis. Curr Allergy Asthma Rep. 2014;14(8):452.
12. Rocha JF. Cómo hacer frente a una reacción alérgica en el perioperatorio: del rash a la anafilaxia. Rev Med Aeronaut. 2013;36:S288-90.
13. Soetens FM. Anaphylaxis during anaesthesia: diagnosis and treatment. Acta Anaesthesiol Belg. 2004;55:229-37.
14. Kannan JA, Bernstein JA. Perioperative anaphylaxis: diagnosis, evaluation, and management. Immunol Allergy Clin North Am. 2015;35(2):321-34.
15. Dewachter P, Mouton-Faivre C, Hepner DL. Perioperative anaphylaxis: what should be known? Curr Allergy Asthma Rep. 2015;15:21.
16. McAleer PT, McNicol L, Rose MA. Perioperative anaphylaxis: progress, prevention and pholcodine policy.Anaesth Intensive Care. 2017;45(2):147-50.
17. Worm M. Epidemiology of anaphylaxis. Chem Immunol Allergy. 2010;95:12-21.
18. Freundlich RE, Duggal NM, Housey M, Tremper TT, Engoren MC, Kheterpal S. Intraoperative medications associated with hemodynamically significant anaphylaxis. J Clin Anesth. 2016;35:415-23.
19.Escolano F, Valero A, Huguet J, Baxarias P, de Molina M, Castro A, et al.Prospective epidemiologic study of perioperative anaphylactoid reactions occurring in Catalonia (1996-7). Rev Esp Anestesiol Reanim. 2002;49(6):286-93.
20. Mertes PM, Lambert M, Guéant-Rodriguez RM, Aimone-Gastin I, Mouton-Faivre C, Moneret-Vautrin DA, et al. Perioperative Anaphylaxis. Immunol Allergy Clin N Am. 2009;29:429-51.
21. Freeman SG, Love NJ, Misbah SA, Pollard RC. Impact of national guidelines on reporting anaphylaxis during anaesthesia - an outcome audit. Acta Anaesthesiol Scand. 2013;57(10):1287-92.
22. Mertes PM, Alla F, Tréchot P, Auroy Y, Jougla E, Groupe d'Etudes des Réactions Anaphylactoïdes Peranesthésiques. Anaphylaxis during anesthesia in France: An 8-year national survey, J Allergy Clin Immunol. 2011;128: 366-73.
23. Niggemann B, Beyer K. Factors augmenting allergic reactions. Allergy. 2014;69:1582-7.
24. Hox V, Desai A, Bandara G, Gilfillan AM, Metcalfe DD, Olivera A. Estrogen increases the severity of anaphylaxis in female mice through enhanced endothelial nitric oxide synthase expression and nitric oxide production. J Allergy Clin Immunol. 2015;135:729-36.
25. Vadas P,GoldM, Perelman B,LissGM,LackG,BlythT,etal.Plateletactivating factor, PAF acetylhydrolase, and severe anaphylaxis. N Engl J Med. 2008;358:28-35.
26. Turner P, Jerschow E, Umasunthar T, Lin R, Campbell DE, Boy RJ. Fatal anaphylaxis: mortality rate and risk factors. J Allergy Clin Immunol Pract. 2017;5:1169-78.
27. Mertes PM, Ebo DG, Garcez T, Rose M, Sabato V, Takazawa T, et al. Comparative epidemiology of suspected perioperative hypersensitivity reactions. Br J Anaesth. 2019;123(1):e16-e28.
28. Garvey LH, Ebo DG, Mertes PM, Dewachter P, Garcez T, Kopac P, et al. An EAACI position paper on the investigation of perioperative immediate hypersensitivity reactions. Allergy. 2019;74(10):1872-84.
29. Garro LS, Aun MV, Soares IS, Ribeiro MR, Motta AA, Kalil JA, et al. Specific questionnaire detects a high incidence of intra-operative hypersensitivity reactions. Clinics. 2018;113:1202-12.
30. Baldo BA, Fisher MM. Substituted ammonium ions as allergenic determinants in drug allergy. Nature. 1983;306:262-4.
31. Baldo BA, Fisher MM. On the origin and specificity of antibodies to neuromuscular blocking (muscle relaxant.) drugs: an immunochemical perspective. Clin Exp Allergy. 2009; 39:325-44.
32. Florvaag E, Johansson SGO. The pholcodine case. Cough medicines, IgE-sensitization and anaphylaxis:a devious connection. World Allergy Organ J. 2012;5(7):73-8.
33. Antunes J, Kochuyt AM, Ceuppens Jl.Perioperative allergic reactions: experience in a Flemish referral centre. Allergol Immunopathol (Madr). 2014:42:348-54.
34. Spoerl D, NIgolian H, Czarnetzki C, Harr T.Reclassifying anaphylaxis to neuromuscular blocking agents based on the presumed pathomechanism: IgE-mediated, pharmacological adverse reaction or "innate hypersensitivity"? Int J Mol Sci. 2017;18:1223.
35. Chiriac AM, Tacquard C, Fadhel BN, Pellerin C, Malinovsky JM, Mertes PM, et al. Safety of subsequent general anesthesia in patient allergic to neuromuscular blocking agents: value of allergy skin testing. Br J Anaesth. 2018;120:1437-40.
36. Fraser BA, Smart JA.Anaphylaxis to cisatracurium following negative skin testing. Anaesth Intensive Care. 2005;33:816-9.
37. Scolaro RJ, Crilly HM, Maycock EJ, McAleers PT, Nicholls KA, Rose MA, et al. The Australian and New Zealand anaesthetic allergy group perioperative anaphylaxis investigation guidelines. Anaesth Intensive Care. 2017;45(5):543-55.
38. Leysen J, Bridts CH, De Clerk LS, Ebo DG. Rocuronium--induced anaphylaxis is probably not mitigated by sugammadex:evidence from an in vitro experiment. Anaesthesia. 2011;66:526-7.
39. Clarke RC, Sadleir PH, Platt PR. The role of sugammadex in the development and modification of an allergic response to rocuronium: evidence from a cutaneous model. Anaesthesia. 2012;67:266-73.
40. Platt PR, Clarke RC, Jonson GH, Sadleir PH.Efficacy of sugammadex in rocuronium-induced or antibiotic-induced anaphylaxis. A case-control study. Anaesthesia. 2015;70:1264-7.
41. Tsur A, Kalansky A. Hypersensitivity associated with sugammadex administration: a systematic review. Anaesthesia. 2014;69:1251-7.
42. Garvey LH, Dewachter P, Hepner DL, Mertes PM, Voltolini S, Clarke R, et al.Management of suspected immediate perioperative allergic reactions: an international overview and consensus recommendations. Br J Anaesth. 2019;123(1):e50-e64.
43. Volcheck GW, Hepner DL. Identification and management of perioperative anaphylaxis. J Allergy Clin Immunol Pract. 2019;7:2134-42.
44. Blaabjerg MS, Andersen KE, Bindeslev-Jensen C, Mortz CG. Decrease in the rate of sensitization and clinical allergy to natural rubber latex. Contact Dematitis. 2015;73:21-8.
45. Cremer R, Lorbacher M, Hering F, Engelskirchen R.Natural rubber latex sensitization and allergy in patients with spina bífida, urogenital disorders and oesophageal atresia compared with normal paediatric population. Eur J Pediatr Surg. 2007;17:194-8.
46. Michavila Gomez AV, Belver Gonzalez MT, Alvarez NC, Giner Muñoz MT, Hernando Sastre V, Porto Arceo JA, et al.Perioperative anaphylactic reactions:Review and procedure protocolinpaediatrics. Allergol Immunopathol (Madr). 2015;43(2):203-14.
47. Dewachter P, Kopac P, Laguna JJ, Mertes PM, Sabato V, Volcheck GW, et al. Anaesthetic management of patients with pre-existing conditions: a narrative review. Br J Anaesth. 2019;123(1):e65-81.
48. Société Française d'Anesthesie et de Réanimation.Société Française d"Allergologie.Reducing the risk of anaphylaxis duringanaesthesia. Short text. Ann Fr Anesth Reanim. 2011;30(3):212-22.
49. Laguna JJ, Archilla J, Doña I, Corominas M, Gastaminza G, Mayorga C, et al. Practical guidelines for perioperative hypersensitivity reactions. J Investig Allergol Immunol. 2018;28(4):216-32.
50. Soares ISC. Sensibilização ao látex em pacientes com mielomeningocele na Urologia do HC-FMUSP:prevalência e fatores associados [tese]. São Paulo; Faculdade de Medicina USP; 2016 doi:10.11606/T.5.2016.tde-20052016-102431.
51. Silva Jr JB. Resolução RDC nº 37, de 26 de agosto de 2015. Ministério da Saúde/Agência Nacional de Vigilância Sanitária/ Diretoria Colegiada. Dispõe sobre a padronização de frases de declaração de conteúdo de látex de borracha natural em rótulos de dispositivos médicos.Diário Oficial da União.Edição 164, Seção 1, Página 46.
52. Mertes PM, Malinovsky JM, Jouffroy L; Working Group of the SFAR and SFA, Aberer W, Tereehorst I, et al. Reducing the risk of anaphylaxis during anesthesia: 2011 update guidelines for clinical practice. J Investig Allergol Clin Immunol. 2011;21(6):442-53.
53. Baldo BA, Pham NH.Histamine-releasing and allergenic properties of opioid analgesic drugs:resolving the two.Anaesth Intensive Care. 2012;40:216-35.
54. Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg. 2003;97:1381-95.
55. Blunk JA, Schmelz M, Zeck S, Skov P, Likar R, Koppert W. Opioid-induced mast cell activation and vascular response: an in vivo microdialysis study in human skin. Anesth Analg. 2004;98:364-70.
56. Ebo DG, Fischer MM, Hagendorens MM, Bridts CH, Stevens WJ. Anaphylaxis during anaesthesia: diagnostic approach. Allergy. 2007;62:471-87.
57. Nasser SM, Ewan PW.Opiate-sensitivity:clinical characteristics and the role of skin prick testing. Clin Exp Allergy. 2001;31:1014-20.
58. Van Gasse AL, Hagendorens MM, Sabato V, Bridts CH, De Clerck LS, Ebo DG. IgE to poppy seed and morphine are not useful tools to diagnose opiate allergy. J Allergy Clin Immunol. 2015;3:396-9.
59. Baker MTN, Aguib M. Propofol: the challenges of formulation. Anesthesiology. 2005;103:860-76.
60. Asseroj LL, Mosbech H, kroigaard M, Garvey LH. No evidence for contraindications to the use of propofol in adults allergic to egg, soy and peanuts. Br J Anaesth. 2016;116(1):77-82.
61. Murphy A, Campbell DE, Baines D, Mehr S. Allergic reactions to propofol in egg-allergic children. Anesth Analg. 2011;113:140-4.
62. Mehta P, Sundaram SS, Furuta GT, Pan Z, Atkins D, Markowitz S. Propofol use in pediatric patients with food allergy and eosinophilic esophagitis. J Pediatr Gastroenterol Nutr. 2017;64:546-9
63. Tacquard C, Collange O, Gomis P, Malinovsky JM, Petipain N, Demoly P, et al. Anaesthetic hypersensitivity reactions in France between 2011 and 2012: the 10th GERAP epidemiology survey. Acta Anaesthesiol Scand. 2017;61:290-9.
64. Harper NJN, Cook TM, Garcez T, Lucas DN, Thomas M, Kemp H, et al. Anaesthesia, surgery, and life-threatening allergic reactions: management and outcomes in the 6th National Audit Project (NAP6). Br J Anaesth. 2018;121:172-88.
65. Kvisselgaard AD, Mosbech HF, Fransson S, Garvey LH. Risk of Immediate-type to local anesthetic is overestimated-results from 5 years of provocation testing in a Danish allergy clinic. J Allergy Clin Immunol Pract. 2018;6:1217-23.
66. Kvisselgaard AD, Melchiors BB, Kroigaard M, Garvey LH. Lidocaine as a rare and hidden allergen in the perioperative setting: a case report. Anesth Analg Pract. 2019;12(11):430-2.
67. Bhole MV, Manson AL, Seneviratne SL, Misbah SA. IgE-mediate allergy to local anaesthetic:separating fact from perception: a UK perspective. Br J Anaesth. 2012;108(6):903-11.
68. Malinovsky JM, Chiriac AM, Tacquard C, Mertes PM, Demoly P. Allergy to local anesthetics: Reality or mith? Presse Med. 2016;45(9):753-7.
69. Volcheck GW, Mertes PM. Local and general anesthetics immediate hypersensitivity reactions. Immunol Allergy Clin N Am. 2014;34:525-46.
70. Rose MA, Garcez T, Savic S, Garvey LH. Chlorhexidine allergy in the perioperative setting: a narrative review. Br J Anaesth. 2019;123(1):e95-e103.
71. Garvey LH, Roed-Petersen J, Husum B. Anaphylactic reactions in anaesthetized patients - four cases of chlorhexidine allergy. Acta Anaesthesiol Scand. 2001;45:1290-4.
72. Opstrup MS, Malling HJ, Kroigaard M, Mosbech H, Skow PS, Poulsen LK, et al. Standardized testing with chlorhexidine in perioperative allergy - a large single - centre evaluation. Allergy. 2014;69(10):1390-6.
73. Palobart C, Cros J, Orsel I, Nathan N. Choc anaphylactique à la povidone iodée. Ann Fr Anesth Reanim. 2009;28:168-70.
74. Dewachter P, Mouton-Faivre C. Allergie aux medicaments et aliments iodés: la sequence allergénique n'est pas l'iode. Presse Med. 2015;44(11):1136-45.
75. Mertes PM, Demoly P, Malinovsky JM. Hypersensitivity reactions in the anesthesia setting/allergic reactions to anesthetics. Curr Opin Allergy Clin Immunol. 2012;12:361-8.
76. Garvey LH. Practical aspects of perioperative anaphylaxis. Trends Anaesth Crit Care. 2013;3:320-6.
77. Opstrup MS, Mosbech H, Garvey LH. Allergic sensitization to ethyelene oxide in patients with suspected allergic reactions during surgery and anesthesia. J Investig Allergol Clin Immunol. 2010;20(3):69-70.
78. Garvey LH. Old, new and hidden causes of perioperative hypersensitivity. Curr Pharm Des. 2016;22(45):6814-24.
79. Bache S, Petersen JT, Garvey LH. Anaphylaxis to ethylene oxide - a rare and overlooked phenomenon? Acta Anaesthesiol Scand. 2011;55:1279-82.
80. Listyo A, Hofmaeier KS, Bandschapp O, Erb T, Hasler CC, Bircher AJ. Severe anaphylactic shock due to ethylene oxide in a patient with myelomeningocele: successful exposure prevention and pretreatment with omalizumab. Anesth Analg Case Rep. 2014;2:3-6.
81. Hamad A, Iweala OI, Henderson C, Madan S, Stouffer III GA, Commins SP, et al. Recurrent anaphylaxis during cardiac catheterization. J Allergy Clin Immunol Pract. 2018;6(6):2148-50.
82. Sokol WN. Nine episodes of anaphylaxis following cystoscopy caused by Cidex OPA (Ortho phthaladehyde) high level desinfectatnt in 4 patients after ciystoscopy. J Allergy Clin Immunol. 2004;114:392-7.
83. Atiych K, Chitkara A, Achlatis S, Branski RC, Amin MR. Allergic reaction to orthophtalaldehyde following flexible laryngoscope. Laryngoscope. 2015;125:2349-52.
84. Larrauri BJ, Torre MG, Malbran E, Juri MC, Fernández-Romero DS, Málbran A. Anafilaxias y reaccciones alérgicas durante cirurgías y procedimientos médicos. Medicina (Buenos Aires). 2017;77:382-7.
85. Cooper DE, White AA, Werkema AN, Auge BK. Anaphylaxis following cystoscopy with equipment sterilized with Cidex OPA (orthophthalaldehyde): a review of two cases. J Endourol. 2008;22:2181-4.
86. Laxenaire MC, Mertes PM, Goupe d'Etudes des Réactions Anaphylacoïdes Peranesthésiques. Anaphylaxis during anaesthesia. Results of two-year survey in France. Br J Anaesth. 2001;87:549-58.
87. Laxenaire MC, Charpentier C, Feldman L. Anaphylactoid reactions to clloid plasma substitutes: incidence, risk factors, mechanisms. A French multicenter prospective study. Ann Fr Anesth Reanim. 1994;13:301-10.
88. Agarwal NS, Spalding C, Nassef M. Life threating intraoperative anaphylaxis to gelatin in Floseal during pediatric spinal surgery. J Allergy Clin Immunol Pract. 2015;3:110-1.
89. Shah G, Scadding G, Nguyen-Lu N, Wigmore T, Chenzbraun A, Wechalekar K, et al. Perio-perative cardiac arrest with ST elevation secondary to gelofusin anaphylaxis-Kounis syndrome in the anaesthetic room. Int J Cardiol. 2013;164:e22-6.
90. Spencer HT, Hsu JT, McDonald DR, Karlin LL. Intraoperative anaphylaxis to gelatina in topical hemostatic agentes during anterior spinal fusion: a case report. Spine J. 2012;12:e1-6
91. Uyttebroeck A, Sabato V, Bridts CH, De Clerck LS, Ebo DG. Anaphylaxis to sccinylated gelatin in a patient with a meat allergy: galactose-alfa(1,3)-galactose (alfa-gal) as antigenic determinant. J Clin Anesth. 2014;26:574-6.
92. Wilson JM, Platts-Mills TAE. Meat Allergy and allergens. Mol Immunol. 2018;100:107-12.
93. Tacquard C, Boudjedir K, Carlier M, Muller JY, Gornis P, Mertes PM. Hypersensitivity transfusion reactions due to IgA deficiency are rare according to French hemovigilance date. J Allergy Clin Immunol. 2017;140:884-5.
94. Squire JE. Risks of transfusion. South Med J. 2011;104:762-9.
95. Tinegate H, Birchall J, Gray A, Haggas R, Massey E, Norfolk D, et al. Guideline on the investigation and management of acute transfusion reaction. Prepared by the BCSH Blood Transfusion Task Force. Br J Haematol. 2012;159(2):143-53.
96. Dewachter P, Mouton-Faivre C, Laroche D, Clément O. Allergie immediate aux produits de contraste iodés et prevention des reactions. Rev Med Interne. 2009;30:872-81.
97. Dewachter P, Mouton-Faivre C, Castells M, Hepner DL. Anesthesia in the patient with multiple drug allergies: are all allergies the same? Curr Opin Anesthesiol. 2011;24:320-5.
98. Kuhen A, Hilger C, Lehners-Weber C, Codreanu-Morel F, Morisset M, Metz-Favre C, et al. Identification of enolases and aldolases as important fish allergens in cod, salmon and tuna: component resolved diagnosis using paravalbumin and the new allergens. Clin Exp Allergy. 2013;43:811-22. 99. Lopata AL, O'Hehir RE, Leherer SB. Shellfish allergy. Clin Exp Allergy. 2010;40:850-8.
100. Ruethers T, Taki AC, Johnston EB, Nugraha R, Le TTK, Kalic T, et al. Seafood allergy: a comprehensive review of fish and sellfish allergy. Mol Immunol. 2018;100:28-57.
101. Huang SW. Seafood and Iodine: An Analysis of a Medical Myth. Allergy Asthma Proc. 2005;26(6):468-9.
102. Beaty AD, Lieberman PL, Slavin RG. Seafood allergy and radiocontrast media: are physicians propagating a myth? J Med. 2008;121(2):158.e1-4.
103. Schrijvers R, Breynaert C, Ahmedali Y, Bourrain JL, Demoly P, Chiriac AM. Skin testing for suspected iodinated contrast media hypersensitivity. J Allergy Immunol Pract. 2018;6:1246-54.
104. Torres MJ, Gomez F, Doña I, Rosado A, Mayorga C, Garcia I, et al. Diagnostic evaluation of patients with nonimmediate cutaneous hypersensitivity to iodinated contrast media. Allergy. 2012;67:929-35.
105. Dewachter P, Laroche D, Mouton-Faivre C, Boloch-Morot E, Cercueil JP, Metget L, et al. Immediate reactions following iodinated contrast media injection: a study of 38 cases. Eur J Radiol. 2011;77:495-501.
106. Sánchez-Borges M, Aberer W, Brockow K, Celik GE, Cernadas J Greenberger PA, et al. Controversies in drug allergy: radiographic contrast media. J Allergy Clin Pract. 2019;7:60-4.
107. Bartlett MJ, Bynevelt M. Acute contrast reaction management by radiologists: a local audit. Australas Radiol. 2003;47:363-7.
108. Rosado Ingelmo A, Doña Diaz I, Cabãnas Moreno R, Moya Quesada MC, Garcia-Avilés C, García Nuñes I, et al. Clinical practice guidelines for diagnosis and management of hypersensitivity reactions to contrast media. J Investig Allergol Clin Immunol. 2016;26(3):144-55.
109. Li A, Wong CS, Wong MK, Lee CM, Au Yeung MC. Acute adverse reactions to magnetic contrast media-gadolinium chelates. Br J Radiol. 2006;79:386-71.
110. Schiavino D, Murzilli F, Del Ninno M, Buonomo A, Roncallo C, Pollastrini E, et al. Demonstration of an IgE-mediated immunological pathogenesis of a severe adverse reaction to gadopentato dimeglumine. J Investig Allergol Clin Immunol. 2003;13:140-2.
111. Mertes PM, Malinovsky JM, Mouton-Faivre, Bonnet-Boyer MC, Benhaijoub A, Lavaud F, et al. Anaphylaxis to dyes during the perioperative period: reports of 14 clinical cases. J Allergy Clin Immunol. 2008;122:348-52.
112. Ishiyama T, Kotoda M, Asano N, Ikimoto K, Mitisui K, Sato H. Blue dye on peripheral and cerebral oxyhemoglobin saturations. Anaesthesia. 2015;70:429-33.
113. Batti MACSB, Mendes A, Pinheiro JT, Frode TS. Reação alérgica ao azul patente. Rev Bras Anest. 2004;54:180.
114. Xu K, Tzankowa V, Li C, Sharma S. Intravenous fluorescein angiograhy- associated adverse reactions. Can J Ophtalmol. 2016;51(5):321-5.
115. Lee T, Sanderson D, Doyle P, Buchsbaum G. Anaphylactic Shock After Intravenous Fluorescein Administration for Intraoperative Cystoscopy. Obstet Gynecol. 2018;131(4):727-9.
116. Levy JH, Adkinson NF. Anaphylaxis during cardiac surgery: implications for clinicians. Anesth Analg. 2008:106:392-403.
117. Dietrich W, Ebell A, Busley R, Boulesteix AL. Aprotinin and anaphylaxis: analysis of 12.403 exposures to aprotinin in cardiac surgery. Ann Thorac Surg. 2007;84:1144-50.
118. Nybo M, Madsen JS. Serious anaphylactica reactions due to protamine sulfate: a systematic literature review. Basic Clin Pharmacol Toxicol. 2008;103:192-6.
119. Greenberger PA, Patterson R, Tobin MC, Liotta JL, Roberts M. Lack of cross-reactivity between IgE to salmon and protamine sulfate. Am J Med Sci. 1989;298:104-8.
120. Levy JH, Scwieger IM, Zaidan JR, Faraj BA, Weintraub WS. Evaluation of patients at risk for protamine reactions. J Thorac Cardiovasc Surg. 1989;98:200-4.
121. Valchanov K, Falter F, George S, Burt C, Roscoe A, Ng C, et al. Three cases of anaphylaxis to protamine: management of anticoagulation reversal. J Cardiothorac Vasc Anesth. 2019;33(2):482-6.
122. Levy JH, Bartz RR. Protamine, is something fishy abaout it? The spectre of anaphylaxis continus. J Cardiothorac Vasc Anesth. 2019;33:487-8.
123. Marinho S, Kemp H, Cook TM, Farmer L, Farooque S, Lucas DN, et al. Cross-sectional study of perioperative drug and allergen exposure in UK practice in 2016: the 6th National Audit Project (NAP6) Allergen Survey. Br J Anaesth. 2018;121(1):146-58.
124. Chiem J, Ivanova I, Parker A, Krengel W 3rd, Jimenez N. Anaphylactic reaction to tranexamic acid in an adolescent undergoing posterior spinal fusion. Paediatr Anaesth. 2017;27(7):774-5.
125. Li PH, Trigg C, Rutkowski R, Rutkowski K. Anaphylaxis to tranexamic acid - a rare reaction to a common drug. J Allergy Clin Immunol Pract. 2017;5(3):839-41.
126. Lee HK, Choi EJ, Lee PB, Nahm FS. Anaphylactic shock caused by the epidurally-administered hyaluronidase. Korean J Pain. 2011;24:221-5.
127. Raichura ND, Alam MS, Jaichandran VV, Mistry S, Mukherjee B. Hyaluronidade allergy mimicking orbital cellulitis. Orbit. 2018;37(2):149-53.
128. Alcubierre R, Sanchez-Dalmau BF, Mousavi K. Compressive optic neuropathy secondary toa n allergic reaction to hyaluronidase. Arch Soc Esp Oftalmol. 2019 Sep;94(9):441-4.
129. Halliday L, Sia PI, Durkin S, Selva D. Atypical case of hyaluronidase allergy with orbital compartment syndrome and visual loss. Clin Exp Ophtalmology. 2018;46(5):563-4.
130. Tan P, Malhotra R. Hyaluronic acid fillers and hyaluronidase use in regional eye blocks. Anaesthesia. 2016;71:988-9.
131. Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols: a review. Clin Exp Allergy. 2016;46:907-22.
132. Cerdá VJ, Pacheco RR, Witek JD, de la Calle FMM, Fernández MLS. Immediate hypersensitivity to polyethylene glycols in unrelated products: when standardization in the nomenclature of the components of drugs, cosmetics and food become necessary. Allergy Asthma Clin Immunol. 2019;15:9.
133. Farber MK, Angelo TE, Castells M, Tsen LC. Anesthetic management of patient with an allergy to propylene glycol and parabens. Anesth Analgesia. 2010;110(3):839-42.
134. Witschi L, Reist L, Stammschulte T, Erlenwein J, Becke K, Stamer U. Perioperative Anwendung von Metamizol und anderen Nichtopioidanalgetika bei KindernPerioperative use of metamizole and other nonopioid analgesics in children. Anaesthesist. 2019;68(3):152-60.
135. Varalda DB, Motta AA. Adverse reactions to nonsteroidal antiinflammatory. Rev Bras Alerg e Imunopatol. 2009;32:27-34.
136. Torres MJ, Barrionuevo E, Kowalski M, Blanca M. Hypersensitivity Reactions to Nonsteroidal Anti-Inflammatory Drugs. Immunol Allergy Clin North Am. 2014;34(3):507-24.
137. Doña I, Blanca-López N, Cornejo-García JA, Torres MJ, Laguna JJ, Fernández J, et al. Characteristics of subjects experiencing hypersensitivity to non-steroidal anti-inflammatory drugs: Patterns of response. Clin Exp Allergy. 2011;41(1):86-95.
138. Wöhrl S. NSAID hypersensitivity - recommendations for diagnostic work up and patient management. Allergo J Int. 2018;27(4):114-21.
139. Aun MV, Blanca M, Garro LS, Ribeiro MR, Kalil J, Motta AA, et al. Nonsteroidal anti-inflammatory drugs are major causes of drug-induced anaphylaxis. J Allergy Clin Immunol Pract. 2014;2(4):414-20.
140. Ensina LF, Bastos PGA, de Lacerda AE, de Araujo CA, Camelo- Nunes I, Solé D. Comments on Balp et al. Pediatr Allergy Immunol. 2018;29(6):669-70.
141. Lobera TI, Audicana MT, Pozo MD, Blasco A, Fernández E, Cañada P, et al. Study of hypersensitivity reactions and anaphylaxis during anesthesia in Spain.J Investig Allergol Clin Immunol. 2008;18(5):350-6.
142. Trautmann A, Seidl C, Stoevesandt J, Seitz CS. General anaesthesia-induced anaphylaxis: Impact of allergy testing on subsequent anaesthesia. Clin Exp Allergy. 2016;46(1):125-32.
143. Kemp HI, Cook TM, Thomas M, Harper NJN. UK anaesthetists' perspectives and experiences of severe perioperative anaphylaxis: NAP6 baseline survey. Br J Anaesth. 2017;119(1):132-9.
144. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project (NAP6). Br J Anaesth. 2018;121(1):159-71.
145. Mertes PM, Laxenaire MC. Anaphylactic and anaphylactoid reactions occurring during anaesthesia in France seventh epidemiologic survey. Ann Fr Anesth Reanim. 2004;23:1133-43.
146. Fieler M, Eich C, Becke K, Badelt G, Leimkühler K, Messroghli L, et al. Metamizole for postoperative pain therapy in 1177 children: a prospective, multicentre, observational, post authorisation safety study. Eur J Anaesthesiol. 2015;32:839-43.
147. De Leeuw TG, Dirckx M, Gonzalez C, Andel A, Scoones GP, Huygen FJPM, et al. The use of dipyrone (metamizol) as an analgesic in children: What is the evidence? A review. Paediatr Anaesth. 2017;27(12):1193-201.
148. Kidon M, Blanca-Lopez N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ENDA position paper: diagnosis and management of hypersensitivity reactions to non-steroidal antiinflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018;29(5):469-80.
149. Ansari F, Erntell M, Goossens H, Davey P. The European Surveillance of Antimicrobial Consumption (ESAC) Point‐Prevalence Survey of Antibacterial Use in 20 European Hospitals in 2006. Clin Infect Dis. 2009;49(10):1496-504.
150. Robert J, Péan Y, Varon E, Bru JP, Bedos JP, Bertrand X, et al. Point prevalence survey of antibiotic use in French hospitals in 2009. J Antimicrob Chemother. 2012;67(4):1020-6.
151. Garvey LH, Hunter JM. Changing culprits in perioperative anaphylaxis. Br J Anaesth. 2018;121(1):114-7.
152. Harper NJN, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery and life-threatening allergic reactions: from the Report and findings of the 6th National Audit Project, Royal College of Anaesthetists. Br J Anaesth. 2018 Jul;121(1):159-71.
153. Trubiano JA, Stone CA, Grayson ML, Urbancic K, Slavin MA, Thursky KA, et al. The 3 Cs of Antibiotic Allergy - Classification, Cross-Reactivity, and Collaboration. J Allergy Clin Immunol Pract. 2017;5(6):1532-42.
154. Romano A, Warrington R. Antibiotic Allergy. Immunol Allergy Clin North Am. 2014;34(3):489-506.
155. Gonzalez-Estrada A, Pien LC, Zell K, Wang XF, Lang DM. Antibiotics are an important identifiable cause of perioperative anaphylaxis in the United States. J Allergy Clin Immunol Pract. 2015;3(1):101-105.e1.
156. Kuhlen JL, Camargo CA, Balekian DS, Blumenthal KG, Guyer A, Morris T, et al. Antibiotics Are the Most Commonly Identified Cause of Perioperative Hypersensitivity Reactions. J Allergy Clin Immunol Pract. 2016;4(4):697-704.
157. Savic LC, Garcez T, Hopkins PM, Harper NJN, Savic S. Teicoplanin allergy - An emerging problem in the anaesthetic allergy clinic. Br J Anaesth. 2015;115(4):595-600.
158. Penicillin Allergy in Antibiotic Resistance Workgroup. Penicillin allergy testing should be performed routinely in patients with self-reported penicillin allergy. J Allergy Clin Immunol Pract. 2017;5(2):333-4.
159. Lucas M, Arnold A, Sommerfield A, Trevenen M, Braconnier L, Schilling A, et al. Antibiotic allergy labels in children are associated with adverse clinical outcomes. J Allergy Clin Immunol Pract. 2019;7(3):975-82.
160. Macy E, Contreras R. Healthcare utilization and serious infection prevalence associated with penicillin "allergy" in hospitalized patients: a cohort study. J Allergy Clin Immunol. 2014;133:790-6.
161. Vorobeichik L, Weber EA, Tarshis J. Misconceptions surroundingpenicillin allergy: implications for Anesthesiologists. Anest Analg. 2018;127:642-9.
162. Har D, Solensky R. Penicillin and beta‐lactam hypersensitivity. Immunol Allergy Clin North Am. 2017;37(4):643-66.
163. Savic LC, Khan DA, Kopac P, Clarke RC, Cooke PJ, Dewachter P, et al. Management of a surgical patient with a label of penicillin allergy: narrative review and consensus recommendations. Br J Anaesth. 2019;123(1):e82-e94.
164. Moussa Y, Shuster J, Matte G, Sullivan A, Goldstein RH, Cunningham D, et al. De-labeling of β-lactam allergy reduces intraoperative time and optimizes choice in antibiotic prophylaxis. Surgery. 2018 May 8. pii: S0039-6060(18)30127-2.
165. Nel L, Eren E. Peri-operative anaphylaxis. Br J Pharmacol. 2011;71(5):647-58.
166. Vitte J, Amadei L, Gouitaa M, Mezouar S, Zieleskiewicz L, Albanese J, et al. Paired acute‐baseline serum tryptase levels in perioperative anaphylaxis: an observational study. Allergy. 2019;74:1157-65.
167. Baretto RL, Beck, S, Heslegrave J, Melchior C, Mohamed O, Ekbote A, et al. Validation of international consensus equation for acute serum total tryptase in mast cell activation: a perioperative perspective. Allergy. 2017;72:2031-4.
168. Laroche D, Gomis P, Gallimidi E, Malinowsky JM, Mertes PM. Diagnostic value of histamine and tryptase concentrations in severe anaphylaxis with shock or cardiac arrest during anesthesia. Anesthesiology. 2014;121:272-9.
169. Ewan PW, Dugué P, Mirakian R, Dixon TA, Harper JN, Nasser SM. BSACI guidelines for thr investigation of suspected anaphylaxis during general anesthesia. Clin Exp Allergy. 2010;40:15-31.
170. Uyttebroek AP, Decuyper II, Bridts CH, Romano A, Hagendorens MM, Ebo DG, et al. Cefazolin Hypersensitivity: Toward Optimized Diagnosis. J Allergy Clin Immunol Pract. 2016;4(6):1232-6.
171. Opstrup MS, Poulsen LK, Malling HJ, Jensen BM, Garvey LH. Dynamics of specific IgE in chlorhexidine allergic patients with and without accidental re‐exposure. Clin Exp Allergy. 2016;46:1090-8.
172. Soetens F, Rose M, Fisher M. Timing of skin testing after a suspected anaphylactic reaction during anaesthesia. Acta Anaesthesiol Scand. 2012;56:1042-6.
173. Mayorga C, Ebo DG, Lang DM, Pichler WJ, Sabato V, Park MA, et al. Controversies in drug allergy: In vitro testing. J Allergy Clin Immunol. 2019;143(1):56-65.
174. Decuyper II, Mangodt EA, Van Gasse AL, Claesen K, Uyttebroek A, Faber M, et al. In vitro Diagnosis of Immediate Drug Hypersensitivity Anno 2017: Potentials and Limitations. Drugs R D. 2017;17(2):265-78.
175. Takazawa T, Sabato V, Ebo DG. In vitro diagnostic tests for perioperative hypersensitivity, a narrative review: potential, limitations, and perspectives. Br J Anaesth. 2019;123(1):e117-e125.
176. Ebo DG, Faber M, Elst J, Van Gasse AL, Bridts CH, Mertens C, et al. In vitro diagnosis of immediate drug hypersensitivity during anesthesia: a review of the literature. J Allergy Clin Immunol Pract. 2018;6(4):1176-84.
177. Aun MV, Malaman MF, Felix MMR, Menezes UP, Queiroz GRS, Rodrigues AT, et al. Testes in vivo nas reações de hipersensibilidade a medicamentos - Parte I: testes cutâneos. Arq Asma Alerg Imunol. 2018;2(4):390-8.
178. Aun MV, Malaman MF, Felix MMR, Menezes UP, Queiroz GRS, Rodrigues AT, et al. Testes in vivo nas reações de hipersensibilidade a medicamentos - Parte II: testes de provocação. Arq Asma Alerg Imunol. 2019;3(1):7-12.
179. Sá AB, Garro LS, Fernandes FR, Rizzo MCV, Sandrin LNA, Ensina LF, et al. Recomendações para o diagnóstico de alergia ao látex. Rev Bras Alerg Imunopatol. 2012;35(5):183-9.
180. Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs - an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013;68(6):702-12.
181. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy. 2003;58:854-63.
182. Kroigaard M, Garvey LH, Menné T, Husum B. Allergic reactions in anaesthesia: are suspected causes confirmed on subsequent testing? Br J Anaesth. 2005;95(4):486-71.
183. Aun MV, Kalil J, Giavina-Bianchi P. Drug-induced anaphylaxis. Immunol Allergy Clin N Am. 2017;37:629-41.
184. Garvey LH, Ebo DG, Krøigaard M, Savic S, Clarke R, Cooke P, et al. The use of drug provocation testing in the investigation of suspected immediate perioperative allergic reactions: current status. Br J Anaesth. 2019;123(1):e126-e134.
185. Melchiors BLB, Kroigaard M, Garvey LH. Intravenous provocation with Neuromuscular Blocking Agents in the investigation of perioperative anaphylaxis - preliminary findings from the Danish Anaesthesia Allergy Centre (DAAC). Eur J Anaesthesiol. 2018;35:(suppl 56):318.
186. van Cuilenborg VR, Hermanides J, Bos EME, Hollmann MW, Kooij FO, Terreehorst I. Awake intravenous provocation with small doses of neuromuscular blocking agent in patients with suspected allergy: experiences from the Dutch Perioperative Allergy Centre. Br J Anaesth. 2019;123(1):e153-e155.
187. Laxenaire MC. Management of the allergic patient. Ann Fr Anesth Reanim. 2002;21(6):93-6.
188. Fischer MM, Doig GS. Prevention of anaphylactic reactions to anesthetic drugs. Drug Saf. 2004;27(6):393-410.
189. Simmons FER, Ebisawa M, Sanchez-Borges M, Thong BY, Worm M, Tanno LK, et al. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allergy Org J. 2015;8(1):32.
190. Guyer AC, Saff RR, Conroy M, Blumenthal KG, Camargo CA, Long AA, et al. Comprehensive Allergy Evaluation Is Useful in the Subsequent Care of Patients with Drug Hypersensitivity Reactions During Anesthesia. J Allergy Clin Immunol Pract. 2015;3:94-100.
191. Miller J, Clough SB, Pollard RC, Misbah SA. Outcome of repeat anaesthesia after investigation for perioperative anaphylaxis. Br J Anaesth. 2018;120(6):1195-201.
192. Miller J, Misbah SA. Mast Cells, Mastocytosis, and Related Disorders. N Engl J Med. 2015;373(19):1884.
193. Szema A, Paz G, Merriam L, Stellaccio F, Jen J. Modern preoperative and intraoperative management of hereditary angioedema. Allergy Asthma Proc. 2009;30:338-42.
194. Levy J, Freiberger D, Roback J. Hereditary angioedema: current and emerging treatment options. Anesth Analg. 2010;110:127-80.
195. Aygoren-Pursun E, Martinez-Saguer I, Kreuz W, Klingebiel T, Schwabe D. Risk of angioedema following invasive or surgical procedures in HAE type I and II - the natural history. Allergy. 2013;68:1034-9.
196. Cicardi M, Bork K, Caballero T, Craig T, Li HH, Longhurst H, et al. Evidence-based recommendations for the therapeutic management of angioedema owing to hereditary C1 inhibitor deficiency: consensus report of an International Working Group. Allergy. 2012;67:147-57.
197. Farkas H, Zotter Z, Csuka D, Szabo E, Nebenfuhrer Z, Temesszentandrasi G, et al. Short-term prophylaxis in hereditary angioedema due to deficiency of the C1-inhibitor - a long-term survey. Allergy. 2012;67:1586-93.
198. Galan HL, Reedy MB, Starr J, Knight AB. Fresh frozen plasma prophylaxis for hereditary angioedema during pregnancy. A case report. J Reprod Med. 1996;41:541-4.
199. Birjmohun RS, Kees Hovingh G, Stroes ESG, Hofstra JJ, Dallinga- Thie GM, Meijers JCM, et al. Effects of short-term and long-term danazol treatment on lipoproteins, coagulation, and progression of atherosclerosis: two clinical trials in healthy volunteers and patients with hereditary angioedema. Clin Ther. 2008;30(12):2314-23.
200. Bouillet L, Ponard D, Drouet C, Dumestre C, Pernollet M, Bonerandi JJ, et al. Acquired angioneurotic edema. Clinical and biological characteristics in 9 patients. Presse Med. 2000;29:640-4.
201. Cicardi M, Zingale LC, Pappalardo E, Folcioni A, Agostoni A. Autoantobodies and lymphoproliferative diseases in acquired C1- inhibitor deficiencies. Medicine (Baltimore). 2003;82(4):274-81.
202. Giavina-Bianchi P, Arruda LK, Aun MV, Campos RA, Chong- Neto HJ, Constantino-Silca R, et al. Diretrizes brasileiras para o diagnóstico e tratamento do angioedema hereditário - 2017. Arq Asma Alerg Imunol. 2017;1(1):23-48.
203. Valent P, Horny HP, Escribano L, Longley BJ, Li CY, Schwartz LB, et al. Diagnostic criteria and classification of mastocytosis: a consensus proposal. Leuk Res. 2001;25(7):603-25.
204. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study on history, clinical features and risk factors in 120 patients. Allergy. 2008;63:226-32.
205. Bonadonna P, Pagani M, Aberer W, Bilò MB, Brockow K, Oude Elberink H, et al. Drug hypersensitivity in clonal mast cell disorders: ENDA/EAACI position paper. Allergy. 2015;70(7):755-63.
206. Ahmad N, Evans P, Lloyd-Thomas AR. Anesthesia in children with mastocytosis - a case based review. Pediatr Anesth. 2009;19:97-107.
207. Dewachter P, Castells MC, Hepner DL, Mouton-Faivre C. Perioperative management of patients with mastocytosis. Anesthesiology. 2014;120(3):753-9.
208. Escribano L, de Gonzalez Olano D, de La Hoz Caballer B, Esteban Lopez I, Sanchez Fernandez I. Mastocitosis: guıas para su diagnostico y tratamiento In: Pelaez Hernandez A, Davila- Gonzalez IJ, eds. Tratado de Alergologia. 1ª ed. Madrid: Ergon; 2007. p. 1241-62.
209. Hermans MAW, Arends NJT, Gerth van Wijk R, van Hagen PM, Kluin-Nelemans HC, Oude Elberink HNG, et al. Management around invasive procedures in mastocytosis: An update. Ann Allergy Asthma Immunol. 2017 Oct;119(4):304-9.
210. Ciach K, Niedoszytko M, Abacjew-Chmylko A, Pabin I, Adamski P, Leszczynska K, et al. Pregnancy and Delivery in Patients with Mastocytosis Treated at the Polish Center of the European Competence Network on Mastocytosis (ECNM). PLoS One. 2016;11(1):e0146924.
211. Carter MC, Uzzaman A, Scott LM, Metcalfe DD, Quezado Z. Pediatric mastocytosis: routine anesthetic management for a complex disease. Anesth Analg. 2008;107(2):422-7.
212. Sandler SG, Eder AF, Goldman M, Winters JL. The entity of immunoglobulin A-related anaphylactic transfusion reactions is not evidence based. Transfusion. 2015;55:199-204.