Número Atual: Janeiro-Março 2020 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Efeitos adversos do uso de ciclosporina em pacientes com dermatite atópica grave
Adverse effects of using cyclosporine in patients with severe atopic dermatitis
Giovanna Lucy Cortez Aliaga1,2; Claudia Leiko Yonekura Anagusko1,2; Laís Souza Gomes1,2; Larissa de Queiroz Mamede1,2; Priscila Moraes1,2; Patrícia Salles Cunha1,2; Fábio Morato Castro1,2; Ariana Campos Yang1,2,3
1. Serviço de Imunologia Clínica e Alergia do Hospital das Clínicas de São Paulo - HC-FMUSP - São Paulo, SP, Brasil
2. Disciplina de Imunologia Clínica e Alergia da Faculdade de Medicina da Universidade de São Paulo - FMUSP - São Paulo, SP, Brasil
3. Disciplina de Imunologia e Alergia da FCM/UNICAMP - Campinas, SP, Brasil
Endereço para correspondência:
Ariana Yang
arianacy@gmail.com
Submetido em: 10/02/2020
Aceito em: 25/02/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
INTRODUÇÃO: A dermatite atópica (DA) é uma doença inflamatória da pele, multifatorial, crônica e recorrente, caracterizada por lesões eczematosas e prurido intenso. Nos casos graves refratários aos tratamentos tópicos, tem se utilizado imunossupressão sistêmica para o controle da doença, sendo a ciclosporina considerada por muitos como terapia de escolha. Este estudo visa avaliar a incidência e gravidade dos eventos adversos relacionados ao uso de ciclosporina em pacientes com DA grave.
MÉTODOS: Estudo retrospectivo observacional com análise de prontuários de pacientes com dermatite atópica grave em uso de ciclosporina atendidos em hospital terciário no período de 3 anos.
RESULTADOS: Avaliados 80 pacientes com dermatite atópica grave usando ciclosporina, com média de idade de 25,5 anos e 41 do sexo feminino (51,3%). Foram relatados eventos adversos em 25 pacientes. O tempo médio de uso de ciclosporina no grupo com eventos adversos foi de 29,3 meses. Os eventos de maior gravidade foram alteração da função renal e hipertensão, sendo mais observados nos casos de doença mais refratária, quando o uso de ciclosporina foi muito prolongado, superior a 60 meses. As reações evidenciadas foram: hipertensão arterial 40%, alteração renal 20%, náuseas/vômitos 16%, cefaleia 12%, herpes de repetição 12% e outros 4%. Os eventos adversos normalizaram após suspensão da ciclosporina.
CONCLUSÃO: Pacientes com dermatite atópica grave que usaram ciclosporina por tempo prolongado tiveram maior frequência de eventos adversos potencialmente graves. Todos os efeitos adversos normalizaram após a suspensão de medicação.
Descritores: Dermatite atópica grave, ciclosporina, eventos adversos.
INTRODUÇÃO
A dermatite atópica (DA) é uma doença inflamatória da pele de etiologia multifatorial, caracterizada por lesões eczematosas e prurido intenso, de caráter crônico e recorrente; muito comum em crianças, com início na primeira infância em 85% dos pacientes, e podendo persistir até a fase adulta1,2. Assim como outras doenças atópicas, a prevalência da DA aumentou nas últimas três décadas, com uma distribuição predominante em lactentes3,4.
A fisiopatologia da DA é multifatorial, envolvendo uma conjunção de fatores genéticos, desregulação imune, disfunção da barreira cutânea, desencadeantes ambientais e disbiose5.
Um dos aspectos importantes na patogênese da DA é a disfunção da barreira cutânea; levando à redução de ceramidas, ácidos graxos de cadeia longa, filagrinas e lipídeos intracelulares da camada córnea, que facilitam a perda transepitelial de água e penetração de alérgenos e irritantes. Na fase aguda, a resposta imunológica é predominantemente Th2 e Th22 com síntese de IL-4, IL-5, IL-13, IL-31 (importante mediador de prurido) e IL-16 que, entre outras ações, recrutam eosinófilos e estimulam linfócitos B e produção de imunoglobulina E (IgE). Na fase crônica, a resposta é desviada para linfócitos Th1 e Th17, que promovem infiltração de macrófagos e, consequentemente, sequelas na pele6,7.
A principal alteração genética associada com a disfunção da barreira cutânea consiste nas mutações com perda de função no gene da filagrina, que afetam de 20 a 50% dos pacientes com DA, resultando em risco maior para desenvolver DA, e com maior gravidade8. A própria inflamação também contribui para disfunção de barreira, uma vez que diversos componentes são regulados por citocinas do perfil Th2.
Alguns dos fatores ambientais e/ou exacerbantes que podem contribuir para a DA são: exposições maternas durante a gestação, irritantes em contato com a pele, clima, poluentes, fumaça de tabaco, "água dura" e alimentação9,10.
A base do tratamento da DA consiste na restauração da barreira cutânea, terapia anti-inflamatória, controle do prurido e controle de fatores desencadeantes. A terapia anti-inflamatória tópica pode ser indicada das formas leves a graves, já a terapia antiinflamatória sistêmica é indicada em casos graves e refratários. O tratamento sistêmico convencional (como ciclosporina, azatioprina, micofenolato de mofetil, metotrexato) visa a supressão de células T, porém afeta outros tipos celulares e favorece o aparecimento de diversos efeitos adversos que podem limitar seu uso11,12. Atualmente, os novos tratamentos visam atuar em um alvo específico, como o anti-IL4 (dupilumab), porém o acesso para a maioria dos pacientes possui alguns obstáculos.
Dos tratamentos sistêmicos convencionais, a ciclosporina é considerada de primeira linha para formas refratárias à terapia tópica, e a única com essa indicação em bula aprovada no Brasil13. A ciclosporina é um potente imunossupressor que age primariamente nas células T inibindo a calcineurina e a transdução do sinal mediada pela ativação do receptor das células T, sendo considerada por muitos como terapia de escolha nos casos de dermatite atópica grave7,14. Uma metanálise com 15 estudos demonstrou eficácia da ciclosporina em 55% após 6 a 8 semanas de tratamento. Houve melhora na área de superfície corporal afetada pela DA, eritema, sono e redução de uso de glicocorticoide15. Quanto ao perfil de segurança, os principais efeitos adversos que levam à descontinuação do tratamento são: alteração de função renal, hipertensão arterial, sintomas neurológicos, fadiga e sintomas gastrointestinais16. Dessa forma, é necessário monitoramento clínico e laboratorial, especialmente da função renal e de pressão arterial durante o acompanhamento dos pacientes em uso desta droga.
Este estudo tem como objetivo avaliar quais efeitos adversos relacionados ao uso da ciclosporina e a sua frequência em pacientes brasileiros com dermatite atópica grave acompanhados em um centro terciário. Além disso, este estudo visa avaliar o perfil de pacientes com maior risco de desenvolver efeitos adversos, como por exemplo, idade e tempo de uso.
MÉTODOS
Realizado um estudo retrospectivo observacional com análise de prontuários de pacientes com DA grave, em uso de ciclosporina, atendidos no Hospital de Clínicas de São Paulo (hospital terciário) no período de 3 anos. Coletados dados demográficos, tempo de uso de ciclosporina e eventos adversos. Todos os pacientes fizeram controle pressórico semanal e exames laboratoriais periódicos. A dose de ciclosporina usada em todos os pacientes foi de 3-5 mg/kg/dia.
RESULTADOS
Foram avaliados 80 pacientes com DA usando ciclosporina, com uma média de idade de 25,5 anos, sendo 41 do sexo feminino.
Foram relatados eventos adversos em 31,2% dos pacientes (n = 25), sendo que estes pacientes tiveram uma média de idade maior (de 31 anos), comparado aos pacientes que não tiveram reação adversa (média de idade de 23 anos). Dos pacientes que apresentaram eventos adversos, segundo a faixa etária, 5 pacientes (20%) eram menores de 20 anos; 19 pacientes (76%) tinham entre 21-60 anos; e 1 caso (4%) tinha acima de 60 anos (Figura 1).
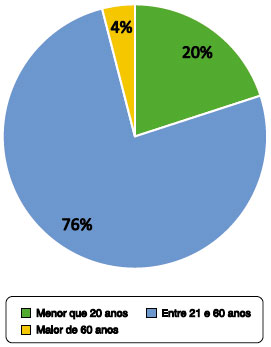
Figura 1 Proporção de pacientes com reações adversas de acordo com faixa etária, n = 25
As reações adversas observadas neste estudo foram: hipertensão arterial 40% (10), alteração renal 20% (5), náuseas/vômitos 16% (4), cefaleia 12% (3), herpes de repetição 12% (3), e outros 4% (1) (Figura 2).
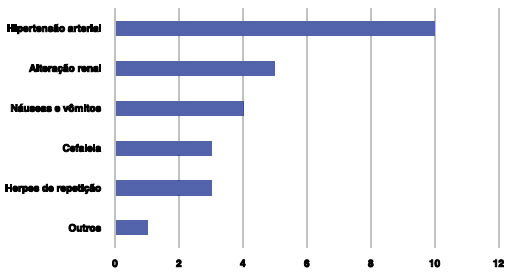
Figura 2 Frequência de reações adversas ao uso de ciclosporina, n = 25
O tempo médio de uso de ciclosporina no grupo com eventos adversos foi de 29,3 meses. Destes, 6 pacientes (24%) fizeram uso de ciclosporina por até 12 meses, com média de 8 meses; porém 76% dos pacientes com eventos adversos (n = 19) usaram por mais de 1 ano, com média de 36 meses.
Os eventos de maior gravidade (redução da função renal e hipertensão arterial) foram mais observados nos casos de doença mais refratária, quando o uso da ciclosporina foi muito prolongado, superior a 60 meses. Os eventos adversos normalizaram após suspensão da ciclosporina.
CONCLUSÃO E DISCUSÃO
A escolha do tratamento na DA deve ser individualizada de acordo com o fenótipo, gravidade, idade e comorbidades do paciente e perfil de eficácia, segurança e custo do tratamento. A ciclosporina é um dos tratamentos de primeira linha para DA grave e tem se mostrado eficaz, porém apresenta efeitos adversos que devem ser monitorizados11.
Neste estudo, observou-se que a hipertensão arterial e alteração da função renal foram os efeitos adversos mais significativos, assim como na literatura12,16, o que reforça a importância de se manter o monitoramento clínico e laboratorial. Um aspecto interessante é que após a suspensão da ciclosporina houve retorno aos níveis basais de pressão arterial e função renal nos pacientes avaliados, assim como na literatura em que houve melhora espontânea, após redução de dose ou suspensão da droga12,17-19.
Além disso, este estudo mostrou que o grupo de pacientes com efeitos adversos relacionados a ciclosporina era composto de pacientes com idade maior e com uso mais prolongado de ciclosporina, porém não foi realizada avaliação estatística. Na literatura, não foi observada essa associação12,18.
Além da eficácia terapêutica, a segurança é um parâmetro a ser considerado durante o uso da ciclosporina. Os efeitos adversos devem ser monitorizados e tendem a melhorar com a suspensão. Diante da frequência de eventos adversos que impõe a suspensão do tratamento imunossupressor, surge a expectativa de novos tratamentos mais eficazes e seguros. Os imunobiológicos têm surgido com resultados promissores neste sentido de melhorar eficácia e segurança, porém questões de idade (faixa pediátrica aguarda aprovação após estudos), custos e acesso, fazem com que tenhamos que continuar considerando o uso de imunossupressores como a ciclosporina como opção terapêutica, ressaltando a necessidade de atenção ao risco de eventos adversos.
REFERÊNCIAS
1. Addor FAZ, Aoki V. Barreira cutânea na dermatite atópica. An Bras Dermatol. 2010;85(2):184-94.
2. Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol (Stockh). 1980;92:44-7.
3. Deckers IA, McLean S, Linssen S, Mommers M, van Schayck CP, Sheikh A. Investigating international time trends in the incidence and prevalence of atopic eczema 1990-2010: a systematic review of epidemiological studies. PLoS One. 2012;7:e39803.
4. Williams H, Stewart A, von Mutius E, Cookson W, Anderson HR, and the International Study of Asthma and Allergies in Childhood (ISAAC) Phase One and Three Study Groups. Is eczema really on the increase worldwide? J Allergy Clin Immunol. 2008;121:947-54.
5. Werfel T, Allam JP, Biedermann T, Eyerich K, Gilles S, Guttman-Yassky E, et al. Cellular and molecular immunologic mechanisms in patients with atopic dermatitis. J Allergy Clin Immunol. 2016;138(2):336-49.
6. Haw S, Shin MK, Haw CR. The Efficacy and safety of long-term oral cyclosporine treatment for patients with atopic dermatitis. Ann Dermatol. 2010;22(1):9-15.
7. Khattri S, Shemer A, Rozenblit M, Dhingra N, Czarnowicki T, Finney R, et al. Cyclosporine in patients with atopic dermatitis modulates activated inflammatory pathways and reverses epidermal pathology. J Allergy Clin Immunol. 2014;133(6):1626-34.
8. Egawa G, Kabashima K. Multifactorial skin barrier deficiency and atopic dermatitis: Essential topics to prevent the atopic march. J Allergy Clin Immunol. 2016;138:350-8.
9. Weidinger S, Gupta AK. Atopic dermatitis. Lancet. 2016;387(10023):1109-22.
10. Kantor R, Silverberg JI. Environmental risk factors and their role in the management of atopic dermatitis. Exp Rev Clin Immunol. 2017:13(1):15-20.
11. Wollenberg A, Oranje A, Deleuran M, Simon D, Szalai Z, Kunz B, et al. ETFAD/EADV Eczema task force 2015 position paper on diagnosis and treatment of atopic dermatitis in adult and paediatric patients. J Eur Acad Dermatol Venereol. 2016;30:729-47.
12. Hijnen DJ, ten Berge O, Timmer-de Mik L, Bruijnzeel-Koomen CA, de Bruin-Weller MS. Efficacy and safety of long-term treatment with cyclosporin A for atopic dermatitis. J Eur Acad Dermatol Venereol. 2007;21(1):85-9.
13. Ministério da Saúde, Consultoria Jurídica/Advocacia Geral da União. Nota Técnica N° 285/2013, Brasília, agosto de 2013. Ciclosporina.
14. Sibbald C, Pope E, Ho N, Weinstein M. Retrospective review of relapse after systemic cyclosporine in children with atopic dermatitis. Pediatr Dermatol. 2015;32(1):36-40.
15. Schmitt J, Schmitt N, Meurer M. Cyclosporin in the treatment of patients with atopic eczema - a systematic review and meta-analysis. J Eur Acad Dermatol Venereol. 2007;21:606-19.
16. Garritsen FM, Roekevisch E, van der Schaft J, Deinum J, Spuls PI, de Bruin-Weller MS. Ten years experience with oral immunosuppressive treatment in adult patients with atopic dermatitis in two academic centres. J Eur Acad Dermatol Venereol. 2015 Oct;29(10):1905-12. doi: 10.1111/jdv.13064. Epub 2015 Mar 9.
17. Haeck IM, Knol MJ, Ten BO, van Velsen SG, de Bruin-Weller MS, Bruijnzeel- Koomen CA. Enteric-coated mycophenolate sodium versus cyclosporin A as long-term treatment in adult patients with severe atopic dermatitis: a randomized controlled trial. J Am Acad Dermatol. 2011;64:1074-84.
18. Harper JI, Ahmed I, Barclay G, Lacour M, Hoeger P, Cork MJ, et al. Cyclosporin for severe childhood atopic dermatitis: short course versus continuous therapy. Br J Dermatol. 2000;142:52-8.
19. Zonneveld IM, De Rie MA, Beljaards RC, Van Der Rhee HJ, Wuite J, Zeegelaar J, et al. The long-term safety and efficacy of cyclosporin in severe refractory atopic dermatitis: a comparison of two dosage regimens. Br J Dermatol. 1996;135(Suppl. 48):15-20.



