Número Atual: Janeiro-Março 2020 - Volume 4 - Número 1
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Imunoterapia no câncer - inibidores do checkpoint imunológico
Immunotherapy and immune checkpoint inhibitors in cancer
Ataualpa Pereira dos Reis; José Augusto Nogueira Machado
Instituto de Ensino e Pesquisa da Santa Casa de Belo Horizonte, Imunobiologia - Belo Horizonte, MG, Brasil
Endereço para correspondência:
Ataualpa Pereira dos Reis
E-mail: ataualpapreis@gmail.com
Submetido em: 10/02/2020
aceito em: 17/02/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
O objetivo deste trabalho é fazer uma revisão atual do tratamento de alguns tipos de câncer com imunoterapia e inibidores do checkpoint imunológico. As fontes de dados incluíram artigos originais, revisões e publicações indexados nos bancos de dados PubMed, MEDLINE, LILACS, SciELO e publicações online nos últimos 20 anos. Os checkpoints imunológicos normalmente impedem o organismo de montar uma resposta imune contra células normais. Alguns tipos de câncer podem adquirir estes checkpoints de tal forma que estas células tumorais não são reconhecidas pelo sistema imune, e isto impede que ele seja ativado. A inibição dos checkpoints imunológicos pode melhorar a sobrevida de pacientes com malignidades avançadas. Isto inclui melanoma maligno, carcinoma renal, linfoma e câncer pulmonar de células não pequenas. Uma extraordinária quantidade de investigações pré-clínicas e clínicas estão explorando o potencial terapêutico das moléculas coestimulatórias positivas e negativas. Aqui, nós revisamos o estado atual do nosso conhecimento dos mecanismos co-estimulatórios da célula T e a inibição dos checkpoints, primariamente do CTLA-4 e do PD-1.
Descritores: Imunoterapia ativa, imunomodulação, neoplasias.
INTRODUÇÃO
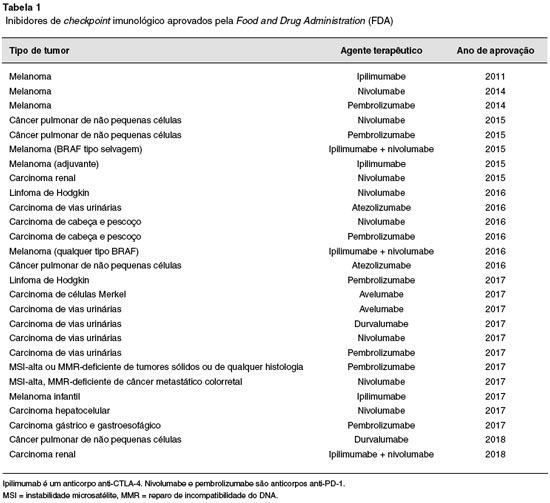
Terapia bloqueadora dos checkpoints imunológicos está atualmente aprovada pela Food and Drug Administration (FDA) dos USA e pela Agência ANVISA do Brasil para tratamento de uma série de tipos de tumores (Tabela 1). Desde a aprovação pela FDA em 2011 para o uso do ipilimumabe (anti-CTLA-4) no tratamento do melanoma metastático, outras terapias para o bloqueio dos checkpoints, todas tendo como alvo o PD-1/PD-L1, foram aprovadas para o tratamento de uma série de tipos de tumores. Também uma combinação de terapia com ipilimumabe e nivolumabe (anti-PD-1) foi aprovada para o tratamento do melanoma avançado e com efeitos superiores quando comparadas com ambas as monoterapias. Contudo, muitos aspectos da ativação de células T e os mecanismos de bloqueio dos checkpoints devem ainda avançar muito. Neste trabalho revisamos como as moléculas coestimuladoras negativas CTLA-4 e PD-1 atenuam a ativação imune celular e também os mecanismos de ação dos anti-PD-1 e anti-CTLA-4 no contexto da imunidade antitumoral e efetivamente combiná-las com outras terapias quimioterapêuticas ou imunoterapêuticas.
Terapia bloqueadora dos checkpoints imunológicos remove os sinais inibitórios da ativação de células T, que possibilitam as células tumorais superarem os mecanismos reguladores do sistema imune1-3. Estes mecanismos reguladores mantêm as respostas imunes dentro de um desejável nível fisiológico e protegem o hospedeiro de autoimunidade.Tolerância imunológica é alcançada através de múltiplos e distintos mecanismos, e que podem ser definidos como centrais e periféricos. Tolerância central é mediada por deleção clonal de clones altamente reativos durante a seleção negativa pelo timo. Tolerância periférica é exercida através de uma variedade de mecanismos, incluindo células T reguladoras (Treg), anergia das células T, sinais tolerogênicos extrínsecos às células e deleção clonal periférica. O sistema imune exerce uma forte pressão seletiva contra a progressão do tumor, que inclui resposta imune inata e adaptiva. Através destas respostas, diversas células efetoras, tais como as células natural killer e citocinas das células T são ativadas contra as células tumorais.
Existe aqui a produção de IL-12 e interferon-gama que matam as células tumorais via mecanismo citotóxico, tais como pelas perfurinas, apoptose induzida pela TNF e por espécies reativas de oxigênio4-7. Por outro lado, existem os sinais inibitórios da ativação de células T, e vamos aqui discutir primariamente o que se sabe sobre estes mecanismos reguladores inibitórios CTL-4, PD-1 e PDL-1 e as implicações terapêuticas dos anticorpos monoclonais dirigidos para estes sinais inibitórios.
INIBIDORES DE CHECKPOINT IMUNOLÓGICO
Em condições normais, os checkpoints imunológicos funcionam como sinais negativos para regular respostas inflamatórias que se seguem à ativação das células T. O checkpoint imunológico CTLA-4 foi pela primeira vez caracterizado por Brunet et al. em 19808. Em seguida foi demonstrado que o CTLA-4 na célula T competitivamente se liga ao B7 (CD80) das células apresentadoras de antígenos, interferido nas interações com o CD28, desta maneira interferindo na coestimulação da fase inicial da ativação das células T. Subsequentemente, o bloqueio do CTLA-4 com anticorpos demonstrou rejeição do tumor, e emergiu como prova de conceito da inibição dos checkpoints imunológicos9. Outro checkpoint imunológico, o PD-1, foi clonado em 199210, com a subsequente caracterização do seu ligante, o PDL-111-14. Este ligante PDL-1 está expresso na superfície de múltiplos tecidos tumorais, incluindo rins e pulmões, sendo importantes na função normal do sistema imune. Inibidores do PD-1 impedem o acoplamento deste ligante com o seu receptor, permitindo que o sistema imune reconheça as células tumorais.
Muitos tumores atualmente são conhecidos por utilizar este mecanismo para evitar o ataque das células T e sua morte celular, e anticorpos inibidores dirigidos contra a interação do PD-1 e seus ligantes demostraram resposta antitumoral15 (Figura 1).
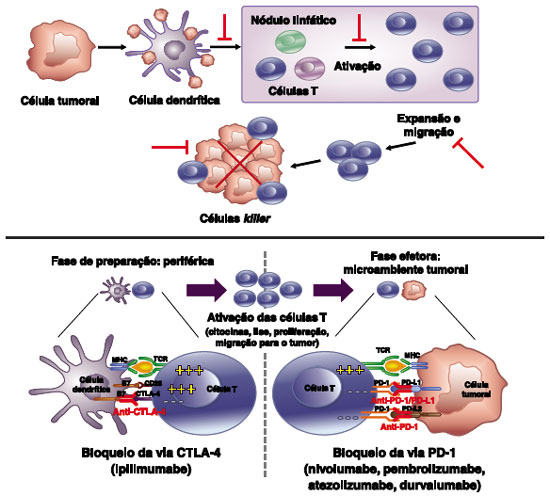
Figura 1 Resposta antitumoral por linfócitos T e Inibidores de checkpoint imunológico CTLA-4 e PD-1 Adaptado de Wolchok JD et al.42
MELANOMA
Ipilimumabe foi o primeiro inibidor de checkpoint imunológico a mostrar benefícios em melanoma avançado. Mais recentemente, outros estudos duplocego controlados e randomizados mostraram que os inibidores do PD-1, nivolumabe e pembrolizumabe, são mais eficientes16-18. Nestes trabalhos o inibidor de PD-1, nivolumabe, e o pembrolizumabe, como monoterapia, tiveram melhores efeitos inibidores do que os inibidores do CTLA-4, ipilimumabe, para pacientes com melanoma avançado. A combinação de nivolumabe e pembrolizumabe alcançou também resultado positivo, mas sem um significado estatístico para detectar uma diferença entre terapia combinada e monoterapia. Existem dois grupos que se beneficiaram mais com a terapia combinada do que com a monoterapia: pacientes com a mutação BRAF do melanoma, e pacientes com metástases cranianas. Infelizmente, este melhor resultado mostrou também aumento de toxicidade. Pacientes com estado funcional baixo ou comorbidades significantes podem não serem elegíveis para a terapia combinada.
CÂNCER DE PULMÃO DE NÃO PEQUENAS CÉLULAS
Desde há poucos anos, uma vez que os benefícios do tratamento com os inibidores do PD-1 e do PDL-1 foram demostrados, três terapias com estes inibidores foram aprovadas pela FDA como segunda linha de tratamento. Estas aprovações incluíram o nivolumabe, pembrolizumabe e atezolizumabe, todos aprovados com base em estudos de fase III, em que demonstraram melhores resultados quando comparados ao uso do antineoplásico docetaxel neste tipo de neoplasia. De um modo geral, não existem grandes diferenças de eficácia e segurança entre estas três terapias para declarar uma escolha de melhor terapia que outra, e nenhum estudo comparativo foi realizado.Talvez haja duas distinções entre as três terapias que possa levar a uma escolha de uso: a expressão de PDL-1 poderia indicar o uso de nivolumabe e atezolizumabe em pacientes já previamente tratados em câncer avançado, independentemente da quantidade de PDL-1, enquanto o pembrolizumabe poderia ser usado em pacientes com PDL-1 > 1%. O esquema de administração do atezolizumabe e do pembrolizumabe é para uso a cada três semanas, enquanto o nivolumabe é para cada duas semanas, baseados em guidelines, embora a FDA tenha recomendado recentemente o esquema a cada 4 semanas para o nivolumabe. O tratamento para pacientes com história de autoimunidade deve ser considerado com cuidado e com avaliação de risco/benefício. Devido ao risco de rejeição, nos pacientes transplantados com órgão sólido estas terapias com inibidores do PD-1 e PDL-1 devem ser evitadas19-21. Câncer pulmonar de pequenas células é um subtipo de câncer pulmonar altamente letal, e que tem poucos avanços terapêuticos, a despeio de inúmeros esforços. A imunoterapia neste tipo de câncer tem obtido modesto resultado.
LINFOMA
Vários estudos demonstram que os inibidores de PD-1, nivolumabe e pembrolizumabe, são efetivos no tratamento de linfomas refratários ou com recaída. O uso destes inibidores resulta em resposta parcial e mesmo completa e está evoluindo para ser indicação primária no tratamento destes linfomas. Estudos de terapia combinada para a inibição de PD-1 com terapia por imunomodulação estão em andamento e também na procura de biomarcadores22-31.
CARCINOMA RENAL
Recentemente houve uma dramática expansão no tratamento para pacientes portadores de carcinoma renal avançado, incluindo drogas que tinham como alvo o fator de crescimento do endotélio vascular (as vias metabólicas mTOR). Com o advento dos inibidores dos checkpoints imunológicos, especificamente com os anti PD-1 e anti CTLA-4, o panorama do tratamento evoluiu muito a ponto de alterá-lo. Sete estudos deste tipo foram identificados numa revisão sistemática da literatura. Nivolumabe foi superior em eficácia e segurança em comparação com everolimus (um inibidor da via metabólica mTOR). Em terapia combinada, foi verificada uma maior eficácia, mas aumentaram os efeitos colaterais em termos de segurança. Outros inibidores dos checkpoints, incluindo o ipilimumabe em combinação com outros agentes e também o atezolizumabe (anti PDL-1), estão em vários estágios de tratamento32-35.
CÂNCER DE CABEÇA E PESCOÇO
Câncer de cabeça e pescoço engloba neoplasias que crescem nos seios paranasais, cavidade nasal, cavidade oral, faringe e laringe. Desde 2016 a FDA aprovou o uso dos anti PD-1 pembrolizumabe e nivolumabe no tratamento destes tipos de tumores, desenhando uma nova era no tratamento desta população de indivíduos que historicamente têm 50% de recorrência, a despeito de várias modalidades agressivas de tratamento, incluindo cirurgia, radioterapia, quimioterapia e inibição do receptor de fator de crescimento epidérmico36. O uso dos inibidores do checkpoints imunológicos nestes tumores têm demonstrado melhoras duradouras em pacientes com a doença avançada ou metastática, e em uso de pembrolizumabe ou nivolumabe, como monoterapia ou terapia combinada, ou, ainda, como terapias combinadas com quimio ou radioterapias37-39.
EFEITOS ADVERSOS
O uso dos inibidores dos checkpoints imunológicos na prática clínica traz um espectro de novas toxicidades. Em adição às reações que possam ocorrer com a infusão, pode haver reação adversa imunológica que pode afetar muitos órgãos. Isto inclui pneumonites, hepatites, nefrites, colites e endocrinopatias. O desafio para os profissionais da saúde é reconhecer estas toxicidades mais prontamente possível, e agir rapidamente. Em geral, estas reações relacionadas ao sistema imune ocorrem entre duas semanas e três meses do início da terapia. No entanto, estas reações podem ocorrer até um ano após a descontinuação da terapia. As reações tóxicas mais comuns são letargia, rash cutâneo com prurido, intoxicação hepática, diarreia, colite, hipofisite. Exames bioquímicos e radiológicos devem ser realizados na hipótese destas reações. Embora não exista um protocolo de rotina para investigar estas reações, parece bastante razoável que os pacientes utilizando terapia de antagonistas dos checkpoints devam realizar hemograma, provas de função renal e hepática, bem como as tiroidianas a cada 2 ou 4 semanas. Na incidência destas toxicidades, está indicado a redução ou cessação da terapia. Se os sintomas são brandos ou moderados, o tratamento pode ser suspenso temporariamente, até que os sintomas sejam resolvidos. Adicionalmente, um curso rápido de prednisona oral (0,5 mg/kg/dia) pode ser administrado, geralmente por uma semana. Em casos de intoxicação grave a imunoterapia deve ser descontinuada, e deve ser utilizada a metilprednisolona IV (1-2 mg/kg/dia). Uma vez debelada a toxicidade, deve-se gradualmente retirar o corticoide. Em casos raros, quando a prednisona não resolve, pode se usar imunoglobulina intravenosa, infliximabe ou plasmaferese40,41.
DURAÇÃO DO TRATAMENTO
Existe pouca evidência científica do total de duração do tratamento com as terapias com checkpoints imunológicos. É possível que muitos pacientes estejam sendo tratados por mais tempo do que o necessário. Alguns pacientes que descontinuaram o tratamento mais cedo devido a toxicidade alcançaram o mesmo benefício do que aqueles que completaram o tempo de terapia planejado. Existe uma escassez de ensaios com alta qualidade, e, portanto, a duração do tratamento é deixada a julgamento dos oncologistas que estão acompanhando os pacientes41.
CONCLUSÃO
Nos últimos anos, inibidores do checkpoint imunológico vêm se tornando uma importante ferramenta para o tratamento de certos tumores, tais como melanoma e câncer de pulmão de pequenas células, e com aumento da sobrevida destes pacientes. Contudo, somente uma proporção, 30% dos pacientes, são respondedores a este tipo de tratamento e, portanto, uma boa parte deles têm ainda um mau prognóstico. Existem vários tipos de ensaios em andamento que tentam combinações imunoterapêuticas e procuram identificar biomarcadores preditivos que possam selecionar respondedores de não respondedores. Procuramos, nesta revisão, entender as funções da célula T, as moléculas coestimulatórias e os mecanismos pelos quais podemos antagonizar o bloqueio destas moléculas. Focamos principalmente no bloqueio do checkpoint imunológico da CTLA-4 e da PD-1. A imunoterapia está levando o tratamento do câncer para uma nova era. Este excitante tipo de tratamento tem criado a esperança de aumentar o tempo de vida dos pacientes portadores de câncer para alguns meses, e até mesmo conseguir uma vitória contra o câncer.
REFERÊNCIAS
1. Sharma P, Allison JP. The future of immune checkpoint therapy. Science. 2015;348:56-61.
2. Topalian SL, Drake CG, Pardoll DM. Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell. 2015;27:450-61.
3. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12:252-6.
4. Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Ann Rev Immunol. 2004;22:329-60.
5. Tang J, Shalabi A, Hubbard-Lucey VM. Comprehensive analysis of the clinical immuno-oncology landscape. Ann Oncol. 2018;29:84-91.
6. Sharma P, Hu-LS, Wargo JA, Ribas A. Primary, adaptive, and acquired resistance to cancer immunotherapy. Cell. 2017;168:707-23.
7. Ribas A, Wolchok JD. Cancer immunotherapy using checkpoint blockade. Science. 2018;359:1350-5.
8. Brunet JF, Denizot F, Luciani MF, Roux-Dosseto M, Suzan M, Mattei MG, et al. A new member of the immunoglobulin superfamily-CTLA-4. Nature. 1987;328:267-70.
9. Krummel MF, Allison JP. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. 1995;182:459-65.
10. Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science. 1996;271:1734-6.
11. Ishida Y, Agata Y, Shibahara K, Honjo T. Induced expression of PD-1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death. EMBO J. 1992;11:3887-95.
12. Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion [published correction appears in Nat Med. 2002;8:1039]. Nat Med. 2002;8:793-800.
13. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation of lymphocyte activation. J Exp Med. 2000;192:1027-34.
14. Dong H, Zhu G, Tamada K, Chen L. B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nat Med. 1999;5:1365-9.
15. Topalian SL, Drake CG, Pardoll DM. Targeting the PD-1/B7-H1(PDL1) pathway to activate anti-tumor immunity. Curr Opin Immunol. 2012;24:207-12.
16. Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L, et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med. 2015;372:2521-32.
17. Weber J, Mandala M, Del Vecchio M, Gogas HJ, Arance AM, Cowey CL, et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma. N Engl J Med. 2017;377:1824-35.
18. Wolchok JD, Chiarion-Sileni V, Gonzalez R, Rutkowski P, Grob JJ, Cowey CL, et al. Overall survival with combined nivolumab and ipilimumab in advanced melanoma. N Engl J Med. 2017;377:1345-56.
19. Planchard D, Popat S, Kerr K, Novello S, Smit EF, Faivre-Finn C. et al. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. On behalf of the ESMO Guidelines Committee. Originally published in 2018 - Ann Oncol. 2018;29 (suppl 4):iv192-iv237.
20. Brahmer J, Reckamp KL, Baas P, Crinò L, Eberhardt WE, Poddubskaya E, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med. 2015;373:123-35.
21. Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, et al. Nivolumab versus docetaxel in advanced nonsquamous nonsmall- cell lung cancer. N Engl J Med. 2015;373:1627-39.
22. Chen B, Chapuy B, Ouyang J, Sun H, Roemer M, Xu M. PDL1 expression is characteristic of a subset of aggressive B-cell lymphomas and virus-associated malignancies. Clin Cancer Res. 2013;19:3462-73.
23. Galanina N, Kline J, Bishop MR. Emerging role of checkpoint blockade therapy in lymphoma. Therapeutic Advances in Hematology. 2017;8:81-90.
24. Younes A, Santoro A, Shipp M, Zinzani PL, Timmerman JM, Ansell S, et al. Nivolumab for classical Hodgkin's lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, single-arm phase 2 trial. Lancet Oncology. 2016;17(9):1283-94.
25. Armand P, Zinzani P, Collins GP, Cohen JB, Halwani A, Carlo- Stella C, et al. Outcomes of allogeneic hematopoietic stem cell transplantation (HSCT) after treatment with nivolumab for relapsed/ refractory Hodgkin lymphoma. Blood. 2016;128:3502.
26. Ansell S, Gutierrez ME, Shipp MA, Gladstone D, Moskowitz A, Borello I, et al. A phase 1 study of nivolumab in combination with ipilimumab for relapsed or refractory hematologic malignancies Blood. 2016;128(22):183.
27. Falchi L, Sawas A, Deng C, Amengual JE, Lichtenstein E, Khan K, et al. PD-1 Blockade after epigenetic therapy in patients with relapsed or refractory Hodgkin lymphoma: higher-than-expected rate of complete responses. Blood. 2016;128(22):2999.
28. Armand P, Shipp M, Ribrag V, Michot JM, Zinzani PL, Kuruvilla P, et al. Pembrolizumab in patients with classical Hodgkin lymphoma after brentuximab vedotin failure: long-term efficacy from the phase 1b Keynote-013 study. Blood. 2016;128(22):1108.
29. Moskowitz CH, Zinzani PL, Fanale MA, Armand P, Nathalie A, Radford JA, et al. Pembrolizumab in relapsed/refractory classical Hodgkin lymphoma: primary end point analysis of the phase 2 Keynote-087 study. Blood. 2016;128:1107.
30. Kwong Y L, Lopes D, Khong P L. Low-dose pembrolizumab induced remission in patients with refractory classical Hodgkin lymphoma. Br J Haematol. 2017;176(1):131-2.
31. Villasboas J C, Ansell S M, Witzig T E. Targeting the PD-1 pathway in patients with relapsed classic Hodgkin lymphoma following allogeneic stem cell transplant is safe and effective. Oncotarget. 2016;7(11):13260-4.
32. Motzer RJ, Escudier B, McDermot DF, Saby S, Hammers HJ, Sandhya Srinivas S, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015;373:1803-13.
33. Atkins MB, Clark JI, Quinn DI. Immune checkpoint inhibitors in advanced renal cell carcinoma: experience to date and future directions. Ann Oncol. 2017;28(7):1484-94.
34. Luyo MA, Carril-Ajuria LA, Schutz FB, Castellano DA, De Velasco GA. Double Immune Checkpoint Blockade in Renal Cell Carcinoma. Kidney Cancer. 2019;3:163-70.
35. Lyu C, Li W, Liu S, Gao S, Zhang H, Hao L, et al. Systematic review on the efficacy and safety of immune checkpoint inhibition in renal cell carcinoma. Future Oncol. 2018 Sep;14(21):2207-21.
36. Argiris A, Karamouzis MV, Raben D, Ferris RL. Head and neck cancer. Lancet. 2008;17;371(9625):1695-709.
37. Forster MD, Devlin MJ. Immune checkpoint inhibition in head and neck cancer. Front Oncol. 2018;8:310.
38. Wang H, Mustafa A, Liu S, Liu J, Lv D, Yang H. Immune checkpoint inhibitor toxicity in head and neck cancer: from identification to management. Front Pharmacol. 2019;10:1254.
39. Cohen EEW, Bell RB, Bifulco CB, Burtness B, Gillison ML, Harrington KJ, et al. The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC). J Immunotherapy Cancer. 2019;7:1-31.
40. Haanen JBAG, Carbonne F, Robert C, Kerr KM, Peters S, Larkin J. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2017;28:119-42.
41. Schadendorf D, Wolchok JD, Hodi FS, Sileni VC, Gonzales R, Rutkowski P, et al. Efficacy and safety outcomes in patients with advanced melanoma who discontinued treatment with Nivolumab and Ipilimumab because of adverse events: a pooled analysis of randomized Phase II and III Trials. Journal of Clinical Oncology. 2017;35:3807-14.
42. Wolchok JD, Kluger HM, Callahan MK, Postow MA, Gordon RA, Segal NW, et al. Safety and clinical activity of nivolumab (anti-PD-1, BMS-936558, ONO-4538) in combination with ipilimumab in patients (pts) with advanced melanoma (MEL). Journal of Clinical Oncology. 2013;31(15_suppl):9012.